16.10:
Equilibrio de Solubilidad
16.10:
Equilibrio de Solubilidad
Los equilibrios de solubilidad se establecen cuando la disolución y precipitación de una especie de soluto se producen a velocidades iguales. Estos equilibrios son la base de muchos procesos naturales y tecnológicos, que van desde la caries dental hasta la purificación del agua. Por lo tanto, es esencial comprender los factores que afectan la solubilidad de los compuestos para el manejo eficaz de estos procesos. Esta sección aplica conceptos y herramientas de equilibrio previamente introducidos a sistemas que involucran disolución y precipitación.
El producto de solubilidad
Recordemos que la solubilidad de una sustancia puede variar desde esencialmente cero (insoluble o escasamente soluble) hasta infinito (miscible). Un soluto con solubilidad finita puede producir una solución saturada cuando se añade a un solvente en una cantidad que excede su solubilidad, resultando en una mezcla heterogénea de la solución saturada y el exceso de soluto no disuelto. Por ejemplo, una solución saturada de cloruro de plata es aquella en la que se ha establecido el equilibrio que se muestra a continuación.
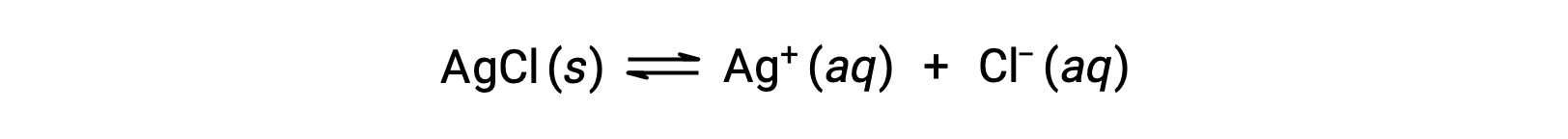
En esta solución, un exceso de AgCl sólido se disuelve y disocia para producir iones Ag+ y Cl− acuosos a la misma velocidad que estos iones acuosos se combinan y precipitan para formar AgCl sólido. Debido a que el cloruro de plata es una sal escasamente soluble, la concentración en equilibrio de sus iones disueltos en la solución es relativamente baja.
La constante de equilibrio para equilibrios de solubilidad como éste se llama constante del producto de solubilidad, Ksp, en este caso
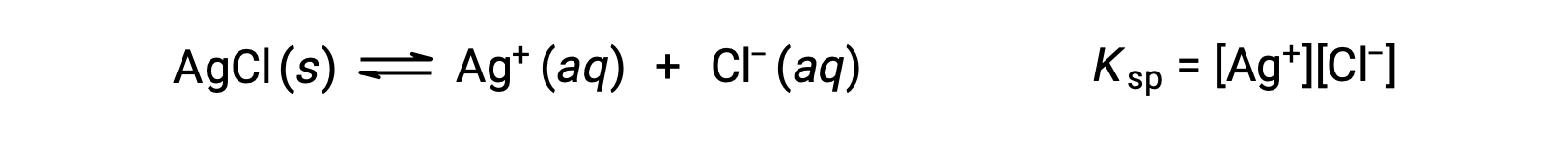
Recuerde que sólo los gases y los solutos se representan en expresiones de la constante de equilibrio, por lo que el Ksp no incluye un término para el AgCl no disuelto.
Ksp y Solubilidad
El Ksp de un compuesto iónico ligeramente soluble puede estar simplemente relacionado con su solubilidad medida, siempre que el proceso de disolución sólo implique disociación y solvatación, por ejemplo:
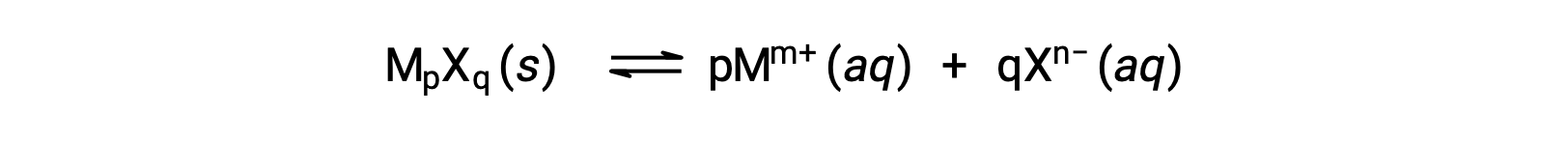
Para casos como estos, se pueden obtener valores de Ksp de las soluciones proporcionadas, o viceversa. Los cálculos de este tipo se realizan más convenientemente utilizando la solubilidad molar de un compuesto, medida como moles de soluto disueltos por litro de solución saturada.
Prediciendo la precipitación
La ecuación que describe el equilibrio entre el carbonato de calcio sólido y sus iones solvatados es:
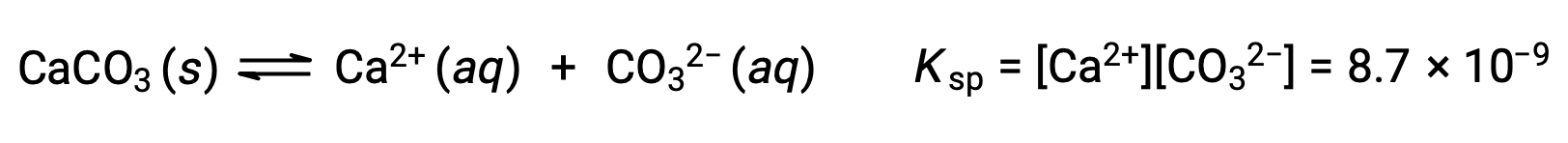
Es importante darse cuenta de que este equilibrio se establece en cualquier solución acuosa que contenga iones Ca2+ y CO32−, no sólo en una solución formada mediante la saturación de agua con carbonato de calcio. Consideremos, por ejemplo, mezclar soluciones acuosas de los compuestos solubles carbonato de sodio y nitrato de calcio. Si las concentraciones de iones de calcio y carbonato en la mezcla no producen un cociente de reacción, Q, que exceda el producto de solubilidad, Ksp, entonces no se producirá la precipitación. Si las concentraciones de iones producen un cociente de reacción mayor que el producto de solubilidad, entonces se producirá la precipitación, reduciendo esas concentraciones hasta que se establezca el equilibrio (Q = Ksp). La comparación de Q con Ksp para predecir la precipitación es un ejemplo del enfoque general para predecir la dirección de una reacción introducida por primera vez en las lecciones sobre el equilibrio. Para el caso específico de los equilibrios de solubilidad:
Q < Ksp: La reacción procede en la dirección de avance (la solución no está saturada; no se observa precipitación)
Q > Ksp: La reacción avanza en dirección inversa (la solución se supersaturó; se producirá precipitación)
Este texto es adaptado de Openstax, Química 2e, Sección 15.1: Precipitación y Disolución.
Suggested Reading
- Clifford, A. F. "The Prediction of Solubility Product Constants1." Journal of the American Chemical Society 79, no. 20 (1957): 5404-5407.
- Hill, Arthur E. "The Inconstancy Of The Solubility Product." Journal of the American Chemical Society 32, no. 10 (1910): 1186-1193.
- Reynolds, John P. "Ksp experiment: The solubility product for barium hydroxide." Journal of Chemical Education 52, no. 8 (1975): 521.
