16.11: 溶解平衡
溶解平衡とは、溶質の溶解と析出が同じ割合で起こる状態のことです。この平衡は、虫歯から水の浄化に至るまで、多くの自然現象や技術的プロセスの基礎となっています。そのため、化合物の溶解度に影響を与える要因を理解することは、これらのプロセスを効果的に管理するために不可欠です。このセクションでは、これまでに紹介した平衡の概念と考え方を、溶解と沈殿を伴うシステムに適用します。
溶解度積
物質の溶解度は、本質的にゼロ(溶けない、またはほとんど溶けない)から無限大(完全に混ざり合う)まで変化します。有限の溶解度を持つ溶質は、その溶解度を超える量を溶媒に加えると飽和溶液となり、飽和溶液と過剰な未溶解の溶質の不均一な混合物を生じます。例えば、塩化銀の飽和溶液とは、以下のような平衡が成立している状態のことです。
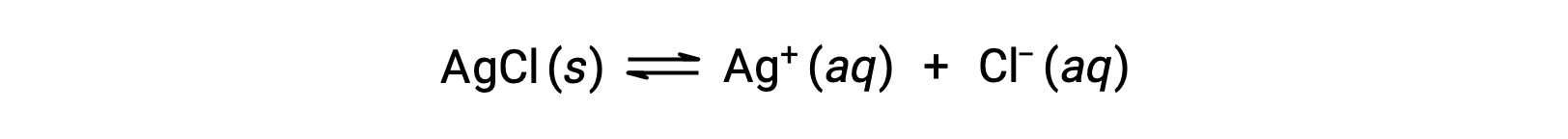
この溶液では、過剰な固体のAgClが溶解・解離して水和したAg+とCl–イオンを生成し、これらの水和イオンが結合して固体のAgClを形成して沈殿するのと同じ速度で溶解・解離します。塩化銀は疎水性の塩であるため、水溶液中の溶存イオンの平衡濃度は比較的低いです。
このような溶解平衡の平衡定数は、溶解度積とKspと呼ばれ、この場合は
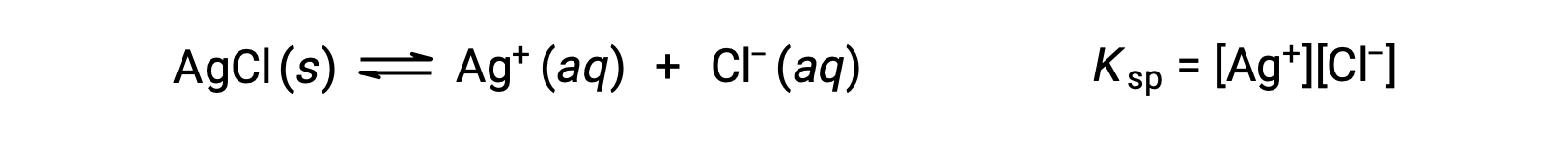
平衡定数の式には気体と溶質のみが含まれるため、Kspには溶解していないAgClの項が含まれていないことに注意する必要があります。
Kspと溶解度
わずかに溶解するイオン性化合物のKspは、例えば、溶解過程が解離と溶媒和だけであれば、測定された溶解度と単純に関連している可能性があります。例えば、
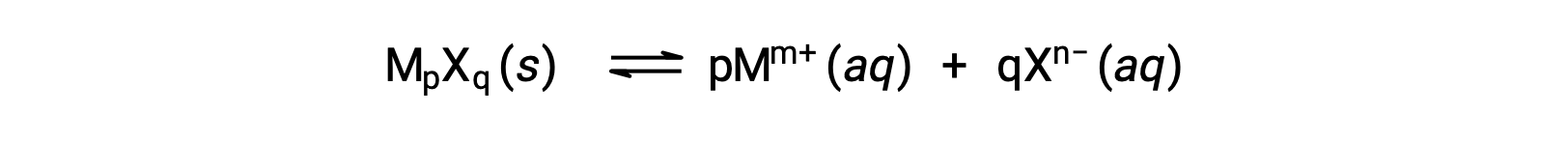
このような場合は、既知の溶解度からKspの値を導き出すことができ、逆もまたしかりです。この種の計算は、飽和溶液1リットルあたりの溶解した溶質の物質量として測定される、化合物’のモル溶解度を用いて行うのが最も便利です。
Predicting Precipitation
固体の炭酸カルシウムとその溶解したイオンの間の平衡を表す式は、次の通りです。
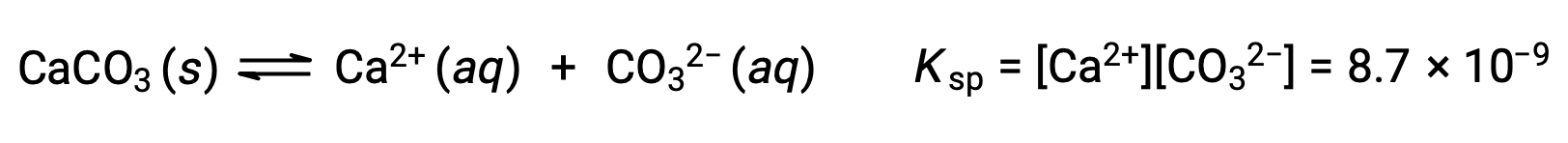
この平衡は、水に炭酸カルシウムを飽和させてできた溶液だけでなく、Ca2+とCO32–イオンを含むあらゆる水溶液で成立します。例えば、可溶性化合物である炭酸ナトリウムと硝酸カルシウムの水溶液を混合することを考えてみましょう。混合溶液中のカルシウムイオンと炭酸イオンの濃度から得られる反応商Qが溶解度積Kspを超えなければ、沈殿は生じません。もし、イオン濃度が溶解度積よりも大きい反応商をもたらすならば、沈殿が発生し、平衡が成立するまでそれらの濃度を下げる(Q=Ksp)。沈殿を予測するためにQとKspを比較することは、平衡に関する箇所で最初に紹介した、反応の方向性を予測するための一般的なアプローチの一例です。溶解平衡の具体的なケースについては、以下の通りです。
Q < Ksp: 反応は順方向に進む(溶液は飽和しない、沈殿は観察されない)
Q > Ksp: 反応は逆方向に進む(溶液が過飽和状態になり、沈殿が発生する)
上記の文章は以下から引用しました。Openstax, Chemistry 2e, Section 15.1: Precipitation and Dissolution.


