16.10:
Равновесия растворимости
16.10:
Равновесия растворимости
Равновесие растворимости устанавливается, когда растворение и осаждение видов растворённое вещество происходят с одинаковой скоростью. Эти равновесии лежат в основе многих природных и технологических процессов, начиная от распада зуба и заканчивая очисткой воды. Таким образом, понимание факторов, влияющих на растворимость соединений, имеет важное значение для эффективного управления этими процессами. В этом разделе используются ранее внедренные концепции и инструменты равновесия для систем, включающих растворение и осадки.
Продукт растворимости
Вспомните, что растворимость вещества может варьироваться от практически нулевого (нерастворимого или малорастворимого) до бесконечности (смешивающийся). растворённое вещество с конечной растворимостью может давать насыщенный раствор, когда он добавляется в растворитель в количестве, превышающем его растворимость, в результате чего образуется гетерогенная смесь насыщенного раствор и избытка нерастворенного растворённое вещество. Например, насыщенный раствор хлорида серебра является тем, в котором установлено равновесие, показанное ниже.
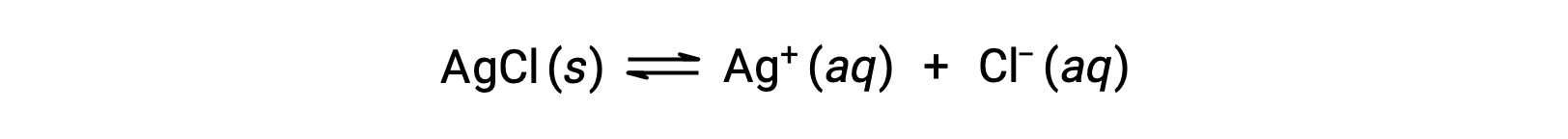
В этом раствор избыток твердого AgCl растворяется и диссоциируется для получения ионов Ag+ и CL– с той же скоростью, с которой эти водные ионы комбинируются и осаждаются для образования твердого AgCl. Поскольку хлорид серебра является малорастворимой солью, равновесная концентрация растворенных ионов в раствор относительно низка.
В данном случае константа равновесия равновесия растворимости, такая как эта, называется постоянной продукта растворимости, KSP
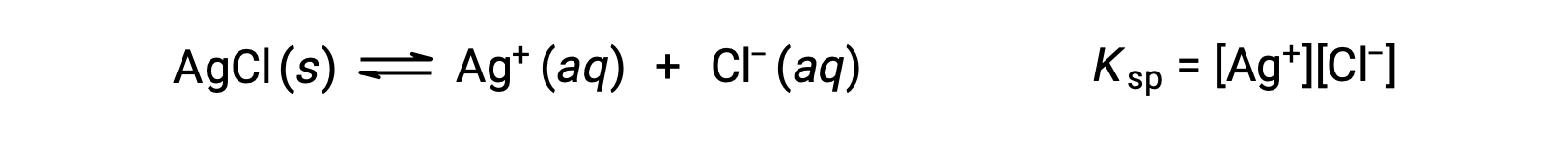
Напомним, что в выражениях констант равновесия представлены только газы и солоты, поэтому в KSP не включен термин для нерастворенного AgCl.
KSP и растворимость
КСП слабо растворимого ионного соединения может быть просто связано с его измеренной растворимостью при условии, что процесс растворения включает только диссоциацию и сольватация, например:
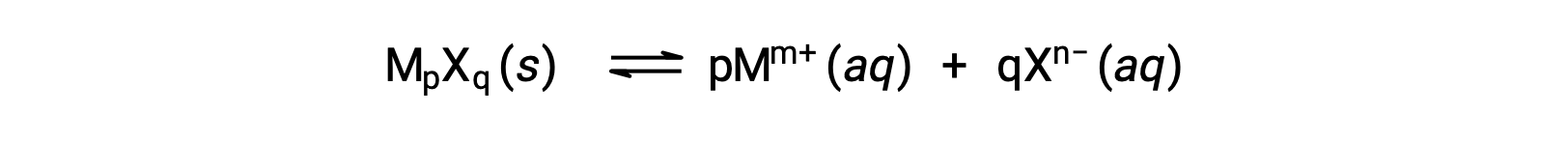
В таких случаях значения KSP могут быть получены из предоставленных растворимости или наоборот. Расчеты такого рода наиболее удобно выполнять с использованием молярной растворимости соединения, измеренной как моли растворенного растворённое вещество на литр насыщенного раствор.
Прогнозирование осадков
Уравнение, описывающее равновесие между твердым карбонатом кальция и его сольватыми ионами, состоит в следующем:
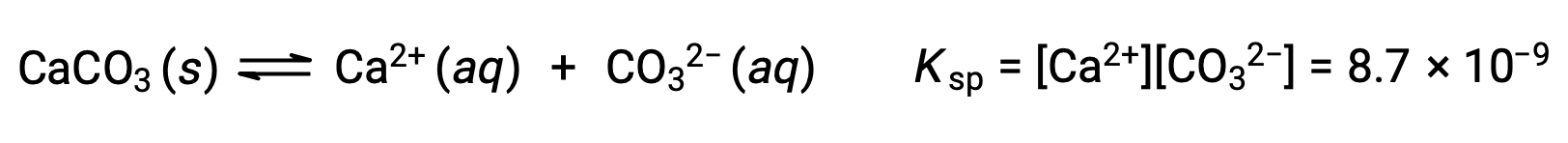
Важно понимать, что это равновесие установлено в любых водных ионах раствор, содержащих ионы Ca2+ и CO32, а не только в раствор, образованной насыщающей водой с карбонатом кальция. Рассмотрим, например, смешивание водных растворов растворимых соединений карбоната натрия и нитрата кальция. Если концентрации ионов кальция и карбоната в смеси не дают реактивного соотита, Q, который превышает продукт растворимости, KSP, то осадки не будут происходить. Если концентрация ионов превышает показатель растворимости, то осадки будут происходить, понижая эти концентрации до тех пор, пока не будет установлено равновесие (Q = KSP). Сравнение Q с KSP для прогнозирования осадков является примером общего подхода к предсказанию направления реакции, впервые введенной в уроках о равновесии. Для конкретного случая равновесия растворимости:
Q < KSP: Реакция идет в прямом направлении (раствор не насыщен; осадки не наблюдаются)
Q > KSP: Реакция идет в обратном направлении (раствор перенасыщен; выпадение осадков происходит)
Этот текст адаптирован из Openstax, Химия 2е изд., раздел 15.1: Осадки и растворение.
Suggested Reading
- Clifford, A. F. "The Prediction of Solubility Product Constants1." Journal of the American Chemical Society 79, no. 20 (1957): 5404-5407.
- Hill, Arthur E. "The Inconstancy Of The Solubility Product." Journal of the American Chemical Society 32, no. 10 (1910): 1186-1193.
- Reynolds, John P. "Ksp experiment: The solubility product for barium hydroxide." Journal of Chemical Education 52, no. 8 (1975): 521.
