17.3:
熱力学の第二法則
17.3:
熱力学の第二法則
ある過程の自発性を予測するための指標の候補の一つに、「エントロピー」があります。系のエントロピーの増加を伴うプロセス( ΔS >0 )は自発的であることが多いが、それとは逆の例も多く知られています。エントロピー変化の考察を周囲の環境にまで広げることで、この性質と自発性の関係について重要な結論を得ることができます。熱力学モデルでは、系とその周辺がすべて、つまり宇宙を構成しているので、次が成立します。

この関係を説明するために、ある系とその外界からなる2つの物体の間で熱が流れる過程を再度考えます。このような過程には3つの可能性があります。
- これらの物体の温度は異なっており、熱は高温の物体から低温の物体へと流れます。これはいかなるときも自発的です。 より高温の物体を系とし、エントロピーの定義を書き下すと次のようになります。
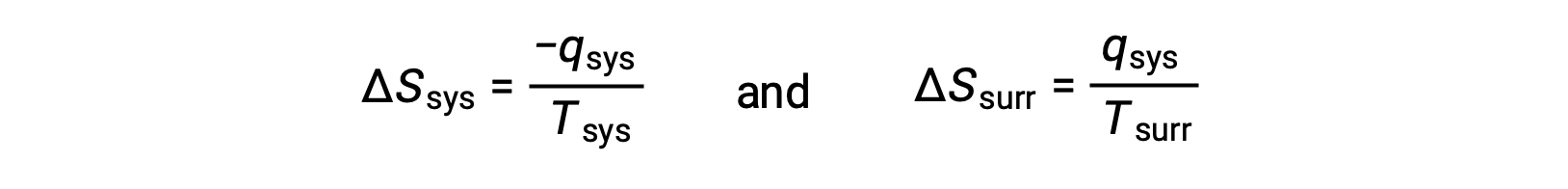
−qsysとqsysの大きさは等しく、それらの反対の符号は系による熱の損失と外界による熱の獲得を示します。この考え方ではTsys > Tsurrであるため、系のエントロピー減少は外界のエントロピー増加よりも小さくなるので、宇宙のエントロピーは増加します。
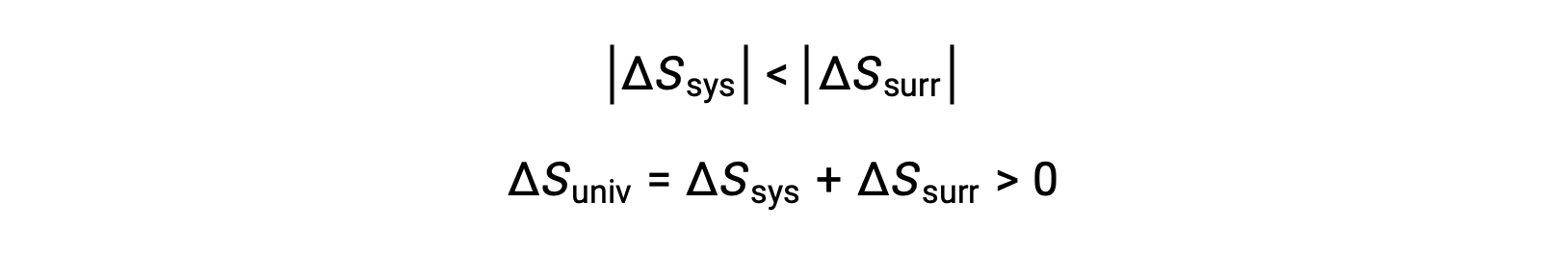
- 温度の異なるこれら2物体において、熱が温度の低い物体から高い物体へと流れる可能性を考えます。これが自発的に起こることは決して観察されません。 再び、高温の物体を系とし、エントロピーの定義を書き下すと、次のようになります。
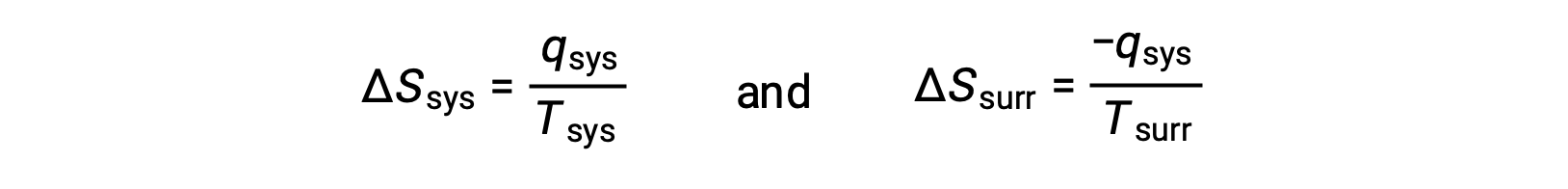
qsys の符号は、系による熱の獲得と外界による熱の損失を表します。外界のエントロピー変化の大きさは系のそれよりも大きくなりますが、この場合、熱変化の符号(つまり熱の流れの方向)により、 ΔSunivは負の値となります。この過程は、宇宙のエントロピーの減少を伴うものです。
- 物体は本質的に同じ温度、Tsys ≈ Tsurrであるため、エントロピー変化の大きさは、系と外界の両方で本質的に同一となります。この場合、宇宙のエントロピー変化はゼロであり、系は平衡状態です。
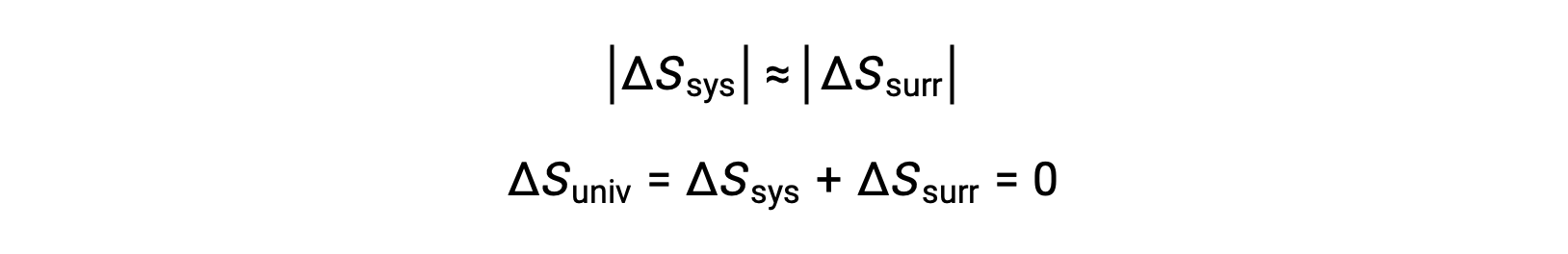
これらの結果は、熱力学の第二法則として知られる、エントロピーと自発性に関する重要な結論を導く。あらゆる自発的変化は、宇宙のエントロピーの増加を引き起こす。 これら3つの関係をまとめたものが下の表です。
| 熱力学の第二法則 | |
| ΔSuniv > 0 | 自発的 |
| ΔSuniv < 0 | 非自発的 (逆方向に自発的) |
| ΔSuniv = 0 | 平衡状態 |
多くの現実的な場合では、系に比べて外界は広大です。このような場合、ある過程の結果として外界で得られた熱や失われた熱は、その全体の熱エネルギーの中では非常に小さく、ほとんど無限小です。例えば、空気中での燃料の燃焼は、反応系(反応している燃料と酸素分子)から無限に巨大な環境(地球の大気)への熱の移動を伴う。その結果、qsurrはqsysの良い近似値となり、第二法則は次のように表すことができます。
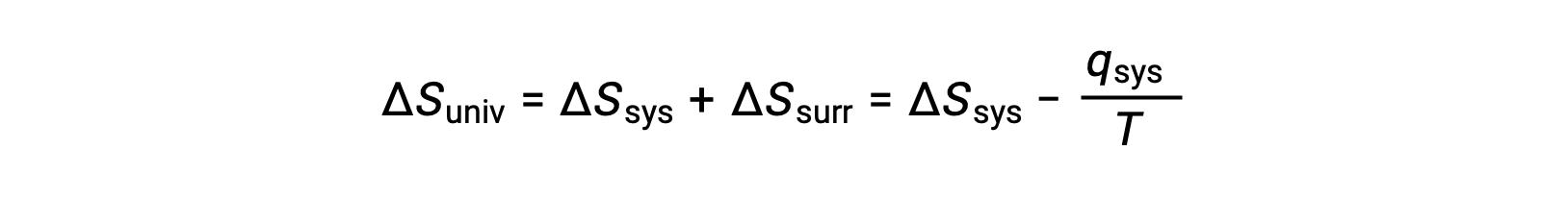
この式は、ある過程の自発性を予測するのに有用です。
上記の文章は以下から引用しました。Openstax, Chemistry 2e, Chapter 16.2: The Second and Third Law of Thermodynamics.
