17.3:
Второй закон термодинамики
17.3:
Второй закон термодинамики
В стремлении определить свойство, которое может достоверно предсказать спонтанность процесса, был выявлен перспективный кандидат: Энтропия. Процессы, которые приводят к увеличению энтропии системы (ΔS > 0), очень часто спонтанные; однако примеров противоположного достаточно. При расширении рассмотрения изменений энтропии с учетом окружающей среды может быть достигнут значительный вывод относительно связи между этим свойством и спонтанностью. В термодинамических моделях система и окружение включают все, то есть вселенную, и поэтому верно следующее:

Чтобы проиллюстрировать это отношение, еще раз рассмотрите процесс теплопотока между двумя объектами, один из которых идентифицирован как система, а другой – как окружающая среда. Существует три возможности для такого процесса:
- Объекты находятся при разных температурах, и тепло поступает от более жаркого объекта к более прохладному. Это всегда наблюдается спонтанно. Назначение более нагретого объекта в качестве системы и вызов определения энтропии приводит к следующему:
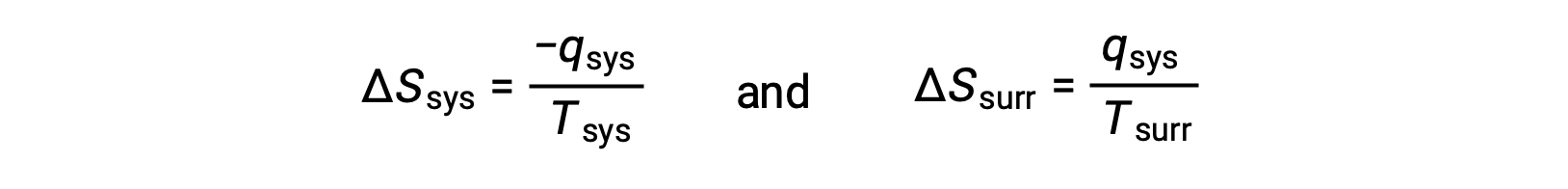
Величины qsys и qsys равны, их противоположные арифметические признаки, обозначающие потерю тепла системой и усиление тепла окружающей средой. Так как в этом сценарии Цys > Цурр, снижение энтропии системы будет меньше, чем возрастания энтропии окружающей среды, и поэтому энтропия Вселенной увеличится:
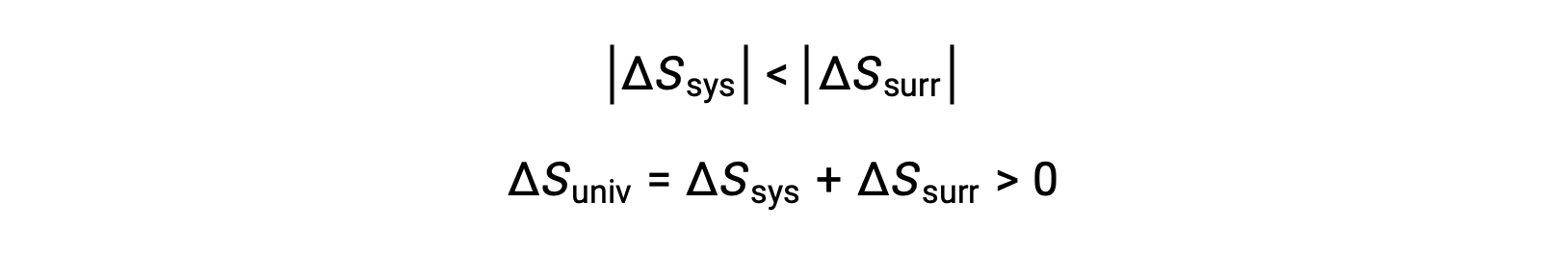
- Объекты находятся при разных температурах, и тепло поступает из охладителя в более горячий объект. Это не наблюдается спонтанно. Повторное назначение объекта с более высокой температурой в качестве системы и вызов определения энтропии приводит к следующему:
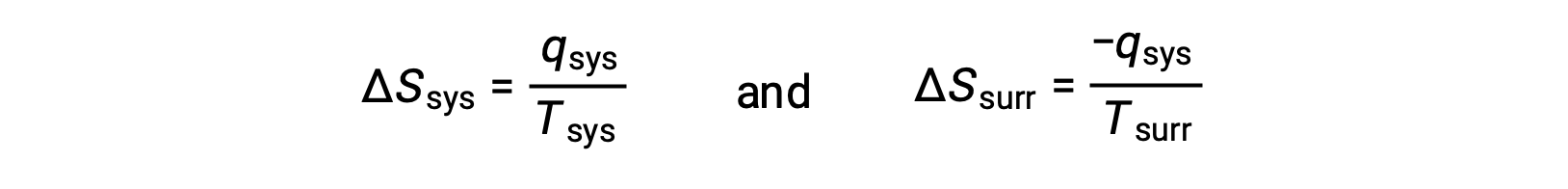
арифметические признаки qsys обозначают усиление тепла системой и потерю тепла окружающей средой. Величина изменения энтропии для окружающей среды снова будет больше, чем для системы, но в этом случае признаки изменения тепла (то есть направления теплопотока) дадут отрицательное значение для ΔSuniv. Этот процесс предполагает снижение энтропии вселенной.
- Объекты по существу имеют одинаковую температуру, Tsys ≈ Tsurr, и поэтому величины изменений энтропии по существу одинаковы как для системы, так и для окружающей среды. В этом случае изменение энтропии вселенной равно нулю, и система находится в равновесии.
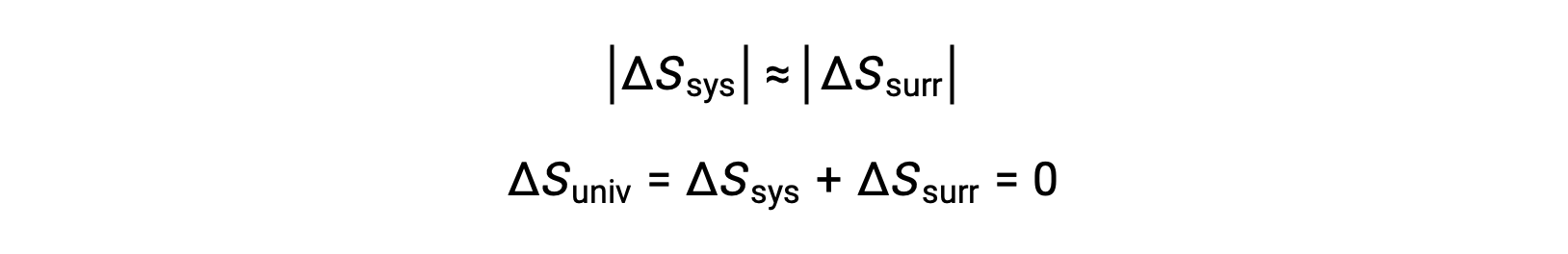
Эти результаты приводят к глубокому утверждению о связи между энтропией и спонтанностью, известной как второй закон термодинамики: Все спонтанные изменения вызывают увеличение энтропии вселенной. Резюме этих трех отношений приводится в таблице ниже.
| Второй закон термодинамики | |
| ΔSuniv > 0 | спонтанно |
| ΔSuniv < 0 | спонтанный (спонтанный в противоположном направлении) |
| ΔSuniv = 0 | равновесие |
Для многих реалистичных приложений окружение огромно по сравнению с системой. В таких случаях тепло, получаемое или теренное окружающей средой в результате какого-либо процесса, представляет собой очень малую, почти бесконечно малую, долю от общей тепловой энергии. Например, сжигание топлива в воздухе включает передачу тепла от системы (молекулы топлива и кислорода, проходящие реакцию) к окружающей среде, которая бесконечно более массивна (атмосфера земли). В результате qsurr является хорошим приближением qsys, и второй закон может быть указан следующим образом:
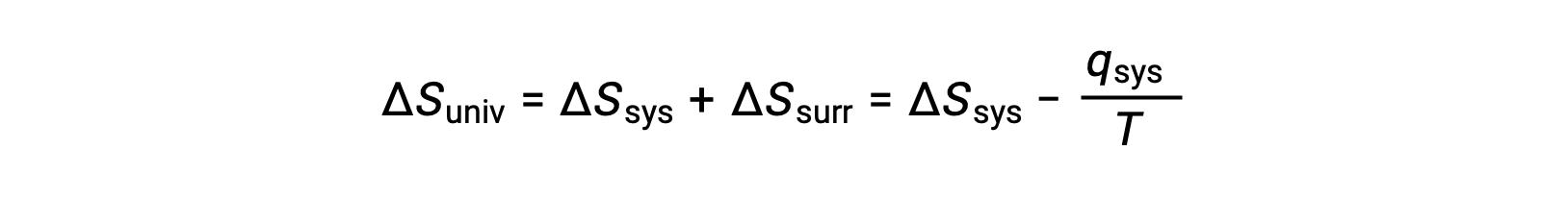
Это уравнение полезно для прогнозирования спонтанности процесса.
Этот текст адаптирован к Openstax, Химия 2е изд., Глава 16.2: Второй и третий Закон термодинамики.
