17.3:
열역학 제2법칙
17.3:
열역학 제2법칙
프로세스의 자발성을 안정적으로 예측할 수 있는 속성을 식별하기 위해 유망한 후보가 확인되었습니다. 시스템의 엔트로피 증가를 포함하는 프로세스 (ΔS > 0)는 매우 자주 자발적입니다; 그러나 반대로 하는 예는 풍부합니다. 주변 환경을 포함하는 엔트로피 변경의 고려를확대함으로써,이 속성과 자발성 사이의 관계에 관한 중요한 결론에 도달 할 수있다. 열역학 모델에서 시스템과 주변은 모든 것, 즉 우주를 구성하므로 다음과 같습니다.

이 관계를 설명하기 위해 두 개체 간의 열 흐름 프로세스를 다시 고려합니다. 이러한 프로세스에는 세 가지 가능성이 있습니다.
- 물체는 온도가 다르고 열은 더 뜨거운 물체에서 쿨러 오브젝트로 흐릅니다. 이것은 항상 자발적으로 발생하는 것으로 관찰됩니다. 더 뜨거운 개체를 시스템으로 지정하고 엔트로피의 정의를 호출하면 다음이 생성됩니다.
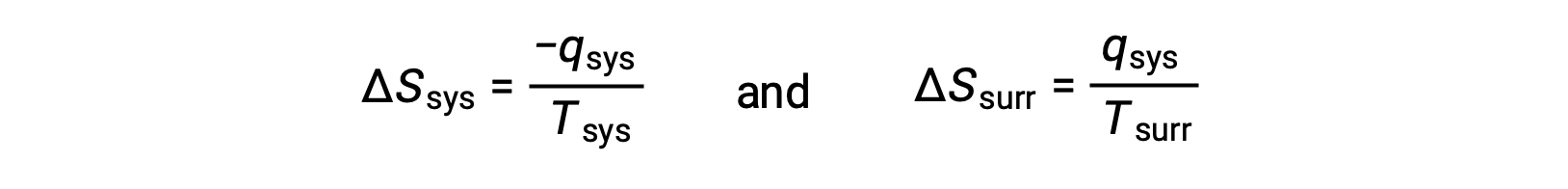
의 크기 –qsys와 qsys는 시스템에 의한 열의 손실을 나타내는 반대 산술 징후와 주변 환경에 의해 열의 이득을 나타내는 그들의 반대 산술 징후입니다. 이 시나리오에서 Tsys > Tsurr 이기 때문에, 시스템의 엔트로피 감소는 주변의 엔트로피 증가보다 적을 것이고, 그래서 우주의 엔트로피가 증가할 것이다:
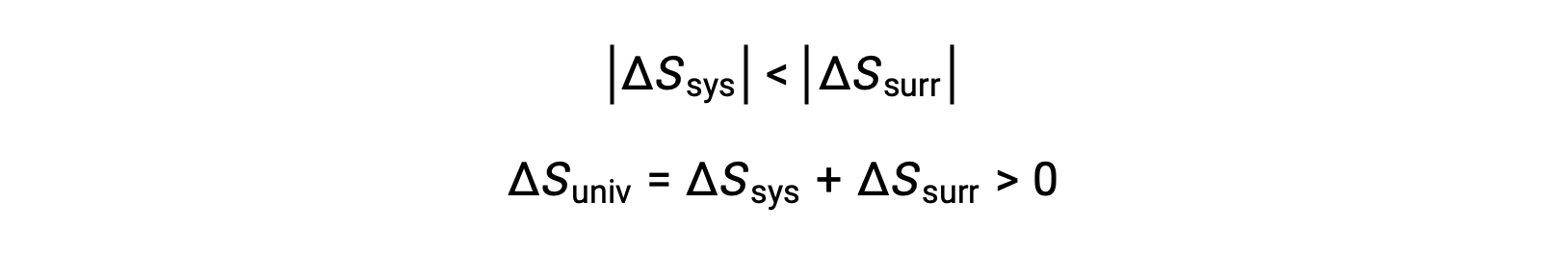
- 오브젝트는 온도가 다르고 열은 쿨러에서 더 뜨거운 물체로 흐릅니다. 이것은 자발적으로 일어나는 것을 관찰하지 않습니다. 다시 더 뜨거운 개체를 시스템으로 지정하고 엔트로피의 정의를 호출하면 다음이 생성됩니다.
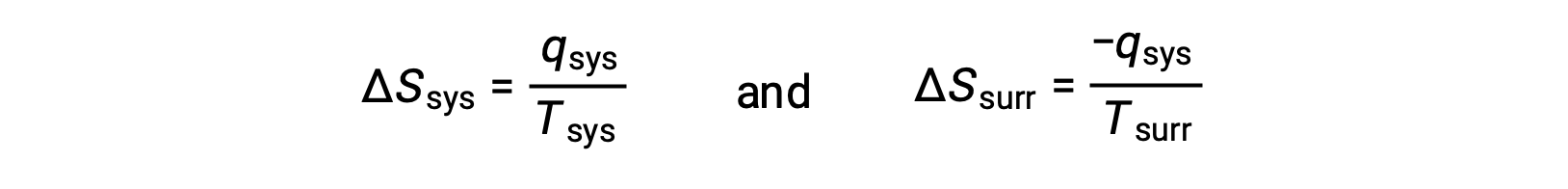
qsys의 산술 징후는 시스템에 의한 열의 이득과 주변 환경에 의한 열 손실을 나타냅니다. 주변 환경에 대한 엔트로피 변화의 크기는 시스템에 대해 다시 그보다 클 것이지만,이 경우 열 변화의 징후 (즉, 열 흐름의 방향)은ΔS대브에대한 음의 값을 산출합니다. 이 과정은 우주의 엔트로피의 감소를 포함한다.
- 물체는 본질적으로 동일한 온도, Tsys ≈ Tsurr,그래서 엔트로피 변화의 크기는 본질적으로 시스템과 주변 모두에 대해 동일합니다. 이 경우, 우주의 엔트로피 변화는 0이며, 시스템은 평형에있다.
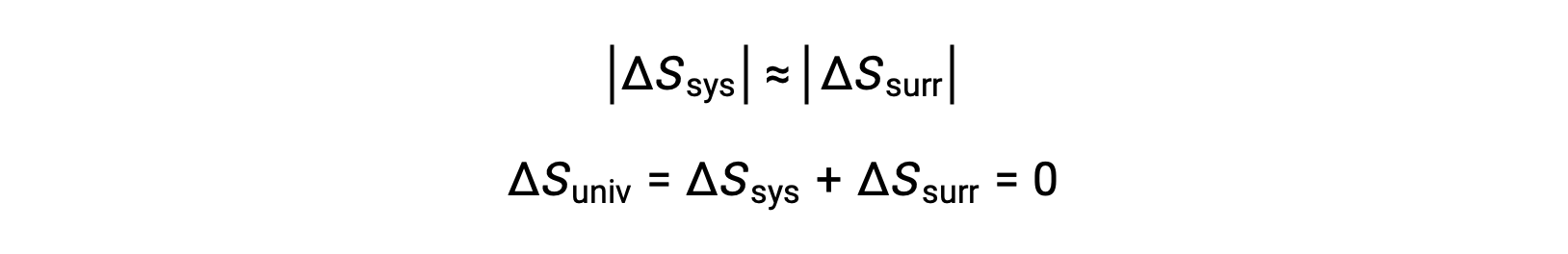
이러한 결과는 열역학의 두 번째 법칙으로 알려진 엔트로피와 자발성 사이의 관계에 관한 심오한 진술로 이어진다: 모든 자발적인 변화는 우주의 엔트로피의 증가를 야기한다. 이 세 가지 관계에 대한 요약은 아래 표에 제공됩니다.
| 열역학의 제2법칙 | |
| ΔS유니브 > 0 | 자발적인 |
| ΔS유니브 & 0 | 비자발적(반대 방향으로 자발적) |
| ΔS대브 = 0 | 평형에서 |
많은 사실적인 응용 프로그램의 경우 주변 환경은 시스템에 비해 광대합니다. 이러한 경우, 일부 공정의 결과로 주변 환경에 의해 얻어지거나 손실되는 열은 총 열 에너지의 매우 작고 거의 무한한 부분을 나타냅니다. 예를 들어, 공기 중연료의 연소는 시스템(반응을 받고 있는 연료 및 산소 분자)에서 무한히 더 거대한 주변 환경(지구 대기)으로 열을 전달하는 것을 포함합니다. 그 결과, qsurr는 qsys의좋은 근사치이며, 두 번째 법은 다음과 같이 명시될 수 있습니다.
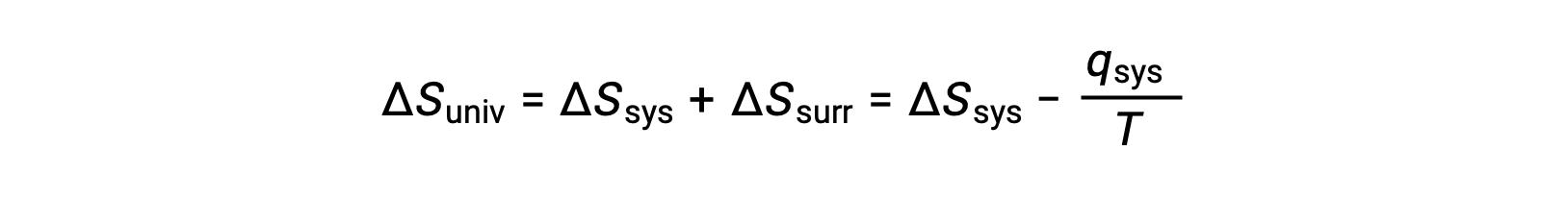
이 방정식은 프로세스의 자발성을 예측하는 데 유용합니다.
이 텍스트는 Openstax, 화학 2e, 제 16.2 장: 열역학의 두 번째 및 세 번째 법칙에서 채택됩니다.
