17.8:
حسابات تغيرات الطاقة الحرة القياسية
17.8:
حسابات تغيرات الطاقة الحرة القياسية
يُطلق على تغيير الطاقة الحرة للتفاعل الذي يحدث في ظل الظروف القياسية لضغط 1 بار وعند 298 كلفن تغيير الطاقة الحرة القياسي. نظرًا لأن الطاقة الحرة هي إحدى وظائف الحالة ، فإن قيمتها تعتمد فقط على ظروف الحالة الأولية والنهائية للنظام. تتمثل الطريقة الملائمة والشائعة لحساب تغيرات الطاقة الحرة للتفاعلات الفيزيائية والكيميائية في استخدام مجموعات متاحة على نطاق واسع من البيانات الديناميكية الحرارية للحالة القياسية.تتضمن إحدى الطرق استخدام المحتوى الحراري القياسي والانتروبيا لحساب تغييرات الطاقة الحرة القياسية، ΔG°، وفقًا للعلاقة التالية.
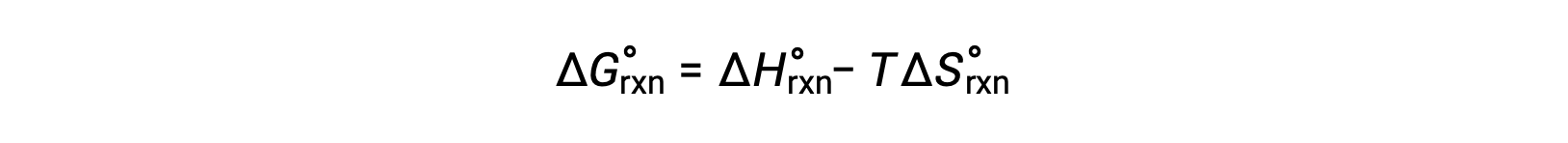
يمكن أيضًا حساب التغير القياسي في الطاقة الحرة للتفاعل من الطاقة الحرة القياسية للتكوين ΔGf° قيم المواد المتفاعلة والنواتج المتضمنة في التفاعل. الطاقة القياسية الحرة للتكوين هي تغيير الطاقة الحرة الذي يصاحب تكوين مول واحد من مادة من عناصرها في حالاتها القياسية. على غرار المحتوى الحراري القياسي للتشكيل، ΔGf° هو بحكم التعريف صفر للمواد الأولية في ظل ظروف الحالة القياسية. للتفاعل
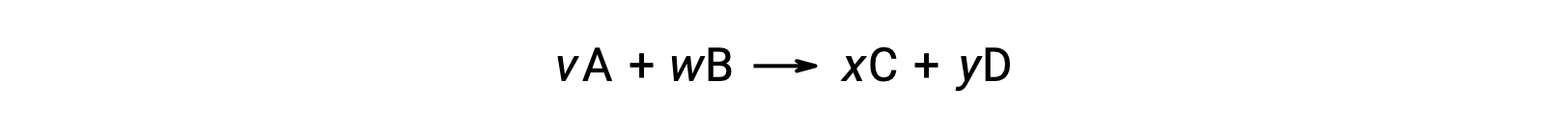
يمكن حساب التغير القياسي في الطاقة الحرة عند درجة حرارة الغرفة على أنه
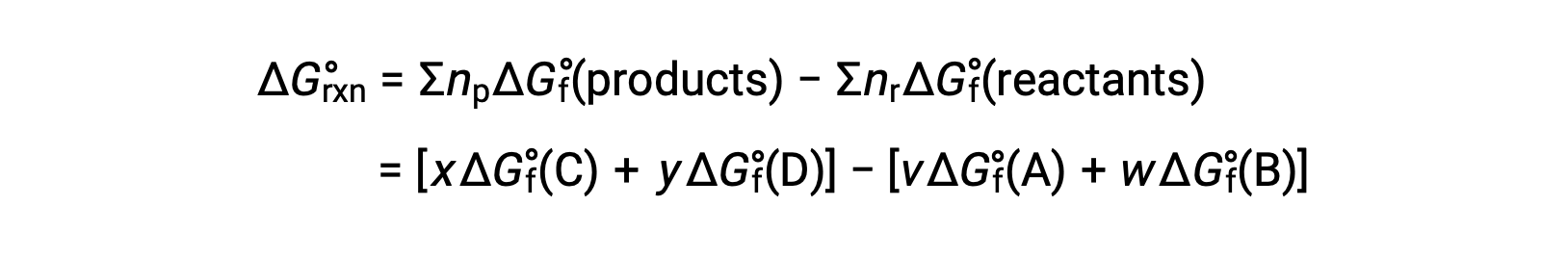
من الممكن استخدام الطاقات الحرة للتكوين لحساب تغيرات الطاقة الحرة للتفاعلات كما هو موضح أعلاه لأن ΔG هي وظيفة حالة ، والنهج مشابه لاستخدام قانون هيس’ يتغير القانون في حساب المحتوى الحراري. فكر في تبخير الماء كمثال:
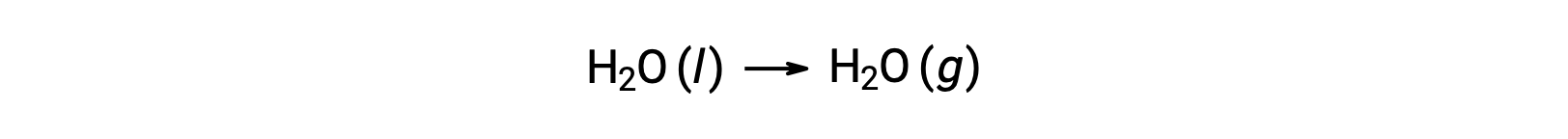
يمكن اشتقاق معادلة تمثل هذه العملية بإضافة تفاعلات التكوين لمرحلتي الماء (بالضرورة عكس تفاعل المرحلة السائلة). تغيير الطاقة الحرة لمجموع التفاعل هو مجموع تغيرات الطاقة الحرة للتفاعلين المضافين:
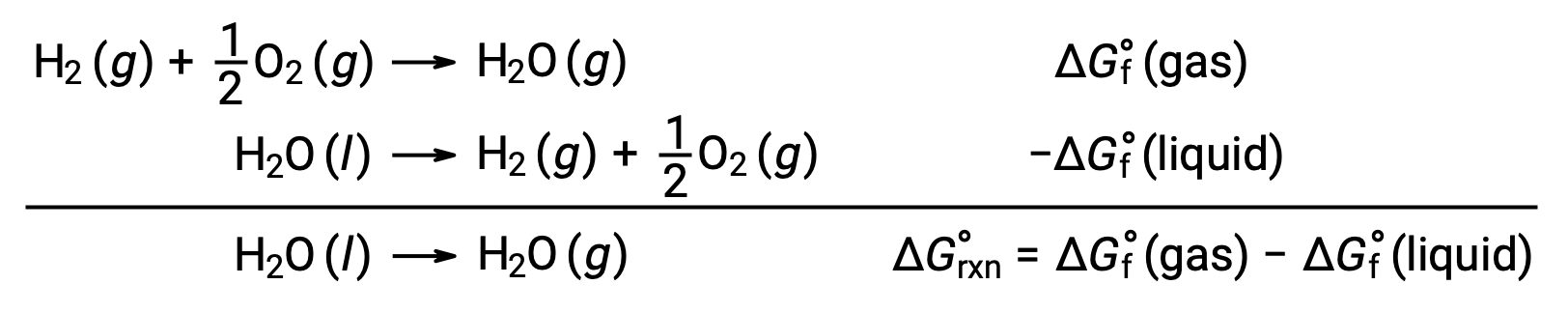
يمكن استخدام هذا الأسلوب أيضًا في الحالات التي يتم فيها تمكين تفاعل غير تلقائي من خلال إقرانه بتفاعل تلقائي. على سبيل المثال ، إنتاج عنصر الزنك من كبريتيد الزنك غير مواتٍ من الناحية الديناميكية الحرارية ، كما يتضح من قيمة موجبة لـ ΔG°1:
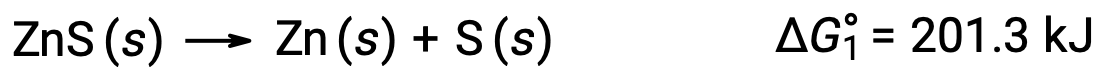
تتضمن العملية الصناعية لإنتاج الزنك من خامات الكبريتيك اقتران تفاعل التحلل هذا مع الأكسدة الديناميكية الحرارية المفضلة للكبريت:

يُظهر التفاعل المقترن تغيرًا سلبيًا في الطاقة الحرة ويكون تلقائيًا:
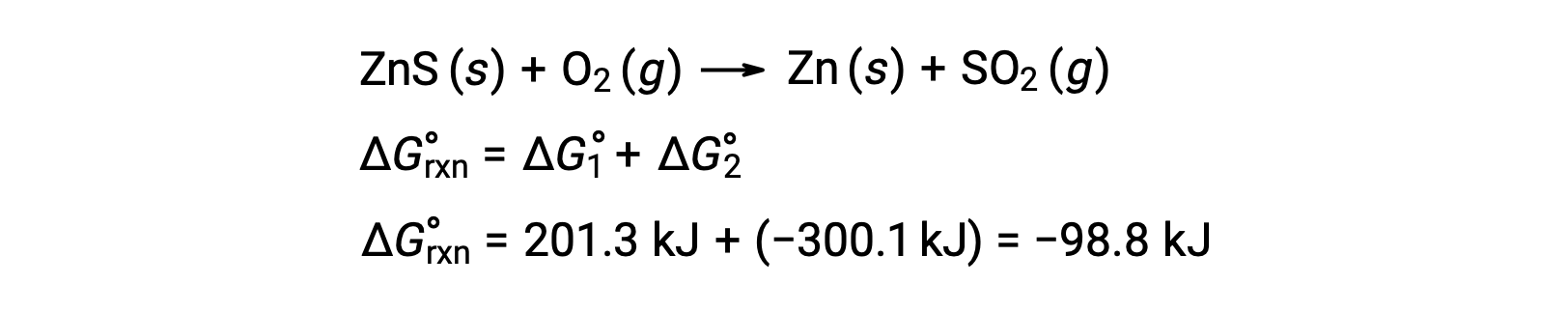
يتم تنفيذ هذه العملية عادةً في درجات حرارة مرتفعة ، لذا فإن هذه النتيجة التي تم الحصول عليها باستخدام قيم الطاقة الحرة القياسية هي مجرد تقدير. ومع ذلك ، فإن جوهر الحساب صحيح.
هذا النص مقتبس من Openstax, Chemistry 2e, Chapter 16.4: Free Energy.
