17.8:
Calcul des variations d'enthalpie libre standard
17.8:
Calcul des variations d'enthalpie libre standard
La variation d’énergie libre pour une réaction qui se produit dans les conditions standard d’une pression de 1 bar et à 298 K est appelée la variation d’énergie libre standard. L’énergie libre étant une fonction d’état, sa valeur dépend uniquement des conditions des états initial et final du système. Une approche pratique et courante pour le calcul des variations d’énergie libre des réactions physiques et chimiques est l’utilisation de compilations largement disponibles de données thermodynamiques à l’état standard. Une méthode consiste à utiliser des enthalpies et des entropies standard pour calculer les variations d’énergie libre standard, ΔG°, selon la relation suivante.
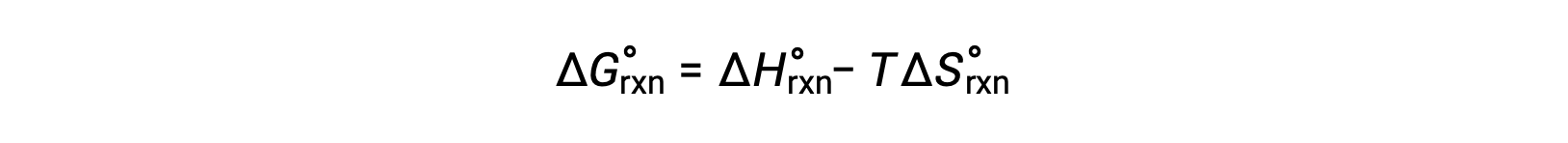
La variation d’énergie libre standard pour une réaction peut également être calculée à partir des valeurs de l’énergie libre standard de formation ΔGf° des réactifs et des produits impliqués dans la réaction. L’énergie libre standard de formation est la variation d’énergie libre qui accompagne la formation d’une mole d’une substance à partir de ses éléments dans leurs états standard. De la même façon que pour l’enthalpie standard de formation, ΔGf° est par définition nul pour les substances élémentaires dans les conditions d’état standard. Pour la réaction
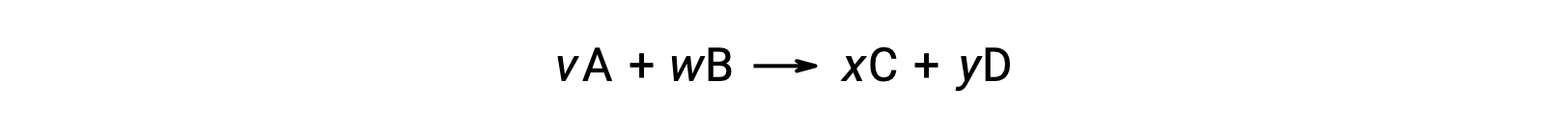
la variation d’énergie libre standard à température ambiante peut être calculée comme suit
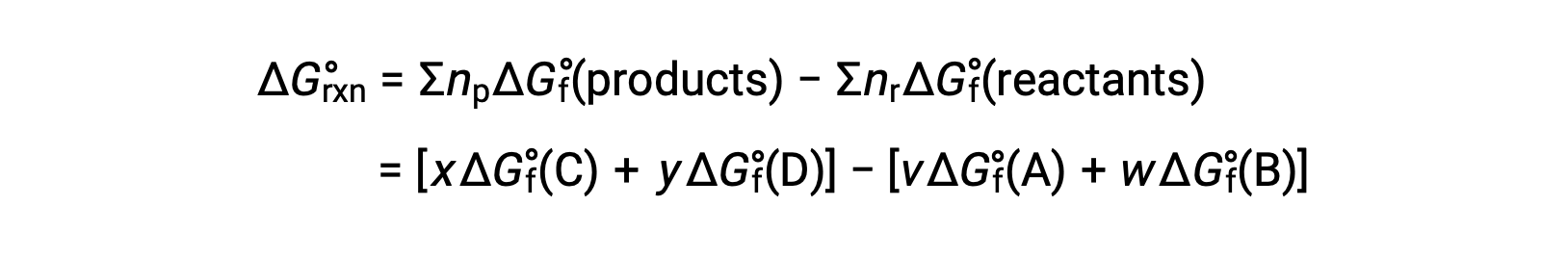
L’utilisation d’énergies libres de formation pour calculer les variations d’énergie libre des réactions comme décrit ci-dessus est possible parce que ΔG est une fonction d’état, et l’approche est analogue à l’utilisation de la loi de Hess dans le calcul des variations d’enthalpie. Prenons l’exemple de la vaporisation de l’eau :
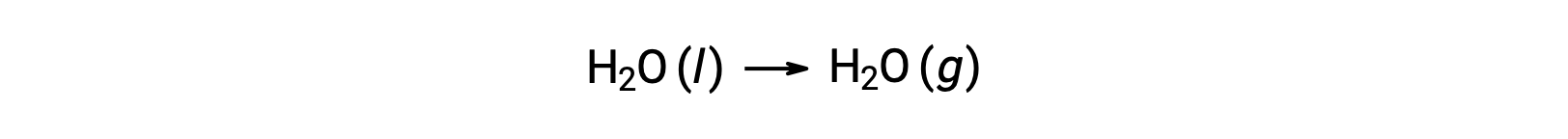
Une équation représentant ce processus peut être déduite en additionnant les réactions de formation pour les deux phases de l’eau (qui inverse nécessairement la réaction pour la phase liquide). La variation d’énergie libre pour la réaction obtenue est la somme des variations d’énergie libre pour les deux réactions additionnées :
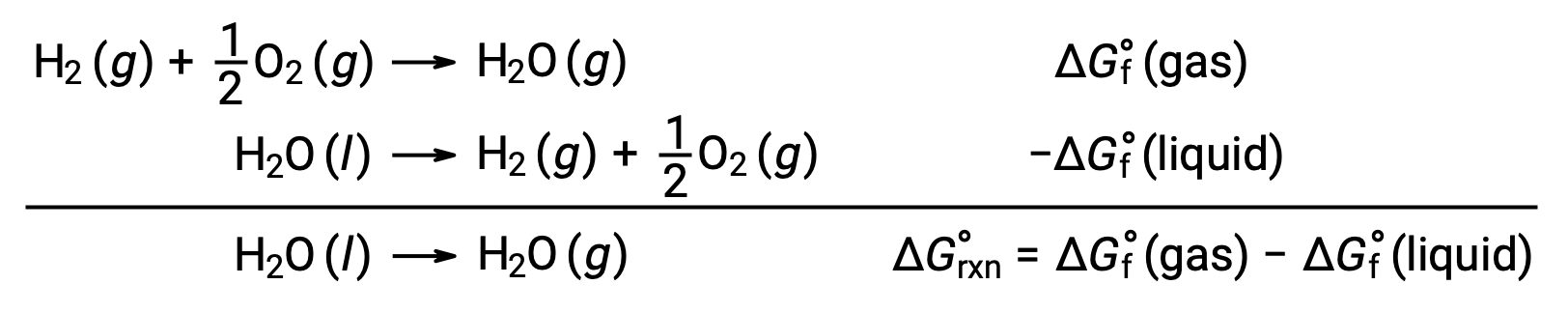
Cette approche peut également être utilisée dans les cas où une réaction non spontanée est activée en la couplant à une réaction spontanée. Par exemple, la production de zinc élémentaire à partir du sulfure de zinc est thermodynamiquement défavorable, comme l’indique la valeur positive de ΔG°1 :
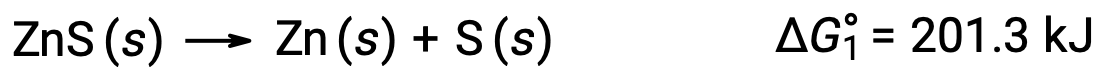
Le procédé industriel pour la production de zinc à partir de minerais de sulfure implique le couplage de cette réaction de décomposition à l’oxydation thermodynamiquement favorable du soufre :

La réaction couplée présente une variation d’énergie libre négative et elle est spontanée :
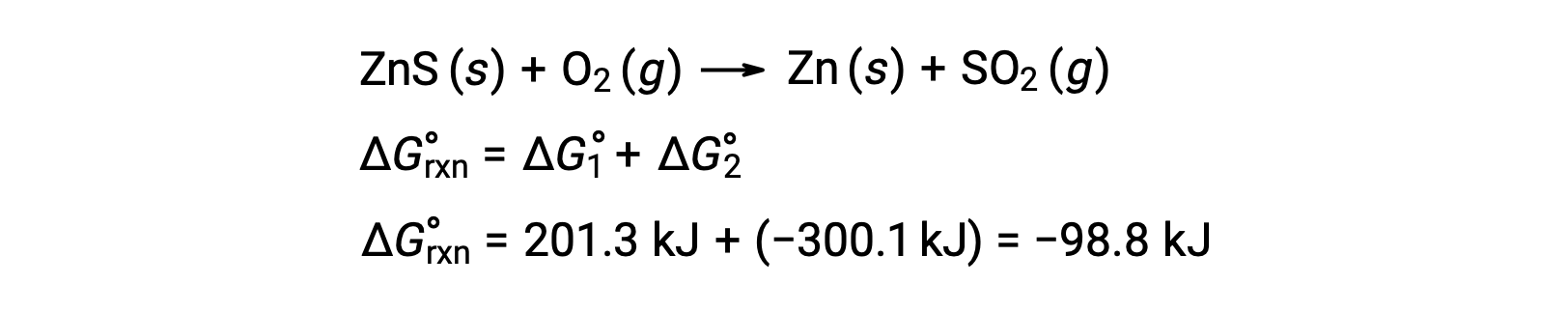
Ce processus est généralement effectué à des températures élevées, de sorte que ce résultat obtenu à l’aide de valeurs d’énergie libre standard n’est qu’une estimation. L’essentiel du calcul, cependant, est vrai.
Ce texte est adapté de Openstax, Chimie 2e, Chapitre 16.4 : Énergie libre.
