17.8:
표준 자유에너지 변화 계산
17.8:
표준 자유에너지 변화 계산
1 바 압력및 298 K의 표준 조건하에서 발생하는 반응에 대한 자유 에너지 변화는 표준 자유 에너지 변화라고합니다. 자유 에너지는 상태 함수이므로 그 값은 시스템의 초기 및 최종 상태의 조건에만 의존합니다. 물리적 및 화학 반응을 위한 자유 에너지 변화 계산에 대한 편리하고 일반적인 접근 방식은 표준 상태 열역학 데이터의 널리 사용되는 컴파일을 사용하는 것입니다. 한 가지 방법은 표준 엔탈피 및 엔트로피의 사용을 사용하여 다음과 같은 관계에 따라 표준 자유 에너지 변화인 ΔG°를계산하는 것입니다.
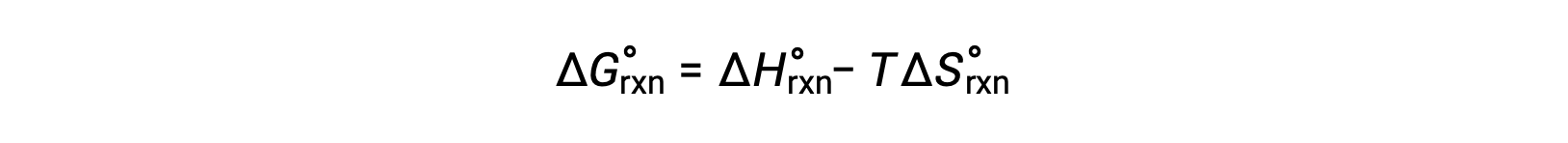
반응에 대한 표준 자유 에너지 변화는 반응에 관여하는 반응제 및 제품의 형성 ΔGf°값의 표준 자유 에너지로부터 계산될 수 있다. 형성의 표준 자유 에너지는 표준 상태에서 원소에서 물질의 한 두더지의 형성을 동반 하는 자유 에너지 변화. 형성의 표준 엔탈피와 유사하게, ΔGf°는 표준 상태 조건하에서 원소 물질에 대한 정의 제로입니다. 반응용
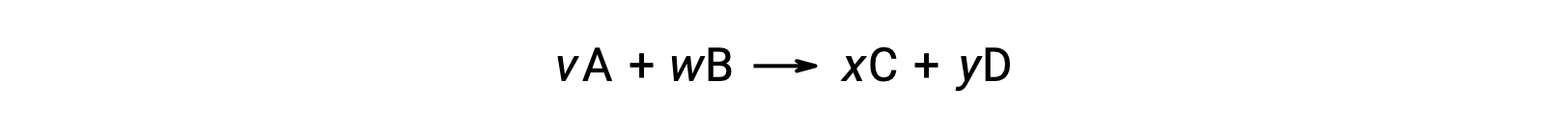
실온에서 의 표준 자유 에너지 변화는
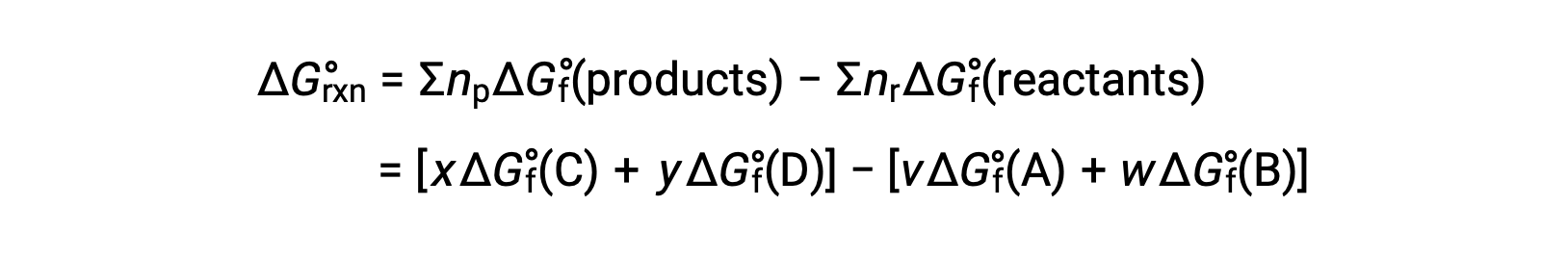
상기와 같이 반응에 대한 자유로운 에너지 변화를 계산하기 위해 형성의 자유로운 에너지를 사용하는 것은 ΔG가 상태 기능이기 때문에 가능하며, 접근 방식은 헤스의 법칙을 컴퓨팅에 사용하는 것과 유사합니다. 물의 기화는 예를 들어 고려하십시오.
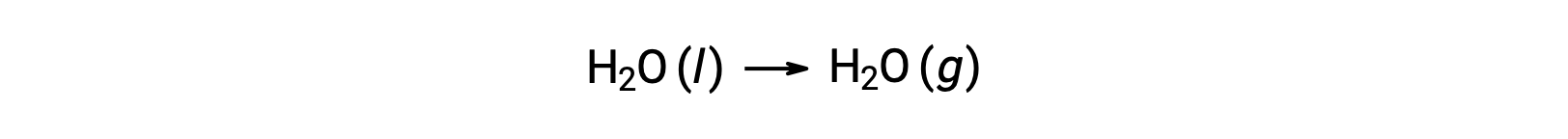
이 과정을 나타내는 방정식은 물의 2상에 대한 형성 반응을 추가하여 도출될 수 있다(반드시 액체 상에 대한 반응을 반전). 합 반응에 대한 무료 에너지 변화는 두 가지 추가 된 반응에 대한 무료 에너지 변화의 합계입니다.
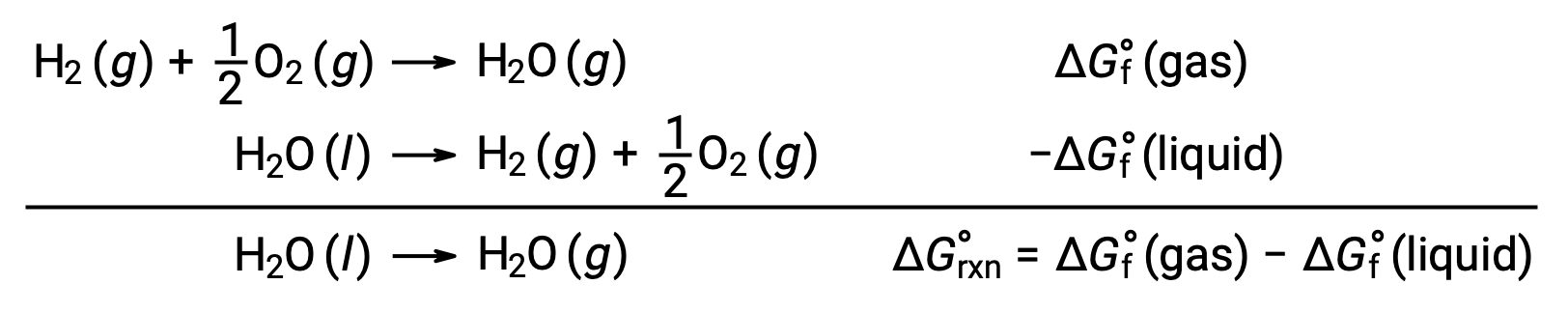
이 접근법은 자발적인 반응에 결합하여 비자발적 반응이 활성화되는 경우에도 사용될 수 있다. 예를 들어, 아연 황화물로부터 원소 아연의 생산은 ΔG°1에대한 양수 값으로 표시된 바와 같이 열역학적으로 불리하다.
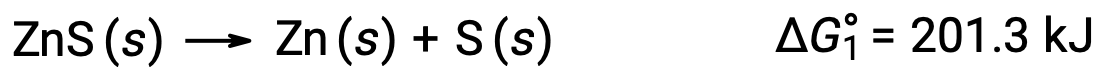
황피액 광석에서 아연의 생산을위한 산업 공정은 황의 열역학적으로 유리한 산화에이 분해 반응을 결합포함 :

결합된 반응은 부정적인 자유로운 에너지 변화를 나타내며 자발적입니다.
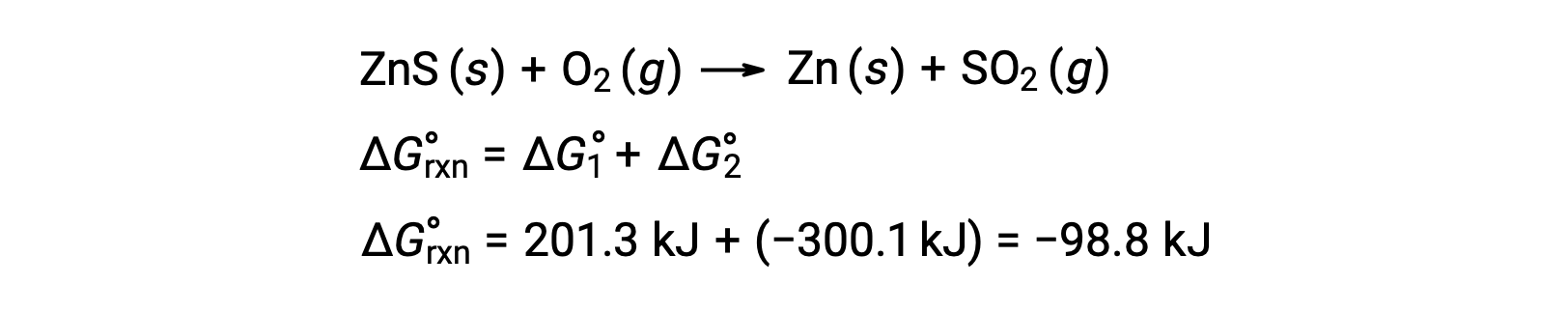
이 과정은 일반적으로 높은 온도에서 수행되므로 표준 자유 에너지 값을 사용하여 얻은 이 결과는 추정치일 뿐입니다. 그러나 계산의 요점은 사실입니다.
이 텍스트는 오픈 탁스, 화학 2e, 장 16.4에서 적응 : 무료 에너지.
