17.8:
计算标准自由能变化
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Calculating Standard Free Energy Changes
对于标准状态下发生的化学反应,可以用以下三种方法之一来计算 它的标准自由能变化。第一种方法是使用反应的 标准ΔG 方程。请考虑氧化钙和二氧化碳 生成碳酸钙的过程。反应的标准焓变 可以从反应中化合物的 生成热来计算,标准熵变可以 由它们的标准摩尔熵来计算。使用参考表中的值,可以确定反应的标准焓变和 标准熵变。将这些值代入 标准自由能变化方程,298 开尔文时反应的标准ΔG 等于 130.7 10³ 焦耳。在第二种方法中,反应的标准自由能变化 由生成物的生成自由能之和 乘以它们的 化学计量系数,与反应物的生成自由能之和 乘以它们的化学计量系数 之差来计算。以氢气和氯气反应 生成两摩尔氯化氢气体为例。像生成焓一样,纯元素的 标准生成自由能为零。因此,氢气和氯气的 生成自由能为零,而氯化氢气体的生成自由能为 95.3 千焦。所以,这个反应的自由能 等于氯化氢气体生成自由能的 2 倍,或者 190.6 千焦。请回想一下盖斯定律,对于分步反应,净焓变可以 由每一步的焓之和来计算。第三种方法以类似方式计算 反应的净自由能变化。请考虑硫化锌燃烧 产生金属锌和二氧化硫气体,在已知标准自由能的情况下,这个反应可以分两步进行。将这些反应的自由能变化相加,得出的总ΔG 为 98.8 千焦耳。请注意,步骤 1 是非自发过程。通过与步骤 2 中的自发反应结合,净反应具有负ΔG,因此是自发过程。
17.8:
计算标准自由能变化
在标准压力为 1 巴且压力为 298 K 时发生的反应的自由能变化称为标准自由能变化。 由于自由能是一个状态函数,因此其值仅取决于系统的初始和最终状态的条件。 计算自由能变化的物理和化学反应的一个方便而常见的方法是使用广泛可用的标准状态热动力学数据汇编。 一种方法是使用标准焓和熵来计算标准自由能变化 ΔG° ,具体取决于以下关系。
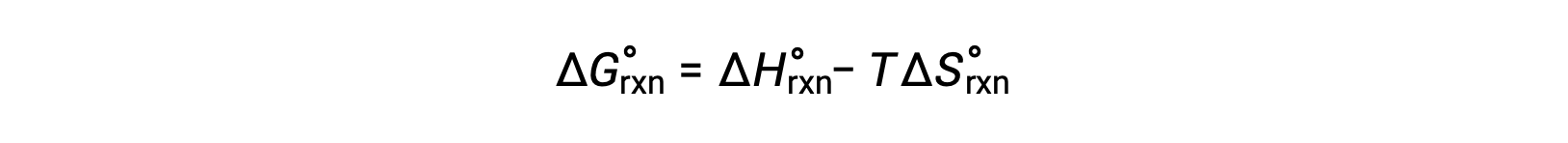
反应的标准自由能变化也可以根据反应中所涉及的反应物和生成物的形成 ΔGf° 值的标准自由能计算。 形成的标准自由能是一种自由能变化,该变化伴随着一种物质在其标准状态中从元素中形成一个摩尔。 与标准的形成焓相似, ΔGf° 在标准状态条件下元素物质的定义为零。 反应
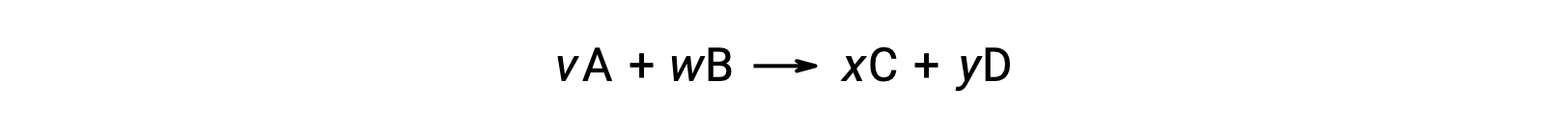
室温下的标准自由能变化可能是 计算为
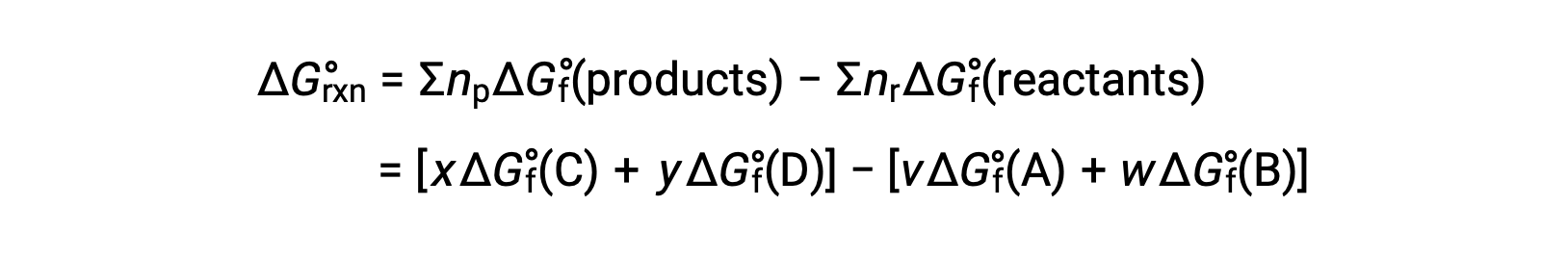
如上所述,可以使用自由形成能量来计算自由能变化的反应,因为 ΔG 是一种状态函数,而这种方法与在计算焓变化时使用赫斯’定律类似。 以汽化 of Water 为例:
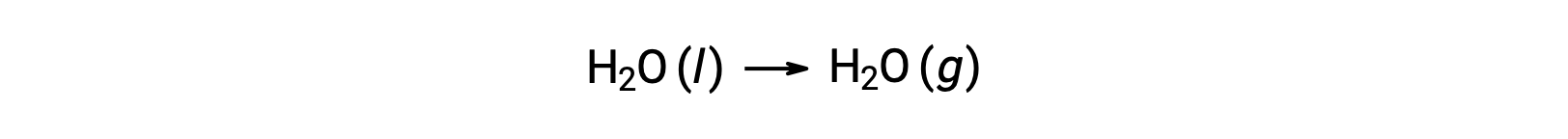
通过添加水的两个相的形成反应 (必须反转液体相的反应) ,可以得出表示此过程的方程。 总和反应的自由能变化是两个新增反应的自由能变化总和:
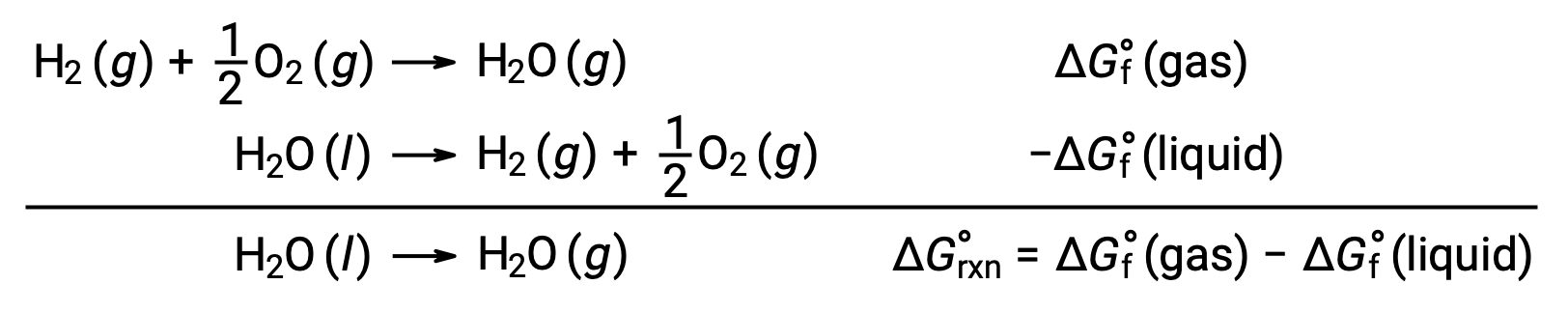
如果非自发反应通过将其与自发反应相结合而得以实现,也可以使用这种方法。 例如,硫化锌元素锌的生产对热动力学不利, ΔG°1 的正值表示:
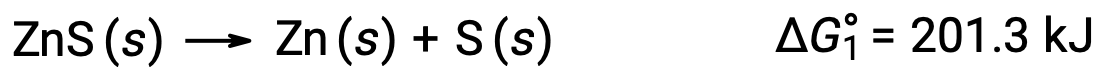
用于从硫酸盐矿石中生产锌的工业过程包括将这种分解反应与热动力学良好的硫氧化结合在一起:

耦合反应呈现负自由能变化,且自发:
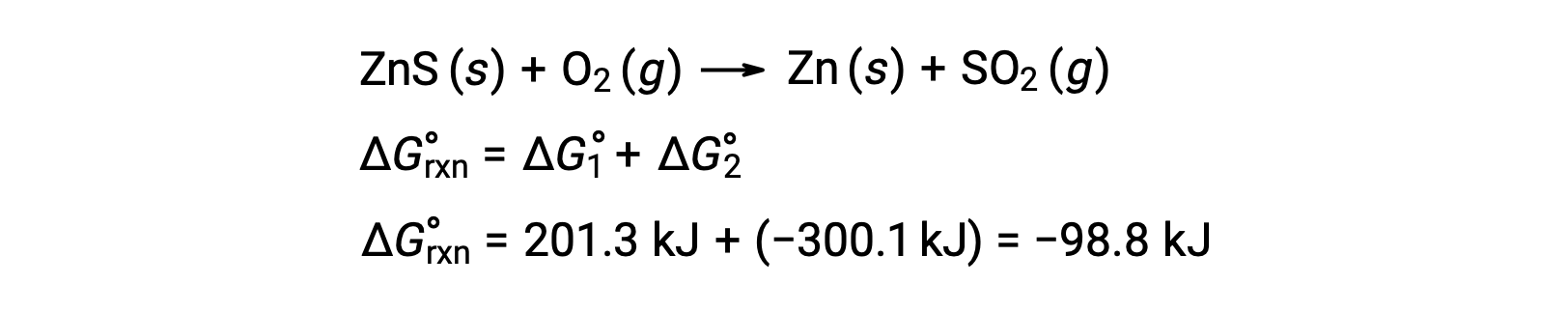
此过程通常在高温下执行,因此使用标准自由能值获得的结果只是一个估计值。 但是,计算的要点是正确的。
Tags
Standard Free Energy ChangeChemical ReactionStandard ConditionStandard ∆GFormationCalcium CarbonateCalcium OxideCarbon DioxideStandard Enthalpy ChangeStandard Entropy ChangeReference TablesStandard Molar Entropies298 KJDifferenceProductsReactantsStoichiometric CoefficientsHydrogen GasChlorine GasHydrogen Chloride Gas
