17.8:
Standart Serbest Enerji Değişimlerinin Hesaplanması
17.8:
Standart Serbest Enerji Değişimlerinin Hesaplanması
1 bar basınçlık ve 298 K’lik standart koşullarda meydana gelen bir reaksiyon için serbest enerji değişimine standart serbest enerji değişimi denir. Serbest enerji bir durum fonksiyonu olduğundan, değeri yalnızca sistemin ilk ve son durumlarının koşullarına bağlıdır. Fiziksel ve kimyasal reaksiyonlar için serbest enerji değişimlerinin hesaplanmasına uygun ve yaygın bir yaklaşım, standart durum termodinamik verilerinin elverişli derlenmelerinin kullanımıyla gerçekleştirilir. Bir metot, aşağıdaki ilişkiye göre standart serbest enerji değişimlerini ΔG° hesaplamak için standart entalpilerin ve entropilerin kullanılmasını içerir.
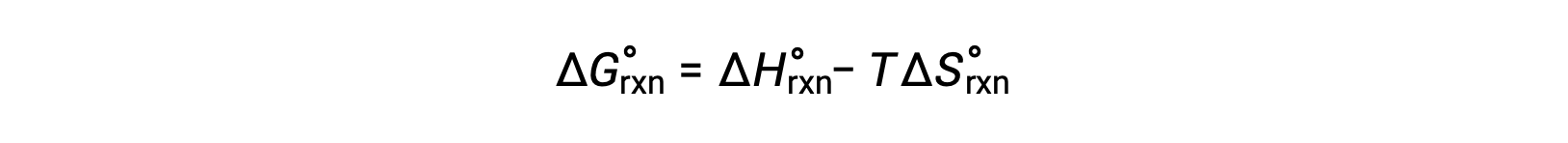
Bir reaksiyon için standart serbest enerji değişimi, reaksiyona katılan reaktanların ve ürünlerin standart serbest oluşum enerjisi ΔGf° değerlerinden de hesaplanabilir. Standart serbest oluşum enerjisi, bir maddenin bir molünün standart hallerindeki elementlerinden oluşumuna eşlik eden serbest enerji değişimidir. Standart oluşum entalpisine benzer şekilde, ΔGf°, standart durum koşulları altında elemental maddeler için tanım gereği sıfırdır. Reaksiyon için
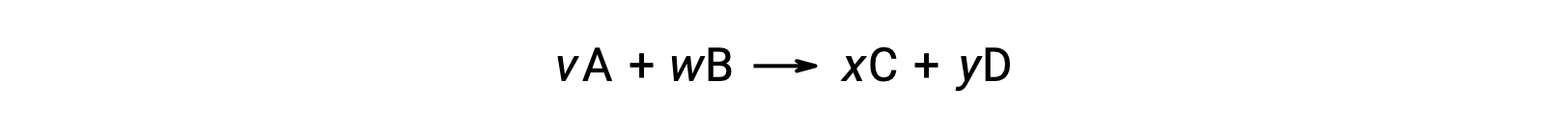
oda sıcaklığında standart serbest enerji değişimi şu şekilde hesaplanabilir
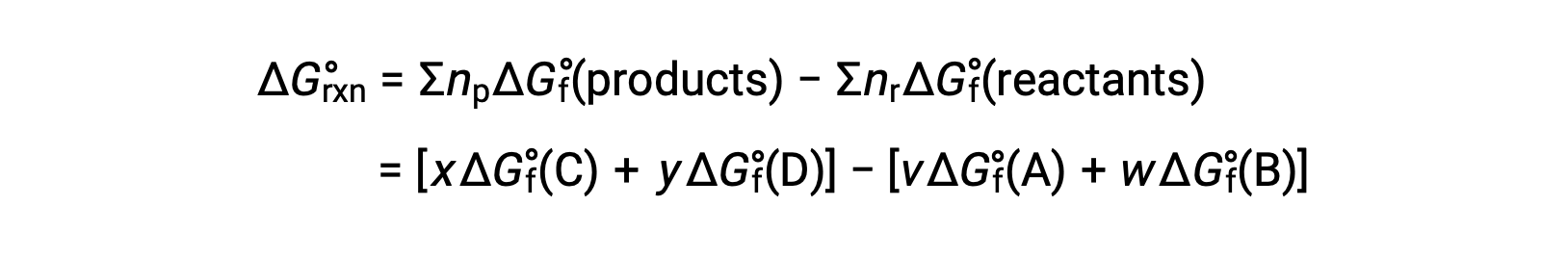
Yukarıda tarif edildiği gibi reaksiyonların serbest enerji değişimlerini hesaplamak için serbest oluşum enerjilerinin kullanılması mümkündür, çünkü ΔG bir durum fonksiyonudur ve yaklaşım, entalpi değişikliklerinin hesaplanmasında Hess Yasasının kullanımına benzerdir. Örnek olarak suyun buharlaşmasını düşünün:
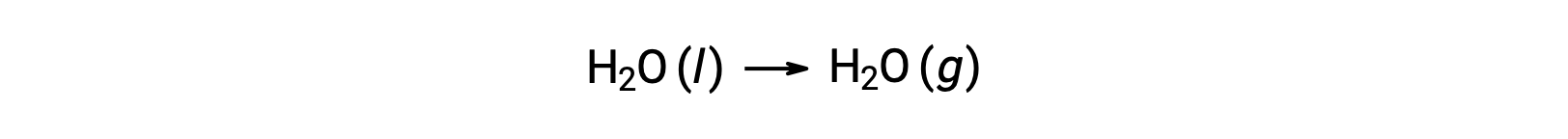
Bu işlemi temsil eden bir denklem, suyun iki fazı için oluşum reaksiyonları eklenerek türetilebilir (sıvı faz için reaksiyonun tersine çevrilmesi gerekir). Toplam reaksiyon için serbest enerji değişimi, eklenen iki reaksiyon için serbest enerji değişikliklerinin toplamıdır:
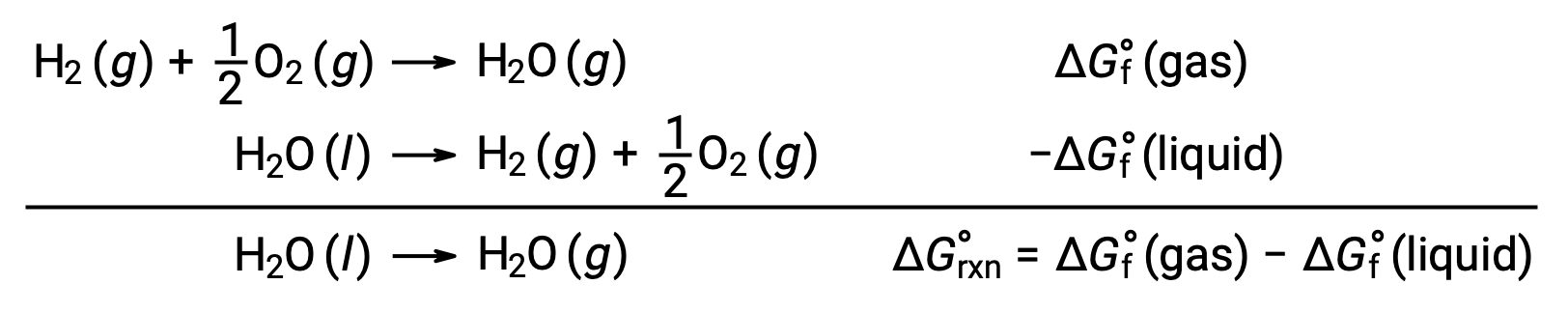
Bu yaklaşım, spontan olmayan bir reaksiyonun spontan bir reaksiyona bağlanmasıyla etkinleştirildiği durumlarda da kullanılabilir. Örneğin, çinko sülfitten elementel çinko üretimi, ΔG°1 için pozitif bir değerle belirtildiği gibi termodinamik olarak elverişsizdir:
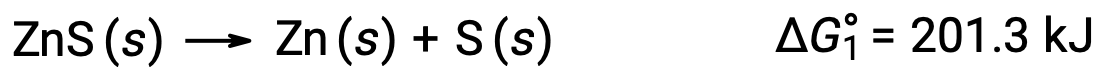
Sülfidik cevherlerden çinko üretimi için endüstriyel işlem, bu ayrışma reaksiyonunun kükürtün termodinamik olarak uygun oksidasyonuna bağlanmasını içerir:

Birleştirilmiş reaksiyon, negatif bir serbest enerji değişimi sergiler ve spontandır:
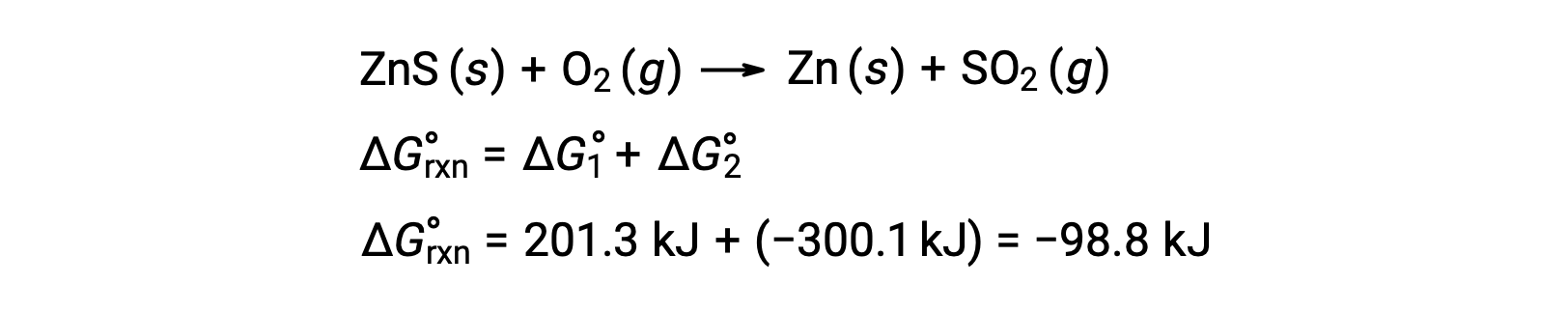
Bu işlem tipik olarak yüksek sıcaklıklarda gerçekleştirilir, bu nedenle standart serbest enerji değerleri kullanılarak elde edilen bu sonuç sadece bir tahmindir. Bununla birlikte, hesaplamanın özü doğrudur.
Bu metin bu kaynaktan uyarlanmıştır: Openstax, Chemistry 2e, Chapter 16.4: Free Energy.
