17.8:
Calculando los Cambios de Energía Libre Estándar
17.8:
Calculando los Cambios de Energía Libre Estándar
El cambio de energía libre para una reacción que ocurre bajo las condiciones estándar de presión de 1 bar y a 298 K se llama cambio de energía libre estándar. Dado que la energía libre es una función de estado, su valor depende sólo de las condiciones de los estados inicial y final del sistema. Un enfoque conveniente y común para el cálculo de los cambios de energía libre para las reacciones físicas y químicas es el uso de compilaciones ampliamente disponibles de datos termodinámicos de estado estándar. Un método implica el uso de entalpías y entropías estándar para calcular los cambios de energía libre estándar, ΔG°, de acuerdo con la siguiente relación.
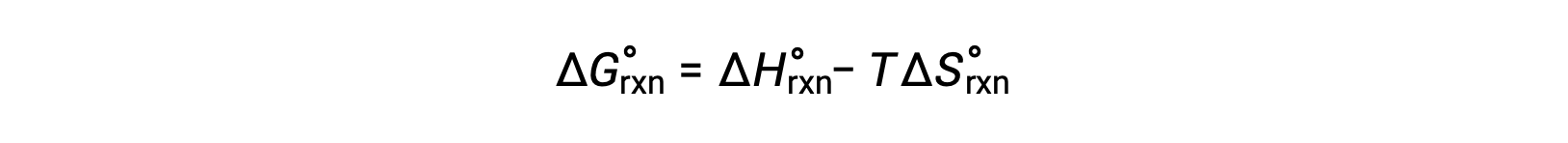
El cambio de energía libre estándar para una reacción también puede calcularse a partir de los valores de energía libre estándar de formación ΔGf° de los reactivos y productos implicados en la reacción. La energía libre estándar de formación es el cambio de energía libre que acompaña la formación de un mol de una sustancia a partir de sus elementos en sus estados estándar. Similar a la entalpía estándar de formación, ΔGf° es por definición cero para sustancias elementales en condiciones de estado estándar. Para la reacción
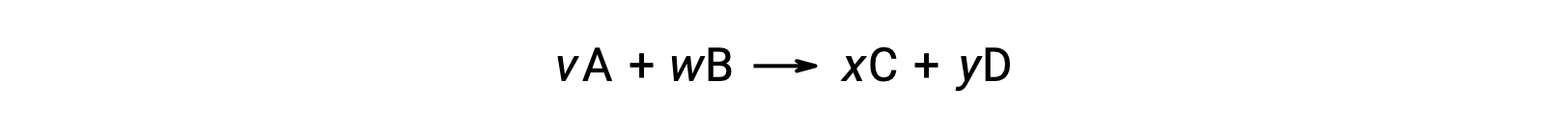
el cambio de energía libre estándar a temperatura ambiente se puede calcular como
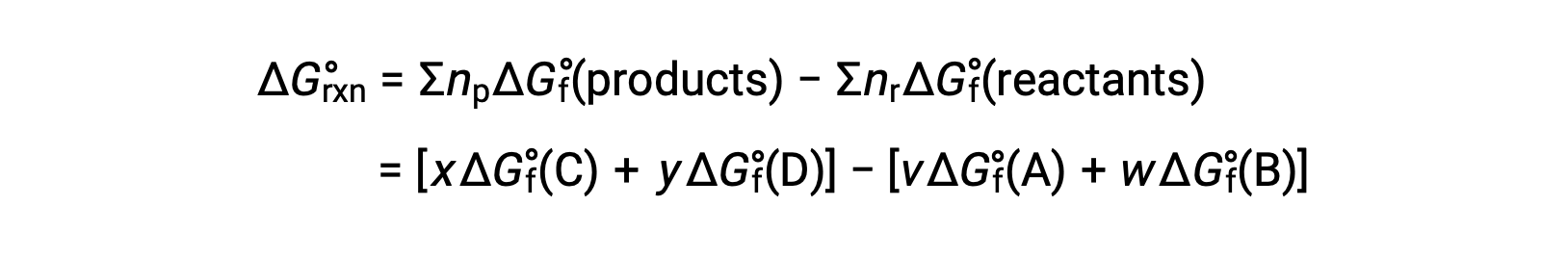
El uso de energías libres de formación para calcular los cambios de energía libre para las reacciones descritas anteriormente es posible porque ΔG es una función de estado, y el enfoque es análogo al uso de la Ley Hess en el cálculo de los cambios de entalpía. Considere la vaporización del agua como un ejemplo:
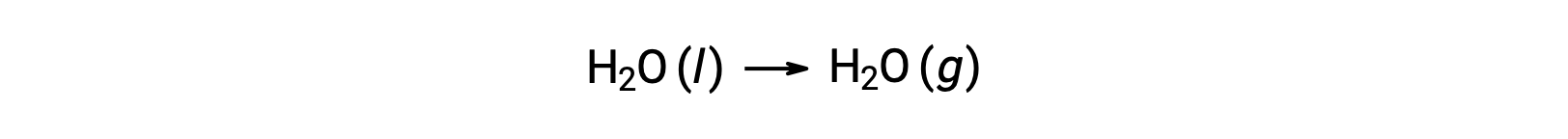
Una ecuación que representa este proceso puede obtenerse agregando las reacciones de formación para las dos fases del agua (necesariamente invirtiendo la reacción para la fase líquida). El cambio de energía libre para la reacción total es la suma de los cambios de energía libre para las dos reacciones sumadas:
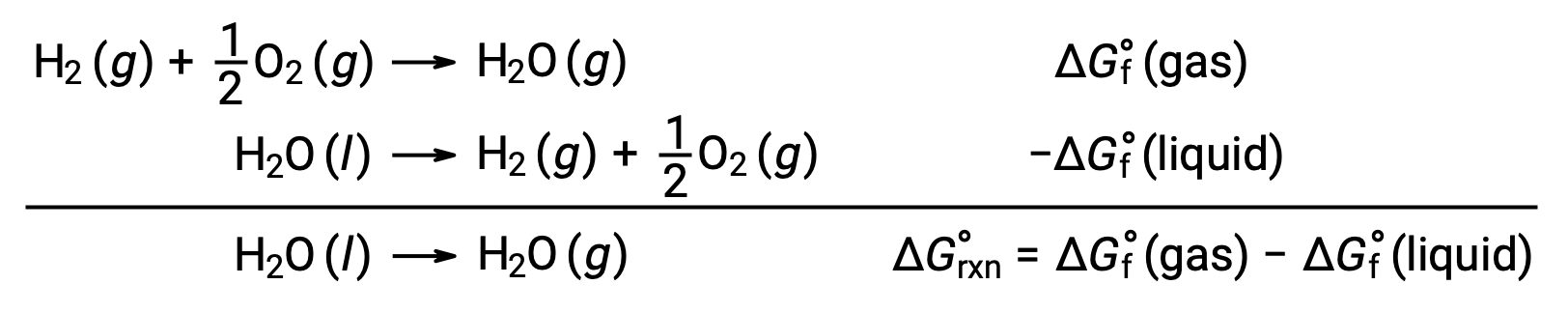
Este enfoque también se puede utilizar en casos en los que se activa una reacción no espontánea acoplándola a una reacción espontánea. Por ejemplo, la producción de zinc elemental a partir de sulfuro de zinc es termodinámicamente desfavorable, como indica un valor positivo para ΔG°1:
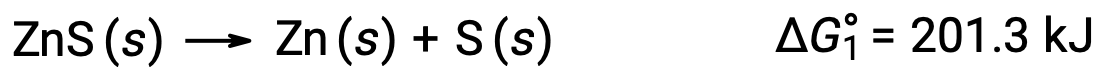
El proceso industrial para la producción de zinc a partir de minerales sulfídicos implica el acoplamiento de esta reacción de descomposición a la oxidación termodinámicamente favorable del azufre:

La reacción acoplada muestra un cambio de energía libre negativo y es espontánea:
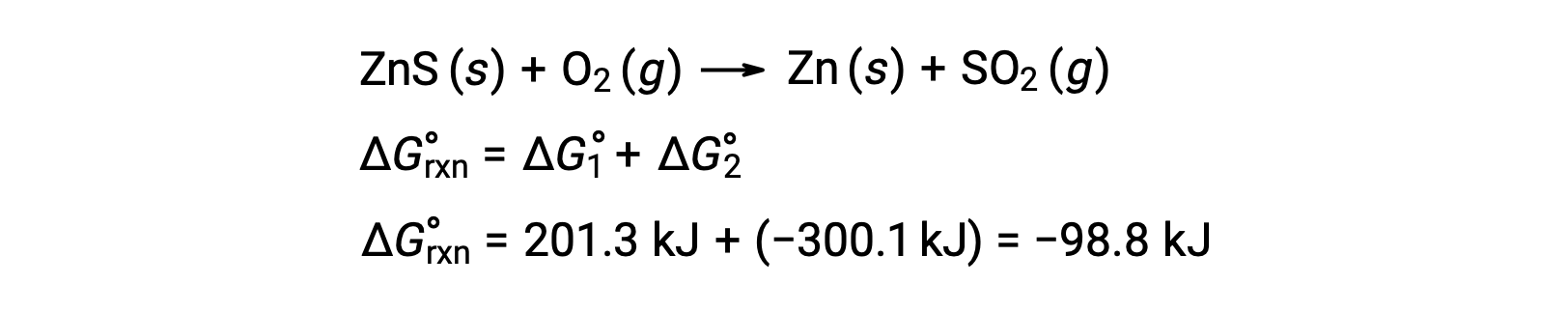
Este proceso se realiza normalmente a temperaturas elevadas, por lo que el resultado obtenido utilizando valores de energía libre estándar es sólo una estimación. Sin embargo, la esencia del cálculo es cierta.
Este texto está adaptado de Openstax, Química 2e, Capítulo 16.4: Energía Libre.
