9.1:
Radioactivité et équations nucléaires
9.1:
Radioactivité et équations nucléaires
La chimie nucléaire est l’étude des réactions qui impliquent des modifications dans la structure nucléaire. Le noyau d’un atome est composé de protons et, à l’exception de l’hydrogène, de neutrons. Le nombre de protons dans le noyau est appelé numéro atomique (Z) de l’élément, et la somme du nombre de protons et du nombre de neutrons est le nombre de masse (A). Les atomes ayant le même numéro atomique mais des nombres de masse différents sont des isotopes du même élément.
Un nucléide d’un élément possède un nombre précis de protons et de neutrons et se trouve dans un état d’énergie nucléaire spécifique. La notation correspondant à un nucléide est 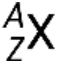 , où X est le symbole de l’élément, A est le nombre de masse et Z est le numéro atomique. Il existe également plusieurs notations raccourcies pour les nucléides, dont beaucoup omettent le numéro atomique. Par exemple,
, où X est le symbole de l’élément, A est le nombre de masse et Z est le numéro atomique. Il existe également plusieurs notations raccourcies pour les nucléides, dont beaucoup omettent le numéro atomique. Par exemple, 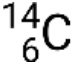 peut être écrit carbone 14, C-14 ou 14C.
peut être écrit carbone 14, C-14 ou 14C.
Si le nucléide est dans un état excité temporaire, il est généralement indiqué par un astérisque. S’il est dans un état excité avec une plus longue durée de vie, appelé un état métastable, cela est indiqué par l’ajout de ‘m’ au nombre de masse. Par exemple, l’isotope technétium 99 existe dans l’état fondamental 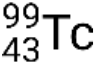 et métastable
et métastable 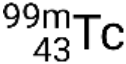 . S’il y a plus d’un état métastable pour un isotope donné, ils sont numérotés par ordre croissant d’énergie. Par exemple, l’isotope tantale 180 possède cinq nucléides : l’état fondamental
. S’il y a plus d’un état métastable pour un isotope donné, ils sont numérotés par ordre croissant d’énergie. Par exemple, l’isotope tantale 180 possède cinq nucléides : l’état fondamental 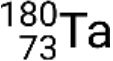 et les états métastables
et les états métastables 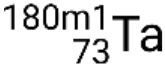 ,
, 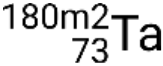 ,
,  , et
, et 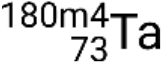 .
.
Les réactions nucléaires sont les transformations d’un ou de plusieurs nucléides en un autre, qui se produisent par des changements dans les nombres atomiques, les nombres de masse ou les états d’énergie nucléaire des noyaux. Pour décrire une réaction nucléaire, nous utilisons une équation qui identifie les nucléides et les particules impliqués dans la réaction. Comme pour les réactions chimiques, les réactions nucléaires obéissent à la conservation de la masse : la somme des nombres de masse des réactifs est égale à la somme des nombres de masse des produits.
De nombreux photons ou particules différentes peuvent être impliqués dans des réactions nucléaires. Les particules les plus courantes sont les particules alpha (α ou 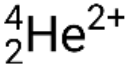 ), qui sont des noyaux d’hélium 4 de haute énergie ; des particules bêta (β), qui comprennent des électrons (e− ou β−) et des positrons (e+ ou β+) ; des rayons gamma (γ) ; des neutrons (
), qui sont des noyaux d’hélium 4 de haute énergie ; des particules bêta (β), qui comprennent des électrons (e− ou β−) et des positrons (e+ ou β+) ; des rayons gamma (γ) ; des neutrons ( 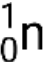 ) ; et des protons (p+ ou
) ; et des protons (p+ ou 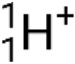 ).
).
Certains nucléides restent intacts indéfiniment, ou sont stables, alors que d’autres se transforment spontanément en d’autres nucléides, ou sont instables. Le changement spontané d’un nucléide instable en un autre est la désintégration radioactive. Le nucléide instable est appelé le nucléide parent, et le nucléide résultant de la désintégration est connu sous le nom de nucléide fille. Le nucléide fille peut être stable, ou il peut se désintégrer lui-même.
Ce texte est adapté de Openstax, Chimie 2e, Section 21.1: Structure et stabilité nucléaires et Openstax, Chimie 2e, Section 21.2 : Équations nucléaires.
Sources supplémentaires
UICPA. Compendium de terminologie chimique, 2e éd. (The Gold Book). Compilé par A. D. McNaught et A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Version en ligne (2019-) créée par S. J. Chalk. https://doi.org/10.1351/goldbook. Accédé le 2021-01-10
Agence internationale de l’énergie atomique, section des données nucléaires. Tableau en direct des nucléides. https://www-nds.iaea.org/relnsd/vcharthtml/VChartHTML.html. Accédé le 2021-01-10
