9.1:
Radiactividad y Ecuaciones Nucleares
9.1:
Radiactividad y Ecuaciones Nucleares
La química nuclear es el estudio de las reacciones que implican cambios en la estructura nuclear. El núcleo de un átomo está compuesto de protones y, excepto el hidrógeno, de neutrones. El número de protones en el núcleo se llama número atómico (Z) del elemento, y la suma del número de protones y el número de neutrones es el número de masa (A). Los átomos con el mismo número atómico pero diferentes números de masa son isótopos del mismo elemento.
Un nucleido de un elemento tiene un número específico de protones y neutrones y se encuentra en un estado específico de energía nuclear. La notación para un nucleido es 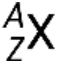 , donde X es el símbolo del elemento, A es el número de masa y Z es el número atómico. También hay varias notaciones taquigráficas para los nucleidos, muchas de las cuales omiten el número atómico. Por ejemplo,
, donde X es el símbolo del elemento, A es el número de masa y Z es el número atómico. También hay varias notaciones taquigráficas para los nucleidos, muchas de las cuales omiten el número atómico. Por ejemplo, 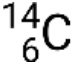 Puede escribirse como carbono-14, C-14 o 14C.
Puede escribirse como carbono-14, C-14 o 14C.
Si el nucleido se encuentra en un estado de excitación temporal, normalmente se indica con un asterisco. Si se encuentra en un estado excitado de larga duración, llamado estado metaestable, esto se denota añadiendo ‘m’ al número de masa. Por ejemplo, el isótopo tecnecio-99 existe en estado fundamental 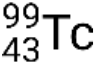 y metaestable
y metaestable 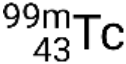 . Si hay más de un estado metaestable para un isótopo dado, se enumeran en orden creciente de energía. Por ejemplo, el isótopo tantalio-180 tiene cinco nucleidos: Estado fundamental
. Si hay más de un estado metaestable para un isótopo dado, se enumeran en orden creciente de energía. Por ejemplo, el isótopo tantalio-180 tiene cinco nucleidos: Estado fundamental 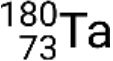 y estados metaestables
y estados metaestables 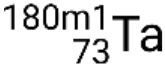 ,
, 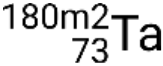 ,
,  , y.
, y. 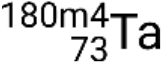 .
.
Las reacciones nucleares son las transformaciones de uno o más nucleidos en otro, que ocurren a través de cambios en los números atómicos, en los números de masa o en los estados de energía de los núcleos. Para describir una reacción nuclear, utilizamos una ecuación que identifica los nucleidos y las partículas involucradas en la reacción. Al igual que con las reacciones químicas, las reacciones nucleares obedecen a la conservación de la masa: La suma de los números de masa de los reactivos equivale a la suma de los números de masa de los productos.
Muchas partículas o fotones diferentes pueden estar involucrados en reacciones nucleares. Los más comunes incluyen partículas alfa (α o. 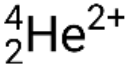 ), que son núcleos de helio-4 de alta energía; partículas beta (β), que incluyen electrones (e− o β−) y positrones (e+ o β+); rayos gamma (γ); neutrones (
), que son núcleos de helio-4 de alta energía; partículas beta (β), que incluyen electrones (e− o β−) y positrones (e+ o β+); rayos gamma (γ); neutrones ( 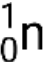 ); y protones (p+ o.
); y protones (p+ o. 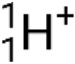 ).
).
Algunos nucleidos permanecen intactos indefinidamente, son estables, mientras que otros se transforman espontáneamente en otros nucleidos, son inestables. El cambio espontáneo de un nucleido inestable en otro es la desintegración radiactiva. El nucleido inestable se llama nucleido padre, y el nucleido que resulta de la desintegración se conoce como nucleido hijo. El nucleido hijo puede ser estable, o puede desintegrarse por sí mismo.
Este texto ha sido adaptado de Openstax, Química 2e, Sección 21.1: Estructura y Estabilidad Nuclear y Openstax, Química 2e, Sección 21.2: Ecuaciones Nucleares.
Fuentes adicionales
IUPAC. Compendio de terminología química, 2da ed. (El "Libro de oro":). Compilado por A. D. McNaught y A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Versión en línea (2019-) creada por S. J. Chalk. https://doi.org/10.1351/goldbook. Consultado el 2021-01-10
Organismo Internacional de Energía Atómica, Sección de Datos Nucleares. Carta viva de nucleidos. https://www-nds.iaea.org/relnsd/vcharthtml/VChartHTML.html. Consultado el 2021-01-10
