9.1:
Radioatividade e Equações Nucleares
9.1:
Radioatividade e Equações Nucleares
A química nuclear é o estudo das reações que envolvem mudanças na estrutura nuclear. O núcleo de um átomo é composto por protões e, excepto para o hidrogénio, neutrões. O número de protões no núcleo é chamado de número atómico (Z) do elemento, e a soma do número de protões e do número de neutrões é o número de massa (A). Átomos com o mesmo número atómico, mas números de massa diferentes são isótopos do mesmo elemento.
Um nuclídeo de um elemento tem um número específico de protões e neutrões e está em um estado de energia nuclear específico. A notação para um nuclídeo é 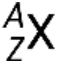 , onde X é o símbolo do elemento, A é o número de massa, e Z é o número atómico. Existem também várias notações mais curtas para nuclídeos, muitas das quais omitem o número atómico. Por exemplo,
, onde X é o símbolo do elemento, A é o número de massa, e Z é o número atómico. Existem também várias notações mais curtas para nuclídeos, muitas das quais omitem o número atómico. Por exemplo, 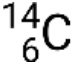 pode ser escrito carbono-14, C-14, ou 14C.
pode ser escrito carbono-14, C-14, ou 14C.
Se o nuclídeo estiver em um estado excitado temporário, isso é normalmente indicado com um asterisco. Se estiver em um estado excitado de longa duração, chamado de estado metastável, isso é denotado adicionando ‘m’ ao número de massa. Por exemplo, o isótopo tecnécio-99 existe como estado fundamental 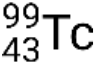 e metastável
e metastável 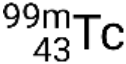 . Se houver mais de um estado metastável para um dado isótopo, eles são numerados por ordem crescente de energia. Por exemplo, o isótopo tântalo-180 tem cinco nuclídeos: o estado fundamental
. Se houver mais de um estado metastável para um dado isótopo, eles são numerados por ordem crescente de energia. Por exemplo, o isótopo tântalo-180 tem cinco nuclídeos: o estado fundamental 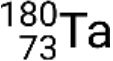 e estados metastáveis
e estados metastáveis 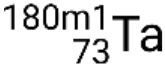 ,
, 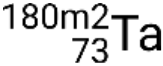 ,
,  , e
, e 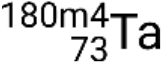 .
.
As reações nucleares são as transformações de um ou mais nuclídeos para outro, que ocorrem através de alterações nos números atómicos, números de massa, ou estados de energia nuclear dos núcleos. Para descrever uma reação nuclear, utilizamos uma equação que identifica os nuclídeos e as partículas envolvidas na reação. Tal como acontece com as reações químicas, as reações nucleares obedecem à conservação da massa: a soma dos números de massa dos reagentes equivale à soma dos números de massa dos produtos.
Muitas partículas ou fotões diferentes podem estar envolvidos em reações nucleares. Os mais comuns incluem partículas alfa (α ou 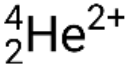 ), que são núcleos de hélio-4 de alta energia; partículas beta (β), que incluem eletrões (e− ou β−) e positrões (e+ ou β+); raios gama (γ); neutrões (
), que são núcleos de hélio-4 de alta energia; partículas beta (β), que incluem eletrões (e− ou β−) e positrões (e+ ou β+); raios gama (γ); neutrões (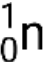 ); e protões (p+ ou
); e protões (p+ ou 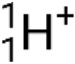 ).
).
Alguns nuclídeos permanecem intactos indefinidamente, ou são estáveis, enquanto que outros se transformam espontaneamente em outros nuclídeos, ou são instáveis. A mudança espontânea de um nuclídeo instável para outro é o decaimento radioativo. O nuclídeo instável é chamado de nuclídeo pai, e o nuclídeo que resulta do decaimento é conhecido como nuclídeo filha. O nuclídeo filha pode ser estável, ou pode decair.
Este texto é adaptado de Openstax, Chemistry 2e, Section 21.1: Nuclear Structure and Stability e Openstax, Chemistry 2e, Section 21.2: Nuclear Equations.
Fontes Adicionais
IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compilado por A. D. McNaught e A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Versão online (2019-) criada por S. J. Chalk. https://doi.org/10.1351/goldbook. Acedido a 2021-01-10
International Atomic Energy Agency, Nuclear Data Section. Live Chart of Nuclides. https://www-nds.iaea.org/relnsd/vcharthtml/VChartHTML.html. Acedido a 2021-01-10
