20.10:
颜色和磁性
20.10:
颜色和磁性
配位化合物中的颜色
当原子或分子以适当的频率吸收光线时,它们的电子会被更高能量的轨道激发。 对于许多主要的组原子和分子,吸收光子处于电磁光谱的紫外线范围内,这是人眼无法检测到的。 对于配位化合物, d 轨道之间的能量差通常允许吸收和发射可见范围内的光子,这被人眼视为颜色。
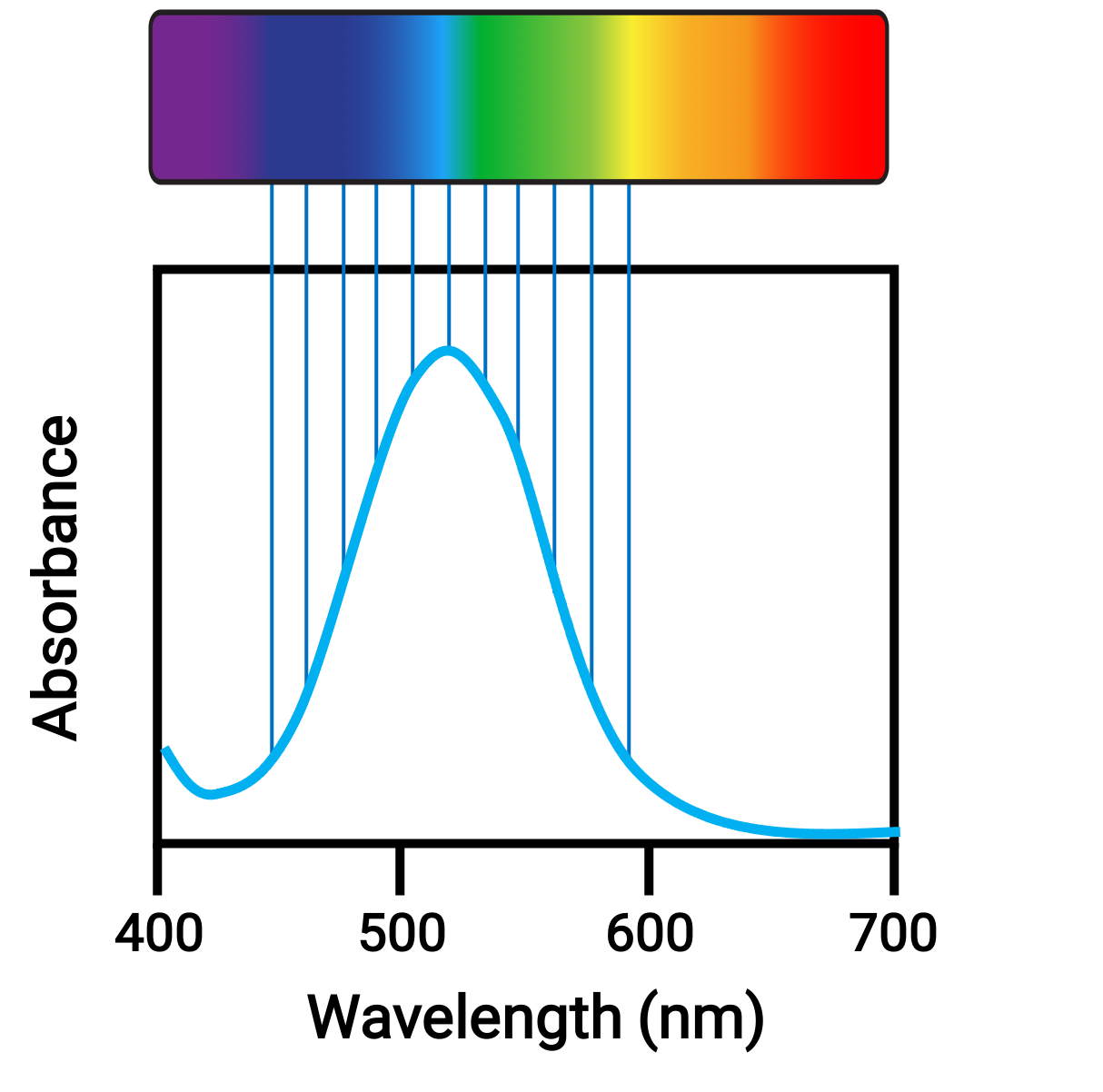
图 1. 可见光和吸光的电磁频谱。
电子在轨道之间转换的相对能量的微小变化可能导致吸收光的颜色发生剧烈变化。 因此,配位化合物的颜色取决于许多因素,例如:
• 不同的水性金属离子具有不同的颜色。
• 一种金属的不同氧化状态会产生不同的颜色。
• 与金属中心协调的特定配体会影响配位化合物的颜色。 例如,铁 (II) 化合物 [Fe (H2O) 6]SO4 呈蓝色 – 绿色,因为高旋转化合物吸收红色波长的光子。 相比之下,低转子铁 (II) 化合物 K4[Fe (CN) 6] 由于吸收了能量较高的紫色光子,因此呈淡黄色。
通常,强磁场配体会导致中心金属原子的 d 轨道能量 (大 Δ) 发生大分裂。 带有这些配体的过渡金属配位化合物为黄色,橙色或红色,因为它们吸收了能量更高的紫色或蓝色光。
另一方面,带有弱射野配体的过渡金属 of 配位化合物通常为蓝绿色,蓝色或靛蓝,因为它们吸收了低能量的黄色,橙色或红色光。 用于分割 d 轨道的配体的强度列于光谱化学系列中。 此处的配体以晶体场分割能量 (Δ) 的值增加而书写。
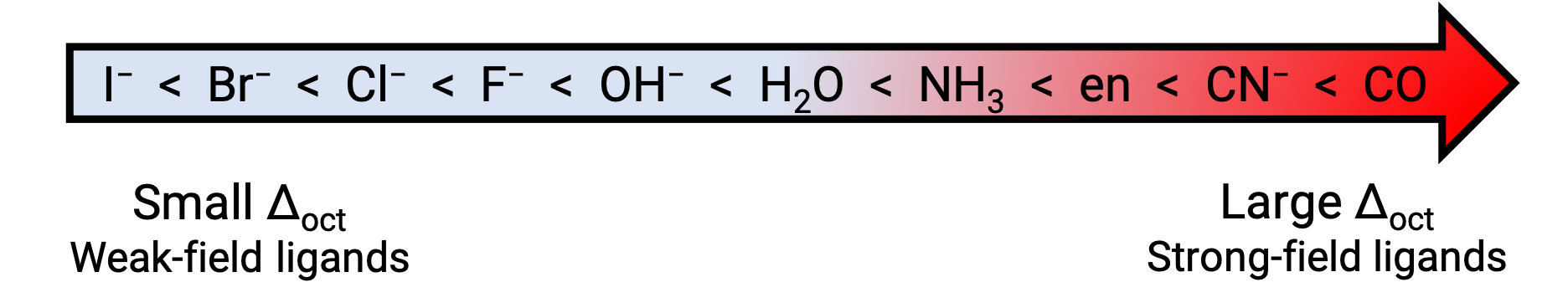
图 2. 光谱化学系列。
例如, Cu+ 离子的配位化合物具有 d10 配置,所有轨道均已填充。 要使电子达到更高水平 (如 4p 轨道) ,必须使用极高能量光子。 该能量对应于光谱紫外区域极短的波长。 没有可见光被吸收,所以眼睛看不到变化,化合物显示为白色或无色。 例如,包含 [Cu (CN) 2]− 的溶液无色。 另一方面,八面体 Cu2+ 化合物在轨道等方面有一个空缺,电子可以达到这一水平。 吸收的光线的波长 (能量) 与频谱的可见部分相对应, Cu2+ 化合物几乎总是彩色的—蓝色,蓝色 – 绿色紫色或黄色。
配位化合物中的磁性
磁性测量的实验证据支持高和低自旋化合物理论。 含未配对电子的分子 (如含氧量) 为准磁性分子。 准磁性物质被磁场吸引。 许多过渡金属化合物都有未配对的电子,因此是准磁性的。 氮气等分子以及不含未配对电子的 Na+ 和 [Fe (CN)6]4− 等离子是双核。 Diamagnic 物质有被磁场排斥的轻微倾向。
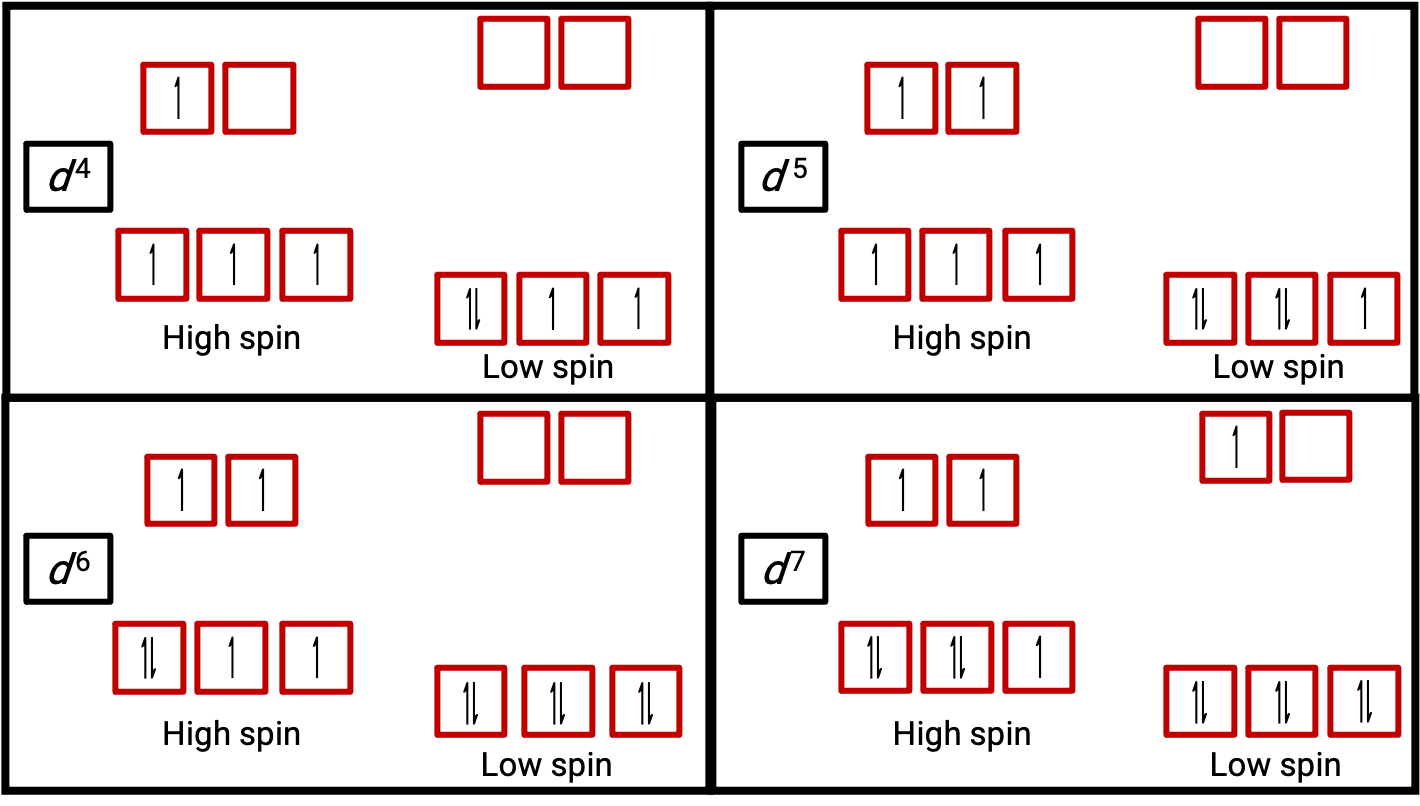
图 3. D4 , D5 , d6 和 D7 系统的八面体络合物高和低自旋状态的轨道图。 这种区别不能用于 D1 , D2 , D3 , D5 , D8 , D9 和 d10 系统。
当原子或离子中的电子不成对时,其旋转产生的磁力矩会使整个原子或离子成为准磁性。 包含未配对电子的系统的磁力矩大小与这些电子的数量直接相关:未配对电子的数量越大,磁力矩越大。 因此,观察到的磁力矩用于确定存在的未配对电子数。 测得的低自旋 d6 [Fe (CN) 6]4− 的磁力矩确认铁是直径,而高自旋 d6 [Fe (H2O) 6]2+ 有四个未配对电子,其磁力矩确认了这种排列 (图 2)。
