20.10:
Couleurs et magnétisme
20.10:
Couleurs et magnétisme
Couleur dans les complexes de coordination
Lorsque des atomes ou des molécules absorbent de la lumière à la fréquence appropriée, leurs électrons sont excités vers des orbitales de plus haute énergie. Pour beaucoup d’atomes et de molécules du groupe principal, les photons absorbés se trouvent dans la plage ultraviolette du spectre électromagnétique, qui ne peut pas être détectée par l’œil humain. Pour les composés de coordination, la différence d’énergie entre les orbitales d leur permet souvent d’absorber et d’émettre des photons dans la plage visible, ce qui est considéré comme des couleurs par l’œil humain.
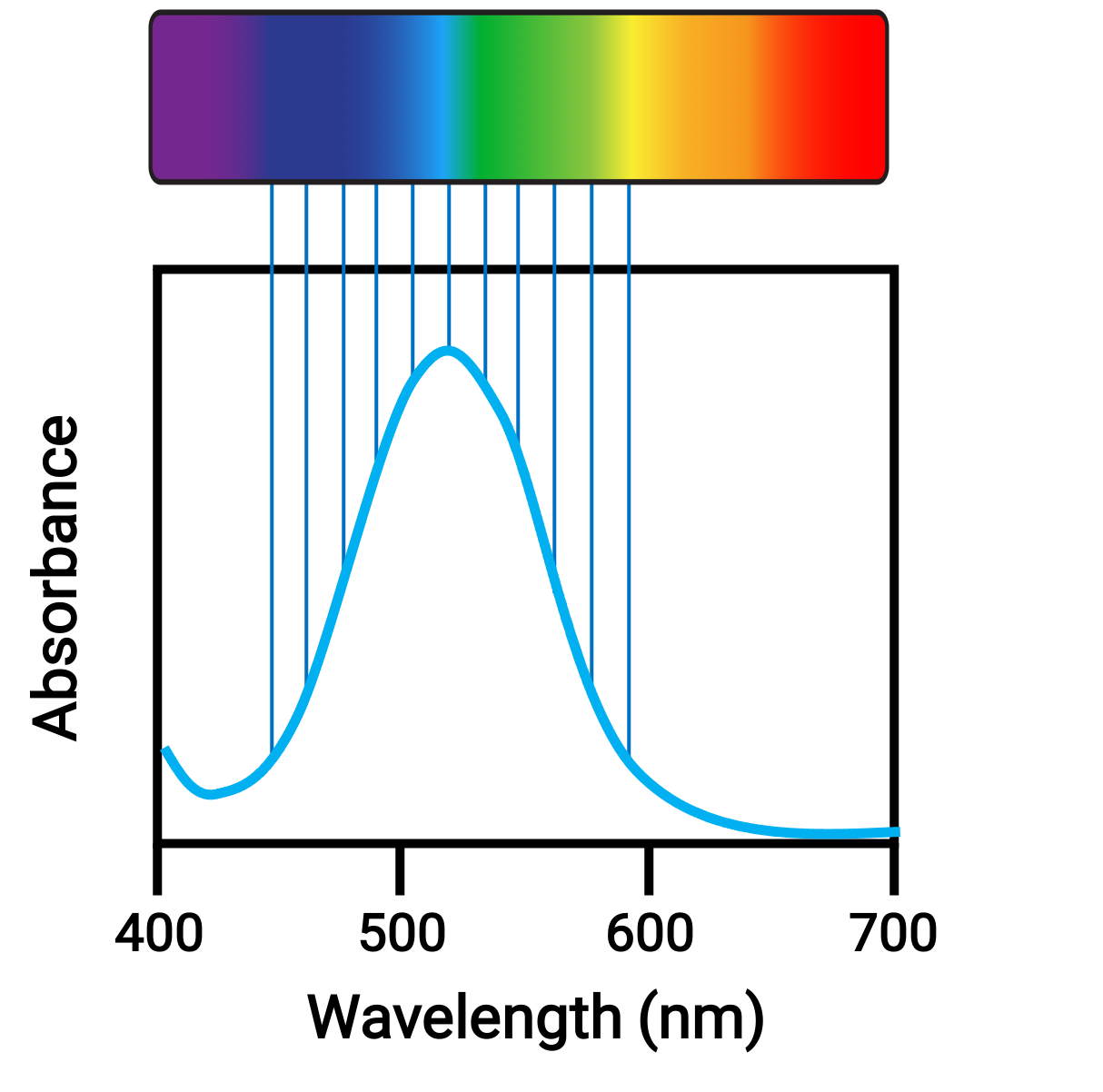
Figure 1. Spectre électromagnétique de la lumière visible et absorption.
De petites variations dans les énergies relatives des orbitales entre lesquelles les électrons transitent peuvent entraîner des changements radicaux dans la couleur de la lumière absorbée. Par conséquent, les couleurs des composés de coordination dépendent de nombreux facteurs, comme :
• Des ions métalliques aqueux différents peuvent avoir différentes couleurs ;
• Les différents états d’oxydation d’un métal peuvent produire différentes couleurs ;
• Des ligands particuliers coordonnés au centre métallique influencent la couleur des complexes de coordination. Par exemple, le complexe du Fer(II) [Fe(H2O)6]SO4 paraît bleu-vert parce que le complexe à haut spin absorbe les photons dans les longueurs d’onde du rouge. En revanche, le complexe du fer(II) à bas spin K4[Fe(CN)6] paraît jaune pâle car il absorbe les photons violets de plus haute énergie.
En général, les ligands à champ fort provoquent un grand dédoublement des énergies des orbitales d de l’atome métallique central (Δ grand). Les composés de coordination des métaux de transition avec ces ligands sont jaune, orange ou rouge parce qu’ils absorbent la lumière violette ou bleue de plus haute énergie.
D’autre part, les composés de coordination des métaux de transition avec des ligands à champ faible sont souvent bleu-vert, bleu ou indigo parce qu’ils absorbent la lumière jaune, orange ou rouge de faible énergie. La force des ligands permettant de dédoubler les orbitales d est indiquée dans la série spectrochimique. Ici, les ligands sont inscrits suivant la valeur croissante de l’énergie de dédoublement du champ cristallin (Δ).
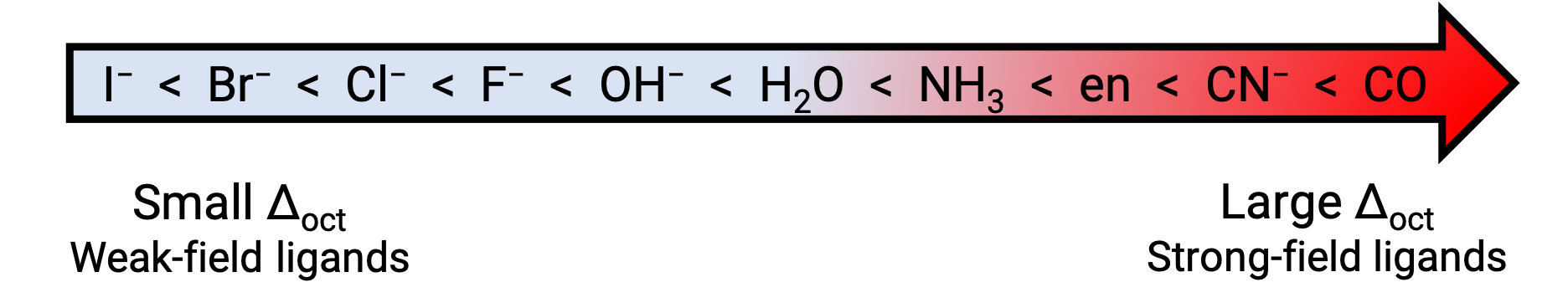
Figure 2. Série spectrochimique.
Par exemple, un composé de coordination de l’ion Cu+ a une configuration d10, et toutes les orbitales eg sont remplies. Pour exciter un électron à un niveau plus élevé, comme l’orbitale 4p, des photons de très haute énergie sont nécessaires. Cette énergie correspond à des longueurs d’onde très courtes dans la région ultraviolette du spectre. Aucune lumière visible n’est absorbée, donc l’œil ne voit aucun changement, et le composé semble blanc ou incolore. Une solution contenant du [Cu(CN)2]−, par exemple, est incolore. D’autre part, les complexes octaédriques de Cu2+ ont une place vacance dans les orbitales eg, et les électrons peuvent être excités vers ce niveau. La longueur d’onde (énergie) de la lumière absorbée correspond à la partie visible du spectre, et les complexes de Cu2+ sont presque toujours colorés : bleu, bleu-vert violet ou jaune.
Magnétisme dans les complexes de coordination
Des preuves expérimentales de mesures magnétiques appuient la théorie des complexes à haut spin et bas spin. Les molécules comme O2 qui contiennent des électrons non appariés sont paramagnétiques. Les substances paramagnétiques sont attirées par les champs magnétiques. De nombreux complexes de métaux de transition ont des électrons non appariés et sont donc paramagnétiques. Les molécules comme N2 ainsi que les ions comme Na+ et [Fe(CN)6]4− qui ne contiennent aucun électron non apparié sont diamagnétiques. Les substances diamagnétiques ont une légère tendance à être repoussées par les champs magnétiques.
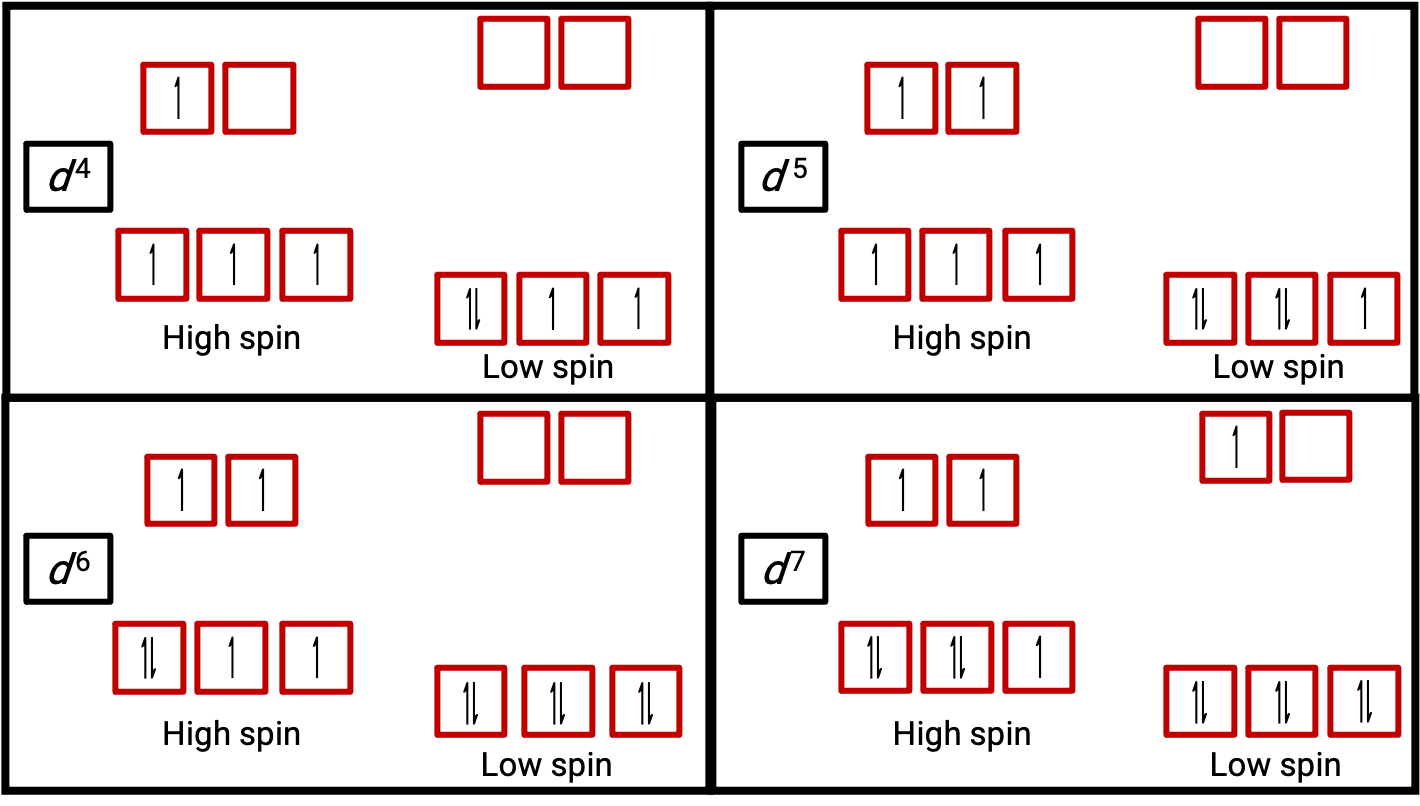
Figure 3. Diagrammes d’orbitales des complexes octaédriques à l’état de haut spin et bas spin pour les systèmes d4, d5, d6 et d7. Cette distinction ne peut pas être faite pour les systèmes d1, d2, d3, d5, d8, d9 et d10.
Lorsqu’un électron dans un atome ou un ion n’est pas apparié, le moment magnétique dû à son spin rend l’atome ou l’ion entier paramagnétique. La taille du moment magnétique d’un système contenant des électrons non appariés est directement liée au nombre de ces électrons : plus le nombre d’électrons non appariés est élevé, plus le moment magnétique est important. Par conséquent, le moment magnétique observé est utilisé pour déterminer le nombre d’électrons non appariés présents. Le moment magnétique mesuré de d6 à bas spin de [Fe(CN)6]4#8722; confirme que le fer est diamagnétique, alors que d6 à haut spin de [Fe(H2O)6]2+ a quatre électrons non appariés avec un moment magnétique qui confirme cette disposition (figure 2).
Ce texte est adapté de Openstax, Chemistry 2e, Section19.3 : Propriétés spectroscopiques et magnétiques des composés de coordination.
