20.10:
色と磁性
20.10:
色と磁性
配位錯体の色
原子や分子が適切な周波数の光を吸収すると、その電子はよりエネルギーの高い軌道へと励起されます。多くの典型原子・分子では、吸収される光子は、人間の目では検出できない紫外領域です。一方、配位化合物では、d軌道のエネルギー差に対応するような可視領域の光子が吸収・放出されることが多く、人間の目には色のついた物質として見えます。
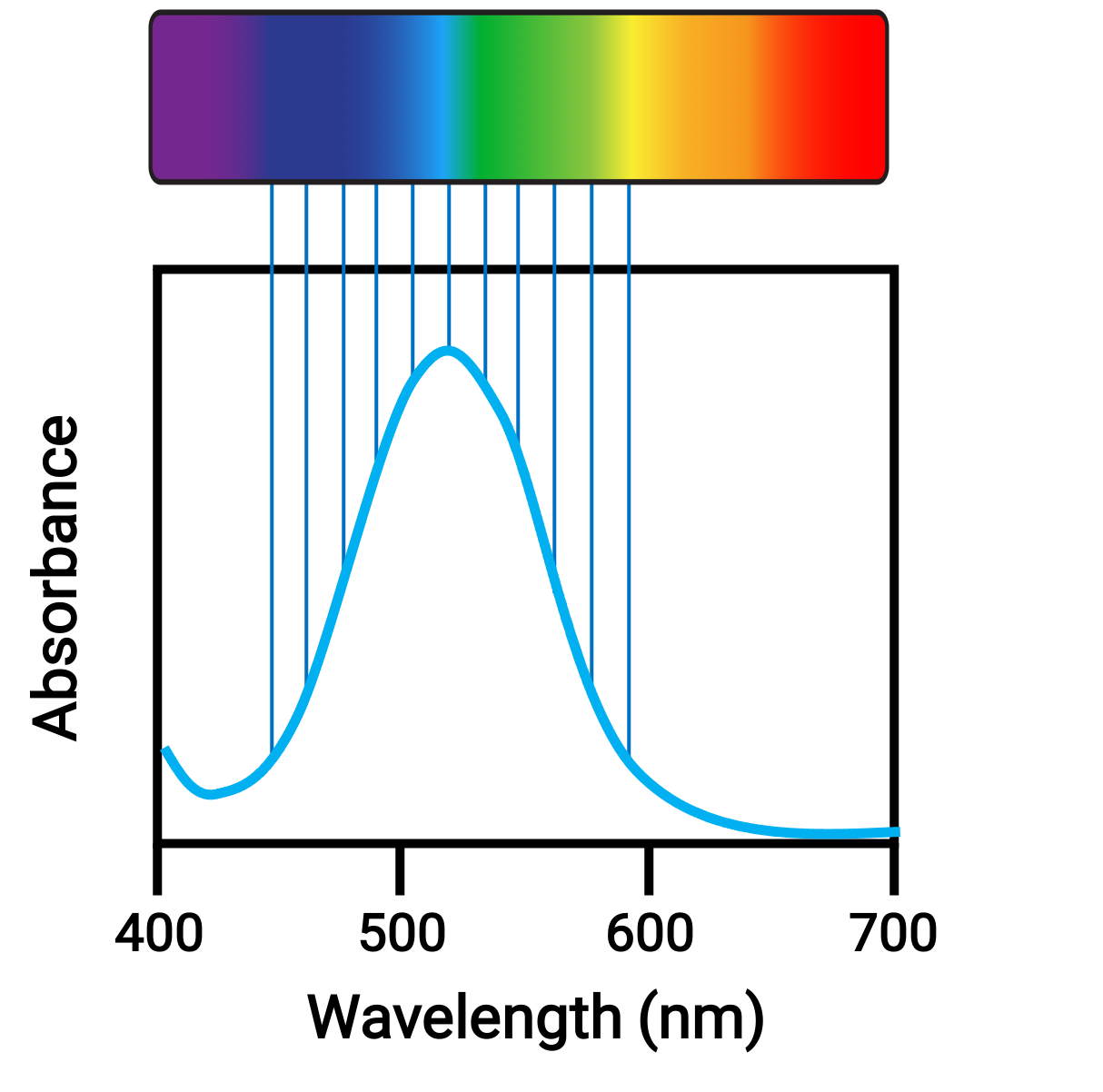
Figure 1. 可視光スペクトルと吸光度
電子が遷移する軌道の相対的なエネルギーがわずかに変化するだけで、吸収される光の色が大きく変化します。したがって、配位化合物の色は、次のような多くの要素に左右されます。
• 水溶液中の金属イオンの種類によって、色が異なることがあります。
• 中心金属の酸化数が異なれば、色も異なります。
• 中心金属に配位する特定の配位子が配位錯体の色に影響を与えます。例えば、鉄(II)錯体[Fe(H2O)6]SO4は、高スピンの錯体が赤色の波長の光子を吸収するため、青緑色に見えます。一方、低スピンの鉄(II)錯体K4[Fe(CN)6]は、よりエネルギーの高い紫色の光子を吸収するため、淡い黄色に見えます。
一般に強い結晶場を持つ配位子は、中心となる金属原子のd軌道のエネルギーを大きく分裂させる(大 Δ)。このような配位子を持つ遷移金属の配位化合物は、よりエネルギーの高い紫や青の光を吸収するため、黄色やオレンジ、赤などの色を示します。
一方、弱い結晶場の配位子を持つ遷移金属の配位化合物は、エネルギーの低い黄色やオレンジ、赤色の光を吸収するため、青緑色や青色、藍色のものが多いです。配位子がd軌道を分割させる強さは、分光学系列に記載されています。ここでは、配位子は結晶場分割エネルギー( Δ )の値が大きい順に書かれています。
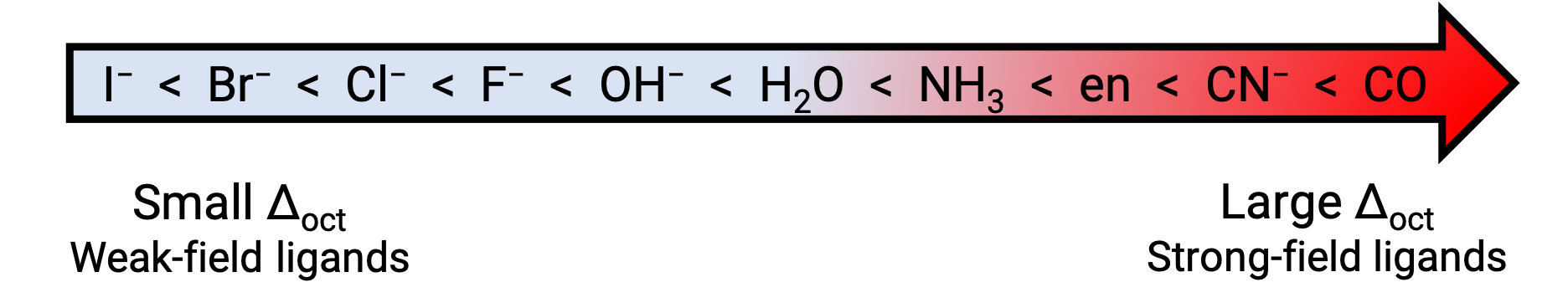
Figure 2.分光学系列.
例えば、Cu+イオンの配位化合物はd10配置で、すべてのeg軌道が満たされています。電子を4p軌道のような高い準位に励起するには、非常に高いエネルギーの光子が必要です。このエネルギーは、紫外域の非常に短い波長に相当します。可視光が吸収されないため、化合物は白色または無色に見えます。例えば、[Cu(CN)2]−を含む溶液は無色です。一方、八面体のCu2+錯体は、eg軌道に空孔があり、電子がこの準位に励起されます。吸収される光の波長(エネルギー)は、スペクトルの可視領域に相当し、Cu2+錯体はほとんどの場合、青、青緑紫、または黄色に見えます。
配位錯体の磁性
磁気測定の実験的証拠は、高スピン・低スピン錯体の理論を裏付けます。O2のように不対電子を持つ分子は常磁性体です。常磁性体は磁場に引き寄せられます。多くの遷移金属錯体は不対電子を持っているため、常磁性を示します。N2などの分子や、Na+、[Fe(CN)6]4−などのイオンで、不対電子を持たないものは反磁性です。反磁性体は、磁場によってわずかに反発します。
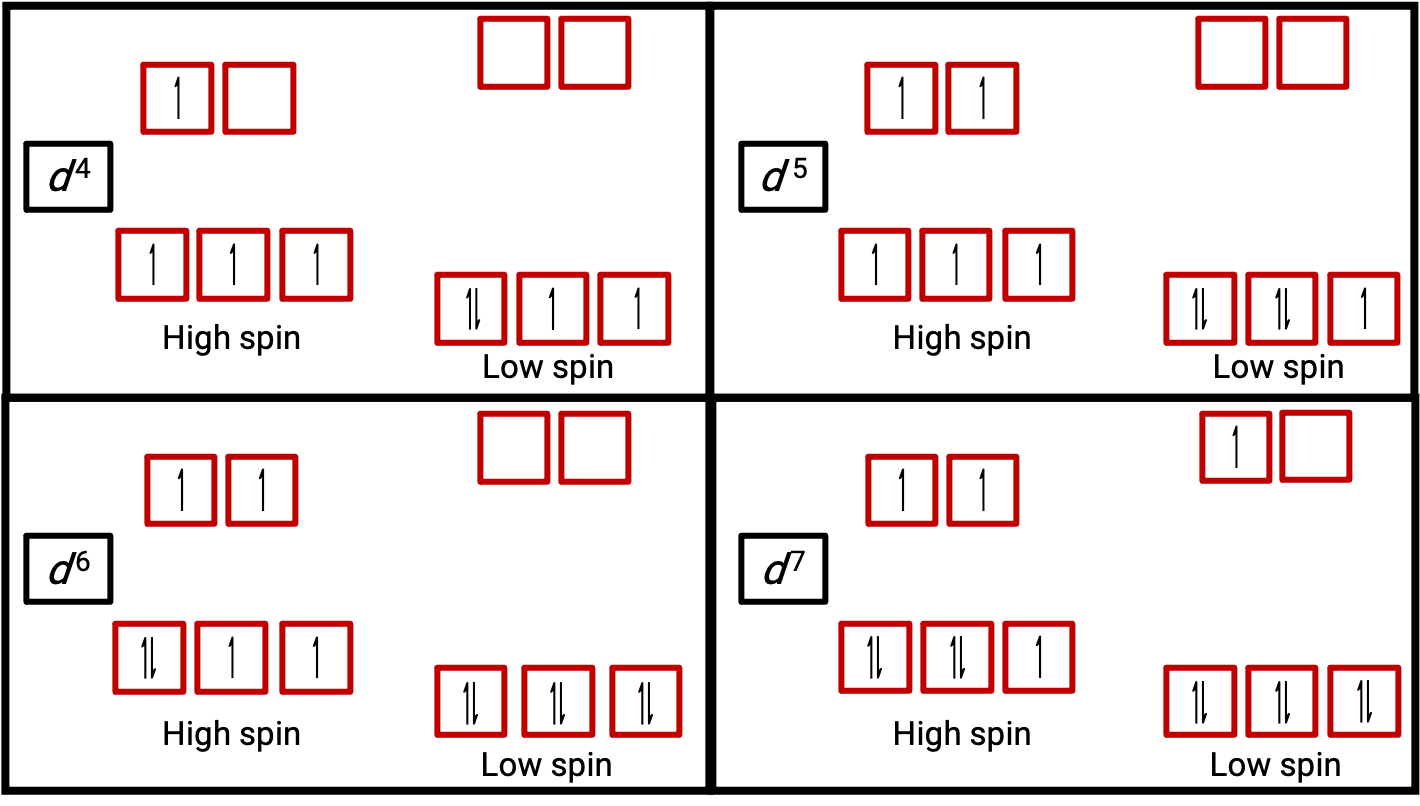
Figure 3. d4, d5, d6, d7系の高スピン状態と低スピン状態での八面体型錯体の軌道図。d1、d2、d3、d5、d8、d9、d10の各系では、この区別はできません。
原子やイオンの電子が不対電子になると、そのスピンによる磁気モーメントによって、原子やイオン全体が常磁性になります。不対電子を含む系の磁気モーメントの大きさは、不対電子の数に直結しており、不対電子の数が多いほど磁気モーメントは大きくなります。したがって、観測された磁気モーメントは、存在する不対電子の数を決定するために用いられます。低スピンのd6 [Fe(CN)6]4−は、磁気モーメント測定によって鉄が反磁性と確認されたのに対し、高スピンのd6 [Fe(H2O)6]2+は磁気モーメントが観測されたことから、4つの不対電子を持つことが確認されました。(Figure 2)
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Section19.3: Spectroscopic and Magnetic Properties of Coordination Compounds.
