20.10:
Cores e Magnetismo
20.10:
Cores e Magnetismo
Cor em Complexos de Coordenação
Quando átomos ou moléculas absorvem luz na frequência adequada, os seus eletrões são excitados para órbitas de maior energia. Para muitos átomos e moléculas do grupo principal, os fotões absorvidos estão na faixa ultravioleta do espectro eletromagnético, que não pode ser detectada pelo olho humano. Para os compostos de coordenação, a diferença de energia entre as orbitais d permite frequentemente que os fotões na gama visível sejam absorvidos e emitidos, o que é visto como cores pelo olho humano.
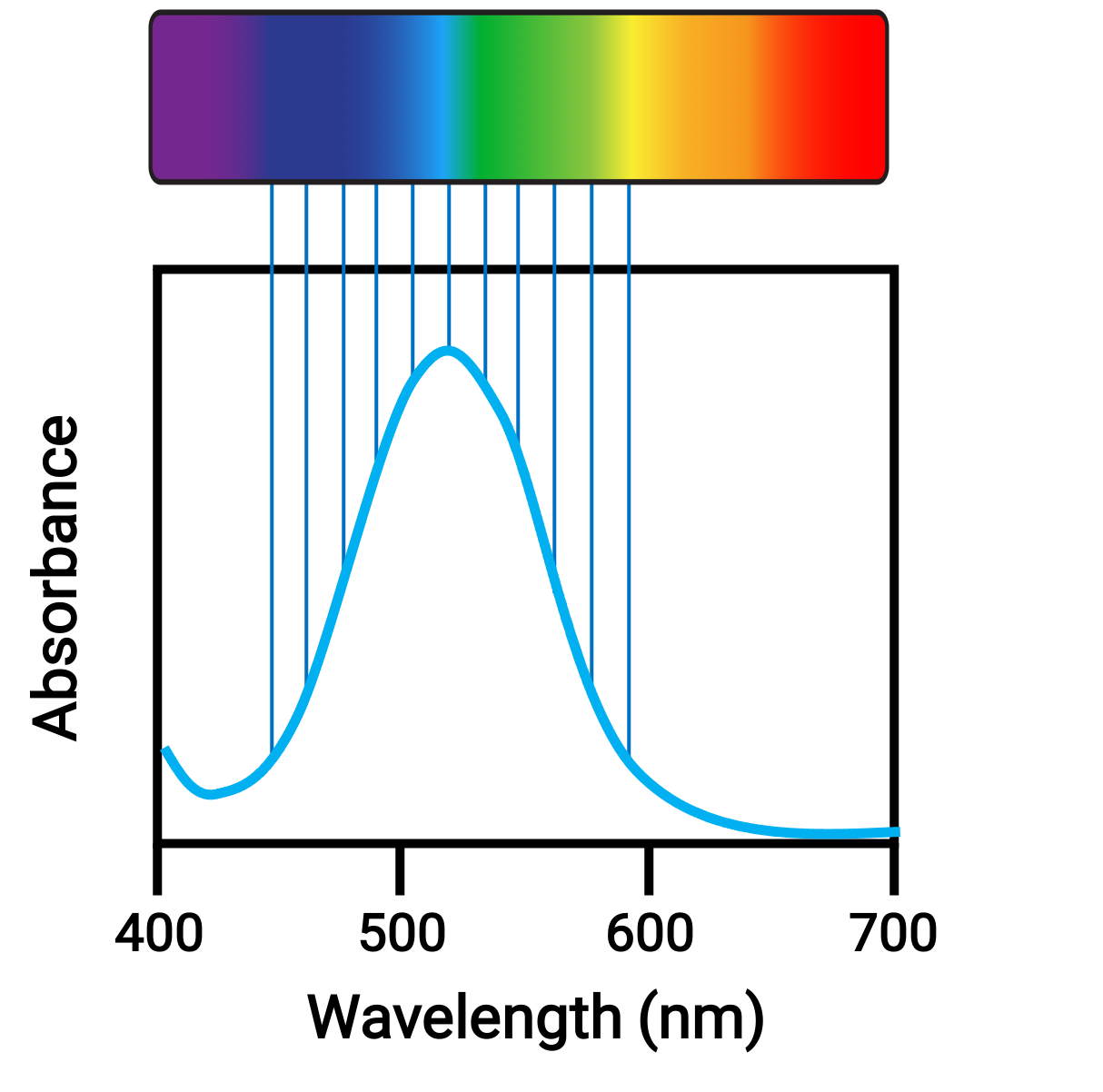
Figura 1. Espectro eletromagnético de luz visível e absorvância.
Pequenas alterações nas energias relativas das orbitais entre as quais os eletrões estão a transitar podem levar a mudanças drásticas na cor da luz absorvida. Portanto, as cores dos compostos de coordenação dependem de muitos factores, como:
• Diferentes iões de metal aquosos podem ter cores diferentes.
• Diferentes estados de oxidação de um metal podem produzir cores diferentes.
• Ligandos específicos coordenados ao centro metálico influenciam a cor dos complexos de coordenação. Por exemplo, o complexo de ferro(II) [Fe(H2O)6]SO4 aparece como azul-verde porque o complexo de alto spin absorve fotões nos comprimentos de onda vermelhos. Em contraste, o complexo de ferro(II) de baixo spin K4[Fe(CN)6] aparece como amarelo pálido porque absorve fotões violeta de maior energia.
No geral, ligandos de campo forte causam uma grande divisão nas energias de orbitais d do átomo central de metal (Δ grande). Compostos de coordenação de metais de transição com estes ligandos são amarelos, alaranjados, ou vermelhos porque absorvem a luz violeta ou azul de maior energia.
Por outro lado, os compostos de coordenação de metais de transição com ligandos de campo fraco são muitas vezes azul-verde, azul, ou índigo porque absorvem luz amarela, laranja, ou vermelha de menor energia. As forças dos ligandos para dividirem as orbitais d estão listadas na série espectroquímica. Aqui os ligandos estão escritos por valor crescente da energia de divisão de campo cristalino (Δ).
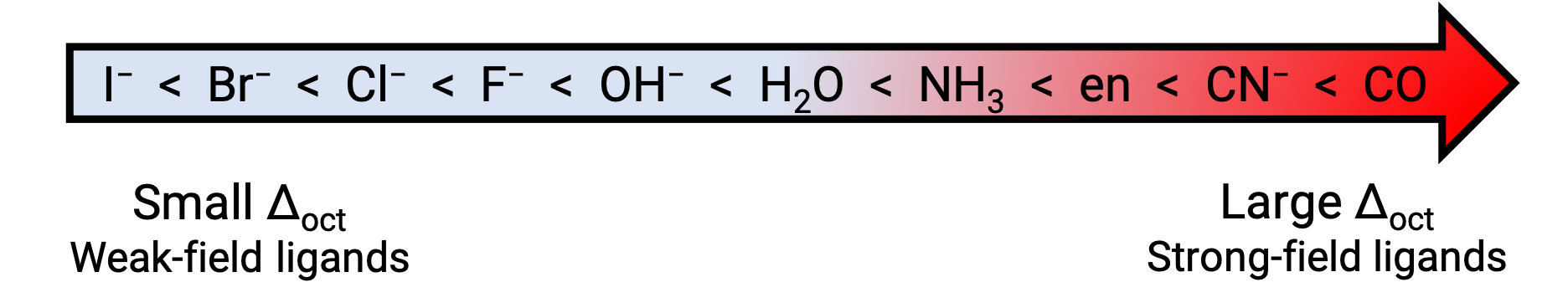
Figura 2. Série espectroquímica.
Por exemplo, um composto de coordenação do ião Cu+ tem uma configuração d10, e todas as orbitais eg estão preenchidas. Para excitar um eletrão para um nível mais elevado, como a orbital 4p, são necessários fotões de energia muito elevada. Esta energia corresponde a comprimentos de onda muito curtos na região ultravioleta do espectro. Nenhuma luz visível é absorvida, portanto o olho não vê nenhuma alteração, e o composto aparece como branco ou incolor. Uma solução contendo [Cu(CN)2]−, por exemplo, é incolor. Por outro lado, complexos octaédricos Cu2+ têm uma vaga nas orbitais eg, e os eletrões podem ser excitados para este nível. O comprimento de onda (energia) da luz absorvida corresponde à parte visível do espectro e os complexos Cu2+ são quase sempre coloridos—azul, azul-verd, violeta, ou amarelo.
Magnetismo nos Complexos de Coordenação
A evidência experimental de medições magnéticas suporta a teoria de complexos de alto e baixo spin. Moléculas como O2 que contêm eletrões não emparelhados são paramagnéticas. As substâncias paramagnéticas são atraídas por campos magnéticos. Muitos complexos de metais de transição têm eletrões não emparelhados e, por conseguinte, são paramagnéticos. Moléculas como N2 e iões como Na+ e [Fe(CN)6]4− que não contêm eletrões não emparelhados são diamagnéticos. As substâncias diamagnéticas têm uma ligeira tendência para serem repelidas por campos magnéticos.
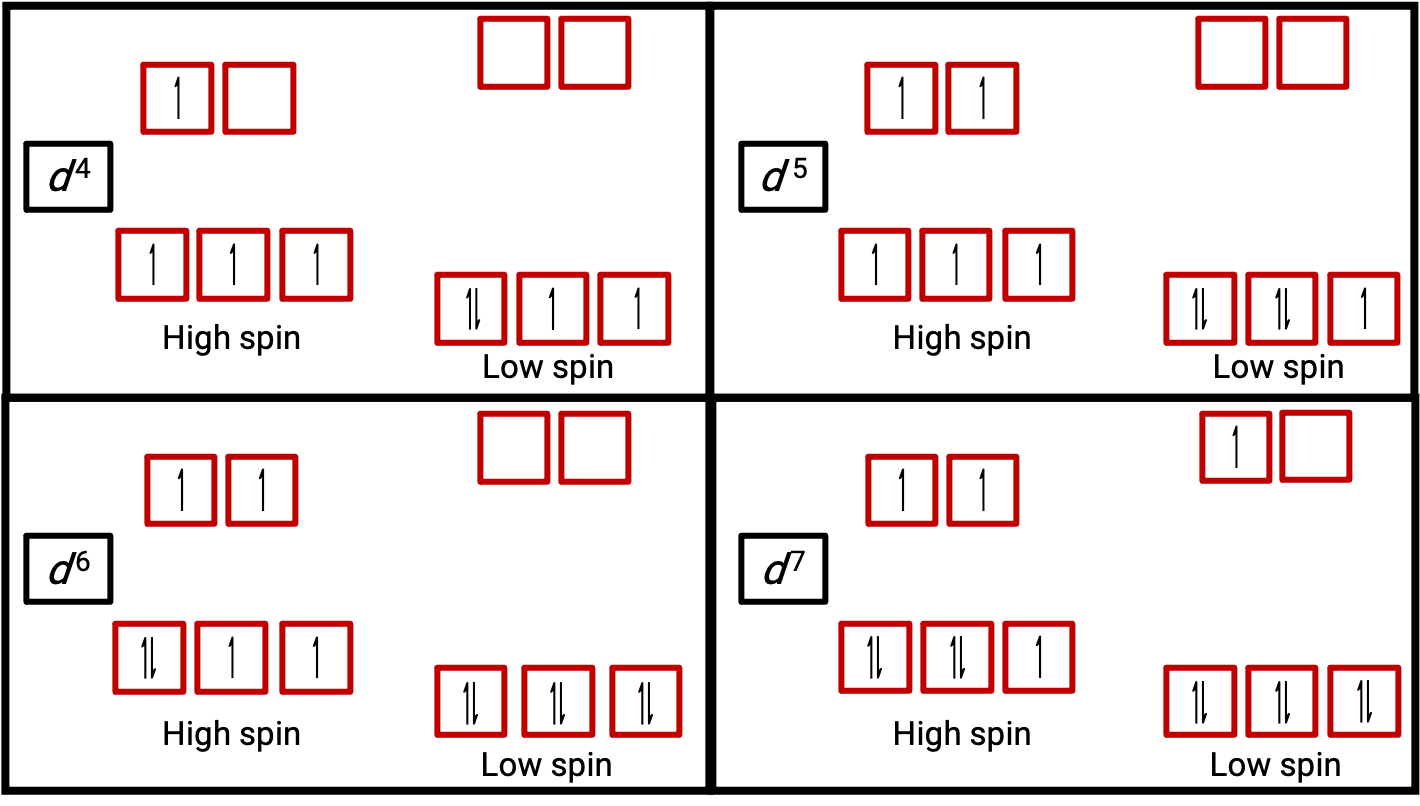
Figura 3. Diagramas orbitais dos complexos octaédricos no estado de alto e baixo spin para os sistemas d4, d5, d6, e d7. Esta distinção não pode ser feita para os sistemas d1, d2, d3, d5, d8,d9 e d10.
Quando um eletrão em um átomo ou ião é desemparelhado, o momento magnético devido ao seu spin torna todo o átomo ou ião paramagnético. O tamanho do momento magnético de um sistema que contém eletrões não emparelhados está diretamente relacionado com o número desses eletrões: quanto maior for o número de eletrões não emparelhados, maior será o momento magnético. Portanto, o momento magnético observado é usado para determinar o número de eletrões não emparelhados presentes. O momento magnético medido de d6 [Fe(CN)6]4− de baixo spin confirma que o ferro é diamagnético, enquanto que d6 [Fe(H2O)6]2+ de alto spin tem quatro eletrões não emparelhados com um momento magnético que confirma esta disposição (Figura 2).
Este texto é adaptado de Openstax, Chemistry 2e, Section19.3: Spectroscopic and Magnetic Properties of Coordination Compounds.
