20.10:
Renkler ve Manyetizma
20.10:
Renkler ve Manyetizma
Koordinasyon Komplekslerinde Renk
Atomlar veya moleküller ışığı uygun frekansta emdiğinde, elektronları daha yüksek enerjili orbitallere uyarılır. Birçok ana grup atomu ve molekülü için, emilen fotonlar, insan gözü tarafından tespit edilemeyen elektromanyetik spektrumun ultraviyole aralığındadır. Koordinasyon bileşikleri için, d orbitalleri arasındaki enerji farkı genellikle görünür aralıktaki fotonların emilmesine ve yayılmasına izin verir, bu da insan gözü tarafından renk olarak görülür.
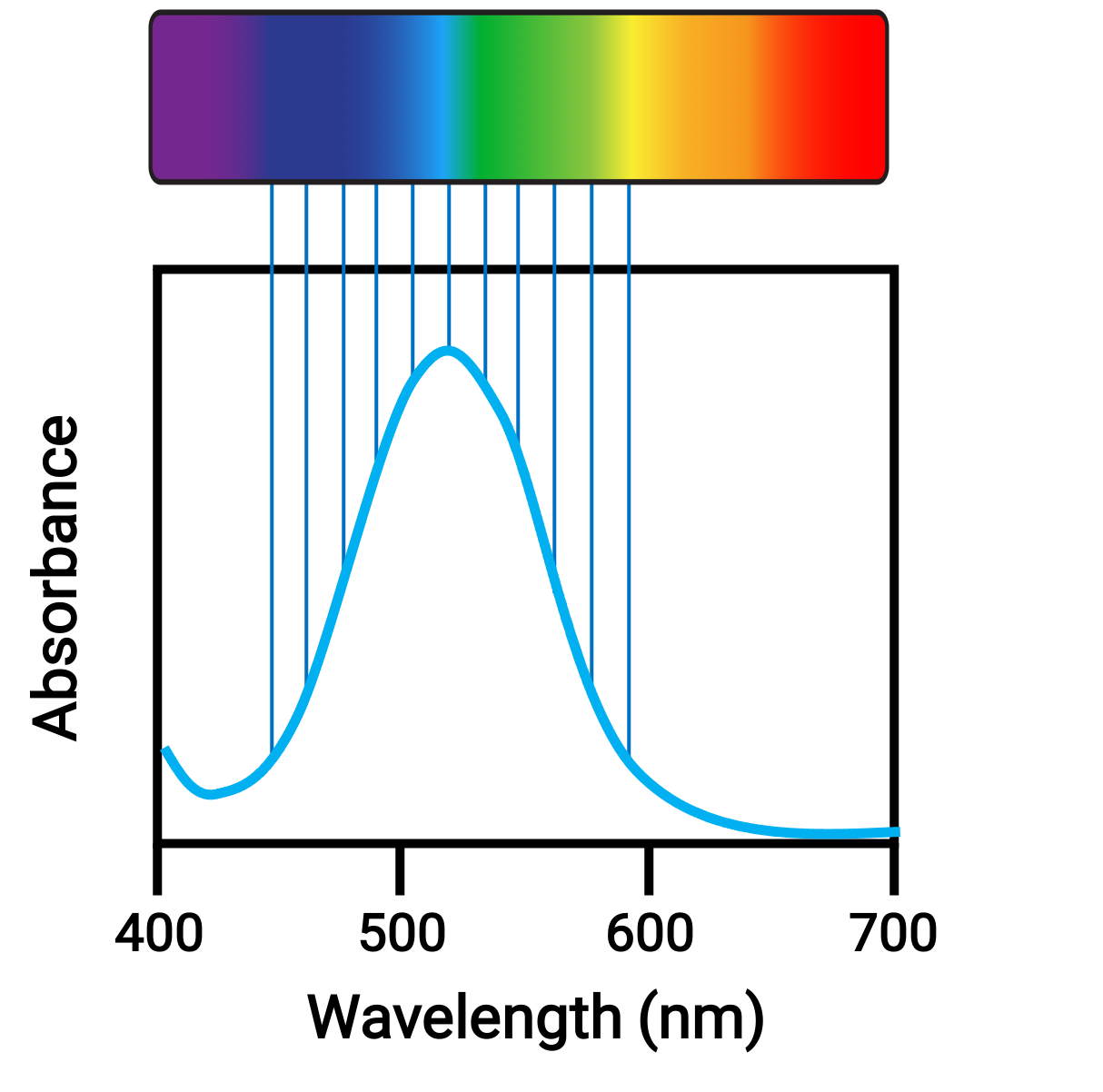
Şekil 1.. Elektromanyetik spektrum görünür ışık ve absorbans.
Elektronların geçiş yaptığı orbitallerin nispi enerjilerindeki küçük değişiklikler, emilen ışığın renginde ciddi kaymalara neden olabilir. Bu nedenle, koordinasyon bileşiklerinin renkleri, aşağıdaki gibi birçok faktöre bağlıdır:
• Farklı sulu metal iyonları farklı renklere sahip olabilir.
• Bir metalin farklı oksidasyon durumları farklı renkler üretebilir.
• Metal merkezine koordine olan spesifik ligandlar, koordinasyon komplekslerinin rengini etkiler. Örneğin, demir(II) kompleksi [Fe(H2O)6]SO4 mavi-yeşil görünür, çünkü yüksek spin kompleksi kırmızı dalga boylarındaki fotonları emer. Buna karşılık, düşük spin demir(II) kompleksi K4[Fe(CN)6] soluk sarı görünür, çünkü daha yüksek enerjili mor fotonları emer.
Genel olarak, güçlü alan ligandları, merkezi metal atomunun d orbitallerinin enerjilerinde büyük bir bölünmeye neden olur (büyük Δ). Bu ligandlarla geçiş metali koordinasyon bileşikleri sarı, turuncu veya kırmızıdır, çünkü daha yüksek enerjili mor veya mavi ışığı emerler.
Öte yandan, zayıf alan ligandlarına sahip geçiş metallerinin koordinasyon bileşikleri genellikle mavi-yeşil, mavi veya indigodur, çünkü daha düşük enerjili sarı, turuncu veya kırmızı ışığı emerler. Ligandların d orbitallerini bölme gücü spektrokimyasal serilerde listelenmiştir. Burada ligandlar, kristal alan bölme enerjisinin (Δ) artan değerinde yazılır.
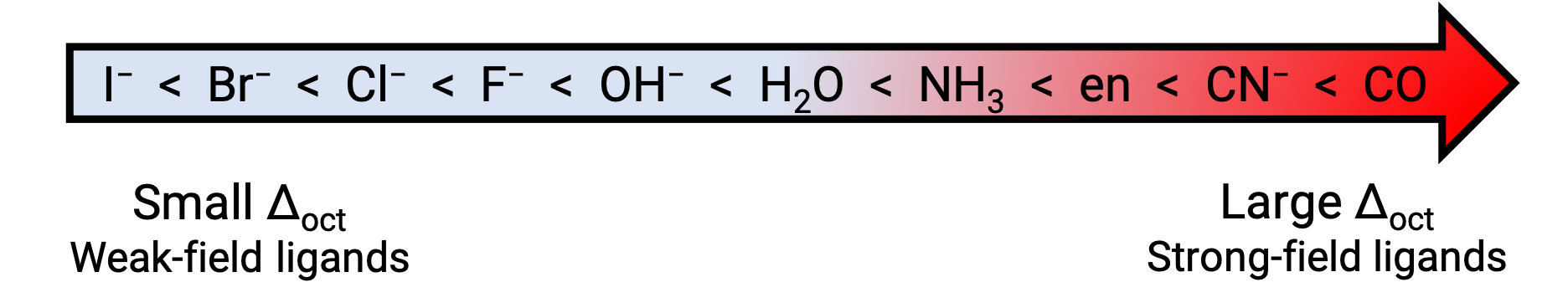
Şekil 2.. Spektrokimyasal seriler.
Örneğin, Cu+ iyonunun bir koordinasyon bileşiği bir d10 konfigürasyonuna sahiptir ve tüm eg orbitalleri doldurulur. Bir elektronu, 4p orbitali gibi daha yüksek bir seviyeye çıkarmak için çok yüksek enerjili fotonlar gereklidir. Bu enerji, spektrumun ultraviyole bölgesindeki çok kısa dalga boylarına karşılık gelir. Görünür ışık emilmez, bu nedenle göz herhangi bir değişiklik görmez ve bileşik beyaz veya renksiz görünür. Örneğin, [Cu(CN)2]− içeren bir çözelti renksizdir. Öte yandan, oktahedral Cu+2 kompleksleri eg orbitallerinde bir boşluğa sahiptir ve elektronlar bu seviyeye kadar uyarılabilir. Emilen ışığın dalga boyu (enerjisi) spektrumun görünür kısmına karşılık gelir ve Cu+2 kompleksleri hemen hemen her zaman renklidir—mavi, mavi-yeşil menekşe veya sarı.
Koordinasyon Komplekslerinde Manyetizma
Manyetik ölçümlerin deneysel kanıtı, yüksek ve düşük spin kompleksleri teorisini desteklemektedir. Eşleşmemiş elektronlar içeren O2 gibi moleküller paramanyetiktir. Paramanyetik maddeler manyetik alanlara çekilir. Birçok geçiş metali kompleksi eşleşmemiş elektronlara sahiptir ve bu nedenle paramanyetiktir. N2 gibi moleküller ve Na+ ve [Fe(CN)6]−4 gibi eşleşmemiş elektronlar içermeyen iyonlar diamanyetiktir. Diamanyetik maddelerin manyetik alanlar tarafından itilmesi için hafif bir eğilimi vardır.
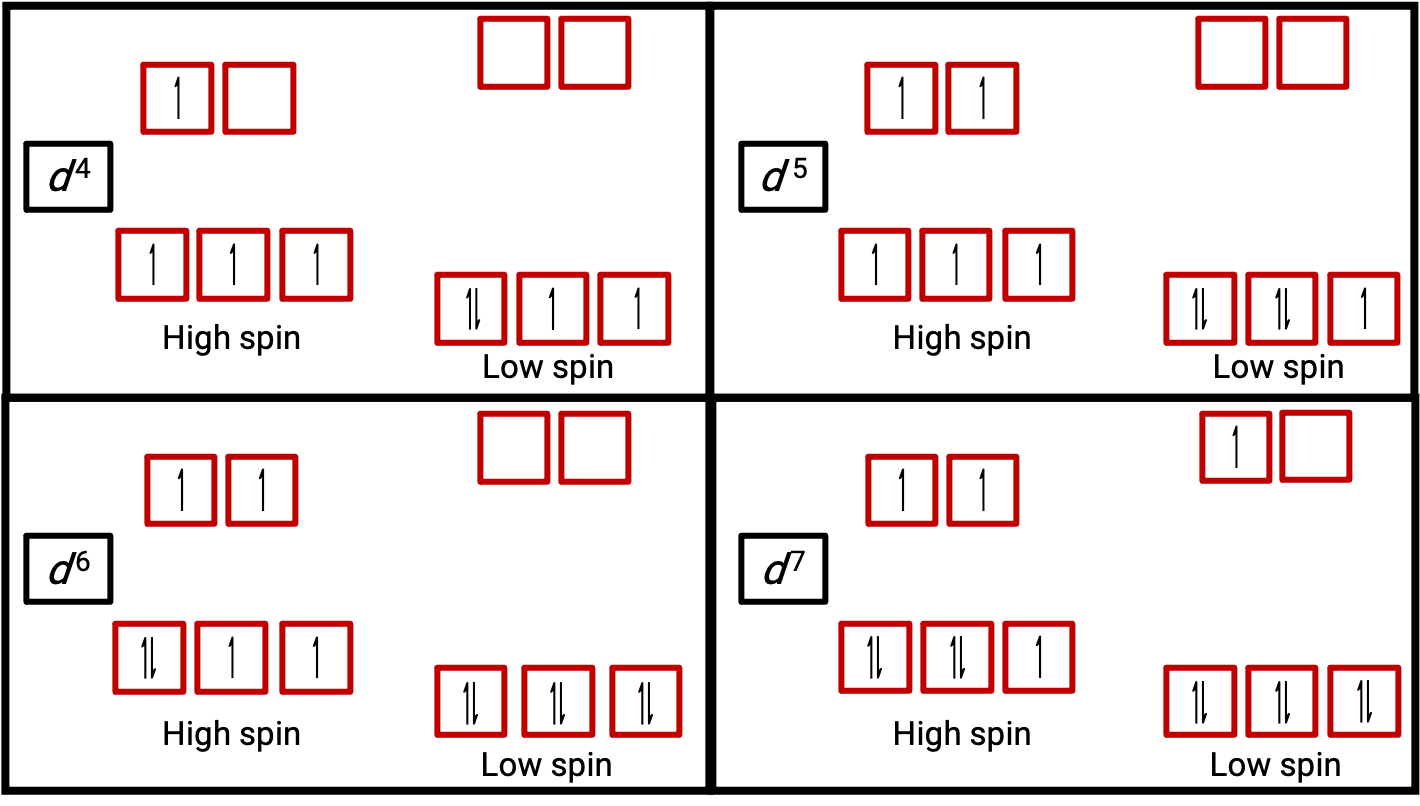
Şekil 3.. d4, d5, d6 ve d7 sistemleri için yüksek ve düşük spin durumunda oktahedral komplekslerin yörünge diyagramları. Bu ayrım d1, d2, d3, d5, d8, d9 ve d10 sistemleri için yapılamaz.
Bir atom veya iyondaki bir elektron eşleştirilmediğinde, spini nedeniyle manyetik moment tüm atomu veya iyonu paramanyetik hale getirir. Eşleştirilmemiş elektronları içeren bir sistemin manyetik momentinin boyutu doğrudan bu elektronların sayısıyla ilgilidir: eşleştirilmemiş elektronların sayısı ne kadar büyük olursa, manyetik moment o kadar büyük olur. Bu nedenle, gözlemlenen manyetik moment, mevcut eşleşmemiş elektronların sayısını belirlemek için kullanılır. Düşük spin d6 [Fe(CN)6]−4‘ün ölçülen manyetik momenti demirin diamanyetik olduğunu doğrularken, yüksek spin d6 [Fe(H2O)6]+2, bu düzenlemeyi doğrulayan manyetik bir momente sahip dört eşleştirilmemiş elektrona sahiptir (Şekil 2).
Bu metin bu kaynaktan uyarlanmıştır: Openstax, Chemistry 2e, Section19.3: Spectroscopic and Magnetic Properties of Coordination Compounds.
