Overview
Quelle: Labor von Dr. Henrik Sundén-Chalmers University of Technology
Kernresonanzspektroskopie (NMR) ist eine wichtige Analysetechnik für organische Chemiker. Mit Hilfe der NMR wurde die Arbeit im biologischen Labor enorm erleichtert. Nicht nur kann es Auskunft über die Struktur eines Moleküls sondern auch bestimmen den Inhalt und die Reinheit einer Probe. Im Vergleich mit anderen häufig auftretenden Techniken für organische Chemiker — wie thermische Analyse und Massenspektrometrie (MS) – NMR ist eine zerstörungsfreie Methode, die wertvoll ist, wenn die Wiederherstellung der Probe wichtig ist.
Eines der am häufigsten verwendeten NMR-Techniken für organischer Chemiker ist Proton (1H) NMR. Die Protonen vorhanden in einem Molekül verhält sich anders abhängig von der chemischen Umgebung, macht es möglich, seine Struktur aufzuklären. Darüber hinaus ist es möglich, den Abschluss einer Reaktion durch den Vergleich der NMR-Spektren des Ausgangsmaterials, des Endprodukts zu überwachen.
Dieses Video veranschaulicht, wie NMR-Spektroskopie in der täglichen Arbeit von organischer Chemiker verwendet werden kann. Die folgenden angezeigt werden: ich) Vorbereitung einer NMR-Probe. (II) Verwendung von 1H NMR, um eine Reaktion zu überwachen. (III) Identifizierung des Erzeugnisses aus einer Reaktion mit 1H NMR gewonnen. Die Reaktion, die angezeigt wird, ist die Synthese aus einer E- Chalcone (3) ein Aldehyd (1) und ein Keton (2) (Schema 1). 1
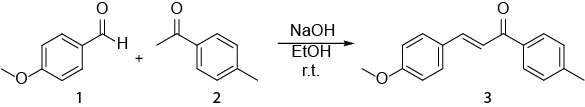
Schema 1. Synthese von (2E)-3-(4-methoxyphenyl)-1-(4-methylphenyl)-2-propen-1-one.
Principles
Atomkerne mit einer ungeraden Masse oder Ordnungszahl haben eine Eigenschaft namens Spin, die es ermöglichen, NMR verwenden, um Elemente wie Wasserstoff (1H), Kohlenstoff (13C) und Phosphor (31P) zu erkennen. Die Spins sind zufällig und in zufällige Richtungen dreht; Allerdings werden durch die Anwendung eines äußeren Magnetfeldes diese Kerne selbst mit oder gegen die angelegten Magnetfeldes ausgerichtet. Diese beiden Staaten haben unterschiedlichen Energieniveaus: ein niedrig-Energie-Zustand und einen energiereichen Zustand. Bestrahlung mit elektromagnetischen Strahlung bewirkt den niedrigen Energiezustand um die energiereichen Zustand umzudrehen. Wenn die Strahlung nicht mehr ist, die Kerne werden Entspannung und ein kostenlosen induktive Zerfall (FID) erzielt wird. Die FID ist Fourier umgewandelt, um die Gipfel des NMR-Spektrum geben. Verschiedene Elemente haben unterschiedliche Frequenzen, was zu verschiedenen chemischen Verschiebungen (Tabelle 1). Die NMR-Spektren können verschiedene Arten von Informationen über eine Verbindung zur Verfügung stellen; Das Integral eines Peaks liefert die Anzahl der Protonen, vertreten die Kupplung konstant (J-Kupplung) gibt die Korrelation der Protonen und der Spaltung Muster eines Peaks erzählt, wie viele andere NMR-aktive Kerne in der Nähe sind (oft als "Nachbarn").
Seit 1H NMR Maßnahmen 1H Kerne ist es wichtig, deuterierte Lösungsmittel zu verwenden; sonst wird das Signal von Interesse in der Lärm des Lösungsmittels Signals verloren gehen.
| Art von proton | Verschiebung (δ, ppm) | Typ des Kohlenstoffs | Verschiebung (δ, ppm) |
| 1° Alkyl, RCH3 | 0,8-1,2 | 1° Alkyl, RCH3 | 0 – 40 |
| 2° Alkyl, R2CH2R | 1.2-1.5 | 2° Alkyl, R2CH2R | 10 – 50 |
| 3° Alkyl, RCHR2 | 1,4-1,8 | 3° Alkyl, RCHR2 | 15 – 50 |
| Allylic, R2C = CRCH3 | 1,6 – 1,9 | Alken, C=C | 100-170 |
| Keton, RC(=O) CH3 | 2.1-2.6 | Aryl, C im aromatischen ring | 100-170 |
| Äther, ROCH2R | 3.3 – 3,9 | Alkohol oder Äther, R3COR | 50 – 90 |
| Alkohol, HOCH2R | 3.3 – 4.0 | Carbonsäure oder Ester, R-C(= O) oder |
160-185 |
| Vinylic, R2C = CH2 | 4,6 – 5,0 | Aldehyd oder Keton, R-C(= O) R |
182 – 215 |
| Vinylic, R2C = CRH | 5.2-5.7 | ||
| Aromatisch, ArH | 6,0-8,5 | ||
| Aldehyd RC(=O)H | 9,5-10,5 | ||
| Alkohol Hydroxyl, ROH | 0,5-6,0 | ||
| Carboxylic, RC(=O) OH | 10 – 13 |
Tabelle 1. Gemeinsamen Protonen und Kohlenstoff NMR chemische Verschiebungen. 2
Subscription Required. Please recommend JoVE to your librarian.
Procedure
1. Vorbereitung der NMR Ausgangsmaterial
- Fügen Sie ~ 10 mg Ausgangsmaterial für ein sauberes NMR-Röhrchen.
- Lösen Sie das Ausgangsmaterial in ~0.7 mL deuterierter Lösungsmittel (Beispiel CDCl-3). Eine passende Höhe des Lösungsmittels für ein gutes Spektrum beträgt 4,5-5 cm.
- Röhrchen Sie die NMR vorsichtig und schreiben Sie den Probennamen auf der Kappe.
- Schütteln Sie die Probe vorsichtig, um sicherzustellen, dass alles Material aufgelöst hatte. Achten Sie darauf, vermeiden Sie den Kontakt zwischen dem Lösungsmittel und die Kappe, die zu möglichen Kontamination der Probe führen könnten.
- Die NMR-Röhrchen vorsichtig in ein Spinner einführen. Der Spinner dreht sich nach dem Einlegen in den Magneten um sicherzustellen, dass die gesamte Probe ein homogenes Magnetfeld erfährt. Reinigen Sie die Außenseite der NMR-Röhrchen und Spinner mit 2-Propanol und Labor Gewebe, um Fingerabdrücke und Schmutz entfernen.
- Ort der Spinner in einer Probe Tiefe messen um sicherzustellen, dass unten die NMR-Röhrchen nicht zu weit in der NMR-Sonde eingefügt wird, da, dass das Spektrometer möglicherweise beschädigen könnte. Verschiedene Sonden haben unterschiedlichen Tiefen und der Benutzer muss die spezifischen Tiefenmesser beachten.
- Legen Sie die Probe in der NMR-Spektrometer. Hier wurde ein Varian 400 MHz-Spektrometer, ausgestattet mit einem Autosampler verwendet.
- Verarbeiten Sie nach Beendigung der NMR-Messung das Spektrum zu und weisen Sie die Peaks im Spektrum.
2. Vorbereitung des 3 M NaOH und Chalcone Synthese
- 60 mg NaOH hinzu kommt eine volumetrische 50 mL-Flasche.
- Auflösen der NaOH durch Zugabe von entionisiertem Wasser auf die Hälfte des Kolbens. Verdünnen Sie die Lösung durch Zugabe von mehr Wasser, bis die Markierung erreicht ist.
- Fügen Sie 10 mL Ethanol in einer 50 mL Rundboden-Kolben ausgestattet mit einer magnetischen Stir Bar.
- Danach fügen Sie 680,5 mg 4-Methoxybenzaldehyde und 5 mL NaOH-Lösung, die in Schritt 2.1 in den gleichen Kolben vorbereitet.
- 671 mg 4-Methylacetophenone Folge der gerührten Lösung und den Kolben Mütze und rühren bei Raumtemperatur.
- Überwachen Sie den Fortschritt der Reaktion von 1H NMR in 30 min Abständen (siehe Schritt 3) bis zum vollständigen Verbrauch der Ausgangsstoffe.
- Fügen Sie 5 mL Wasser hinzu, wenn die Reaktion Abschluss (~ 3 h) erreicht hat. Filtern Sie den entstehenden Niederschlag zu und waschen Sie es mit 20 mL Ethanol/Wasser 1:2. Lassen Sie der Niederschlag der Luft trocknen.
- Berechnen Sie die Rendite des erworbenen Produkts. Eine NMR-Probe gemäß Schritt 1.2.2.7 vorbereiten. Überprüfen Sie die Reinheit mit 1H NMR. Wenn nicht rein, reinigen Sie das Produkt über Rekristallisation mit Ethanol.
- Ein NMR-Röhrchen mit einer Pasteurpipette ca. 3 Tropfen des Reaktionsgemisches hinzu und spülen Sie die Pipette mit deuterierte Lösungsmittel.
- Wiederholen Sie die Schritte 1,2 – 1,8.
3. kurze Interpretation von NMR-Spektrum
- Das Spektrum mit einem geeigneten Programm (Beispiel MestReNova) zu verarbeiten.
- Die verschiedenen Gipfeln der NMR Verschiebungen in der Tabelle 1zu korrelieren. Die chemischen Verschiebungen verleiht einen Hauch von welche Art von Umgebung, die die Protonen existiert in.
- Integrieren Sie die Spitzen um die Anzahl der Wasserstoffatome entspricht jede Spitze zu geben. Integration aller Peaks gibt eine relative Anzahl der gesamten Protonen.
- Die Aufspaltung der Proton-Gipfel, die die Anzahl der Nachbarn zu bewerten.
- Messen Sie die J-Kupplung um zu sehen, wie die Protonen miteinander verbunden sind.
Kernspintomographie oder NMR, Spektroskopie ist eine wichtige Methode zur Bestimmung der molekularen Struktur und Reinheit der Proben in der organischen Chemie.
Im NMR sind Spektroskopie Proben ein starkes Magnetfeld ausgesetzt. Bei Einwirkung bestimmter Atomkerne Übergang oder mitschwingen, zwischen diskreten Energieniveaus. Die Energielücke zwischen diesen Ebenen kann gemessen und als Spektren sichtbar gemacht werden. Diese Daten können verwendet werden, um die chemische Struktur der Probe zu erhellen.
Nicht alle Kerne haben die erforderlichen Eigenschaften, NMR-aktiv sein. Gemeinsamen Isotope untersucht sind, 1H, 2H, 13C, 19F und 31s.
Dieses Video stellen die Prinzipien hinter NMR, Schritt durch Beispiel Vorbereitung der NMR-Proben aus verschiedenen Stufen einer chemischen Reaktion, und mehrere Anwendungen zu diskutieren.
In der NMR-Instrument dienen flüssigem Stickstoff und Helium ein supraleitender Magnet abkühlen lassen. Der Magnet gilt ein konstantes Magnetfeld für eine Probe. Innerhalb der Stichprobe richten Atomkerne mit einer ungeraden Anzahl von Protonen und Neutronen mit Feld Annahme einen energiearmen Zustand oder dagegen Annahme einen energiereichen Zustand.
Die Energiedifferenz zwischen den beiden Ebenen ist die Resonanzfrequenz, die Stärke der angewandten Bereich und die Art des Kerns abhängt. Für die Magnete im NMR verwendet ist der Wert in der Radio-Frequenz oder RF, Bereich.
Eine HF-Spule erregt die Probe mit einem Hochfrequenz-Impuls, bewegen die Niedrigenergie-Kerne in den höheren Zustand, bevor Sie wieder zurückkehren. Die Spule erkennt diese Veränderungen in der Magnetisierung, die als Gipfel angezeigt werden.
Die Stärke der NMR liegt in seiner Fähigkeit, Kerne, in diesem Fall Wasserstoff, von ihrer chemischen Umgebung zu unterscheiden. Elektronen auf benachbarte Atome werden blockieren oder "Schild", die Kerne von einigen des magnetischen Feldes. Dieses effektive Feld ändert sich die Resonanzfrequenz für die bestimmten Kerne, eine chemische Verschiebung genannt. In Ethanol haben die Methylenblau, Hydroxyl und Methyl Protonen alle einzigartigen Resonanzfrequenzen. Bestimmung der Fläche unter jeder Gipfel verdeutlicht die Anzahl der einzelnen Arten von Proton.
Da Instrumente mit unterschiedlichen magnetischen stärken die Resonanzfrequenzen verschieben werden, werden sie an eine standard-Molekül hinzugefügt, um die Probe, oft Tetramethylsilane oder TMS referenziert. Die chemische Verschiebung der Frequenzen ist sehr klein, oft in Teilen pro Million oder ppm berichtet.
Wenn Sie einen starken Magneten mit hoher Auflösung verwenden, werden Spitzen Subpeaks manchmal aufgeteilt. Ursache hierfür ist die benachbarte Kerne, von denen einige mit dem magnetischen Feld, einige gegen ausgerichtet sind; weiter verändern Feld wirksamere auf die Kerne angewendet. Im Äthanol 2 Methylen-Protonen den Methyl-Gipfel zweimal in eine Triole aufgeteilt und 3 Methyl-Protonen Methylen-Gipfel dreimal in einem Quartett aufgeteilt. Der Abstand der Spaltung oder J-Kupplung, bezieht sich auf den Abstand der Atomkerne, Beihilfe bei der qualitativen Entdeckung.
Nun, da Sie die grundlegenden Prinzipien hinter NMR verstehen, betrachten wir eine Beispielprozedur, die Proton NMR verwendet, um die Synthese von Chalcone aus einem Aldehyd und Keton zu überwachen.
Beginnen Sie mit einer Pasteurpipette ein Becherglas eine winzige Menge des Ausgangsmaterials hinzu. Bewegen in der Dunstabzugshaube und das Ausgangsmaterial mit 0,7 mL deuterierte Lösungsmittel verdünnen. Deuterierte Lösungsmittel dienen, da Deuterium Resonanzfrequenz außerhalb des Gültigkeitsbereichs für Protonen ist.
Mit Hilfe einer Pasteurpipette 0,7 mL verdünnten Ausgangsmaterial in einem Schlauch sauber 5 mm NMR, füllen die 4,5 – 5 cm. Cap NMR Unterrohr hinzu und beschriften Sie sie. Schütteln Sie das Rohr, kümmert sich um den um Kontakt zwischen der Probe und der Kappe zu vermeiden. Dann legen Sie das Rohr in den Spinner.
Reinigen Sie die Außenseite des Schlauches und Spinner mit 2-Propanol und Labor Gewebe. Legen Sie die Probe-Versammlung in der Tiefenbegrenzer und kalibrieren Sie die Einstecktiefe zu.
Nach der Kalibrierung, die Assembly Probe in das NMR-Spektrometer entweder manuell oder mit einem Auto-Sampler. Schließlich verwenden Sie einen Computer-Arbeitsplatz das NMR-Spektrum zu erwerben.
NMR-Spektren, die mit diesem Verfahren für jede der Ausgangsstoffe der Reaktion zu erzeugen. Für die Synthese von Chalcone sollten Spektren für Methoxybenzaldehyde und Methylacetophenone generiert werden.
Führen Sie dann die Probe-Synthese durch die Kombination der Ausgangs- und Reagenzien in einem Kolben um die Reaktion zu beginnen.
In 30 Minuten Abständen eine kleine aliquoten des Reaktionsgemisches mit einer Pasteurpipette entfernen und 3 Tropfen auf ein sauberes NMR-Röhrchen.
Dieses grobe Reaktionsprodukt mit deuterierte Lösungsmittel verdünnen und NMR mit dem zuvor beschriebenen Verfahren vorbereiten.
Da die Reaktion fortschreitet ein gelben Niederschlag bilden. Wenn die Reaktion beendet ist, waschen und den Niederschlag zu filtern und NMR-Spektren für das gereinigte Reaktionsprodukt zu generieren.
Nun, da wir in jeder Phase der chemischen Reaktion NMR-Spektren generiert haben, lassen Sie uns analysieren.
Die Gipfel der NMR-Spektren für jede der Ausgangsstoffe sind verschiedene Proton Gruppen innerhalb des Moleküls nach ihrer chemischen Verschiebungen und die Anzahl der Protonen, die einen Beitrag zu jeder Gipfel zugeordnet. Hier ordnen wir die 4 großen Proton-Gruppen für Methylacetophenone und Methoxybenzaldehyde, Kenntnis nehmend von der Aldehyd-Gipfel zwischen 9,5 und 10,5 ppm. Durch den Vergleich der NMR-Spektren der rohen Reaktionsprodukte zu verschiedenen Zeitpunkten, ist die Entwicklung der chemischen Reaktion, die Chalcone synthetisiert aufgeklärt. Z. B. Aldehyd-Gipfel vom Ausgangspunkt Material Methoxybenzaldehyde ist noch vorhanden, nach 30 min der Reaktion, aber ist nach 3 h, bedeutet die Vollendung der Reaktion vollständig verschwunden.
Durch die Untersuchung des Spektrums des gereinigten Produktes können wir jeder Gipfel ein Proton-Gruppe in die Chalcone Struktur zuweisen. Zum Beispiel untersuchen Gipfel 3 und 4, die wir sehen, dass ihre integrale sind beide eins, entsprechend Gruppen mit nur einem Proton.
Spitzen 3 und 4 sind sogenannte Dubletten unter Angabe einer benachbarten Proton. Beide haben J-Koppelung konstanten von 16 Hz, was darauf hindeutet, dass sich die Protonen befinden sich über ein E-Doppelbindung. Durch die Zuordnung alle NMR Gipfel des gereinigten Reaktionsproduktes, bestätigen wir die Synthese von einem reinen Chalcone.
NMR-Spektroskopie hat eine breite Palette von Anwendungen und ist in vielen wissenschaftlichen und medizinischen Bereichen eingesetzt.
In dieser Anwendung, Proton NMR dient zur Bestätigung der Synthese und Struktur von Diamidocarbene und Mononoamidocarbine, haben deren NMR-Spektren Peak-splitting Mustern. Diese Carbene generiert auch scheinbar unterschiedliche Reaktionsprodukte in Kombination mit weißem Phosphor; DAC1 generiert eine leuchtend rote Reaktionsprodukt, während MAAC2 ein helles orange Produkt hergestellt. Diese Unterschiede in der Reaktionsprodukte wurden bestätigt mit einer zweiten Anwendung der NMR, 31P NMR, die Spektren basierend auf Unterschiede in der Resonanzfrequenz der Phosphor-Kerne erzeugt.
Nukleare Magnetresonanztomographie oder MRT, wurde hier eine anatomische Karte des Gehirns zu generieren und die Hirnregionen von Interesse wählen verwendet. NMR-Spektroskopie wurde dann zur Spektren der wichtigsten Metaboliten zu generieren. Zu guter Letzt mittels MRI Veränderungen im Gehirn-Stoffwechsel in verschiedenen experimentellen Bedingungen wurden ausgewertet.
In dieser Anwendung wurde NMR verwendet, um die Bindungseigenschaften analysieren und schlagen eine 3D-Struktur eines Peptids Kupfer-Bindung. Zuerst, NMR-Spektren wurden verglichen, des Peptids ungebunden und Kupfer-gebundenen Staaten. Dann wurden mit fortgeschrittenen 2-dimensionaler NMR-Techniken, verschiedene mögliche Konformationen der Peptid-Struktur bewertet. Schließlich wurden diese NMR-abgeleitete strukturelle Zwänge verwendet, um eine vorgeschlagene 3-dimensionale Struktur für das ungebundene Peptid zu entwickeln.
Sie sah nur Jupiters Einführung in die NMR-Analyse. Sie sollten jetzt die zugrunde liegenden Prinzipien hinter NMR-Spektren-Generierung und Analyse sowie ein Verfahren zur NMR-Probenvorbereitung verstehen.
Danke fürs Zuschauen!
Subscription Required. Please recommend JoVE to your librarian.
Results
Durch den Vergleich der Spektren der Ausgangsstoffe (Abbildungen 1 und 2), dass das Endprodukt (Abbildung 5) einen deutlichen Unterschied zwischen den Spektren kann beobachtet werden, Bildung von die Chalcone angibt. Der Endpunkt der Reaktion kann sein bestimmt durch die Entnahme von NMR-Proben in verschiedenen Zeitabständen; zum Beispiel den Aldehyd Proton Gipfel (C(=O)H) (1) sehen Sie in Abbildung 3 , aber nicht in Abbildung 4, bedeutet der Abschluss der Reaktion nach 3 h. Mit Blick auf die integrale, splitting Muster und J-Kupplungen der Gipfel, ist es möglich, die Struktur der die Chalcone zu validieren. Die integrale der Gipfel (Nummern unter dem Gipfel, Abbildung 5) zeigen die relative Höhe der Wasserstoffatome vorhanden, die auf die Höhe der Wasserstoffatome im Produkt gefunden entsprechen sollte. Darüber hinaus gibt das splitting Muster Aufschluss über die Anzahl der Nachbarn; z. B. Peak (5) und (1) — beide Unterhemden — bzw. keine Nachbarn in der Nähe mit integrale der 3 korreliert mit der MeO- und mir-Gruppe angeben. Durch den Vergleich der chemischen Verschiebungen in den Spektren mit Tabelle 1 lässt sich verdeutlichen, dass die MeO-Gruppe das Singulett bei 3,80 ppm und mir-Gruppe auf 2,45 ppm entspricht. Darüber hinaus kann man als zwei Dubletten (Abbildung 5), Bildung der Doppelbindung 7,80 und 7,44 ppm. Blick auf die J-Kopplung von 16 Hz zeigt Bildung eines E-Alken; die Z-Alken hat in der Regel einen kleineren Wert von 10 – 12 Hz.3 Zuordnung von den aromatischen Gipfeln überprüft die Struktur (Abbildung 5). 4

Abbildung 1: Zugewiesene 1H NMR-Spektren von 4-Methylacetophenone Klicken Sie bitte hier, um eine größere Version dieser Figur.

Abbildung 2: Zugewiesene 1H NMR-Spektren von 4-Methoxybenzaldehyde. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3. Rohe 1H NMR-Spektren nach 30 min zeigt die verbleibende Aldehyd-Spitze. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4. Rohe 1H NMR-Spektren nach 3 h zeigt keine Aldehyd Rest Spitze. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 5. 1 H-NMR-Spektren des erhaltenen Produkts nach Aufarbeitung. Das eingefügte Bild zeigt die J -Kupplungen die Alken. Bitte klicken Sie hier für eine größere Version dieser Figur.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
NMR, beispielsweise lässt sich erkennen Reaktion Zwischenprodukte, erleichtern die Arbeit in der Aufklärung einen Reaktionsmechanismus. Mit Hilfe der NMR ist es auch möglich, molekularen Bewegungen und Interaktionen wichtig für die Entwicklung von Medikamenten zu beobachten. Darüber hinaus kann NMR Strukturinformationen über solide Materialien geben; zum Beispiel, eine Begründung für die beobachteten Materialeigenschaften bieten. Andere Anwendungen der NMR finden Sie im Bereich der Medizin, wo die Magnetresonanz-Tomographie (MRT) zur medizinischen Diagnostik häufig verwendet wird. NMR hat auch in Metabolomics verwendet worden, um verschiedene Metaboliten ausgeschieden durch den Organismus, wodurch einen metabolischen Fingerabdruck zu erkennen. Die Verwendung von NMR sind breit; aus der Bestimmung der Struktur eines einzelnen Moleküls zu Bildgebung des menschlichen Gehirns.
Subscription Required. Please recommend JoVE to your librarian.
References
- Ta, L., Axelsson, A., Bijl, J., Haukka, M., Sundén, H., Ionic Liquids as Precatalysts in the Highly Stereoselective Conjugate Addition of α,β-Unsaturated Aldehydes to Chalcones. Chem. Eur. J. 20 (43), 13889-13893 (2014).
- Table adapted from Graham Solomons, T. W. Fryhle, C. B., Organic Chemistry, 10th edition, Wiley, p. 387, 418 (2011).
- Clayden, J., Greeves, N., Warren, S., Wothers, P. Proton nuclear magnetic resonance. Organic Chemistry, Chapter 11, Oxford University Press, 269 (2001).
- Wu, X.-F., Neumann, H., Spannenberg, A., Schulz, T., Jiao, H., Beller, M.,Development of a General Palladium-Catalyzed Carbonylative Heck Reaction of Aryl Halides. J. Am. Chem. Soc. 132 (41), 14596-14602 (2010).




