Summary
Mostriamo come planare patch-clamp chip fabbricato presso il National Research Council of Canada sono sterilizzati, innescato, caricato con il mezzo, placcato con le cellule, ed utilizzato per le registrazioni elettrofisiologiche.
Abstract
Grazie alla sua squisita sensibilità e la capacità di monitorare e controllare le singole cellule a livello dei canali ionici, patch-bloccaggio è il gold standard di elettrofisiologia applicata a modelli di malattia e gli schermi farmaceutiche egualmente 1. Il metodo comporta tradizionalmente delicatamente a contatto una cellula con una pipetta di vetro riempita da una soluzione fisiologica per isolare una zona della membrana sotto il suo apice 2. Un elettrodo inserito nella pipetta cattura canale ionico attività all'interno del cerotto membrana o, quando rottura, per tutta la cella. Nell'ultimo decennio, patch-clamp chip sono stati proposti come alternativa 3, 4: una pellicola sospesa separa il mezzo fisiologica dal mezzo di coltura, e un'apertura microfabbricata nel film sostituisce l'apice della pipetta. Patch-clamp chip sono stati integrati in sistemi automatizzati e commercializzato per la high-throughput screening 5. Per incrfacilità velocità, esse comprendono la fornitura fluidico di celle da sospensione, il loro posizionamento sul diaframma di aspirazione, e procedure automatizzate per rilevare cellula-sonda guarnizioni ed entrare nella modalità a cellula intera. Abbiamo riportato la realizzazione di una patch-clamp chip di silicio con impedenza ottimizzati e la forma dell'orifizio che permette l'alta qualità di registrazione dei potenziali d'azione nei neuroni di lumaca colture 6; di recente, abbiamo segnalato i progressi compiuti interrogando i neuroni dei mammiferi 7. I nostri patch-clamp chip sono realizzati presso la Canadian Photonics Fabrication Centro 8, una fonderia commerciale, e sono disponibili in grande serie. Siamo desiderosi di impegnarsi in collaborazioni con elettrofisiologi per convalidare l'uso della tecnologia NRCC in diversi modelli. I chip vengono usati secondo lo schema generale rappresentato nella figura 1: il chip di silicio è sul fondo di una fiala cultura plexiglas e la parte posteriore del diaframma è collegato ad un sotterraneo Channel dotato di tubi alle estremità del pacchetto. Le cellule vengono coltivate nella fiala e la cella sulla parte superiore della sonda è controllata da un elettrodo di misura inserito nel channel.The due porte fuori fluidici facilitare lo scambio di soluzione con il minimo disturbo alla cella, questo è un vantaggio rispetto alle pipette vetro per intracellulare perfusione.
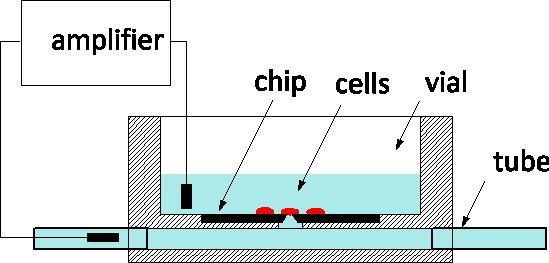
Figura 1. Principio di misurazione utilizzando la NRCC patch-clamp truciolo
Noi dettaglio qui i protocolli di sterilizzare e innescare i circuiti integrati, caricarli con il mezzo, li piatto con le cellule, e, infine, li usano per le registrazioni elettrofisiologiche.
Protocol
1. Chip fabbricazione
Il processo descritto in 6 risultati in uno spessore di 3 um autoportante pellicola, una bassa resistenza di accesso 1 Mohm e una superficie liscia imbuto un'apertura a forma che facilita una tenuta intimo con la cella 9, vedi figura 2. I chip vengono singulated e incollati in pacchetti di plexiglas con l'apertura rivolta verso un foro di collegamento del chip di un canale sotterraneo. L'incollaggio viene erogato in modo da minimizzare la capacità di uno shunt nominale 17 pF. I pacchetti sono dotati di due 1,5 mm di diametro e 6 mm, tubi di vetro lunghe, come le porte fluidici (Figura 3).

Figura 2. Microscopio elettronico a scansione di una sezione mirata fascio di ioni di un NRCC patch-clamp circuito mostra una superficie liscia e biossido di silicio a forma di imbuto che favorisce i contatti intimi cellulari, e un orifizio superficiale che rappresenta una resistanc accesso a bassoe.

Figura 3. Un chip viene incollato sul fondo del flacone di coltura in un pacchetto plexiglas dotato fluidica sotterranee e tubi di vetro.
2. Sterilizzazione, adescamento e test
Le seguenti operazioni devono essere eseguite in una cella di sicurezza per evitare la contaminazione di biologia o di collegare dell'apertura.
- Sterilizzare chip in un pulitore Harrick base plasma (www.harrickplasma.com) con una pressione dell'aria 0,1-0,3 mbar residua per 15 minuti alla potenza massima di 18 W. Altri sistemi di aerei plasma può essere utilizzato, con densità di potenza paragonabile (24 mW / cm 3) e mantenendo il prodotto della densità di potenza e costante di tempo. Il trattamento al plasma rende anche i chip idrofilo, che facilita adescamento.
- Montare tubi di vetro sterile, con tubi in silicone Silastic Laboratory, 1mm x 2mm ID OD (Cole ParmerCat. # 96.115-08), 3inch su un lato, 1 pollice sull'altro lato.
- Riempire fluidica attraverso i tubi sterili con tampone fosfato filtrato standard (PBS), assicurandosi che nessuna bolla è intrappolato.
- Agganciare il tubo lungo in silicone, mentre la pressurizzazione della PBS dal lato corto a 1 atm. Un pool di PBS filtra attraverso l'apertura potrebbe essere visibile nel flacone. Agganciare il pressurizzata della PBS e staccare il tubo corto in silicone da quello di alimentazione.
- Riempire flaconcino con filtrata PBS utilizzando una siringa.
- Immergere uno Ag / Ag: elettrodo di Cl nel tubo corto e un contro-elettrodo nel flacone. Un misuratore di impedenza viene usato per confermare che la resistenza di accesso è tra 300kohm e 3mohm e la capacità shunt è tra 10pF e 25pF. Un chip con una minore resistenza può avere una perdita, e una capacità superiore è da considerarsi improprio per l'uso in quanto non può catturare più rapida dinamica di elettrofisiologia della cella 6. Un chip con una capacità inferioreo maggiore resistenza è considerato collegato, anche se potrebbe essere semplicemente una bolla che è intrappolato nel orifizio. Alcuni chip sono ri-testati dopo 1H e dimostrato di avere la corretta impedenza elettrochimica.
- Lavare il canale fluidico con acqua deionizzata sterile; svuotare il flacone superiore e sciacquarlo con la stessa, due volte.
- Immergere il chip confezionato con tubi in acqua fresca sterile deionizzata per 30 minuti quindi caricare con altri chip in un contenitore sterile riempita con acqua deionizzata sterile. Questo assicura che i chip rimangono idrofilo e protetto dalla contaminazione.
3. Chips di preparazione in laboratorio di biologia cellulare
Le seguenti operazioni vengono eseguite in una cappa HEPA filtrato flusso laminare utilizzando tecniche asettiche, tutte le soluzioni utilizzate in questa procedura deve essere filtrata sterilizzati prima dell'uso utilizzando un filtro 0.22μm.
- Aprire un contenitore chip sotto una cappa HEPA filtrato flusso laminare e rimuovere i chip da Container a faccia in giù per evitare di scavare possibili contaminanti galleggianti nella fiala top.
- Risciacquare superiore della fiala di 2x chip con appena filtrata acqua sterile deionizzata per rimuovere eventuali detriti residuo dalla superficie del chip.
- Aspirare acqua deionizzata sterile dalla fiala in alto.
- Collegare un'estremità della tubazione di silastic collegato al canale fluidico di una siringa pressurizzato contenente acqua filtrata sterile deionizzata. Nel nostro sistema, siringhe piene di soluzione sono sotto pressione da il collegamento ad un serbatoio di aria compressa impostato a 20psi. Per assicurare la sterilità, l'aria viene filtrata (0,22 um filtro) prima dell'ingresso nella siringa e il sistema ha anche una valvola on / off che ci permette di interrompere o applicare pressione quando necessario.
- Utilizzando un emostatico, bloccare l'estremità di uscita del tubo.
- Aprire il valvole on / off per pressurizzare la soluzione.
- Per risciacquare il fluidico subterranen del chip con acqua fresca sterile deionizzata, sbloccare l'estremità di uscita del tubo.
- Per dice l'acqua attraverso l'apertura, bloccare l'estremità di uscita del tubo con una pinza emostatica.
- Per evitare il drenaggio dell'acqua, bloccare le estremità di ingresso e di uscita del tubo con un hemostats e chiudere il valvole on / off.
- Rimuovere l'estremità di ingresso del tubo dalla siringa.
- Inserire i tasselli di vetro in entrambe le estremità del tubo e rimuovere i hemostats.
- Riempire top flaconcino con acqua deionizzata steriled filtro.
- Posizionare il coperchio di un piatto 35 millimetri sterile nella base di un piatto 100 millimetri sterile
- Chip di posizione sulla sommità del coperchio 35 mm e con coperchio 100 millimetri coperchio piatto.
- Chip immagine per assicurare che la membrana e l'apertura dei chip sono liberi di detriti e / o bolle d'aria. Nel nostro laboratorio utilizzare un microscopio montante ed un obiettivo 20x lunga distanza di lavoro.
- Se detriti e / o bolle d'aria sono presenti, lavare ripetutamente il canale fluidico e il flaconcino top. Se i detriti e / o bolle d'aria non può essere rimosso il chip viene scartato.
- Una volta che i chip sonoimmaginata, tornare alla cappa a flusso laminare e staccare entrambe le estremità del tubo.
- Collegare un'estremità del tubo ad una siringa contenente pressione dei media fisiologici.
- Fissare la estremità di uscita del tubo con una pinza emostatica
- Aprire la valvola di pressione, rimuovere la pinza emostatica dalla fine uscita dei fluidica e lavare il canale fluidico con i media fisiologici
- Per risciacquare fluidico sotterraneo con mezzi fisiologici, aprire la valvole on / off e rimuovere la pinza emostatica dalla fine del tubo di uscita.
- Per imporre il supporto fisiologiche attraverso l'apertura, bloccare l'estremità di uscita del tubo con una pinza emostatica.
- Morsetto terminale di ingresso del tubo con una pinza emostatica e chiudere il valvole on / off.
- Rimuovere l'estremità di ingresso del tubo dalla siringa e spina entrambe le estremità del tubo con tappi glas.
- Rimuovere le hemostats.
- Rimuovere l'acqua dalla fiala superiore.
- Riempire il flacone in alto con filtro dei media sterilizzati fisiologici.
- Posizionare il nuovo chip nel piatto mm 100 Petri.
- Posizionare la base di un piatto 35 millimetri nella capsula 100 mm e riempirlo con filtro ad acqua sterilizzata deionizzata per arricchire umidità.
- Coprire il piatto fino a quando non è tempo per la placcatura
4. Placcatura cellulare di neuroni di lumaca
Le patch-clamp chip può essere adatto per una varietà di preparazioni. Al momento stiamo testando le nostre chips con mammiferi neuroni corticali primarie e hanno ottenuto risultati preliminari con cellule in coltura per 14 giorni 7, il che indica che il nostro protocollo di sterilizzazione è adeguata e che i chip non sono citotossici in colture a lungo termine. Ai fini del presente protocollo, i neuroni di lumaca sono stati scelti perché rappresentano un modello semplice ma ben consolidata per studiare neuronale elettrofisiologia 11, ed è con quelle cellule che abbiamo ottenuto i risultati più significativi fino ad oggi 10. Isolamento delle cellule dettagliata e le procedure di coltura hannostato descritto in precedenza 12, 13.
Togliere il guscio esterno 2-3 stagnalis vecchia mesi Lymnaea con pinza smussati e anestetizzare gli animali in Lymnaea saline contenenti il 10% Listerine.
Tutte le fasi successive effettuate in modo asettico in una cappa a flusso laminare attrezzature dissezione sterilizzata e soluzioni a temperatura ambiente.
- Sostituire i media fisiologiche nelle fluidica con la soluzione di registrazione appropriata usando una pipetta Eppendorf. Nel caso di neuroni Lymnaea la soluzione contiene (in mM): 50 KCl, 5 MgCl 2, 5 etilenebis (oxyethylenenitrilo) tetraacetico (EGTA) e 5 4 - (2-idrossietil)-1-piperazineethanesulfonic acido (HEPES, pH 7,4 ; 130 mOsm) 14
- Pin le lumache in un piatto pieno di Sylgard Lymnaea soluzione salina e rimuovere intero cervello come descritto in precedenza 13
- Trattare il isolatEd il cervello in mezzi definiti (DM) con tripsina dell'enzima (0,2% Solution, Sigma, Catalog # T-9201) per 18 minuti, seguita da trattamento in DM e inibitore della tripsina (Sigma, soia, Catalog # T-9003) per 15 minuti.
- Appunta il cervello in un piatto Sylgard piccola riempita con osmolarità elevata definita media (HODM - DM con glucosio aggiunto, 750 ml di soluzione di glucosio 1 M a 20 mL DM).
- Utilizzo di pinze e forbici dissezione fine, rimuovere la guaina esterna e interna dei gangli di interesse, esponendo i neuroni.
- Usando una pipetta di vetro lucidato fuoco riempito HODM e attaccato ad una microsiringa, applicare aspirazione delicata prossimità della cella di interesse (sinistra dorsale del piede 1) fino a quando il neurone stacca dal cervello e viene sospeso nella pipetta.
- La pipetta di vetro viene quindi spostata e immersi in neurochips singoli dove espulsione dolce dal microsiringa permette i neuroni da delicatamente spinto fuori della pipetta e posto sulla sommità dei fori patch sui singoli chip.
- Permettere alle cellule di riposare per un minimo di 2 ore a temperatura ambiente per promuovere la loro adesione alla superficie del chip che circonda l'apertura.
5. Le registrazioni elettrofisiologiche
Per collegare i chip per l'amplificatore (nel nostro caso un amplificatore Multiclamp 700B, Molecular Devices, Foster City, CA, USA)
- Sostituire la soluzione nel fluidica sotterraneo e nel flacone chip con le soluzioni di registrazione appropriate. Nel caso di neuroni Lymnaea, le camere di coltura superiori sono riempiti con Lymnaea salina (in mM: 51,3 NaCl, KCl 1,7, 4 CaCl2 e MgCl2 1,5) tamponata a pH 7,9 con HEPES 14.
- Per la stabilità, la colla il chip su un vetrino e metterla sotto un microscopio.
- Per collegare il chip per l'amplificatore (nel nostro caso un amplificatore Multiclamp 700B, Molecular Devices, Foster City, CA, USA), tagliare un'estremità del tubo e inserire un Silver filo che è collegato alla testa-stadio.
- Posizionare l'elettrodo di riferimento nel flacone superiore del chip.
- Il chip è ora pronto per la registrazione.
- Applicare un passo 5 mV con l'amplificatore per misurare la resistenza totale (R t) e determinare la configurazione dei neuroni: cell-attached (R t> 1 GΩ); cellula intera (Rt = 50-100 transienti mQ più capacitivo, indicativo di rottura della membrana sull'apertura), oppure no tenuta (R t <5 mQ). Nella nostra ultima serie di 10 esperimenti, il 58% per cento delle cellule avevano guarnizioni ad alta resistenza e, di questi, l'80% delle cellule ha mostrato risposte eccitabili.
6. Risultati rappresentativi
- Applicare depolarizzante impulsi di corrente (20 incremento pA) al neurone (in questo caso LPeD1).
- Tenere il neurone alla chiusura Vm al suo potenziale di riposo (~ - 60 mV).
- Osservare le risposte a questi impulsi depolarizzanti. Superamento potenziali d'azione dovrebbeessere osservata se il neurone è vitale.
- Figura 4 mostra un risultato rappresentativo che è discussa in dettaglio in 14, 15.

Figura 4 risposte tensione. (In alto) di un neurone LPeD1 alla serie graduata di intracellulari impulsi di corrente (sotto). Gli impulsi di corrente sono stati applicati a Vm = - 60mV.
Risoluzione dei problemi
- Prima di placcatura, trucioli di immagine per determinare se membrana e apertura sono liberi di detriti e adatto per la placcatura. Noi usiamo un microscopio verticale e uno 20x obiettivo a lungo distanza di lavoro. Nella nostra ultima serie di esperimenti 1, 67% dei chip sono stati correttamente innescato in quel modo.
- Se detriti e / o bolle d'aria sono presenti scartare chip e provare un altro.
- Diversi trattamenti superficiali (plasma) o rivestimenti (PDL, PEI ecc) può essere provato, ma il successo può essere fortemente dipendente dal tipo di cellulautilizzato.
- La composizione del ("pipetta") in soluzione fluida critico per la formazione del giga-sigillo e la cellula intera. Regolare la soluzione, facendo attenzione a osmolarità, pH, e il trucco ionica.
- Per la cultura a lungo termine, iniziano con i media nel canale microfluidica, quindi passare alla pipettare soluzione prima della registrazione mediante perfusione dolce alimentato a gravità (~ 0,5 ml / min).
Discussion
NRCC di patch-clamp piattaforma interrogatorio chip è uno strumento potenzialmente efficace per le prove ad alto contenuto di informazione farmaceutica e di indagare in modelli in vitro di malattia. I suoi vantaggi rispetto alle pipette di vetro sono una resistenza di accesso bassa, che è un vantaggio per sondare le cellule grandi, e nonostante una capacità leggermente maggiore comporta dinamica comparabili per celle più piccole. Cellula spontanea alle guarnizioni di apertura sono stati regolarmente ottenuti, e l'entrata a cellula intera è stato osservato che il 14 spontanea. Una chiara differenza tra i chip e il metodo pipetta di vetro è il fatto che la sonda è parte della piastra di coltura cellulare e non è manualmente portato in contatto con la membrana cellulare. Coltura di cellule, eventualmente parte di reti funzionali, risultati in modelli più biologicamente rilevanti, come modelli di malattia, e un diverso meccanismo per assicurare celle ad alta tenuta per sondare 16. Tuttavia, in contrasto con sospensioni cellulari, aspirazione cannot essere utilizzato per posizionare una cella sulla sonda. Neuroni Snail, come altre grandi cellule, sono suscettibili di posizionamento manuale sulla parte superiore della sonda. Per il posizionamento piccole cellule che richiedono lunghi tempi di coltura, si è ovviato la necessità di manipolazione e di mantenere una elevata probabilità di ottenere un sigillo di polipeptidi adesione patterning sopra le sonde per posizionare le cellule sopra delle sonde, e ha dimostrato di celle sul Sonda 17,18.
NRCC sta sviluppando una poliimmide microfluidica patch-clamp circuito 19 con una capacità paragonabile a quella del vetro pipetta. L'obiettivo finale di tale progetto è a più sonde patch-clamp chip che consente il monitoraggio simultaneo dell'attività elettrofisiologica dei neuroni più impegnate nel comportamento della rete alla risoluzione dei canali ionici singoli 14. Questo metodo è un metodo ad alta risoluzione complementare a multi-elettrodo array 20.
Disclosures
Non ci sono conflitti di interesse dichiarati.
Acknowledgments
Gli autori desiderano ringraziare Alexei Bogdanov per la realizzazione di patch-clamp chip al CPFC e Hue Tran, Zhao Ping e Matthew Shiu per l'assistenza al montaggio. Naweed Syed è stata sostenuta da una Canadian Institute of Health Research (CIHR) sovvenzione. Collin Luk è il destinatario di NSERC e Alberta Heritage Foundation for Medical Research (AHFMR) borse di studio.
References
- Walz, W. Patch-Clamp Analysis: Advanced Techniques. Neuromethods. , 2nd, Springer Protocols. 38 (2007).
- Neher, E., Sakmann, B. Single-channel currents recorded from membrane of denervated frog muscle fibers. Nature. 260, 799-802 (1976).
- Behrends, J. C., Fertig, N. Ch. 14: Planar Patch-clamp. Neuromethods. , 2nd, (2007).
- Fertig, N., Tilke, A., Blick, R. H. Stable integration of isolated cell membrane patches in a nanomachined aperture. Applied Physics Letters. 77, 1218-1220 (2000).
- Dunlop, J., Bowlby, M., Peri, R., Vasilyev, D., Arias, R. High-throughput electrophysiology: an emerging paradigm for ion-channel screening and hysiology. Nat. Rev. Drug. Discov. 7 (4), 358-368 (2008).
- Py, C., Denhoff, M., Martina, M. A novel silicon patch-clamp chip permits high-fidelity recording of ion channel activity from functionally defined neurons. Biotechnology and Bioengineering. 107 (4), 593-600 (2010).
- Martinez, D., Martina, M., Kremer, L. Development of patch-clamp chips for mammalian cell applications. Micro and Nanosystems. 2 (4), (2010).
- National Research Centre of Canada . , Candian Photonics Fabrication Centre. Available from: http://www.nrc-cnrc.gc.ca/eng/solutions/facilities/prototyping_index.html (c1995-2001).
- Py, C., Salim, D., Monette, R. Cell to aperture interaction in patch-clamp chips visualized by fluorescence microscopy and focused-ion beam sections. Biotechnology & Bioengineering. 108, 1395-1403 (2011).
- Martina, M., Luk, C., Py, C. Interrogation of Cultured Neurons using Patch-Clamp Chips. Journal of Neural Engineering. 8, 034002 (2011).
- Bell, H. J., Syed, N. I. Hypoxia-induced modulation of the respiratory CPG. Frontiers in bioscience : a journal and virtual library. 14, 3825-3835 (2009).
- Syed, N. I., Bulloch, A. G. M., Lukowiak, K. In vitro reconstruction of the respiratory central pattern generator of the mollusk Lymnaea. Science. 250, 282-285 (1990).
- Syed, N. I., Zaidi, H., Lovell, P. In vitro reconstruction of neuronal circuits: A simple model system approach. Modern techniques in neuroscience research. Windhorst, U., Johansson, H. , Springer. (1999).
- Martina, M., Luk, C., Py, C. Interrogation of Cultured Neurons using Patch-Clamp Chips. Journal of Neural Engineering. 8, 034002 (2011).
- Py, C., Denhoff, M., Martina, M., et al. Silicon patch-clamp chip suitable for high-fidelity recording of ion channel activity from cultured neurons. Biotechnology and Bioengineering. 107 (4), (2010).
- Ong, W. -L., Yobas, L., Ong, W. -Y. A missing factor in chip-based patch clamp assay: gigaseal. Journal of Physics: Conference Series. 34, 187 (2006).
- Charrier, A., Martinez, D., Monette, R. Cell placement and guidance on substrates for neurochip interfaces. Biotechnology and Bioengineering. 105, 368-373 (2010).
- Diaz-Quijada, D., Maynard, C. C. omas, Monette, T., Py, R., A, C. K. rantis, Mealing, G. Surface Patterning with Chemisorbed Chemical Cues for Advancing Neurochip Applications. Industrial & Engineering Chemistry Research. 50 (17), 10029-10035 (2011).
- Martinez, D., Py, C., Denhoff, M., et al. High-fidelity patch-clamp recordings from neurons cultured on a polymer microchip. Biomedical Microdevices. 12, 977-97 (2010).
- Taketani, M., Baudry, M. Advances in Network Electrophysiology: Using Multi-Electrode Arrays. , Springer. (2006).



