Summary
Vi viser hvordan planar patch-clamp chips fabrikkert ved National Research Council of Canada er sterilisert, primet, lastet med medium, belagt med celler, og brukt til elektrofysiologiske opptak.
Abstract
På grunn av sin utsøkte følsomhet og evne til å overvåke og kontrollere individuelle celler på nivå med ionekanaler, er patch-festebraketter gullstandarden for elektrofysiologi gjaldt sykdom modeller og farmasøytiske skjermer både en. Metoden innebærer tradisjonelt forsiktig kontakte en celle med et glass pipette fylles av en fysiologisk løsning for å isolere en lapp av membranen under sitt toppunkt to. En elektrode inn i pipetten fanger ion-kanal aktivitet innenfor membranen patch eller når sprukket, for hele cellen. I det siste tiåret, har patch-clamp chips blitt foreslått som en tre alternativ, 4: en suspendert film skiller fysiologisk medium fra kultur medium, og en blender microfabricated i filmen erstatter apex av pipetten. Patch-Clamp chips har blitt integrert i automatiserte systemer og kommersialisert for high-throughput screening 5. Til INCRlette gjennomstrømning, inkluderer de fluidic levering av celler fra suspensjon, deres posisjonering på blender ved suging, og automatiserte rutiner for å oppdage celle-til-probe sel og inngå helcelle modus. Vi har rapportert om fabrikasjon av en silisium patch-clamp chip med optimalisert impedans og orifice form som tillater høykvalitets opptak av aksjonspotensialer i dyrkede sneglen nevroner 6; nylig, har vi også rapportert fremgang mot avhør pattedyr nerveceller 7. Våre patch-clamp chips er fabrikkert ved den kanadiske Photonics Fabrikasjon 8 Centre, en kommersiell støperi, og er tilgjengelig i store serier. Vi er ivrige etter å engasjere seg i samarbeid med electrophysiologists å validere bruk av NRCC teknologi i ulike modeller. Flisen brukes i henhold til den generelle ordningen representert i figur 1: silisium chip er på bunnen av en pleksiglass kultur hetteglass og baksiden av blenderåpningen er koblet til en underjordisk channel utstyrt med rør i hver ende av pakken. Cellene dyrkes i hetteglasset og cellen på toppen av sonden overvåkes av en måling elektrode inn i channel.The to utenfor fluidic porter rette løsningen utveksling med minimal forstyrrelse av cellen, og dette er en fordel sammenlignet med glass pipetter til intracellulære perfusjon.
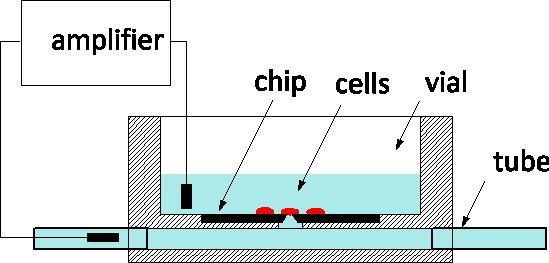
Figur 1. Prinsippet måling med NRCC patch-clamp chip
Vi detalj her protokollene å sterilisere og klargjøre chips, laste dem med middels, plate dem med celler, og til slutt bruke dem for elektrofysiologiske opptak.
Protocol
1. Chip fabrikasjon
Prosessen er beskrevet i 6 resultater i en tre mikrometer tykk frittstående film, en lav en Mohm tilgang motstand og en glatt overflate traktformet blenderåpning som muliggjør en intim tetning med cellen 9, se figur 2. Flisen singulated og limt i pleksiglass pakker med åpningen vendt et hull koble chip til en underjordisk kanal. Den liming påføres på en måte som minimerer shunt kapasitans til en nominell 17 pF. Pakker er utstyrt med to 1,5 mm diameter og 6 mm lange glassrør som fluidic porter (figur 3).

Figur 2. Scanning elektron micrograph av en fokusert ion stråle delen av en NRCC patch-clamp chip viser en jevn silisiumdioksid overflate og traktform som favoriserer intime celle kontakter, og et grunt åpningen som står for en lav tilgang resistance.

Figur 3. En chip er limt nederst kulturen hetteglasset i en plexiglass pakke utstyrt med underjordiske lufthåndtering og glassrør.
2. Sterilisering, grunning og testing
Følgende trinn skal utføres i en biologi sikkerhet skap for å unngå forurensning eller plugging av blenderåpningen.
- Steriliser chips i en harrick grunnleggende plasma cleaner (www.harrickplasma.com) med en 0.1 til 0.3 mbar gjenværende lufttrykket etter 15 minutter ved maksimal effekt på 18 W. Andre air plasma-systemer kan brukes, med sammenlignbare strømtetthet (24 mW / cm 3) og holde på produktet av strømtetthet og tidskonstant. Den plasma behandling gjengir også chips hydrofile, som letter priming.
- Monter glassrør med steril Silastic Laboratory silikonslanger, 1mm ID x 2mm OD (Cole ParmerCat. # 96115-08), 3inch på den ene siden, en tomme på den andre siden.
- Fyll lufthåndtering gjennom rørene med sterilt filtrert standard fosfatbuffer Solution (PBS), noe som gjør at ingen boble er fanget.
- Klem lang silikontuben mens trykksetting PBS fra kortsiden ved 1 atm. En pool av PBS siver gjennom blenderåpningen kan være synlig i ampullen. Klem trykksatt levering av PBS og ta den korte silikontuben fra at tilbud.
- Fyll glasset med filtrert PBS hjelp av en sprøyte.
- Fordyp en Ag / Ag: Cl elektrode på kort tube og en counter-elektrode i hetteglasset. En impedans meter brukes til å bekrefte at tilgangen motstanden er mellom 300kohm og 3Mohm og shunten kapasitans er mellom 10pF og 25pF. En chip med en lavere motstand er sannsynlig å ha en lekkasje, og en høyere kapasitans anses som uegnet til bruk som det ikke kan fange de raskeste dynamikken i cellens elektrofysiologi 6. En chip med en lavere kapasitanseller høyere motstand regnes plugget, men det kan være ganske enkelt at en boble er fanget i åpningen. Noen chips er re-testet etter 1H og funnet å ha den riktige elektrokjemisk impedans.
- Skyll fluidic kanalen med sterilt avionisert vann, tømme toppen hetteglasset og skyll med det samme, to ganger.
- Senk pakkede chip med rør i frisk sterilt avionisert vann for 30min legg deretter sammen med andre brikker i en steril beholder fylt med sterilt avionisert vann. Dette sikrer at chips forbli hydrofile og beskyttet mot forurensning.
3. Chips forberedelse i cellebiologi lab
Følgende trinn utføres i et HEPA filtrert laminær hetten med aseptiske teknikker, må alle løsninger som brukes i denne prosedyren bli filtrert steriliseres før bruk ved hjelp av en 0.22μm filter.
- Åpne en chip beholder under en HEPA filtrert laminær hette og fjerne sjetonger fra Container forsiden ned for å unngå scooping mulige flytende forurensninger inn i øverste hetteglasset.
- Skyll toppen av hetteglass chip 2x med fersk filtrert sterilt avionisert vann for å fjerne rusk fra brikken overflaten.
- Sug sterilt avionisert vann på toppen hetteglasset.
- Koble den ene enden av silastic slangen festet til fluidic kanalen til en trykksatt sprøyte som inneholder sterilt filtrert deionisert vann. I vårt system, sprøyter fylt med løsningen er presset av tilkobling til en komprimert luft tank satt til 20psi. For å sikre sterilitet, blir luften filtrert (0,22 mikrometer filter) før innreise i sprøyten og vårt system har også en av / på ventil som tillater oss å stoppe eller legge press når det trengs.
- Ved hjelp av en hemostat, klemme utgangen enden av slangen.
- Åpne av / på ventiler for trykksetting av løsningen.
- Å skylle subterranen fluidic av brikken med fersk sterilt avionisert vann, unclamp utgangen enden av slangen.
- Til force vannet opp gjennom blenderåpning, klemme utgangen enden av slangen med en hemostat.
- For å unngå drenering, klemme inn-og utgang endene av slangen med en hemostats og lukke / på ventiler.
- Løsne innspill enden av slangen fra sprøyten.
- Sett glass plugger i begge endene av slangen og fjern hemostats.
- Fyll topp hetteglass med filter steriled avionisert vann.
- Sett lokket på en 35 mm sterilt rett inn i bunnen av en 100 mm steril fatet
- Plasser chip på toppen av den 35 mm lokk og dekk med 100 mm parabolen lokk.
- Image chips å sikre at membranen og blenderåpning av sjetongene er fri for rusk og / eller luftbobler. I vårt laboratorium bruker vi en oppreist mikroskop og en 20x lang arbeidsavstand mål.
- Hvis rusk og / eller luftbobler er tilstede, gjentatte ganger skylles fluidic kanal og topp hetteglass. Hvis rusk og / eller luftbobler ikke kan fjernes brikken blir forkastet.
- Når chips erbildebehandlet, tilbake til laminær hette og koble begge ender av slangen.
- Fest den ene enden av slangen til en trykksatt sprøyte som inneholder fysiologiske media.
- Klem utgang enden av slangen med en hemostat
- Åpne trykkventil, fjerne hemostat fra utdataene slutten av lufthåndtering og spyl fluidic kanal med fysiologiske media
- Å skylle det underjordiske fluidic med fysiologiske media, åpne på / av ventiler og fjern hemostat fra utdataene enden av slangen.
- For å tvinge de fysiologiske media opp gjennom blenderåpning, klemme utgangen enden av slangen med en hemostat.
- Klem innspill enden av slangen med en hemostat og lukke / på ventiler.
- Fjern innspill enden av slangen fra sprøyten og plug begge endene av slangen med glas plugger.
- Fjern hemostats.
- Fjern vannet fra toppen hetteglasset.
- Fyll topp hetteglasset med filter sterilisert fysiologiske media.
- Plasser brikken tilbake i 100 mm petriskål.
- Plasser foten av en 35 mm rett inn i 100 mm fat og fyll den med filter steriliseres deionisert vann for å berike fuktighet.
- Dekk formen før det er tid for plating
4. Cell plating av sneglen nevroner
De patch-clamp chips kan være egnet for en rekke preparater. Vi tester for tiden våre chips med pattedyr primære kortikale nevroner og har fått de foreløpige resultatene med celler dyrket i 14 dager 7, hvilket indikerer at vår sterilisering protokollen er tilstrekkelig og at chips er ikke cytotoksisk i langsiktige kulturer. For hensikten med denne protokollen, ble sneglen nevroner valgt fordi de representerer en enkel, men veletablert modell for å studere nevrale elektrofysiologi 11, og det er med de cellene som vi har fått de mest betydelige resultater til dags dato 10. Detaljert celleisolasjon og kultur prosedyrer harblitt beskrevet tidligere 12, 13.
Fjern den ytre skallet 2-3 mnd gammel Lymnaea stagnalis med butte tang og anesthetize dyr i Lymnaea saltløsning som inneholder 10% Listerine.
Alle etterfølgende trinn utført aseptisk i en laminær luftstrøm hette med sterilisert disseksjon utstyr og løsninger ved romtemperatur.
- Bytt fysiologiske media i lufthåndtering med riktig opptak løsning ved hjelp av en Eppendorf pipette. Ved Lymnaea nevroner løsningen inneholder (i mm): 50 KCl, 5 to MgCl, 5 ethylenebis (oxyethylenenitrilo) tetraacetic acid (EGTA) og 5 4 - (2-hydroxyethyl)-1-piperazineethanesulfonic syre (HEPES; pH 7,4 ; 130 mOsm) 14
- Pin sneglene inn i en Sylgard tallerken fylt med Lymnaea saltvann og fjerne hele hjernen som tidligere beskrevet 13
- Behandle isolated hjerner i definerte media (DM) med trypsin enzym (0,2% Solution, Sigma, Catalog # T-9201) i 18 minutter, etterfulgt av behandling i DM og trypsin inhibitor (Sigma, soya, Catalog # T-9003) i 15 minutter.
- Pin hjernen til en liten Sylgard tallerken fylt med høy osmolaritet definert media (HODM - DM med glukose lagt, 750 mL av 1M glukoseoppløsning til 20 ml DM).
- Bruke fine tenger og disseksjon saks, fjerne det ytre og indre kappen ganglia av interesse, utsette nervecellene.
- Ved hjelp av en brann polert glass pipette fylt med HODM og festet til en microsyringe, gjelder skånsom suging nær cellen av interesse (Venstre pedal dorsal 1) til nervecellen løsner fra hjernen og er suspendert i pipetten.
- Glasset pipette nå flyttes og dyppet i individuelle neurochips hvor skånsom utvisning fra microsyringe tillater nervecellene skal forsiktig skjøvet ut av pipetten og plassert på toppen av de enkelte patch hullene på chips.
- La cellene å sitte uforstyrret i minimum 2t ved romtemperatur for å fremme sin tilknytning til det chip overflaten rundt åpningen.
5. Elektrofysiologiske opptak
Å koble chips til forsterkeren (i vårt tilfelle en Multiclamp 700B forsterker, molekylære enheter, Foster City, CA, USA)
- Bytt løsningen i det underjordiske fluidic og i brikken hetteglasset med de aktuelle innspillingen løsninger. Ved Lymnaea nevroner, blir de øvre kultur kamre fylt med Lymnaea saltvann (i mm: 51,3 NaCl, 1,7 KCl, 4 CaCl2, og 1,5 MgCl2) bufret til pH 7,9 med HEPES 14.
- For stabilitet, lim brikken på en glass-slide og plassere den under et mikroskop.
- Slik kobler du chip til forsterkeren (i vårt tilfelle en Multiclamp 700B forsterker, molekylære enheter, Foster City, CA, USA), kuttet den ene enden av slangen og sett en Silver wire som er koblet til head-scenen.
- Plasser referanse elektrode i toppen hetteglasset av brikken.
- Brikken er nå klar for innspilling.
- Påfør en 5 mV takt med forsterkeren å måle total motstand (R t) og bestemme konfigurasjonen av nevroner: celle-attached (R t> 1 GΩ); hel-celle (RT = 50-100 MΩ pluss kapasitiv transienter, veiledende av membran brudd over blenderåpning), eller ingen forsegling (R t <5 MΩ). I vår siste sett av eksperimenter 10, 58% prosent av cellene hadde høy motstand sel og, av dem, viste 80% av cellene opphisset svar.
6. Representative Resultater
- Påfør depolariserende strømpulser (20 pA tilvekst) til nervecellen (i dette tilfellet LPeD1).
- Hold nervecellen på Vm nær sitt hvilested potensial (~ - 60 mV).
- Observer svarene til disse depolariserende pulser. Overskyting aksjonspotensialer børobserveres hvis nervecellen er levedyktig.
- Figur 4 viser et representativt resultat som er omtalt i detaljer i 14, 15.

Figur 4. Voltage svar (øverst) til en LPeD1 nervecelle til gradert rekke intracellulære strømpulser (nedenfor). De nåværende pulser ble anvendt på Vm = - 60mV.
Feilsøking
- Før plating, til bilde chips avgjøre om membran og blenderåpning er fri for rusk og egnet for platekledning. Vi bruker en oppreist mikroskop og en 20x lang arbeidsavstand mål. I vår siste sett av eksperimenter 1, ble 67% prosent av chips vellykket grunnes på den måten.
- Hvis rusk og / eller luftbobler er tilstede forkaste chip og prøv en annen.
- Ulike overflatebehandlinger (plasma) eller belegg (PDL, PEI etc.) kan forsøkes, men suksessen kan være svært avhengig av celletypebrukt.
- Sammensetningen av fluidic ("pipette") løsning i kritisk for dannelsen av giga-steinkobbe og hel-celle. Juster løsning, betaler oppmerksomhet til osmolaritet, pH, og ionisk makeup.
- For lengre sikt kultur, begynne med media i microfluidic kanal, deretter bytte til pipetter løsning før opptak via skånsom tyngdekraften matet perfusjon (~ 0,5 ml / min).
Discussion
NRCC sin patch-clamp chip avhør plattform er en potensielt kraftig verktøy for høyt informasjonsinnhold farmasøytiske analyser og å undersøke in vitro modeller av sykdom. Dens fordeler sammenlignet med glass pipetter er en lav tilgang motstand, noe som er en fordel å undersøke store celler, og til tross for en noe større kapasitans vil resultere i tilsvarende dynamikk for mindre celler. Spontan celle til Aperture forseglingene er rutinemessig innhentet, og hele celleoppføring har blitt observert å være spontan 14. En klar forskjell mellom chips og glasset pipetten metoden er det faktum at sonden er en del av cellekultur fatet og ikke manuelt bringes i kontakt med cellemembranen. Dyrkning celler, muligens en del av funksjonelle nettverk, resulterer i flere biologisk relevante modeller som sykdom modeller, og en annen mekanisme for å sikre høy celle å sondere sel 16. Men i motsetning til cellesuspensjoner, aspirasjon cannot brukes til å plassere en celle på sonden. Snail nevroner, som andre store celler, er mottagelig for manuell posisjonering på toppen av sonden. For mindre celler som krever lengre kultur tider, har vi obviated behovet for manipulasjon og holde en høy sannsynlighet for å få et segl med mønster vedheft polypeptider på toppen av sonder å plassere celler på toppen av sonder, og viste plassering av celler på probe 17,18.
NRCC utvikler også en polyimid microfluidic patch-clamp chip 19 med en kapasitans sammenlignes med glass pipette. Det ultimate målet at prosjektet er et flere-prober patch-clamp chip som gjør den samtidig overvåking av elektrofysiologisk aktivitet av flere nevroner som er engasjert i nettverk oppførsel ved oppløsning av individuelle ionekanaler 14. Denne metoden er en høy oppløsning komplementær metode til multi-elektrode arrays 20.
Disclosures
Ingen interessekonflikter erklært.
Acknowledgments
Forfatterne ønsker å erkjenne Alexei Bogdanov for fabrikasjon av patch-klemmen chips på CPFC, og Hue Tran, Ping Zhao og Matthew Shiu for hjelp med montering. Naweed Syed ble støttet av en Canadian Institute of Health Research (CIHR) tilskudd. Collin Luk er mottaker av NSERC og Alberta Heritage Foundation for medisinsk forskning (AHFMR) studentships.
References
- Walz, W. Patch-Clamp Analysis: Advanced Techniques. Neuromethods. , 2nd, Springer Protocols. 38 (2007).
- Neher, E., Sakmann, B. Single-channel currents recorded from membrane of denervated frog muscle fibers. Nature. 260, 799-802 (1976).
- Behrends, J. C., Fertig, N. Ch. 14: Planar Patch-clamp. Neuromethods. , 2nd, (2007).
- Fertig, N., Tilke, A., Blick, R. H. Stable integration of isolated cell membrane patches in a nanomachined aperture. Applied Physics Letters. 77, 1218-1220 (2000).
- Dunlop, J., Bowlby, M., Peri, R., Vasilyev, D., Arias, R. High-throughput electrophysiology: an emerging paradigm for ion-channel screening and hysiology. Nat. Rev. Drug. Discov. 7 (4), 358-368 (2008).
- Py, C., Denhoff, M., Martina, M. A novel silicon patch-clamp chip permits high-fidelity recording of ion channel activity from functionally defined neurons. Biotechnology and Bioengineering. 107 (4), 593-600 (2010).
- Martinez, D., Martina, M., Kremer, L. Development of patch-clamp chips for mammalian cell applications. Micro and Nanosystems. 2 (4), (2010).
- National Research Centre of Canada . , Candian Photonics Fabrication Centre. Available from: http://www.nrc-cnrc.gc.ca/eng/solutions/facilities/prototyping_index.html (c1995-2001).
- Py, C., Salim, D., Monette, R. Cell to aperture interaction in patch-clamp chips visualized by fluorescence microscopy and focused-ion beam sections. Biotechnology & Bioengineering. 108, 1395-1403 (2011).
- Martina, M., Luk, C., Py, C. Interrogation of Cultured Neurons using Patch-Clamp Chips. Journal of Neural Engineering. 8, 034002 (2011).
- Bell, H. J., Syed, N. I. Hypoxia-induced modulation of the respiratory CPG. Frontiers in bioscience : a journal and virtual library. 14, 3825-3835 (2009).
- Syed, N. I., Bulloch, A. G. M., Lukowiak, K. In vitro reconstruction of the respiratory central pattern generator of the mollusk Lymnaea. Science. 250, 282-285 (1990).
- Syed, N. I., Zaidi, H., Lovell, P. In vitro reconstruction of neuronal circuits: A simple model system approach. Modern techniques in neuroscience research. Windhorst, U., Johansson, H. , Springer. (1999).
- Martina, M., Luk, C., Py, C. Interrogation of Cultured Neurons using Patch-Clamp Chips. Journal of Neural Engineering. 8, 034002 (2011).
- Py, C., Denhoff, M., Martina, M., et al. Silicon patch-clamp chip suitable for high-fidelity recording of ion channel activity from cultured neurons. Biotechnology and Bioengineering. 107 (4), (2010).
- Ong, W. -L., Yobas, L., Ong, W. -Y. A missing factor in chip-based patch clamp assay: gigaseal. Journal of Physics: Conference Series. 34, 187 (2006).
- Charrier, A., Martinez, D., Monette, R. Cell placement and guidance on substrates for neurochip interfaces. Biotechnology and Bioengineering. 105, 368-373 (2010).
- Diaz-Quijada, D., Maynard, C. C. omas, Monette, T., Py, R., A, C. K. rantis, Mealing, G. Surface Patterning with Chemisorbed Chemical Cues for Advancing Neurochip Applications. Industrial & Engineering Chemistry Research. 50 (17), 10029-10035 (2011).
- Martinez, D., Py, C., Denhoff, M., et al. High-fidelity patch-clamp recordings from neurons cultured on a polymer microchip. Biomedical Microdevices. 12, 977-97 (2010).
- Taketani, M., Baudry, M. Advances in Network Electrophysiology: Using Multi-Electrode Arrays. , Springer. (2006).



