Summary
Mostramos cómo plana patch-clamp fichas fabricadas en el Consejo de Investigación Nacional de Canadá se esterilizan, preparado, cargado con el medio, recubierto de células, y se utiliza para los registros electrofisiológicos.
Abstract
Debido a su exquisita sensibilidad y la capacidad de monitorear y controlar las células individuales en el nivel de los canales iónicos, de patch-clamp es el estándar de oro de la electrofisiología se aplica a modelos de enfermedad y las pantallas de farmacéuticos por igual 1. El método implica tradicionalmente suavemente en contacto una célula con una pipeta de vidrio lleno de una solución fisiológica con el fin de aislar un parche de la membrana bajo su vértice 2. Un electrodo insertado en la pipeta captura de iones canal actividad dentro del parche o membrana, cuando se rompió, por toda la celda. En la última década, patch-clamp virutas se han propuesto como una alternativa 3, 4: una película suspendido separa el medio fisiológico del medio de cultivo, y una abertura en la película microfabricated reemplaza el ápice de la pipeta. Patch-clamp fichas se han integrado en los sistemas automatizados y comercializado para el cribado de alto rendimiento 5. Para incrfacilitar el rendimiento, que incluyen la entrega de fluidos de las células de la suspensión, su posicionamiento en la apertura por medio de succión, y las rutinas automatizadas para la detección de la célula a la sonda juntas y entrar en el modo de célula entera. Nos han informado sobre la fabricación de silicio de un chip de patch-clamp con una impedancia optimizada y forma del orificio que permite la grabación de alta calidad de los potenciales de acción en las neuronas cultivadas de 6 caracoles, recientemente, también han informado de los progresos hacia el interrogatorio neuronas de mamíferos 7. Nuestros patch-clamp chips son fabricados en el Centro Canadiense de Fabricación Fotónica 8, un comercial de la fundición, y están disponibles en grandes series. Estamos ansiosos de participar en la colaboración con los electrofisiólogos para validar el uso de la tecnología NRCC en diferentes modelos. Los chips se utilizan de acuerdo con el esquema general representada en la figura 1: el chip de silicio está en el fondo de un frasco de cultivo de plexiglás y la parte posterior de la abertura está conectado a un subterráneo ChannEl provista de tubos en cada extremo del paquete. Las células se cultivaron en el vial y la célula en la parte superior de la sonda se controla mediante un electrodo de medición insertado en el channel.The dos fuera de los puertos fluídicos facilitar el intercambio de solución con una perturbación mínima a la celda, lo cual es una ventaja en comparación con pipetas de vidrio para intracelular perfusión.
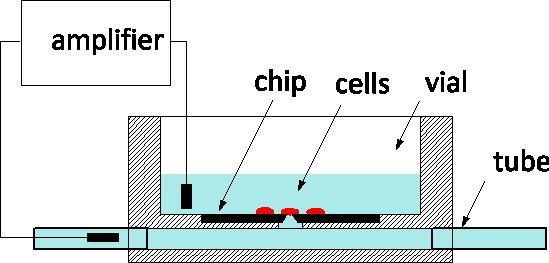
Figura 1. Principio de medición usando el NRCC parche-abrazadera de chip
Detallamos aquí los protocolos de esterilización y preparar las patatas fritas, cargarlos con el medio, a la placa con las células y, finalmente, los utilizan para registros electrofisiológicos.
Protocol
1. Fabricación de chips
El proceso descrito en 6 resultados en un 3 m de espesor autónomo película, una baja resistencia acceso 1 Mohmio y una superficie lisa en forma de embudo abertura que facilita un sello íntimo con la célula 9, véase la Figura 2. Las virutas se singulated y pegadas en paquetes de plexiglás con la abertura hacia un agujero que conecta el chip a un canal subterráneo. El encolado se dispensa en un modo que se minimice la capacidad en paralelo a un nominal de 17 pF. Paquetes están equipados con dos mm de diámetro y 1,5 mm 6 tubos de vidrio largas como puertos fluídicos (Figura 3).

Figura 2. Micrografía electrónica de barrido de una sección de haz de iones enfocado de una NRCC de patch-clamp de chips muestra una superficie lisa y de dióxido de silicio en forma de embudo que favorece los contactos íntimos de células, y un orificio poco profundo que representa una baja de acceso resistanccorreo.

Figura 3. Un chip está pegado a la parte inferior del frasco de cultivo en un paquete de plexiglás equipado con fluidos subterráneos y tubos de vidrio.
2. La esterilización, el cebado y pruebas
Los siguientes pasos deben realizarse en una cabina de seguridad biología para evitar la contaminación o el taponamiento de la abertura.
- Esterilizar fichas en un limpiador Harrick básica de plasma (www.harrickplasma.com) con una presión de aire residual 0.1-0.3 mbar durante 15 minutos a la máxima potencia de 18 W. Otros sistemas de aire de plasma puede ser utilizado, con una densidad de potencia comparables (24 mW / cm 3) y mantener el producto de la densidad de potencia y constante de tiempo. El tratamiento con plasma también hace que los chips hidrófilo, lo que facilita el cebado.
- Colocar los tubos de vidrio con agua estéril tubo de silicona Silastic Laboratorio, 1 mm de diámetro interno x 2 mm OD (Cole ParmerCat. # 96115 hasta 08), 3inch en un lado, de 1 pulgada en el otro lado.
- Llenar fluídica a través de los tubos con solución estéril filtrada estándar tampón fosfato (PBS), asegurándose de que ninguna burbuja está atrapado.
- Sujete el tubo de silicona de largo, mientras que la presurización de la PBS desde el lado corto a 1 atm. Una piscina de PBS se filtra a través de la abertura puede ser visible en el vial. Sujete la fuente de presión de la PBS y desconecte el tubo de silicona pasos de que la oferta.
- Llenar vial con filtrada PBS utilizando una jeringa.
- Sumergir una Ag / Ag: electrodo Cl en el tubo corto y un contra-electrodo en el vial. Un medidor de impedancia se usa para confirmar que la resistencia de acceso es entre 300kohm y 3Mohm y la capacitancia de derivación está entre 10pF y 25 pF. Un chip con una menor resistencia es probable que tenga una fuga, y una capacidad mayor se considera inadecuado para su uso, ya que no pueden captar la dinámica de los más rápidos de la electrofisiología de la célula 6. Un chip con una capacidad menoro una mayor resistencia se considera enchufado, aunque podría ser simplemente que una burbuja queda atrapada en el orificio. Algunos chips se vuelven a prueba después de 1H y se encontró que la correcta impedancia electroquímica.
- Enjuague bien el canal de fluidos con agua desionizada estéril, vaciar el frasco de la parte superior y enjuagar dos veces con la misma.
- Sumergir el chip empaquetada con tubos en fresco agua desionizada estéril durante 30 minutos después cargar con otros chips en un recipiente estéril llena con agua desionizada estéril. Esto asegura que los chips de permanecer hidrófilo y protegido de la contaminación.
3. Chips de la preparación en el laboratorio de biología celular
Los pasos siguientes se realizan en una campana de filtrado HEPA de flujo laminar utilizando técnicas asépticas, todas las soluciones que se utilizan en este procedimiento debe ser filtrada esterilizada antes de su uso mediante un filtro de 0.22μm.
- Abrir un contenedor de astillas bajo una campana de filtrado HEPA de flujo laminar y retirar fichas de ContaINER boca abajo para evitar sacar posibles contaminantes flotantes en el vial de la parte superior.
- Lavar la parte superior del frasco de 2x chip con recién filtrada agua desionizada estéril para eliminar los residuos de la superficie del chip.
- Aspirar el agua desionizada estéril fuera del vial superior.
- Conectar un extremo del tubo de Silastic unido al canal fluídico a una jeringa estéril a presión que contiene agua desionizada filtrada. En nuestro sistema, jeringas llenas de solución están presurizados por conexión a un tanque de aire comprimido a 20 psi establecido. Para asegurar la esterilidad, el aire es filtrado (0,22 micras filtro) antes de la entrada en la jeringa y nuestro sistema también tiene una válvula de encendido / apagado que nos permite detener o aplicar presión cuando sea necesario.
- Utilizando una pinza hemostática, sujetar el extremo de salida de la tubería.
- Abra el encendido / apagado para presurizar las válvulas de la solución.
- Para enjuagar el fluídico subterranen del chip con fresca agua desionizada estéril, suelte el extremo de salida del tubo.
- Para lace el agua hacia arriba a través de la abertura, sujetar el extremo de salida de la tubería con una pinza hemostática.
- Para evitar el drenaje del agua, sujetar los extremos de entrada y salida de la tubería con una hemostatos y cerrar el encendido / apagado válvulas.
- Separar el extremo de entrada del tubo de la jeringa.
- Insertar los tapones de vidrio en ambos extremos de la tubería y eliminar las pinzas hemostáticas.
- Llene la parte superior del vial con agua desionizada steriled filtro.
- Colocar la tapa de un plato 35 mm estéril en la base de un plato 100 mm estéril
- Colocar chip en la parte superior de la tapa 35 mm y cubierta con tapa 100 mm plato.
- Chips de imagen para asegurar que la membrana y la abertura de los chips están libres de desechos y / o burbujas de aire. En nuestro laboratorio usamos un microscopio vertical y un largo 20x objetivo distancia de trabajo.
- Si los desechos y / o burbujas de aire, lave varias veces de canal de fluidos y el vial superior. Si la suciedad y / o burbujas de aire no se puede quitar el chip se descarta.
- Una vez que las virutas sonimágenes impresas, vuelva a la campana de flujo laminar y desenchufe los dos extremos de la tubería.
- Una un extremo de la tubería a una jeringa a presión que contiene medios fisiológicos.
- Fijar el extremo de salida de la tubería con una pinza hemostática
- Abrir la válvula de presión, quitar el hemostato desde el extremo de salida de los fluidos y vaciar el canal fluídico con medios fisiológicos
- Para enjuagar el fluídico subterráneo con medios fisiológicos, abrir el encendido / apagado válvulas y eliminar el hemostato desde el extremo de salida del tubo.
- Para forzar los medios fisiológicos a través de la abertura, sujetar el extremo de salida de la tubería con una pinza hemostática.
- Sujetar extremo de entrada del tubo con una pinza hemostática y cerrar el encendido / apagado válvulas.
- Eliminar el extremo de entrada del tubo de la jeringa y el tapón ambos extremos de la tubería con tapones Glas.
- Retire las pinzas hemostáticas.
- Eliminar el agua del vial superior.
- Llenar el vial con la parte superior del filtro esterilizado medios fisiológicos.
- Vuelva a colocar el chip en la placa de Petri de 100 mm.
- Coloque la base de un plato de 35 mm en el plato de 100 mm y llenarlo con filtro de agua desionizada esterilizada para enriquecer la humedad.
- Cubra el plato hasta que sea tiempo para el revestimiento
4. Célula de recubrimiento de las neuronas de caracol
Los chips de patch-clamp puede ser adecuado para una variedad de preparaciones. Actualmente estamos probando nuestras fichas con los mamíferos las neuronas corticales primarias y han obtenido resultados preliminares con células cultivadas durante 14 días 7, lo que indica que nuestro protocolo de esterilización es suficiente y que los chips no son citotóxicos en cultivos a largo plazo. A los efectos de este protocolo, las neuronas de los caracoles fueron escogidos porque representan un modelo simple, pero bien establecido para el estudio de electrofisiología neuronal 11, y es con las células que se han obtenido los resultados más significativos hasta la fecha 10. Aislamiento de células detallada y los procedimientos de la cultura tienenhan descrito anteriormente 12, 13.
Quite la cubierta exterior 2 a 3 meses de edad stagnalis Lymnaea con unas pinzas romas y los animales anestesiar en Lymnaea salina que contiene 10% de Listerine.
Todas las etapas subsiguientes a cabo asépticamente dentro de una campana de flujo laminar con equipo esterilizado disección y soluciones a temperatura ambiente.
- Vuelva a colocar los medios fisiológicos en los fluidos con la solución de grabación de su caso, utilizando una pipeta de Eppendorf. En el caso de las neuronas Lymnaea la solución contiene (en mM): KCl 50, 5 MgCl 2, 5 etilenbis (oxietilenonitrilo) tetraacético (EGTA) y 4 5 - (2-hidroxietil)-1-piperazineethanesulfonic ácido (HEPES, pH 7,4 , 130 mOsm) 14
- Pin los caracoles en un plato lleno de Sylgard Lymnaea salina y eliminar todo el cerebro como se ha descrito previamente 13
- Tratar el aised cerebros en medios definidos (DM) con tripsina (0,2% de solución, Sigma, Catálogo # T-9201) durante 18 minutos, seguido por tratamiento en DM y el inhibidor de tripsina (Sigma, soja, Catálogo # T-9003) durante 15 minutos.
- Pin el cerebro en un plato pequeño lleno de Sylgard alta osmolaridad define los medios de comunicación (HODM - DM con glucosa añadida, 750 mL de solución de glucosa 1M a 20 ml DM).
- Con unas pinzas finas y tijeras de disección, retirar la cubierta exterior y la interior de los ganglios de interés, la exposición de las neuronas.
- Utilizando una pipeta fuego vidrio pulido llena HODM y unido a una microjeringa, aplicar succión suave cerca de la célula de interés (Izquierda dorsal del pedal 1) hasta que la neurona se separa del cerebro y se suspende en la pipeta.
- La pipeta de vidrio se mueve entonces y se sumerge en neurochips individuales cuando la expulsión suave desde la microjeringa permite que las neuronas que se empuja suavemente hacia fuera de la pipeta y se coloca en la parte superior de los agujeros de parches individuales sobre los chips.
- Permitir que las células de sentarse en reposo durante un mínimo de 2 horas a temperatura ambiente para promover su adhesión a la superficie del chip que rodea la abertura.
5. Registros electrofisiológicos
Para conectar las fichas para el amplificador (en nuestro caso un amplificador MultiClamp 700B, Molecular Devices, Foster City, CA, EE.UU.)
- Sustituir la solución en el fluídico subterráneo y en el vial chip con las soluciones de grabación apropiados. En el caso de las neuronas Lymnaea, las cámaras de cultivo superiores están llenos de Lymnaea salina (en mM: NaCl 51,3, 1,7 KCl, 4 CaCl2, y MgCl2 1,5) tamponada a pH 7,9 con HEPES 14.
- Para mayor estabilidad, pegamento el chip en un portaobjetos de vidrio y colocar bajo el microscopio.
- Para conectar el chip al amplificador (en nuestro caso un amplificador MultiClamp 700B, Molecular Devices, Foster City, CA, EE.UU.), cortar un extremo del tubo e insertar un Silvealambre R que está conectada a la cabeza-etapa.
- Colocar el electrodo de referencia en el vial superior del chip.
- El chip está ahora listo para la grabación.
- Aplicar un paso mV 5 con el amplificador para medir la resistencia total (R t) y determinar la configuración de las neuronas: células adjunta (R t> 1 GΩ); de células enteras (Rt = 50-100 transitorios mW más capacitiva, indicativa de la ruptura de la membrana sobre la abertura), o sin sello (R t <5 MW). En nuestra última serie de experimentos 10, 58% por ciento de las células tenían los sellos de alta resistencia y, de ellos, el 80% de las células excitables mostraron respuestas.
6. Los resultados representativos
- Aplicar despolarizante pulsos de corriente (20 incremento pA) a la neurona (en este caso LPeD1).
- Mantenga la neurona al cierre de Vm a su potencial de reposo (~ - 60 mV).
- Tenga en cuenta las respuestas a estos pulsos despolarizantes. Los potenciales de acción debe rebasamientose observa si la neurona es viable.
- La Figura 4 muestra un resultado representativo que se discute en detalle en 14, 15.

Figura 4. Las respuestas de tensión (superior) de una neurona a LPeD1 serie graduada de intracelular pulsos de corriente (abajo). Los pulsos de corriente se aplicaron a Vm = - 60mV.
Solución de problemas
- Antes de placas, chips de imagen para determinar si la membrana y la apertura son libres de desechos y adecuado para el revestimiento. Nosotros usamos un microscopio vertical y una larga 20x objetivo de distancia de trabajo. En nuestra última serie de experimentos 1, 67% por ciento de los chips se cebaron con éxito de esta manera.
- Si los desechos y / o burbujas de aire están presentes descartan chip y probar con la otra.
- Diversos tratamientos de superficie (plasma) o recubrimientos (PDL, PEI, etc) puede ser juzgado, pero el éxito puede ser altamente dependiente del tipo celularutilizada.
- La composición de la fluídica ("pipeta") en solución crítica para la formación de la giga-sello y toda la celda. Ajustar la solución, prestando especial atención a la osmolaridad, pH, y el maquillaje iónico.
- Para el cultivo de más largo plazo, empezar con los medios de comunicación en el canal de microfluidos, luego cambiar a la pipeta solución antes de la grabación a través de la gravedad de perfusión suave alimentado (~ 0,5 ml / min).
Discussion
Patch-clamp NRCC la plataforma de la interrogación chip es una herramienta potencialmente poderosa para la alta ensayos de contenido de información farmacéutica y para investigar en modelos in vitro de la enfermedad. Sus ventajas en comparación con pipetas de vidrio son una resistencia acceso bajo, lo cual es una ventaja para sondear células grandes, ya pesar de una capacitancia algo mayor resultará en la dinámica comparables para células más pequeñas. Celular espontánea a los sellos de apertura se han obtenido rutinariamente, y la entrada de células enteras se ha observado que 14 espontánea. Una diferencia clara entre los chips y el método de pipeta de vidrio es el hecho de que la sonda es parte de la placa de cultivo de células y no es manualmente pone en contacto con la membrana celular. El cultivo de células, posiblemente parte de las redes funcionales, los resultados de los modelos más relevantes biológicamente como modelos de enfermedades, y un mecanismo diferente para asegurar la celda de alta para probar los sellos 16. Sin embargo, en contraste con las suspensiones de células, la aspiración Cannot se utiliza para posicionar una celda de la sonda. Neuronas del caracol, como otras células grandes, son susceptibles de posicionamiento manual en la parte superior de la sonda. Para células más pequeñas que requieren largos tiempos de cultivo, hemos obviado la necesidad de cualquier manipulación y mantener una alta probabilidad de obtener un sello por polipéptidos de adhesión de modelado en la parte superior de las sondas para colocar las células en la parte superior de las sondas, y demostró la colocación de las células en el sonda de 17,18.
NRCC también está desarrollando una poliimida microfluidos parche-abrazadera chip de 19 con una capacitancia comparable a la del vidrio pipeta. El objetivo final de que es un proyecto múltiples sondas-parche-abrazadera chip que permite el control simultáneo de la actividad electrofisiológica de las neuronas que participan en varias comportamiento de la red en la resolución de los canales iónicos individuales 14. Este método es un método de alta resolución complementaria a las matrices de electrodos múltiples 20.
Disclosures
No hay conflictos de interés declarado.
Acknowledgments
Los autores desean agradecer Alexei Bogdanov para la fabricación de chips de patch-clamp en el CPFC y Hue Tran, Zhao Ping y Shiu Mateo para obtener ayuda con el montaje. Naweed Syed fue apoyada por un Instituto Canadiense de Investigación en Salud (CIHR) subvención. Collin Luk es el receptor de NSERC y Alberta Heritage Foundation for Medical Research (AHFMR) becas de.
References
- Walz, W. Patch-Clamp Analysis: Advanced Techniques. Neuromethods. , 2nd, Springer Protocols. 38 (2007).
- Neher, E., Sakmann, B. Single-channel currents recorded from membrane of denervated frog muscle fibers. Nature. 260, 799-802 (1976).
- Behrends, J. C., Fertig, N. Ch. 14: Planar Patch-clamp. Neuromethods. , 2nd, (2007).
- Fertig, N., Tilke, A., Blick, R. H. Stable integration of isolated cell membrane patches in a nanomachined aperture. Applied Physics Letters. 77, 1218-1220 (2000).
- Dunlop, J., Bowlby, M., Peri, R., Vasilyev, D., Arias, R. High-throughput electrophysiology: an emerging paradigm for ion-channel screening and hysiology. Nat. Rev. Drug. Discov. 7 (4), 358-368 (2008).
- Py, C., Denhoff, M., Martina, M. A novel silicon patch-clamp chip permits high-fidelity recording of ion channel activity from functionally defined neurons. Biotechnology and Bioengineering. 107 (4), 593-600 (2010).
- Martinez, D., Martina, M., Kremer, L. Development of patch-clamp chips for mammalian cell applications. Micro and Nanosystems. 2 (4), (2010).
- National Research Centre of Canada . , Candian Photonics Fabrication Centre. Available from: http://www.nrc-cnrc.gc.ca/eng/solutions/facilities/prototyping_index.html (c1995-2001).
- Py, C., Salim, D., Monette, R. Cell to aperture interaction in patch-clamp chips visualized by fluorescence microscopy and focused-ion beam sections. Biotechnology & Bioengineering. 108, 1395-1403 (2011).
- Martina, M., Luk, C., Py, C. Interrogation of Cultured Neurons using Patch-Clamp Chips. Journal of Neural Engineering. 8, 034002 (2011).
- Bell, H. J., Syed, N. I. Hypoxia-induced modulation of the respiratory CPG. Frontiers in bioscience : a journal and virtual library. 14, 3825-3835 (2009).
- Syed, N. I., Bulloch, A. G. M., Lukowiak, K. In vitro reconstruction of the respiratory central pattern generator of the mollusk Lymnaea. Science. 250, 282-285 (1990).
- Syed, N. I., Zaidi, H., Lovell, P. In vitro reconstruction of neuronal circuits: A simple model system approach. Modern techniques in neuroscience research. Windhorst, U., Johansson, H. , Springer. (1999).
- Martina, M., Luk, C., Py, C. Interrogation of Cultured Neurons using Patch-Clamp Chips. Journal of Neural Engineering. 8, 034002 (2011).
- Py, C., Denhoff, M., Martina, M., et al. Silicon patch-clamp chip suitable for high-fidelity recording of ion channel activity from cultured neurons. Biotechnology and Bioengineering. 107 (4), (2010).
- Ong, W. -L., Yobas, L., Ong, W. -Y. A missing factor in chip-based patch clamp assay: gigaseal. Journal of Physics: Conference Series. 34, 187 (2006).
- Charrier, A., Martinez, D., Monette, R. Cell placement and guidance on substrates for neurochip interfaces. Biotechnology and Bioengineering. 105, 368-373 (2010).
- Diaz-Quijada, D., Maynard, C. C. omas, Monette, T., Py, R., A, C. K. rantis, Mealing, G. Surface Patterning with Chemisorbed Chemical Cues for Advancing Neurochip Applications. Industrial & Engineering Chemistry Research. 50 (17), 10029-10035 (2011).
- Martinez, D., Py, C., Denhoff, M., et al. High-fidelity patch-clamp recordings from neurons cultured on a polymer microchip. Biomedical Microdevices. 12, 977-97 (2010).
- Taketani, M., Baudry, M. Advances in Network Electrophysiology: Using Multi-Electrode Arrays. , Springer. (2006).



