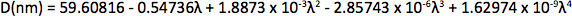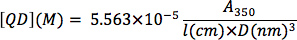Summary
Мы описываем получения коллоидных квантовых точек с минимальным гидродинамическим размер одной молекулы флуоресцентной микроскопии. По сравнению с обычными квантовыми точками, эти наночастицы близки по размерам к глобулярных белков и оптимизированы для одной молекулы яркость, устойчивость против фотостарения, а также устойчивость к неспецифического связывания с белками и клетками.
Protocol
Следующие процедуры синтеза включает стандартные воздуха без техники и использования вакуума / инертной газовой трубе; подробной методологии можно найти в ссылках 10 и 11. Бюллетени для всех потенциально токсичных и легковоспламеняющихся веществ необходимо проконсультироваться с использованием и все легковоспламеняющихся и / или воздушно-лабильные соединения должны быть аликвоты в перегородке-запечатанных флаконов в ящике для перчаток или перчатки сумки.
1. Синтез селенида кадмия ртути (Hg х Cd 1-х Se) Quantum Dot сердечников
- Подготовить 0,4 М раствор селена в trioctylphosphine (TOP). Добавить селена (0,316 г, 4 ммоль) в 50 мл 3-колбу, а затем эвакуировать и заполнить аргоном с помощью линии Шленка. В воздухе свободный условиях (сухого азота или аргона), добавить 10 мл TOP и тепла до 100 ° C при перемешивании в течение 1 часа, получая прозрачный, бесцветный раствор. Охладите раствор до комнатной температуры и установить колбу в сторону.
- В 250 мл 3-колбу, добавляют оксид кадмия (CdO 0,0770 г, 0,6 ммоль), tetradecylphosphonic кислоты (TDPA, 0,3674 г, 1,32 ммоль) и октадецена (ОДУ, 27,6 мл), и эвакуировать решения с использованием линии Шленка при перемешивании. Увеличение температуры до 100 ° C и эвакуировать еще 15 минут для удаления низкокипящих примесей точки.
- В атмосфере аргона или азота, нагреть смесь до 300 ° С в течение 1 ч до полного растворения CdO. Решение будет меняться от красноватого цвета с прозрачным и бесцветным. Охладите раствор до комнатной температуры.
- Добавить гексадециламин (HDA, 7,0 г) к кадмию решение, нагреть до 70 ° C, и эвакуировать. После постоянного давления достигается, повышение температуры до 100-110 ° C и рефлюкс раствор в течение 30 мин. Переключение клапана Шленка линии инертного газа и вставить термопару непосредственно в раствор.
- В воздухе без условий, добавить дифенилфосфина (DPP, 100 мкл) к решению и увеличить температуру до 310 ° C. Удалить 7,5 мл 0,4 М ТОП-Se решения(3 ммоль селен) в одноразовый пластиковый шприц прилагается к 16 иглы.
- Как только температура в равновесие при 310 ° C, установить регулятор температуры до 0 ° C и быстро вводить ТОП-Se решение непосредственно в кадмий решение. Решение будет меняться от бесцветного до желто-оранжевого и температура быстро падает и снова вырасти до ~ 280 ° C. Через 1 мин реакции, снимите колбу с нагревательным кожухом и быстро прохладной струей воздуха до температуры ниже 200 ° C.
- Когда температура достигает ~ 40 ° C, разбавляют 30 мл гексана, большинство из оставшихся предшественника кадмия осядет из раствора. Удалить этот осадок центрифугированием (5.000 мкг, 10 мин).
- В каждой из шести 50 мл коническую трубку полипропилена центрифуги, развести 12 мл сырого раствора нанокристаллов с 40 мл ацетона, центрифуга (5.000 мкг в течение 10 мин), и осторожно сливают и отбросить супернатант.
- Растворите nanocrystal гранул в гексане (25 мл общего объема). Извлеките этот раствор 3 раза с равным объемом метанола, сохраняя верхнюю фазу. Для третьего добычи, объем метанола может быть скорректирована до ~ 15 мл для получения концентрированного раствора гексана чистой КТ CdSe примерно 200 мкМ. Типичный выход из этой реакции составляет 3 мкмоль нанокристаллов CdSe диаметром 2,3 нм (50-60% выход реакции).
- Определить диаметр нанокристаллов и концентрации путем измерения UV-Vis спектра поглощения и консультаций с размером облегающие схема Mulvaney и его коллеги 12 и исчезновения корреляций Bawendi и сотрудников 13. См. Приложение для деталей.
- Mercury катионообменная: нанокристаллы могут быть частично обменивались с ртуть красного смещения спектров поглощения и флуоресценции. Смешайте следующие вместе с тем в 20 мл стеклянный флакон с stirbar (эта реакция может быть расширена по желанию): 3 мл гексана, 2 мл хлороформа, 1 мл 200 мкМ CdSe QD решения (200 нмоль), 15 мкл олеиламин (УПВ) и 500 мкл 0,1 М раствора Hg (OT) 2 в хлороформе. Mercury octanethioate (HgOT 2) могут быть получены путем взаимодействия ацетата ртути и octanethiol в метаноле (см. приложение). В качестве катион доходов обменной реакции, степень красного смещения можно контролировать с UV-Vis абсорбционной спектрофотометрии. После того, как желаемое полоса поглощения была достигнута, измерения поглощения раствора нанокристаллов при 350 нм и определить новый коэффициент экстинкции, предполагая, что концентрация нанокристаллов не изменилась (30,7 мкМ в этом примере). Quench реакции путем удаления непрореагировавшего ртути: добавить 5 мл декана, 10 мл гексана, и 7 мл метанола и извлечения решения, сохраняя верхнюю фазу, содержащую нанокристаллов. Извлечение в два раза больше гексаном и метанолом, и регулировать громкость метанола так, чтобы верхняя фаза ~ 7 мл. Если фазы медленного отделить, решение может быть центрифугировали (5000 мкг,10 мин). Добавить 100 мкл TOP 100 мкл УПВ, и 100 мкл олеиновой кислоты в нанокристаллы затем 40 мл ацетона, чтобы вызвать осадки. Сбор нанокристаллов с помощью центрифугирования и разогнать в 3-гексана мл. Центрифуга снова, чтобы удалить нерастворимые компоненты и определения концентрации нанокристаллов снова, используя новый коэффициент экстинкции при 350 нм. Разрешить решение нанокристаллов в возрасте не менее 24 часов при комнатной температуре, прежде чем переходить к следующему шагу.
2. Рост сульфида кадмия цинка (Zn Cd у 1-й S) Shell
- Подготовить 0,1 М решениях корпуса предшественника в 50 мл 3-горлую колбы. Кадмий предшественника: кадмия ацетата гидрата (230,5 мг, 1 ммоль) и 10 мл олеиламин (УПВ). Цинк предшественника: ацетат цинка (183,5 мг, 1 ммоль) и 10 мл УПВ. Сера предшественника: серы (32,1 мг, 1 ммоль) и 10 мл ОДУ. Под вакуумом, нагревать каждое решение с обратным холодильником в течение 1 часа, получая четкие решения, а затем взимать с аргоном. Сера решение можетбыть охлажден до комнатной температуры, но кадмия и цинка прекурсоров поддерживается на уровне 50 ° C. Расчет количества оболочки предшественника можно найти в работе 14.
- Добавить к 3-колбу: Hg х Cd 1-X SE КТ (120 нмоль, 2,3 нм в диаметре), ОДУ (2 мл), и trioctylphosphine азота (TOPO, 250 мг). Эвакуировать от гексана при комнатной температуре на линии Шленка. Увеличение температуры до 100 ° C и обратным холодильником в течение 15 мин. Изменение клапан Шленка линия аргон или азот и вставьте термопары в раствор нанокристаллов.
- Повышение температуры до 120 ° C, добавляют 0,5 монослоя серы решения предшественника (140 мкл), и позволяют реакции протекать в течение 15 мин. Малые аликвоты (<50 мкл) могут быть удалены с помощью стеклянного шприца для контроля за ходом реакции с помощью флуоресцентной и / или UV-Vis абсорбционной спектрофотометрии. Повышение температуры до 140 ° C, добавляют 0,5 монослоя кадмия решение предшественника (140 мкл), и позволяют протекания реакции в течение 15 мин. Добавить 500 мкл безводного OLA к реакционному раствору.
- При 160 ° С добавляют 0,5 монослоя серы решения предшественника (220 мкл) с последующим равным количеством цинка решение предшественника при 170 ° С 15 мин между каждым добавлением. Затем при температуре 180 ° C добавьте 0,25 монослоя серы решения предшественника (150 мкл) и цинка раствор предшественника интервалом в 15 мин.
- Охладите раствор до комнатной температуры и снова вычислить новый коэффициент экстинкции для этих частиц с помощью UV-Vis спектре, предполагая, что число нанокристаллы не изменилось (120 нмоль в 3,8 реакционный раствор мл). Хранить реакции раствора в виде сырой смеси в морозильной камере; нанокристаллы могут быть разморожены и очищают по мере необходимости, используя тот же метод, описанный в разделах 1.8 и 1.9.
- Нанокристаллы могут быть охарактеризованы с помощью электронной микроскопии, UV-Vis спектроскопии поглощения и флуоресцентной спектроскопии. Квантовый выход может бытьрассчитанный абсолютно использованием интегрирующей сферы или относительно, по сравнению с известными стандартными методами ведения 15.
3. Фазового перехода
- Добавить очищенные ядро / оболочка Hg х Cd 1-х Se / Cd у Zn 1-й S КТ (5 мл, 20 мкМ) в 50 мл 3-колбу и удаления гексана в высоком вакууме с получением сухой пленки. Наполните колбу с аргоном, добавляют безводный пиридин (3 мл) к фильму наночастиц и тепла в суспензии до 80 ° C. В течение 1-2 часов наночастицы полностью растворяются.
- Добавить 1-тиоглицерин (1 мл) к раствору и перемешивали при 80 ° C в течение 2 часов. Затем охлаждают раствор до комнатной температуры и добавляют триэтиламин (0,5 мл) для депротонирования тиоглицерин. Перемешать в течение 30 мин. Раствор мутнеет после добавления триэтиламина из-за плохой растворимости полярных нанокристаллов в этой смеси растворителей.
- Передача QD раствора в 50 мл коническую трубку продолжение центрифугиaining смесь из 20 мл гексана и 20 мл ацетона, и хорошо перемешать. Изолировать осажденного нанокристаллов с помощью центрифугирования (5.000 мкг, 10 мин) и промыть осадок ацетоном.
- Растворите QD гранул в ДМСО (5 мл) с ванной ультразвуком, а затем центрифуги (7.000 мкг, 10 мин), чтобы удалить возможные агрегаты. Определить концентрацию наночастиц от UV-Vis спектра поглощения. Это решение чисто КТ должны быть использованы в течение 3 часов, а поверхность тиолов может медленно окисляется в условиях окружающей среды в воздух.
- Развести QD решение 10 мкм или менее с ДМСО и перенести в 50 мл колбу. Подготовить 5 мг / мл раствора тиолированного полиакриловой кислоты (синтез описан в приложении) в ДМСО. Добавить полимерный раствор (0,15 мг полимера на нмоль КТ) по каплям к QD решение при перемешивании и дегазации раствора при комнатной температуре в течение 5 мин.
- Очистите КТ / раствор полимера с аргоном и тепла до 80 ° С в течение 90 мин. Затем охлаждают раствор до комнатной температурыг каплям добавляют равный объем 50 мМ борат натрия, рН 8. Перемешать в течение 10 мин.
- Очищают КТ с помощью диализа (20 кДа отсечки) в 50 мМ борат натрия, рН 8, а затем сосредоточиться частиц с помощью центробежного фильтра (10 кДа обрезания). Определить концентрацию от UV-Vis спектра поглощения.
4. PEG покрытия
- В 4 мл стеклянный флакон с stirbar, смешайте 1 нмоль КТ в боратного буфера с 40000 х молярный более 750 Da monoamino-полиэтиленгликоля (30 мг, 40 мкмоль). Если конкретные функциональные химические должна быть добавлена к нанокристаллов (например, гидразид или малеимида), она может быть введена путем замены доли амино-ПЭГ с гетеробифункциональных амино-ПЭГ (30% молярной доли обычно хорошо работает). Разведите раствор нанокристаллов до 1 мкм с боратный буфер. Эта реакция может быть расширена по желанию.
- Подготовка свежий раствор DMTMM (20 мг, 72 мкмоль) в ДМСО (144 мкл). Это решение может быть кратко нагревается иnder струей теплой водопроводной воды или погружается в ванну ультразвуком, чтобы полностью растворить DMTMM. Быстро добавить 25000 х молярный избыток этого 0,5 М раствора DMTMM (50 мкл) в КТ решения и перемешивают при комнатной температуре в течение 30 мин.
- Повторите шаг 4,2 четыре раза для насыщения поверхности нанокристаллов с PEG. Наконец, добавьте 200 мкл 1 М Трис-буфера для гашения реакции и очистить нанокристаллов использованием диализ, центробежные фильтры, или ультрацентрифугирования.
- Нанокристаллы могут быть проанализированы для монодисперсности, гидродинамический размер и заряд поверхности методом жидкостной хроматографии, электрофореза в агарозном геле, и флуоресцентной микроскопии. Для определения гидродинамических размер и распределение по размерам с использованием автоматизированной жидкостной хроматографии (GE AKTAprime Plus), использовать Superose 6 колонку, скорость потока 0,5 мл / мин с элюент PBS буфера и поглощения обнаружения при 260 или 280 нм. Сравнить раз наночастиц элюирования с тех стандартов молекулярной массы. Для агарозном геле электрофотографическихсопротивления, подготовить 0,5% агарозном геле в 50 мМ борат натрия буфером (рН 8,5) или 50 мМ натрий-фосфатного буфера (рН 7,4), смешайте 1 мкм образцы с 10% глицерина и нагрузки в скважины, и работать на 100 В в течение 30 мин . Изображение нанокристаллов в геле с использованием УФ палочки рукой или УФ-просвечивания и для возбуждения флуоресценции. Чтобы изображение нанокристаллов на одном уровне молекул с помощью флуоресцентной микроскопии, развести частиц до 0,2 нМ в 10 мМ фосфатного буфера, падение 2,5 мкл раствора на стекло покровное, и осторожно поместите второй покровное в верхней части жидкого шарика распространяться пленки между покровные. Изображение поверхности связанных частиц с помощью высокой числовой апертуры объектива (в идеале, по крайней мере, 1,40) в любом эпифлуоресцентной или TIRF режиме при возбуждении на длинах волн 400-580 нм и электронно-умножение CCD камера. Точные параметры изображения будет варьироваться между микроскопии установки.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
На рисунке 2 представлена представитель спектры поглощения и флуоресценции для CdSe нанокристаллов, Hg х Cd 1-X SE нанокристаллов после катионного обмена, и Hg х Cd 1-х Se / Cd у Zn 1-й нанокристаллы S после оболочку роста. Нанокристаллов CdSe есть основной квантовый выход флуоресценции около 15% (в том числе длинноволновой глубокие ловушки выбросов), но эта эффективность падает до менее чем 1% после обмена ртути, вероятно, из-за носителей заряда ловушек вводится через поверхностный атом нарушению 9. Однако рост тонкой оболочки у Cd Zn 1-й S повышает эту эффективность более чем на 70%, что в значительной степени сохраняется после передачи воды (50% является типичной). В отличие от нанокристаллов CdSe / у Cd Zn 1-й S без ртути включения потерять значительную часть своих квантовый выход в воду, если толстая оболочка выросли. Таким образом, путем включения ртути в основных nanocrystaл, небольшой размер нанокристаллов может быть сохранена (см. TEM на рисунке 3) без потери яркости. Важно отметить, что укупорки с Cd у Zn 1-й S сдвигает спектр в красной из-за утечки электронных носителей заряда в материал оболочки; этот сдвиг составляет около 20-30 нм ядра CdSe 16, и увеличивается с увеличения содержания ртути в ядре (до 100 нм).
Использование 2-х ступенчатый фазовый переход в воде имеет решающее значение для получения однородного населения нанокристаллов, которые не требуют дальнейшего Размер сортировке, чтобы удалить кластеров и агрегатов. На первом этапе, нанокристаллы передаются в ДМСО с использованием 1-тиоглицерин, который вытесняет олеиламин на поверхности нанокристаллов. Тиоглицерин затем заменили линейную полидентатным полимера, в результате чего очень стабильные частицы с минимальным увеличением размера гидродинамических в результате органического покрытия (<4 нм ВКЛАДна гидродинамический диаметр). Гель-хроматограммы изображенный на рисунке 4а подтверждает, что размер похож на conalbumin (75 кДа), и после модификации с 750 Da амино-PEG, размер увеличен до всего лишь 12 нм, похож на антитела IgG . PEG модификации нейтрализует заряд поверхности, что подтверждается в электрофореза в агарозном геле эксперимента изображена на рисунке 4б. Мы регулярно использовать гель-хроматографии и гель-электрофореза для быстрого характеристика размера, распределения по размерам, и поверхностного заряда. Динамическое рассеяние света и дзета-потенциометрии также может быть использован, однако сечения рассеяния этих частиц сверхмалых очень мало, и мы обнаружили, что результаты от коммерческих документов, не воспроизводимые. Рисунке 5а эпифлуоресцентной микрофотография эти нанокристаллы, нанесенных на покровное стекло и возбуждении 545 нм видимый свет. Эти нанокристаллы легко O. bserved на одной молекуле уровне 30 кадров в секунду с электронно-умножение ПЗС-камеры рисунке 5б показывает, что число флуоресцентных частиц, наблюдаемых в каждом кадре колеблется с течением времени с непрерывным возбуждением, это связано с сочетанием мигать и фотодеградации . Мигает доминирует в первом ~ 7 минут до окислительного фотодеградации медленно становится очевидной.

Рисунок 1. Схематическое изображение процедуры синтеза наночастиц. (А) кадмия и селена прекурсоров реагировать генерировать CdSe нанокристаллов, которые рассматриваются с ртутью octanethiolate, вызывая частичный Cd → Hg катионообменная с получением Hg х Cd 1-X SE нанокристаллов тройной сплав. Оболочка Cd у Zn 1-й S затем выросла на ядре использования кадмия ацетат, ацетат цинка и серы. (Б) Как синтhesized, эти нанокристаллы покрыты неполярных органических лигандов (олеиламин). Для растворения этих частиц в водных буферах, лиганды заменить полидентатным лиганда полимер, который ковалентно связан с амино-PEG.

Рисунок 2. Оптические свойства Hg х Cd 1-х Se / Zn Cd у нанокристаллов 1-й S. (А) Поглощение (черный) и флуоресценции (красный) CdSe нанокристаллов ядер, Hg х Cd 1-X SE ядра после катионного обмена, и Hg х Cd 1-х Se / Cd у Zn 1-й нанокристаллы S после оболочку роста . Спектры смещены для ясности (б) Спектры флуоресценции Hg х Cd 1-х Se / Cd у Zn 1-й S с разными относительными количествами включения ртути. Синий спектр изображен ядер с нулевым содержанием ртути (х = 0, CdSe).

Рисунок 3. Передачи электронного микроскопа (а) и распределение частиц по размерам (б) Hg х Cd 1-х Se / Cd у Zn 1-й S нанокристаллов, показывая средний диаметр ± стандартное отклонение 3,2 ± 0,6 нм.

Рисунок 4. Гидродинамическая характеристика Hg х Cd 1-х Se / Cd у Zn 1-й КТ S в водном растворе. (А) Размер исключение хроматограмме нанокристаллов покрытие полидентатным лиганда полимера до (красный) и после (синий) конъюгации с амино-PEG. Молекулярная стандартов белка веса указанных выше участков. (Б) агарозном гель-электрофореза эксперимент КТ в буфере бората натрия (рН ~ 8,5) до (слева) И после (справа) конъюгации с амино-PEG. Также отмечена стрелкой и полярность электродов указаны на правой, показывая, что до сопряжения нанокристаллов миграцию как анионные частицы и ПЭГилированный нанокристаллов электростатически нейтральным.

Рисунок 5. Hg х Cd 1-х Se / Cd у Zn 1-й S КТ адсорбированных на стекло покровное в фосфатный буфер, полученную с эпифлуоресцентной микроскопии. (А) QD изображение, полученное при 33 кадрах в секунду. Изображение 15 мкм х 15 мкм. (Б) количество флуоресцентных квантовых точек в поле зрения при непрерывном освещении в течение 20 мин с ртутные дуговые лампы с 545 нм (30 нм полосовой) возбуждения фильтра и 625 нм (20 нм полосовой) излучения фильтров и 100x 1,4 NA цели. Измерения от 3 поля зрения были усреднены в течение 20 мин при 12,5 кадра в секунду.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
По сравнению с обычными CdSe квантовых точек, тройной сплав ртути х Cd 1-X SE нанокристаллы могут быть настроены по размеру и длине волны флуоресценции самостоятельно. Размер первой выбранной в процессе синтеза нанокристаллов CdSe ядра, а длина волны флуоресценции выбран вторичной ртути катионообменная шаг, который существенно не изменяет размер нанокристаллов 9. Важно, чтобы очищенная Hg х Cd 1-X SE нанокристаллов для инкубации при комнатной температуре в течение по крайней мере за 24 часа до укупорки. Это позволяет некоторым слабо адсорбированные катионы ртути диффундируют в решетке нанокристаллов. Не позволяя этот процесс происходит, вторая полоса флуоресценции в ближней инфракрасной часто наблюдается в связи с гомогенной нуклеации HgS нанокристаллов от диссоциированных ионов ртути.
В примере, приведенном в этой работе, мы подготовили CdSe ядра размером около 2,3 нм, которые могут бытьнастроились флуоресценции между 550-800 нм после укупорки, изменяя количество ртути включены в основной решетки. С 2,5 монослоя оболочки, окончательный диаметр этих квантовых точек было около 3,2 нм, что существенно наименьший размер наночастицы, которые мы можем подготовить, который является одновременно достаточно photostable и достаточно ярким для одной молекулы томография (коэффициент экстинкции около 350000 М -1 см -1 при 400 нм и квантовым выходом около 50% в воде). Эти нанокристаллы существенно ярче и photostable, чем ранее описанные нанокристаллов с сопоставимыми размерами, которые излучают на этом спектральном диапазоне (например, CdTe, InAs, InP). Как и большинство флуорофоры, флуоресценция из этих частиц на одном уровне молекулы прерывистый (мигающий) 5,6.
В некоторых случаях, это может быть выгодно использовать несколько больший нанокристаллов. При использовании большего CdSe нанокристаллов ядро, флуоресценция bandwiDTH уже, после обмена катиона ртути. Типичные флуоресценции ширина пика Hg х Cd 1-х нанокристаллов Se с выбросом в 600-650 нм окна на 50-70 нм на 2,3 ядра нм и 40-50 нм для 3,2 нм ядрах. Таким образом, больше нанокристаллов позволяют больше возможностей для спектрального мультиплексирования. Кроме того, увеличение размера будет также увеличить сечение поглощения нанокристаллов. Увеличение толщины слоя CdS временной оболочке также увеличить яркость, а в дальнейшем продлить флуоресценции стабильность во время возбуждения. Размер CdSe ядра может быть увеличена просто увеличение продолжительности CdSe синтеза ядра, и контроль за эффективным размером через UV-Vis абсорбционной спектрофотометрии.
Мы обнаружили, что водная КТ, покрытые карбоновых кислот, склонных к неспецифической адсорбции клеток и белков, и что нейтрализация их сильный отрицательный заряд в физиологических буферов крitical для минимизации неспецифические взаимодействия 17. В приведенных здесь примерах мы использовали короткие цепи ПЭГ для нейтрализации поверхностного заряда и поддержания стабильности в воде. PEG могут быть введены в основной цепи полимера либо до привязанности к КТ или после нанесения покрытия. Обе процедуры приводят к почти нейтральных частиц, но те первые покрытием с карбоксильными-полимерных существенно меньше, по-видимому в связи с улучшением полидентатным взаимодействия с поверхностью. Для полной нейтрализации поверхности с PEG, мы обнаружили, что повторный того карбоновой кислоты, активирующие агенты необходимо в связи с коротким периодом полураспада реактивных видов. Мы используем DMTMM на место чаще реагентов карбодиимида (например, EDC) благодаря улучшению стабильности DMTMM в хранении и за счет повышения эффективности реакции в воде 18.
Наконец, важно отметить, что квантовые точки и много других типов нанокристаллов содержащиецитотоксических элементов 5. Кадмий и ионы ртути может повлиять на нормальные процессы живых клеток и организмов и может быть канцерогенным 19-21. Однако цитотоксичность обычных CdSe / ZnS нанокристаллов был широко изучен, и было сообщено, что надежно покрытие нанокристаллов со стабильными органическими лигандами не вызывают открыто цитотоксического ответа по сравнению с их составные элементы, просто потому, что их токсичные элементы эффективно поглощенных вдали от окислителей 5. Кроме того, для одиночных молекул и обработки изображений, токсических эффектов маловероятно из-за чрезвычайно малых концентрациях, используемых для работы с изображениями (обычно от 1 нМ или менее), который на несколько порядков меньше, чем наступление обнаружены токсические эффекты (50-100 нм). Большинство из одной молекулы экспериментов осуществления КТ на сегодняшний день использовали коммерчески доступные CdSe / ZnS нанокристаллов, которые существенно больше, чем описано здесь. По минимизации пanocrystal размер, общее число поверхностных атомов на одну частицу, а общее количество токсичных атомов в частице значительно снижается, тем самым снижая общий потенциал для токсикологического воздействия. Включение ртути в нанокристаллических ожидается дальнейшее снижение токсичности потенциал, как двухвалентной ртути, как известно, менее токсичны, чем двухвалентное кадмия во многих типах клеток 19-21.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Нет конфликта интересов объявлены.
Acknowledgments
Авторы хотели бы поблагодарить д-ра Hong Yi в Университете Эмори Основные микроскопии для визуализации комплексной электронной микроскопии. Эта работа была организована NIH гранты (PN2EY018244, R01 CA108468, U54CA119338, и 1K99CA154006-01).
Materials
| Name | Company | Catalog Number | Comments |
| Selenium | Sigma-Aldrich | 229865 | |
| Tri-n-octylphosphine | Strem | 15-6655 | 97% pure, unstable in air |
| Cadmium oxide | Sigma-Aldrich | 202894 | Highly toxic: use caution |
| Tetradecylphosphonic acid | PCI Synthesis | 4671-75-4 | |
| Octadecene | Alfa Aesar | L11004 | Technical grade |
| Hexadecylamine | Sigma-Aldrich | H7408 | |
| Diphenylphosphine | Sigma-Aldrich | 252964 | Pyrophoric |
| Mercury acetate | Sigma-Aldrich | 456012 | Highly toxic: use caution |
| 1-Octanethiol | Sigma-Aldrich | 471836 | Strong odor |
| Oleic acid | Sigma-Aldrich | W281506 | |
| Zinc acetate | Alfa Aesar | 35792 | |
| Cadmium acetate hydrate | Sigma-Aldrich | 229490 | Highly toxic: use caution |
| Oleylamine | Fisher Scientific | AC12954 | Unstable in air |
| Sulfur | Sigma-Aldrich | 344621 | |
| Trioctylphosphine oxide | Strem | 15-6661 | 99% |
| Pyridine | VWR | EM-PX2012-6 | Anhydrous |
| Thioglycerol | Sigma-Aldrich | M1753 | Strong odor |
| Triethylamine | Sigma-Aldrich | 471283 | Anhydrous |
| Dialysis tubing | Spectrum Labs | 131342 | 20 kDa cutoff |
| Centrifugal filter | Millipore | UFC801024 | 10 kDa cutoff |
| Monoamino-PEG | Rapp Polymere | 12 750-2 | 750 Da |
| DMTMM, 4-(4,6-Dimethoxy-1,3,5-triazin-2-yl)-4-methylmorpholinium chloride hydrate | Alfa Aesar | H26333 | |
| AKTAprime Plus Chromatography System | GE HealthCare | ||
| Superose 6 10/300 GL chromatography column | GE HealthCare | 17-5172-01 | |
| Agarose, OmniPur | VWR | EM-2120 | |
Appendix Synthesis of mercury octanethiolate: Slowly add a methanol solution of mercury acetate (1 eq.) to a stirring solution of 1-octanethiol (3 eq.) and potassium hydroxide (3 eq.) in methanol at room temperature. Isolate the mercury(II) octanethiolate precipitate via filtration, wash two times with methanol and once with ether, and then dry under vacuum. Synthesis of multidentate polymer: Dissolve polyacrylic acid (1 g, 1,773 Da) in 25 ml dimethylformamide (DMF) in a 150 ml three-necked flask and bubble with argon for 30 min. Add an anhydrous solution of cysteamine (374 mg, 4.87 mmol) in 10 ml DMF. At room temperature with vigorous stirring, slowly add anhydrous diisopropylcarbodiimide (DIC, 736 mg, 5.83 mmol) over 30 min, followed by triethylamine (170 μl, 1.22 mmol), and allow the reaction to proceed for 72 hr at 60 °C. Add mercapt–thanol (501 mg, 6.41 mmol) to quench the reaction, and stir for 2 hr at room temperature. Remove DMF via rotary evaporation and isolate the polymer with the addition of a 2:1 mixture of ice-cold acetone:chloroform, followed by centrifugation. Dissolve the polymer in ~5 ml anhydrous DMF, filter, precipitate again with diethyl ether, and repeat. Dry the product under vacuum and store under argon. Determination of CdSe core diameter: From the UV-Vis absorption spectrum determine the wavelength of the first exciton peak (λ, in nm), which is the longest-wavelength peak (e.g. roughly 498 nm for CdSe in Figure 2a), and use the sizing curve of Mulvaney and coworkers 12:
Determination of CdSe nanocrystal concentration: From a background-subtracted UV-Vis spectrum of an optically clear solution of CdSe nanocrystals, determine the absorption at 350 nm wavelength. Serial dilutions can be used to determine if the optical absorption is within the linear range of Beer's Law. The nanocrystal concentration (QD, in M) can be determined by plugging in the nanocrystal diameter (D, in nm), the optical absorption value (A3sa), and the cuvette path length (l, in cm) into the following equation from the empirical correlation of Bawendi and coworkers 13:
|
|||
References
- Toprak, E., Selvin, P. R. New fluorescent tools for watching nanometer-scale conformational changes of single molecules. Annu. Rev. Biophys. Biomol. Struct. 36, 349-369 (2007).
- Joo, C., Balci, H., Ishitsuka, Y., Buranachai, C., Ha, T. J. Advances in single molecule fluorescence methods for molecular biology. Annu. Rev. Biochem. 77, 51-76 (2008).
- Pinaud, F., Clarke, S., Sittner, A., Dahan, M. Probing cellular events, one quantum dot at a time. Nat. Method. 7, 275-285 (2010).
- Smith, A. M., Wen, M. M., Nie, S. M. Imaging dynamic cellular events with quantum dots. Biochemist. 32, 12-17 (2010).
- Smith, A. M., Duan, H. W., Mohs, A. M., Nie, S. M. Bioconjugated quantum dots for in vivo molecular and cellular imaging. Adv. Drug Deliv. Rev. 60, 1226-1240 (2008).
- Smith, A. M., Nie, S. M. Next-generation quantum dots. Nature Biotech. 27, 732-733 (2009).
- Groc, L., Lafourcade, M., Heine, M., Renner, M., Racine, V., Sibarita, J. -B., Lounis, B., Choquet, D., Cognet, L. Single trafficking of neurotransmitter receptor: comparison between single-molecule/quantum dot strategies. J. Neurosci. 27, 12433-12437 (2007).
- Smith, A. M., Nie, S. M. Minimizing the hydrodynamic size of quantum dots with multifunctional multidentate polymer ligands. J. Am. Chem. Soc. 130, 11278-11279 (2008).
- Smith, A. M., Nie, S. M. Bright and compact alloyed quantum dots with broadly tunable near-infrared absorption and fluorescence spectra through mercury cation exchange. J. Am. Chem. Soc. 133, 24-26 (2011).
- Shriver, D. F., Drezdzon, M. A. The Manipulation of Air-Sensitive Compounds. , 2nd edn, Wiley-Interscience. (1986).
- Errington, R. J. Advanced Practical Inorganic and Metalorganic Chemistry. , Blackie. (1997).
- Jasieniak, J., Smith, L., van Embden, J., Mulvaney, P., Califano, M. Re-examination of the size-dependent absorption properties of CdSe quantum dots. J. Phys. Chem. C. 113, 19468-19474 (2009).
- Leatherdale, C. A., Woo, W. K., Mikulec, F. V., Bawendi, M. G. On the absorption cross section of CdSe nanocrystal quantum dots. J. Phys. Chem. B. 106, 7619-7622 (2002).
- Smith, A. M., Mohs, A. M., Nie, S. M. Tuning the optical and electronic properties of colloidal nanocrystals by lattice strain. Nature Nanotech. 4, 56-63 (2009).
- Demas, J. N., Crosby, G. A. The measurement of photoluminescence quantum yields. A review. J. Phys. Chem. 75, 991-1024 (1971).
- Van Embden, J., Jasieniak, J., Mulvaney, P. Mapping the optical properties of CdSe/CdS heterostructure nanocrystals: the effects of core size and shell thickness. J. Am. Chem. Soc. 131, 14299-14309 (2009).
- Smith, A. M., Duan, H. W., Rhyner, M. N., Ruan, G., Nie, S. M. A systematic examination of surface coatings on the optical and chemical properties of semiconductor quantum dots. Phys. Chem. Chem. Phys. 8, 3895-3903 (2006).
- Zhang, X., Mohandessi, S., Miller, L. W., Snee, P. T. Efficient functionalization of aqueous CdSe/ZnS nanocrystals using small-molecule chemical activators. Chem. Comm. 47, 3532-3534 (2011).
- Bucio, L., Souza, V., Albores, A., Sierra, A., Chavez, E., Carabez, A., Guiterrez-Ruiz, M. C. Cadmium and mercury toxicity in a human fetal hepatic cell line (WRL-68 cells). Toxicol. 102, 285-299 (1995).
- Han, S. G., Castranova, V., Vallyathan, V. J. Comparative cytotoxicity of cadmium and mercury in a human bronchial epithelial cell line (BEAS-2B) and its role in oxidative stress and induction of heat shock protein 70. J. Toxicol. Environ. Health Part A. 70, 852-860 (2007).
- Strubelt, O., Kremer, J., Tilse, A., Keogh, J., Pentz, R. J. Comparative studies on the toxicity of mercury, cadmium, and copper toward the isolated perfused rat liver. J. Toxicol. Environ. Health Part A. 47, 267-283 (1996).