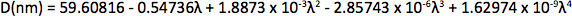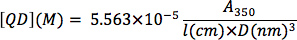Summary
Se describe la preparación de puntos cuánticos coloidales con un tamaño minimizado hidrodinámico para imágenes de fluorescencia de una sola molécula. En comparación con los puntos cuánticos, estas nanopartículas son similares en tamaño a las proteínas globulares y están optimizados para el brillo de una sola molécula, la estabilidad contra la fotodegradación, y la resistencia a la unión no específica a proteínas y células.
Abstract
Una sola molécula de imágenes es una herramienta importante para la comprensión de los mecanismos de la función biomolecular y para la visualización de la heterogeneidad espacial y temporal de los comportamientos moleculares que subyacen a la biología celular 1-4. Para la imagen de una molécula individual de interés, que se conjuga típicamente a una etiqueta fluorescente (tinte, proteína, perla o punto cuántico) y se observaron con epifluorescencia o de reflexión interna total de fluorescencia (TIRF) microscopía. Aunque los tintes y las proteínas fluorescentes han sido el pilar de imágenes de fluorescencia durante décadas, su fluorescencia es inestable bajo altos flujos de fotones necesarios para observar las moléculas individuales, produciendo sólo unos pocos segundos de observación antes de la pérdida completa de la señal. Perlas de látex y perlas marcada con colorante de proporcionar una mayor estabilidad de la señal, pero a expensas de tamaño hidrodinámico drásticamente más grande, que puede alterar perjudicialmente a la difusión y el comportamiento de la molécula en estudio.
ntent "> Los puntos cuánticos (QDs) ofrecen un equilibrio entre estos dos regímenes problemáticos. Estas nanopartículas están compuestas de materiales semiconductores y pueden ser diseñados con un tamaño compacto hidrodinámicamente con una excepcional resistencia a la fotodegradación 5. Por tanto, en años recientes los puntos cuánticos han sido instrumentales en que permite observación a largo plazo del comportamiento complejo macromolecular en el nivel de moléculas individuales. Sin embargo estas partículas han todavía ha encontrado que exhiben deterioro de la difusión en ambientes de hacinamiento molecular, tales como el citoplasma celular y la hendidura sináptica neuronal, donde sus tamaños son todavía demasiado grandes 4,6 , 7.Recientemente hemos diseñado los núcleos y revestimientos de superficies de puntos cuánticos para el tamaño minimizado hidrodinámico, mientras que equilibrar las compensaciones a la estabilidad coloidal, fotoestabilidad, el brillo, y de unión no específicos que han obstaculizado la utilidad de QDs compactos en el pasado 8,9. El objetivo de este artículo es demostrarla síntesis, la modificación, y la caracterización de estos nanocristales optimizados, compuesto de una aleación Cd Hg x 1-x núcleo Se recubierta con un aislante Zn Cd y 1-y shell S, recubierto adicionalmente con un ligando multidentado polímero modificado con polietilenglicol corto ( cadenas PEG) (Figura 1). En comparación con los nanocristales de CdSe convencionales, Hg x CD 1-x aleaciones de Se ofrecen mayores rendimientos cuánticos de fluorescencia, fluorescencia a longitudes de onda roja e infrarroja cercana para una mejor relación señal-ruido en las células, y la excitación a no citotóxicas longitudes de onda visibles. Multidentados revestimientos de polímero se unen a la superficie de nanocristales en una conformación cerrada y plana para minimizar el tamaño hidrodinámico, y PEG neutraliza la carga de la superficie para minimizar la unión no específica a las células y biomoléculas. El resultado final es un brillante fluorescente nanocristales con emisión entre 550-800 nm y un tamaño hidrodinámico total de cerca de 12 nm. Esto es en el sAME intervalo de tamaño como muchas proteínas solubles globulares en células, y sustancialmente más pequeños que los convencionales de puntos cuánticos PEGilados (25-35 nm).
Protocol
Los procedimientos de síntesis siguientes implican estándar sin aire técnicas y el uso de un vacío / colector de gas inerte; metodología detallada se puede encontrar en las referencias 10 y 11. MSDS para todas las sustancias potencialmente tóxicas e inflamables deben ser consultados antes de su uso y compuestos inflamables todo y / o aire-lábil debe alícuotas en viales sellados septo en una caja de guantes o bolsa de guantes.
1. Síntesis de seleniuro de cadmio mercurio (Hg Cd x 1-x Se) Quantum Dot Cores
- Preparar una solución 0,4 M de selenio en trioctilfosfina (TOP). Añadir selenio (0,316 g, 4 mmol) a una 50 ml de 3 bocas, a continuación, evacuar y llenar con argón mediante una línea de Schlenk. Bajo condiciones libres de aire (nitrógeno seco o argón), añadir 10 ml de TOP y calor a 100 ° C mientras se agita durante 1 h para dar una solución clara, incolora. Enfriar la solución a temperatura ambiente y ajustar el matraz a un lado.
- Para una 250 ml de 3 bocas, añadir óxido de cadmio (CdO 0,0770 g, 0,6 mmol), ácido tetradecylphosphonic (TDPA, 0,3674 g, 1,32 mmol), y octadeceno (ODE, 27,6 ml), y evacuar la solución utilizando una línea Schlenk mientras se agita. Aumentar la temperatura a 100 ° C y evacuar por un adicional de 15 minutos para eliminar impurezas de bajo punto de ebullición de punto.
- En atmósfera de argón o nitrógeno gas, se calienta la mezcla a 300 ° C durante 1 hora para disolver completamente la CdO. La solución cambia de un color rojizo a transparente e incoloro. Enfriar la solución a temperatura ambiente.
- Añadir hexadecilamina (HDA, 7,0 g) a la solución de cadmio, calentar a 70 ° C, y evacuar. Una vez que una presión constante se alcanza, aumentar la temperatura a 100-110 ° C y la de reflujo de la solución durante 30 min. Cambie la válvula de línea de Schlenk de gas inerte e insertar el termopar directamente en la solución.
- Bajo condiciones libres de aire, añadir difenilfosfina (DPP, 100 l) a la solución y aumentar la temperatura a 310 ° C. Retirar 7,5 ml de 0,4 M TOP-Se solución(3 selenio mmol) en una jeringa desechable de plástico unido a una aguja de calibre 16.
- Una vez que la temperatura se equilibra a 310 ° C, ajustar el controlador de temperatura a 0 ° C y rápidamente inyectar la solución de TOP-Se directamente en la solución de cadmio. La solución cambia de incoloro a amarillo-naranja y rápidamente la temperatura se reducirá y aumentará de nuevo a ~ 280 ° C. Después de 1 min de reacción, retirar el matraz de la camisa de calentamiento y enfriar rápidamente con una corriente de aire hasta que la temperatura es inferior a 200 ° C.
- Cuando la temperatura alcanza 40 ° C, se diluye con 30 ml de hexano; más del precursor de cadmio restante se asentará de solución. Eliminar este precipitado por centrifugación (5.000 xg, 10 min).
- En cada uno de seis tubo de polipropileno de 50 ml de centrífuga cónico, diluir 12 ml de la solución de nanocristales crudo con acetona 40 ml, de centrifugación (5.000 xg durante 10 min), y se decanta cuidadosamente y descartar el sobrenadante.
- Disolver el nanocrgránulos ystal en hexano (25 ml volumen total). Extraer esta solución 3 veces con un volumen igual de metanol, manteniendo la fase superior. Para la tercera extracción, el volumen de metanol puede ajustarse a ~ 15 ml para obtener una solución de hexano concentrada de puntos cuánticos CdSe puros a aproximadamente 200 mM. El rendimiento típico de esta reacción es 3 mol de nanocristales de CdSe con un diámetro de 2,3 nm (50-60% rendimiento de la reacción).
- Determine el diámetro de nanocristales y concentración midiendo el espectro de absorción UV-Vis y la consulta de la tabla de tallas de ajuste de Mulvaney y compañeros de trabajo 12 y las correlaciones de extinción de Bawendi y compañeros de trabajo 13. Consulte el Apéndice para obtener más información.
- Intercambio de cationes mercurio: los nanocristales pueden ser parcialmente intercambiado con mercurio para desplazamiento al rojo de la absorción y emisión de fluorescencia. Mezclar la siguiente juntos en el orden en un vial de vidrio de 20 ml con barra de agitación (esta reacción puede ser escalado según se desee): 3 ml de hexano, 2 ml de cloroformo, 1 ml de 200 mM CdSe QD solución (200 nmol), 15 oleilamina l (OLA), y 500 l de una solución 0,1 M de Hg (OT) 2 en cloroformo. Mercury octanethioate (HgOT 2) se pueden preparar haciendo reaccionar acetato de mercurio y octanotiol en metanol (véase el apéndice). Medida que la reacción de intercambio de cationes, en la medida de desplazamiento al rojo puede ser vigilado con espectrofotometría de absorción UV-Vis. Después de que la banda de absorción deseada ha sido alcanzada, medir la absorción de la solución de nanocristales en 350 nm y determinar el coeficiente de extinción nuevo, suponiendo que la concentración de nanocristales no ha cambiado (30,7 mu M en este ejemplo). Se detiene la reacción mediante la eliminación del mercurio sin reaccionar: añadir 5 ml de decano, 10 ml de hexano, y 7 ml de metanol y se extrae la solución, manteniendo la fase superior que contiene los nanocristales. Se extrae dos veces más con hexano y metanol, y ajustar el volumen de metanol de modo que la fase superior es de ~ 7 ml. Si las fases son lentos para separar, la solución se puede centrifugar (5000 xg,10 min). Añadir 100 TOP l, 100 l OLA, y 100 l de ácido oleico a los nanocristales seguidas por 40 ml de acetona para inducir la precipitación. Recoge los nanocristales mediante centrifugación y se dispersan en 3 ml de hexano. Se centrifuga de nuevo para eliminar los componentes insolubles y determinar la concentración de nanocristales de nuevo, usando el coeficiente de extinción nuevo a 350 nm. Dejar que la solución de nanocristales de edad durante al menos 24 horas a temperatura ambiente antes de proceder a la siguiente etapa.
2. El crecimiento de sulfuro de cadmio Zinc (Zn Cd y 1-y S) Shell
- Preparar 0,1 M soluciones precursoras shell en 50 ml de 3 bocas matraces. Cadmio precursor: hidrato de acetato de cadmio (230,5 mg, 1 mmol) y 10 ml oleilamina (OLA). Precursor de zinc: acetato de zinc (183,5 mg, 1 mmol) y 10 ml OLA. Precursor de azufre: azufre (32,1 mg, 1 mmol) y 10 ml ODE. Bajo vacío, calentar cada solución a reflujo durante 1 h para dar soluciones claras, y luego cargar con argón. La solución de azufre puedese enfrió a temperatura ambiente, pero los precursores de cadmio y de zinc se mantiene a aproximadamente 50 ° C. Los cálculos de las cantidades de precursores de concha se puede encontrar en la referencia 14.
- Añadir a un matraz de 3 bocas: Hg x Cd 1-X SE puntos cuánticos (120 nmol, 2,3 nm de diámetro), ODE (2 ml), y óxido de trioctilfosfina (TOPO, 250 mg). Evacuar fuera del hexano a temperatura ambiente usando la línea de Schlenk. Aumentar la temperatura a 100 ° C y reflujo durante 15 min. Cambie la válvula de la línea de Schlenk de argón o nitrógeno gaseoso y introducir el termopar en la solución de nanocristales.
- Aumentar la temperatura a 120 ° C, añadir 0,5 monocapas de solución de precursor de azufre (140 l), y permitir que la reacción procediera durante 15 min. Pequeñas alícuotas (<50 l) se puede eliminar usando una jeringa de vidrio para controlar el progreso de la reacción usando fluorescencia y / o UV-Vis espectrofotometría de absorción. Aumentar la temperatura a 140 ° C, añadir 0,5 monocapas de solución cadmio precursor (140 l), y permitir que la reacción procediera durante 15 min. Añadir 500 anhidro mu l OLA a la solución de reacción.
- A 160 ° C agregar 0,5 monocapas de solución de precursor de azufre (220 l), seguido por una cantidad igual de solución de zinc precursor a 170 ° C con 15 min entre cada adición. Luego, a 180 ° C agregar 0,25 monocapas de solución de precursor de azufre (150 l) y solución de zinc precursor en intervalos de 15 min.
- Enfriar la solución a temperatura ambiente de nuevo y calcular un coeficiente de extinción nuevo para estas partículas utilizando un espectro de UV-Vis, suponiendo que el número de nanocristales no ha cambiado (120 nmol en 3,8 ml de solución de reacción). Almacenar la solución de reacción como una mezcla en bruto en un congelador; los nanocristales pueden ser descongelados y se purifica según sea necesario usando el mismo método descrito en las secciones 1.8 y 1.9.
- Los nanocristales pueden ser caracterizados utilizando microscopia electrónica, UV-Vis espectroscopia de absorción, y espectroscopia de fluorescencia. Rendimiento cuántico puede sercalculado absolutamente usando una esfera de integración o relativamente en comparación con un estándar conocido utilizando los métodos de referencia 15.
3. Fase de transferencia
- Añadir purificó núcleo / corteza Hg x Cd 1-x Se / Cd y Zn 1-y S puntos cuánticos (5 ml, 20 mM) a una ml 50 3-bocas, y eliminar el hexano bajo un alto vacío para producir una película seca. Llenar el matraz con argón, se añade piridina anhidra (3 ml) a la película de nanopartículas y calentar la suspensión a 80 ° C. En el transcurso de 1-2 horas las nanopartículas se disolverá completamente.
- Añadir 1-tioglicerol (1 ml) a la solución y se agita a 80 º C durante 2 h. Luego enfriar la solución a temperatura ambiente y se añade trietilamina (0,5 ml) para desprotonar tioglicerol. Se agita durante 30 min. La solución puede enturbiarse después de la adición de trietilamina debido a la pobre solubilidad de los nanocristales polares en esta mezcla de disolventes.
- Transferir la solución a un QD cont cónico de 50 ml tubo de centrífugaaining una mezcla de 20 ml de hexano y 20 ml de acetona, y mezclar bien. Aislar los nanocristales precipitados mediante centrifugación (5.000 xg, 10 min), y se lava el precipitado con acetona.
- Disolver el precipitado QD en DMSO (5 ml) con baño de ultrasonidos y, a continuación centrifugar (7.000 xg, 10 min) para eliminar los agregados posibles. Determinar la concentración de nanopartículas a partir de un espectro de absorción UV-Vis. Esta solución de puntos cuánticos puros se debe utilizar dentro de 3 horas, como los tioles de superficie puede oxidar lentamente en condiciones ambientales en el aire.
- Diluir la solución de QD a 10 micras o menor, con DMSO y transferir a un matraz de 50 ml. Preparar un 5 mg / ml de solución de ácido poliacrílico tiolado (síntesis descrita en el Apéndice) en DMSO. Añadir la solución de polímero (0,15 mg de polímero por nmol QDs) gota a gota a la solución QD mientras se agitaba y desgasificar la solución a temperatura ambiente durante 5 min.
- Se purga la solución QD / polímero con argón y se calienta a 80 ° C durante 90 min. Luego enfriar la solución a temperatura ambiente unad gota a gota añadir un volumen igual de borato de sodio 50 mM, pH 8. Se agita durante 10 min.
- Purificar los puntos cuánticos a través de diálisis (20 kDa de corte) en borato de sodio 50 mM, pH 8, y luego se concentran las partículas utilizando un filtro centrífugo (10 kDa de corte). Determinar la concentración de un espectro de absorción UV-Vis.
4. PEG Coating
- En un vial de vidrio de 4 ml con barra de agitación, mezcla 1 nmol de puntos cuánticos en tampón de borato con un exceso molar de 40.000 x 750 Da monoamino-polietilenglicol (30 mg, 40 mmol). Si una funcionalidad química específica es que se añaden a los nanocristales (por ejemplo, hidrazida o maleimida), puede ser introducido mediante la sustitución de una fracción de la amino-PEG heterobifuncional con un amino-PEG (30% fracción molar normalmente funciona bien). Diluir la solución de nanocristales a 1 mM con tampón de borato. Esta reacción puede hacerse a escala según se desee.
- Preparar una solución fresca de DMTMM (20 mg, 72 mmol) en DMSO (144 l). Esta solución puede calentarse brevemente unDer una corriente de agua de grifo caliente o sumergidos en un baño de ultrasonidos para disolver completamente el DMTMM. Añadir rápidamente un exceso de 25.000 x molar de esta solución 0,5 M DMTMM (50 l) a la solución QD y se agita a temperatura ambiente durante 30 min.
- Repita el paso cuatro veces más 4,2 para saturar la superficie de nanocristales con PEG. Por último, añadir 200 l 1 M Tris buffer para inactivar la reacción y purificar los nanocristales usando la diálisis, filtros centrífugos, o ultracentrifugación.
- Los nanocristales pueden ser analizados para monodispersidad, el tamaño hidrodinámico, y la carga superficial, usando la cromatografía líquida, la electroforesis en gel de agarosa, y microscopía de fluorescencia. Para determinar el tamaño hidrodinámico y la distribución de tamaño utilizando un sistema automatizado de cromatografía líquida (GE AKTAprime Plus), usar una columna de Superose 6, una velocidad de flujo de 0,5 ml / min con PBS eluyente tampón, y la detección de la absorción a 260 o 280 nm. Comparar los tiempos de elución de nanopartículas con los de patrones de peso molecular. Para gel de agarosa de electroforesisresistencia, preparar un gel de agarosa al 0,5% en 50 mM de tampón de borato de sodio (pH 8,5) o 50 mM de tampón de fosfato de sodio (pH 7,4), mezclar muestras de 1 m con 10% de glicerol y de carga a los pozos, y funcionar a 100 V durante 30 min . Imagen de los nanocristales en el gel usando una varilla de UV o transiluminador UV y para la excitación de fluorescencia. Para la imagen de los nanocristales en el nivel de una sola molécula usando microscopía de fluorescencia, diluir las partículas a 0,2 nM en tampón fosfato 10 mM, gota 2,5 ml de la solución sobre un cubreobjetos de vidrio, y se coloca cuidadosamente un cubreobjetos segundos en la parte superior del líquido talón para difundir una película entre los cubreobjetos. Imagen de la superficie con destino partículas usando un objetivo de alta apertura numérica (lo ideal es por lo menos 1,40) en cualquiera de los modos de epifluorescencia o TIRF con excitación a longitudes de onda entre 400-580 nm y una cámara CCD multiplicador de electrones. Parámetros exactos de imagen variará entre configuración microscopía.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
La figura 2 muestra la absorción y fluorescencia representante de nanocristales CdSe Hg, Cd x 1-x nanocristales SE después de intercambio catiónico, y Hg Cd x 1-x Se / Cd y Zn 1-y S después de nanocristales crecimiento de la concha. Los nanocristales de CdSe núcleo tienen un rendimiento cuántico de fluorescencia cerca de 15% (incluida la longitud de onda larga profundo-trampa de emisión), pero esta eficiencia cae a menos del 1% después de mercurio de cambio, probablemente debido a la carga trampas de portadores introducidos a través de la interrupción superficie átomo 9. Sin embargo, el crecimiento de una capa delgada de Cd y Zn 1-y S aumenta esta eficiencia a más de 70%, que se mantiene en gran medida después de la transferencia al agua (50% es típico). En contraste, CdSe / Cd y Zn 1-y S nanocristales sin incorporación mercurio perder una fracción sustancial de su rendimiento cuántico en agua a menos de cáscara gruesa se cultiva. Así, mediante la incorporación de mercurio en el núcleo nanocrystal, el pequeño tamaño del nanocristal se puede mantener (ver TEM en la figura 3) sin sacrificar el brillo. Es importante tener en cuenta que tapar con Cd y Zn 1-y S se desplaza el espectro de color rojo debido a la fuga de los portadores de carga electrónicos en el material de corteza; este cambio es de alrededor de 20-30 nm para CdSe núcleos 16, y aumenta con la aumentar el contenido de mercurio en el núcleo (hasta 100 nm).
El uso de una transferencia de fase 2-step al agua es crítico para obtener una población homogénea de nanocristales que no requieren de tamaño aún más la selección para retirar las agrupaciones y los agregados. En el primer paso, los nanocristales son transferidos a DMSO usando 1-tioglicerol, que desplaza oleilamina en la superficie del nanocristal. Tioglicerol luego se reemplaza con un polímero lineal multidentado, resultando en partículas altamente estables con un mínimo incremento en el tamaño hidrodinámico resultante del recubrimiento orgánico (<4 nm CONTRIBUCIen que el diámetro hidrodinámico). El cromatograma de exclusión por tamaño se representa en la figura 4a confirma que el tamaño es similar al de conalbúmina (75 kDa), y después de la modificación con 750 Da amino-PEG, el tamaño se aumenta a tan sólo 12 nm, similar a la de un anticuerpo IgG . PEG modificación neutraliza la carga de la superficie, como se confirma en el experimento de electroforesis en gel de agarosa representado en la Figura 4b. Habitualmente usamos cromatografía de exclusión molecular y electroforesis en gel para la caracterización rápida de tamaño, distribución de tamaño, y la carga superficial. Dispersión de luz dinámica y potenciometría zeta también se puede utilizar, sin embargo, la sección transversal de dispersión de estas partículas ultra pequeños es muy pequeña, y hemos encontrado que los resultados de los instrumentos comerciales no son reproducibles. Figura 5a muestra una micrografía de epifluorescencia de estos nanocristales depositado sobre un vidrio cubreobjetos y entusiasmados con 545 nm de luz visible. Estos nanocristales son fácilmente o. 5b bserved a nivel de una sola molécula a 30 cuadros por segundo con una cámara CCD multiplicador de electrones figura muestra que el número de partículas fluorescentes observados en cada trama fluctúa en el tiempo con excitación continua, esto es debido a una combinación de parpadear y fotodegradación . Parpadeo domina la primera ~ 7 min antes de fotodegradación oxidativa lentamente se hace evidente.

Figura 1. Representación esquemática del procedimiento de síntesis de nanopartículas. (A) Los precursores de cadmio y selenio reaccionan para generar nanocristales de CdSe, que son tratadas con mercurio octanethiolate, induciendo parcial Cd → intercambio catiónico Hg para dar Hg x Cd 1-X SE nanocristales aleación ternaria. Una cáscara de Cd y Zn 1-y S se cultivan a continuación sobre el núcleo usando acetato de cadmio, acetato de zinc, y azufre. (B) Como Synthesized, estos nanocristales están recubiertas con ligandos orgánicos no polares (oleilamina). Para solubilizar estas partículas en tampones acuosos, los ligandos se sustituyen con un ligando multidentado polímero, que está acoplado covalentemente a amino-PEG.

Figura 2. Propiedades ópticas de Hg Cd x 1-x Se / Cd y Zn nanocristales 1-y S. (A) Absorción (negro) y espectros de fluorescencia (rojo) de CdSe nanocristales núcleos, Hg Cd x 1-x núcleos SE after intercambio catiónico, y Hg Cd x 1-x Se / Cd y Zn 1-y S después de nanocristales crecimiento de la concha . Spectra se compensan para mayor claridad (b) los espectros de fluorescencia de Hg x Cd 1-x Se / Cd y Zn 1-y S con diferentes cantidades relativas de incorporación mercurio. El espectro azul representa núcleos con cero contenido de mercurio (x = 0, CdSe).

Figura 3. Micrografía electrónica de transmisión (a) y la distribución de tamaño de partícula (b) de Hg x Cd 1-x Se / Cd y Zn 1-y nanocristales S, que muestra un diámetro promedio ± desviación estándar de 3,2 ± 0,6 nm.

Figura 4. Caracterización hidrodinámica de Hg x Cd 1-x Se / Cd y Zn 1-y S puntos cuánticos en solución acuosa. (A) cromatograma de exclusión por tamaño de los nanocristales recubiertos de un polímero ligando multidentado antes (rojo) y después (azul) conjugación de amino-PEG. Moleculares estándares de proteína de peso se indican encima de las parcelas. (B) electroforesis en gel de agarosa experimento de los puntos cuánticos en tampón de borato sódico (pH ~ 8,5) antes (izquierda) Y después (derecha) conjugación de amino-PEG. El pozo está marcada con una flecha y las polaridades de los electrodos se indica a la derecha, que muestra que antes de la conjugación de los nanocristales migrar como partículas aniónicas y los nanocristales pegilados son electrostáticamente neutra.

Figura 5. Hg x Cd 1-x Se / Cd y Zn 1-y puntos cuánticos S adsorbidos sobre un cubreobjetos de vidrio en tampón de fosfato, con imágenes de microscopía de epifluorescencia. (A) Imagen de QD obtenido en 33 fotogramas por segundo. Imagen es de 15 micras x 15 micras. (B) Número de puntos cuánticos fluorescentes por campo de visión durante la iluminación continua durante 20 min con lámpara de arco de mercurio con 545 nm (30 nm de paso de banda) y un filtro de excitación de 625 nm (20 nm de paso de banda) y filtro de emisión de 100 x 1,4 NA objetivo. Las mediciones de 3 campos de visión se promediaron durante 20 min a 12,5 fotogramas por segundo.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
En comparación con los convencionales CdSe puntos cuánticos, aleación ternaria Hg Cd x 1-x nanocristales de Se puede ajustar en tamaño y longitud de onda de fluorescencia de forma independiente. El tamaño se selecciona por primera vez durante la síntesis de nanocristales de CdSe núcleos, y la longitud de onda de fluorescencia se elige en una etapa de intercambio de cationes secundaria de mercurio, que no altera sustancialmente el tamaño de nanocristales 9. Es importante permitir que el Hg purificado x Cd 1-x nanocristales de Se incubar a temperatura ambiente durante al menos 24 horas antes de la limitación. Esto permite que parte de los cationes de mercurio débilmente adsorbidos se difunda en la celosía de nanocristales. Sin permitir que este proceso ocurra, una banda de fluorescencia en segundo lugar en el infrarrojo cercano, se observa a menudo debido a la nucleación homogénea de nanocristales HgS de iones de mercurio disociadas.
En el ejemplo mostrado en este trabajo, se prepararon núcleos de CdSe con un tamaño de cerca de 2,3 nm, que puede sersintonizado en la fluorescencia entre 550-800 nm después de la limitación mediante la alteración de la cantidad de mercurio incorporado en la red de núcleo. Con una cáscara monocapa 2,5, el diámetro final de estos QDs era cerca de 3,2 nm, que es esencialmente la nanopartícula tamaño más pequeño que se puede preparar de que es a la vez lo suficientemente fotoestables y brillante suficientemente para una sola molécula de formación de imágenes (coeficiente de extinción alrededor de 350.000 M -1 cm -1 a 400 nm y el rendimiento cuántico cerca de 50% en agua). Estos nanocristales son sustancialmente más brillante y más fotoestable de nanocristales anteriormente descritos, con tamaños comparables que emiten en este rango espectral (por ejemplo, CdTe, InAs, InP). Como la mayoría de fluoróforos, la fluorescencia de estas partículas en el nivel de la molécula única es intermitente (intermitente) 5,6.
Para algunas aplicaciones, puede ser beneficioso usar nanocristales algo más grandes. Mediante el uso de una mayor CdSe nanocristales de núcleo, la bandwi fluorescenciadth es más estrecho después de intercambio catiónico mercurio. Típicos anchuras de los picos de fluorescencia para Hg x CD 1-x nanocristales SE con emisión en la ventana de 600-650 nm son 50-70 nm de 2,3 núcleos nm y 40-50 nm para núcleos 3.2 nm. De esta manera, grandes nanocristales permitir una mayor capacidad de multiplexación espectral. Además, el aumento del tamaño también aumentará la sección eficaz de absorción de los nanocristales. El aumento del grosor de la capa del cuerpo CdS provisional también aumentar el brillo, y además prolongar la estabilidad durante la excitación de fluorescencia. El tamaño del núcleo de CdSe se puede aumentar simplemente mediante la extensión de la duración de la síntesis núcleo CdSe, y supervisar el tamaño efectivo mediante espectrofotometría de absorción UV-Vis.
Se ha encontrado que los puntos cuánticos acuosas revestidas con ácidos carboxílicos son propensos a la adsorción no específica a las células y proteínas, y que la neutralización de su fuerte carga negativa en tampones fisiológicos es critical para minimizar interacciones no específicas 17. En los ejemplos aquí, se utilizó PEG de cadena corta para neutralizar la carga superficial y mantener la estabilidad en agua. PEG se puede introducir en la cadena principal del polímero o bien antes de la fijación a los puntos cuánticos o después del recubrimiento. Ambos procedimientos dan lugar a partículas casi neutro, pero aquellos recubiertos primero con el carboxilo-polímero son sustancialmente más pequeños, presumiblemente debido a la mejora de la interacción con la superficie multidentado. Para la neutralización completa de la superficie con PEG, se ha encontrado que la adición repetida de ácido carboxílico agentes activantes es necesario debido a la corta vida media de las especies reactivas. Usamos DMTMM en el lugar de reactivos de carbodiimida más comunes (por ejemplo EDC) debido a la estabilidad mejorada de DMTMM en almacenamiento y debido a la eficacia de la reacción en agua mejorada 18.
Finalmente, es importante tener en cuenta que los puntos cuánticos y muchos otros tipos de nanocristales contenerelementos citotóxicos 5. Iones cadmio y el mercurio puede afectar el proceso normal de células y organismos vivos y pueden ser cancerígenos 19-21. Sin embargo, la citotoxicidad de CdSe convencional / nanocristales de ZnS se ha estudiado ampliamente y se ha informado de que los nanocristales de robustamente recubiertos con ligandos orgánicos estables no provocan respuestas abiertamente citotóxicos en comparación con sus elementos constitutivos, simplemente porque sus elementos tóxicos son eficientemente secuestrado junto con agentes oxidantes 5. Además, para aplicaciones de imágenes de una sola molécula, efectos tóxicos son poco probables debido a las concentraciones extremadamente pequeñas que se usan para formación de imágenes (típicamente 1 nM o menos), que son órdenes de magnitud más pequeña que la aparición de efectos tóxicos detectables (50-100 nM). La mayoría de los experimentos de una sola molécula de ejecución puntos cuánticos a la fecha han utilizado comercialmente disponible CdSe / nanocristales de ZnS, que son sustancialmente mayores que los descritos en la presente memoria. Al minimizar el nanocrystal tamaño, el número total de átomos de la superficie de las partículas y por el número total de átomos por partícula tóxicos se reducen sustancialmente, lo que reduce el potencial total de impacto toxicológico. La incorporación de mercurio en el nanocristal se espera para reducir más el potencial de toxicidad, como mercurio divalente se sabe que es menos tóxico que el cadmio divalente en muchos tipos de células 19-21.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
No hay conflictos de interés declarado.
Acknowledgments
Los autores desean agradecer al Dr. Hong Yi en el Núcleo de la Universidad Emory Microscopía Integrado de imágenes de microscopía electrónica. Este trabajo ha sido patrocinado por el NIH subvenciones (PN2EY018244, R01 CA108468, U54CA119338 y 1K99CA154006-01).
Materials
| Name | Company | Catalog Number | Comments |
| Selenium | Sigma-Aldrich | 229865 | |
| Tri-n-octylphosphine | Strem | 15-6655 | 97% pure, unstable in air |
| Cadmium oxide | Sigma-Aldrich | 202894 | Highly toxic: use caution |
| Tetradecylphosphonic acid | PCI Synthesis | 4671-75-4 | |
| Octadecene | Alfa Aesar | L11004 | Technical grade |
| Hexadecylamine | Sigma-Aldrich | H7408 | |
| Diphenylphosphine | Sigma-Aldrich | 252964 | Pyrophoric |
| Mercury acetate | Sigma-Aldrich | 456012 | Highly toxic: use caution |
| 1-Octanethiol | Sigma-Aldrich | 471836 | Strong odor |
| Oleic acid | Sigma-Aldrich | W281506 | |
| Zinc acetate | Alfa Aesar | 35792 | |
| Cadmium acetate hydrate | Sigma-Aldrich | 229490 | Highly toxic: use caution |
| Oleylamine | Fisher Scientific | AC12954 | Unstable in air |
| Sulfur | Sigma-Aldrich | 344621 | |
| Trioctylphosphine oxide | Strem | 15-6661 | 99% |
| Pyridine | VWR | EM-PX2012-6 | Anhydrous |
| Thioglycerol | Sigma-Aldrich | M1753 | Strong odor |
| Triethylamine | Sigma-Aldrich | 471283 | Anhydrous |
| Dialysis tubing | Spectrum Labs | 131342 | 20 kDa cutoff |
| Centrifugal filter | Millipore | UFC801024 | 10 kDa cutoff |
| Monoamino-PEG | Rapp Polymere | 12 750-2 | 750 Da |
| DMTMM, 4-(4,6-Dimethoxy-1,3,5-triazin-2-yl)-4-methylmorpholinium chloride hydrate | Alfa Aesar | H26333 | |
| AKTAprime Plus Chromatography System | GE HealthCare | ||
| Superose 6 10/300 GL chromatography column | GE HealthCare | 17-5172-01 | |
| Agarose, OmniPur | VWR | EM-2120 | |
Appendix Synthesis of mercury octanethiolate: Slowly add a methanol solution of mercury acetate (1 eq.) to a stirring solution of 1-octanethiol (3 eq.) and potassium hydroxide (3 eq.) in methanol at room temperature. Isolate the mercury(II) octanethiolate precipitate via filtration, wash two times with methanol and once with ether, and then dry under vacuum. Synthesis of multidentate polymer: Dissolve polyacrylic acid (1 g, 1,773 Da) in 25 ml dimethylformamide (DMF) in a 150 ml three-necked flask and bubble with argon for 30 min. Add an anhydrous solution of cysteamine (374 mg, 4.87 mmol) in 10 ml DMF. At room temperature with vigorous stirring, slowly add anhydrous diisopropylcarbodiimide (DIC, 736 mg, 5.83 mmol) over 30 min, followed by triethylamine (170 μl, 1.22 mmol), and allow the reaction to proceed for 72 hr at 60 °C. Add mercapt–thanol (501 mg, 6.41 mmol) to quench the reaction, and stir for 2 hr at room temperature. Remove DMF via rotary evaporation and isolate the polymer with the addition of a 2:1 mixture of ice-cold acetone:chloroform, followed by centrifugation. Dissolve the polymer in ~5 ml anhydrous DMF, filter, precipitate again with diethyl ether, and repeat. Dry the product under vacuum and store under argon. Determination of CdSe core diameter: From the UV-Vis absorption spectrum determine the wavelength of the first exciton peak (λ, in nm), which is the longest-wavelength peak (e.g. roughly 498 nm for CdSe in Figure 2a), and use the sizing curve of Mulvaney and coworkers 12:
Determination of CdSe nanocrystal concentration: From a background-subtracted UV-Vis spectrum of an optically clear solution of CdSe nanocrystals, determine the absorption at 350 nm wavelength. Serial dilutions can be used to determine if the optical absorption is within the linear range of Beer's Law. The nanocrystal concentration (QD, in M) can be determined by plugging in the nanocrystal diameter (D, in nm), the optical absorption value (A3sa), and the cuvette path length (l, in cm) into the following equation from the empirical correlation of Bawendi and coworkers 13:
|
|||
References
- Toprak, E., Selvin, P. R. New fluorescent tools for watching nanometer-scale conformational changes of single molecules. Annu. Rev. Biophys. Biomol. Struct. 36, 349-369 (2007).
- Joo, C., Balci, H., Ishitsuka, Y., Buranachai, C., Ha, T. J. Advances in single molecule fluorescence methods for molecular biology. Annu. Rev. Biochem. 77, 51-76 (2008).
- Pinaud, F., Clarke, S., Sittner, A., Dahan, M. Probing cellular events, one quantum dot at a time. Nat. Method. 7, 275-285 (2010).
- Smith, A. M., Wen, M. M., Nie, S. M. Imaging dynamic cellular events with quantum dots. Biochemist. 32, 12-17 (2010).
- Smith, A. M., Duan, H. W., Mohs, A. M., Nie, S. M. Bioconjugated quantum dots for in vivo molecular and cellular imaging. Adv. Drug Deliv. Rev. 60, 1226-1240 (2008).
- Smith, A. M., Nie, S. M. Next-generation quantum dots. Nature Biotech. 27, 732-733 (2009).
- Groc, L., Lafourcade, M., Heine, M., Renner, M., Racine, V., Sibarita, J. -B., Lounis, B., Choquet, D., Cognet, L. Single trafficking of neurotransmitter receptor: comparison between single-molecule/quantum dot strategies. J. Neurosci. 27, 12433-12437 (2007).
- Smith, A. M., Nie, S. M. Minimizing the hydrodynamic size of quantum dots with multifunctional multidentate polymer ligands. J. Am. Chem. Soc. 130, 11278-11279 (2008).
- Smith, A. M., Nie, S. M. Bright and compact alloyed quantum dots with broadly tunable near-infrared absorption and fluorescence spectra through mercury cation exchange. J. Am. Chem. Soc. 133, 24-26 (2011).
- Shriver, D. F., Drezdzon, M. A. The Manipulation of Air-Sensitive Compounds. , 2nd edn, Wiley-Interscience. (1986).
- Errington, R. J. Advanced Practical Inorganic and Metalorganic Chemistry. , Blackie. (1997).
- Jasieniak, J., Smith, L., van Embden, J., Mulvaney, P., Califano, M. Re-examination of the size-dependent absorption properties of CdSe quantum dots. J. Phys. Chem. C. 113, 19468-19474 (2009).
- Leatherdale, C. A., Woo, W. K., Mikulec, F. V., Bawendi, M. G. On the absorption cross section of CdSe nanocrystal quantum dots. J. Phys. Chem. B. 106, 7619-7622 (2002).
- Smith, A. M., Mohs, A. M., Nie, S. M. Tuning the optical and electronic properties of colloidal nanocrystals by lattice strain. Nature Nanotech. 4, 56-63 (2009).
- Demas, J. N., Crosby, G. A. The measurement of photoluminescence quantum yields. A review. J. Phys. Chem. 75, 991-1024 (1971).
- Van Embden, J., Jasieniak, J., Mulvaney, P. Mapping the optical properties of CdSe/CdS heterostructure nanocrystals: the effects of core size and shell thickness. J. Am. Chem. Soc. 131, 14299-14309 (2009).
- Smith, A. M., Duan, H. W., Rhyner, M. N., Ruan, G., Nie, S. M. A systematic examination of surface coatings on the optical and chemical properties of semiconductor quantum dots. Phys. Chem. Chem. Phys. 8, 3895-3903 (2006).
- Zhang, X., Mohandessi, S., Miller, L. W., Snee, P. T. Efficient functionalization of aqueous CdSe/ZnS nanocrystals using small-molecule chemical activators. Chem. Comm. 47, 3532-3534 (2011).
- Bucio, L., Souza, V., Albores, A., Sierra, A., Chavez, E., Carabez, A., Guiterrez-Ruiz, M. C. Cadmium and mercury toxicity in a human fetal hepatic cell line (WRL-68 cells). Toxicol. 102, 285-299 (1995).
- Han, S. G., Castranova, V., Vallyathan, V. J. Comparative cytotoxicity of cadmium and mercury in a human bronchial epithelial cell line (BEAS-2B) and its role in oxidative stress and induction of heat shock protein 70. J. Toxicol. Environ. Health Part A. 70, 852-860 (2007).
- Strubelt, O., Kremer, J., Tilse, A., Keogh, J., Pentz, R. J. Comparative studies on the toxicity of mercury, cadmium, and copper toward the isolated perfused rat liver. J. Toxicol. Environ. Health Part A. 47, 267-283 (1996).