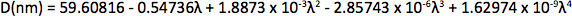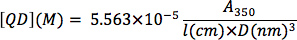Summary
Si descrive la preparazione di punti quantici colloidali con minimizzata dimensione idrodinamica per singola molecola imaging di fluorescenza. Rispetto ai tradizionali punti quantici, queste nanoparticelle sono di dimensioni simili alle proteine globulari e sono ottimizzati per singola molecola luminosità, stabilità contro la fotodegradazione, e resistenza al legame non specifico a proteine e cellule.
Abstract
Singola molecola di imaging è uno strumento importante per la comprensione dei meccanismi di funzionamento biomolecolare e per visualizzare l'eterogeneità spaziale e temporale dei comportamenti molecolari che sono alla base della biologia cellulare 1-4. Esporre una singola molecola di interesse, è tipicamente coniugato ad un tag fluorescente (colorante, proteine, perlina, o quantum dot) e osservato con epifluorescenza o totale riflessione interna fluorescenza (TIRF) microscopio. Mentre coloranti e proteine fluorescenti sono state il pilastro di immagini a fluorescenza per decenni, la loro fluorescenza è instabile in alto fondenti fotoni necessari per osservare singole molecole, ottenendo solo pochi secondi di osservazione prima completa perdita di segnale. Perle di lattice e perline dye-etichettati fornire stabilità del segnale migliorata, ma a scapito della dimensione idrodinamica drasticamente più grande, che può alterare deleteria la diffusione e il comportamento della molecola in esame.
S copi "> Punti quantici (QD) offrono un equilibrio tra questi due regimi problematici. Queste nanoparticelle sono composti da materiali semiconduttori e può essere costruito con un idrodinamico compatto con eccezionale resistenza alla fotodegradazione 5. Così, nel corso degli ultimi anni QD sono state fondamentali per consentire osservazione a lungo termine del comportamento complesso macromolecolare a livello di singola molecola. Tuttavia, queste particelle sono ancora stati trovati esporre diffusione ridotta in ambienti affollati molecolari come il citoplasma cellulare e la fessura sinaptica neuronale, in cui le loro dimensioni sono ancora troppo grandi 4,6 , 7.Recentemente abbiamo progettato i nuclei e rivestimenti per superfici di QD per ridurre al minimo dimensioni idrodinamico, mentre il bilanciamento offset per la stabilità colloidale, fotostabilità, luminosità, e vincolante non specifici che hanno impedito l'utilità di QD compatti in passato 8,9. L'obiettivo di questo articolo è quello di dimostrarela sintesi, la modifica e la caratterizzazione di questi nanocristalli ottimizzate, composto da una lega Hg Cd x 1-x Se nucleo rivestito con un isolante Zn Cd y 1-y shell S, ulteriormente rivestito con un legante polimerico multidentati modificato con polietilenglicole corta ( PEG) catene (Figura 1). Rispetto ai nanocristalli CdSe convenzionali, Hg Cd x 1-x leghe selenio offrire maggiori rese quantiche di fluorescenza, fluorescenza a lunghezze d'onda rosse e nel vicino infrarosso per una maggiore rapporto segnale-rumore nelle cellule, e di eccitazione a lunghezze d'onda visibili non citotossiche. Multidentati rivestimenti polimerici legarsi alla superficie nanocristallo in una conformazione chiusa e piana di minimizzare la dimensione idrodinamica, PEG e neutralizza la carica superficiale per ridurre il legame non specifico di cellule e biomolecole. Il risultato finale è un nanocristallo brillantemente fluorescente con emissione tra 550-800 nm e una dimensione idrodinamica totale vicino a 12 nm. Questo è in same gamma di dimensioni, come molte proteine globulari solubili nelle cellule, e di dimensioni notevolmente inferiori rispetto ai tradizionali QD pegilato (25-35 nm).
Protocol
Le procedure di sintesi seguenti comporta standard di aria libere tecniche e l'uso di un vuoto / collettore gas inerte; metodologia dettagliata può essere trovata in riferimenti 10 e 11. Scheda di sicurezza per tutte le sostanze potenzialmente tossiche e infiammabili deve essere consultata prima dell'uso e composti tutti infiammabili e / o aria-labile deve essere frazionato in setto-fiale sigillate in un vano portaoggetti o borsa guanto.
1. Sintesi di seleniuro di cadmio mercurio (Hg Cd x 1-x Se) Quantum Dot Nuclei
- Preparare una soluzione 0,4 M di selenio in trioctylphosphine (TOP). Aggiungere selenio (0,316 g, 4 mmol) ad una 50 ml a 3 colli pallone, poi evacuare e riempire con argon usando una linea Schlenk. Sotto aria senza condizioni (azoto secco o argon), aggiungere 10 ml TOP e calore a 100 ° C sotto agitazione per 1 ora per ottenere una soluzione limpida, incolore. Raffreddare la soluzione a temperatura ambiente e impostare il matraccio da parte.
- Per 250 ml a 3 colli pallone, aggiungere ossido di cadmio (CdO 0,0770 g, 0,6 mmol), acido tetradecylphosphonic (TDPA, 0,3674 g, 1,32 mmol), e octadecene (ODE, 27,6 ml), ed evacuare la soluzione utilizzando una linea Schlenk agitando. Aumentare la temperatura a 100 ° C ed evacuare per altri 15 minuti per rimuovere impurità bassobollenti point.
- Sotto argon o azoto, riscaldare la miscela a 300 ° C per 1 ora per sciogliere completamente la CdO. La soluzione cambierà da un colore rossastro al trasparente ed incolore. Raffreddare la soluzione a temperatura ambiente.
- Aggiungi esadecilammina (HDA, 7,0 g) alla soluzione cadmio, riscaldare a 70 ° C, ed evacuare. Una volta che una pressione costante viene raggiunta, aumentare la temperatura a 100-110 ° C e la soluzione riflusso per 30 min. Commutare la valvola linea Schlenk a gas inerte e inserire la termocoppia direttamente nella soluzione.
- Sotto aria senza condizioni, aggiungere diphenylphosphine (DPP, 100 pl) alla soluzione e aumentare la temperatura a 310 ° C. Rimuovere 7,5 ml di M 0.4 TOP-Se la soluzione(3 selenio mmol) in una siringa di plastica monouso collegato a un ago calibro 16.
- Una volta che la temperatura si equilibra a 310 ° C, impostare il regolatore di temperatura a 0 ° C e rapidamente iniettare il TOP-Se la soluzione direttamente nella soluzione di cadmio. La soluzione passa da incolore a giallo-arancio e la temperatura rapidamente scendere e aumentare di nuovo a ~ 280 ° C. Dopo 1 min di reazione, allontanare il pallone dal mantello riscaldante e raffreddare velocemente con un flusso di aria fino a quando la temperatura è inferiore a 200 ° C.
- Quando la temperatura raggiunge i 40 ° C, diluire con 30 ml di esano, la maggior parte del precursore cadmio rimanente depositarsi di soluzione. Rimuovere questo precipitato mediante centrifugazione (5000 xg, 10 min).
- In ciascuna delle sei tubo da 50 ml conica in polipropilene da centrifuga, diluire 12 ml della soluzione grezza nanocristalli con 40 ml di acetone, centrifuga (5.000 xg per 10 minuti), e con attenzione decantare ed eliminare il surnatante.
- Sciogliere il nanocrpellets ystal in esano (25 ml di volume totale). Estrarre questa soluzione 3 volte con un uguale volume di metanolo, mantenendo la fase superiore. Per la terza estrazione, il volume di metanolo può essere regolata per ~ 15 ml per ottenere una soluzione concentrata di esano QD CdSe puri a circa 200 pM. La resa tipica di questa reazione è 3 micromole di nanocristalli CdSe con un diametro di 2,3 nm (50-60% resa di reazione).
- Determinare il diametro di nanocristalli e la concentrazione misurando la UV-Vis spettro di assorbimento e la consultazione delle dimensioni-montaggio grafico di Mulvaney e collaboratori 12 e le correlazioni di estinzione Bawendi e collaboratori 13. Vedi Appendice per i dettagli.
- Di scambio cationico Mercury: i nanocristalli possono essere parzialmente scambiate con il mercurio al rosso-spostare l'assorbimento e l'emissione di fluorescenza. Mescolare il seguente insieme in ordine in una fiala di vetro da 20 ml con stirbar (questa reazione può essere scalata a piacere): 3 ml di esano, 2 ml di cloroformio, 1 ml 200 uM CdSe QD soluzione (200 nmol), 15 microlitri oleilammina (OLA), e 500 microlitri di una soluzione 0,1 M di Hg (OT) 2 in cloroformio. Mercury octanethioate (HgOT 2) possono essere preparati facendo reagire acetato di mercurio e octanethiol in metanolo (vedi appendice). Con il procedere della reazione di scambio cationico, il grado di spostamento verso il rosso può essere monitorato con UV-Vis spettrofotometria di assorbimento. Dopo la banda di assorbimento desiderato è stato raggiunto, misurare l'assorbimento della soluzione nanocristallo a 350 nm e determinare il nuovo coefficiente di estinzione, assumendo che la concentrazione nanocristallo non è cambiata (30,7 pM in questo esempio). Estinguere la reazione rimuovendo il mercurio non reagito: aggiungere 5 ml decano, 10 ml di esano, e 7 ml di metanolo ed estrarre la soluzione, mantenendo la fase superiore contenente i nanocristalli. Estratto due volte con esano e metanolo, e regolare il volume di metanolo in modo che la fase superiore è ~ 7 ml. Se le fasi sono lenti a separare, la soluzione può essere centrifugati (5000 xg,10 min). Aggiungere 100 microlitri TOP, 100 microlitri OLA, e 100 microlitri di acido oleico ai nanocristalli seguiti da 40 ml di acetone per indurre la precipitazione. Raccogliere i nanocristalli mediante centrifugazione e si disperdono in 3 ml di esano. Centrifugare nuovamente per rimuovere i componenti insolubili e determinare la concentrazione nanocristallo nuovamente, utilizzando il coefficiente di estinzione nuovo a 350 nm. Consentire alla soluzione nanocristallo invecchiare per almeno 24 ore a temperatura ambiente prima di procedere alla fase successiva.
2. Crescita di solfuro di cadmio di zinco (Zn Cd y 1-y S) Shell
- Preparare 0,1 m soluzioni precursori shell in 50 ml a 3 colli palloni. Cadmio precursore: acetato idrato cadmio (230,5 mg, 1 mmol) e 10 ml oleilammina (OLA). Zinco precursore: acetato di zinco (183,5 mg, 1 mmol) e 10 ml OLA. Precursore zolfo: zolfo (32,1 mg, 1 mmol) e 10 ml ODE. Sotto vuoto, riscaldare ogni soluzione a riflusso per 1 ora per ottenere soluzioni chiare, e poi caricare con argon. La soluzione di zolfo puòessere raffreddata a temperatura ambiente, ma i precursori cadmio e zinco sono mantenuta a circa 50 ° C. I calcoli di quantità precursori shell si possono trovare in riferimento 14.
- Aggiungi a un pallone a 3 colli: Hg Cd x 1-x Se QD (120 nmol, 2.3 nm di diametro), ODE (2 ml), e trioctylphosphine ossido (TOPO, 250 mg). Evacuare fuori esano a temperatura ambiente utilizzando la linea Schlenk. Aumentare la temperatura a 100 ° C sotto riflusso per 15 min. Modificare la valvola della linea di Schlenk argon o azoto e inserire la termocoppia nella soluzione nanocristalli.
- Aumentare la temperatura a 120 ° C, aggiungere 0,5 monostrati di soluzione di precursore di zolfo (140 pl), e consentire la reazione per 15 min. Piccole aliquote (<50 pl) può essere rimosso usando una siringa di vetro per monitorare l'andamento della reazione mediante fluorescenza e / o UV-Vis spettrofotometria di assorbimento. Aumentare la temperatura a 140 ° C, aggiungere 0,5 monostrati di soluzione precursore cadmio (140 pl), e consentire la reazione per 15 min. Aggiungere 500 pl anidro OLA alla soluzione di reazione.
- A 160 ° C aggiungere 0,5 monostrati di soluzione di precursore di zolfo (220 microlitri) seguita da una pari quantità di soluzione di precursore di zinco a 170 ° C con 15 min tra ogni aggiunta. Poi a 180 ° C aggiungere 0,25 monostrati di soluzione di precursore di zolfo (150 ml) e soluzione di precursore di zinco in intervalli di 15 min.
- Raffreddare la soluzione a temperatura ambiente e ancora calcolare un nuovo coefficiente di estinzione per queste particelle utilizzando un spettro UV-Vis, supponendo che il numero di nanocristalli non è cambiata (120 nmol in 3,8 ml di soluzione di reazione). Conservare la soluzione di reazione come una miscela grezza in un congelatore, i nanocristalli possono essere scongelate e purificato come necessario utilizzando lo stesso metodo descritto nelle sezioni 1.8 e 1.9.
- I nanocristalli possono essere caratterizzati mediante microscopia elettronica, spettroscopia UV-Vis di assorbimento, e la spettroscopia di fluorescenza. Resa quantica può essereassolutamente calcolato utilizzando una sfera di integrazione o relativamente rispetto ad uno standard noto utilizzando i metodi di riferimento 15.
3. Fase di trasferimento
- Aggiungere purificato nucleo / guscio Hg x Cd 1-x Se / Zn Cd y 1-y S QDs (5 ml, 20 pM) per un 50 ml a 3 colli pallone e rimuovere la esano sotto alto vuoto per ottenere un film secco. Riempire il pallone con argon, aggiungere piridina anidra (3 ml) al film nanoparticelle e calore dello slurry a 80 ° C. Nel corso di 1-2 ore le nanoparticelle si dissolvono completamente.
- Aggiungere 1-tioglicerolo (1 ml) alla soluzione e agitare a 80 ° C per 2 h. Quindi raffreddare la soluzione a temperatura ambiente ed aggiungere trietilammina (0,5 ml) a deprotonate tioglicerolo. Agitare per 30 min. La soluzione può diventare torbida dopo l'aggiunta di trietilammina a causa della scarsa solubilità dei nanocristalli polari in questa miscela solvente.
- Trasferire la soluzione QD in un cont centrifuga da 50 ml tubo conicoaining una miscela di 20 ml di esano e 20 ml di acetone, e mescolare bene. Isolare i nanocristalli precipitati tramite centrifugazione (5000 xg, 10 min), e lavare il pellet con acetone.
- Sciogliere il precipitato QD in DMSO (5 ml) con sonicazione vasca, e quindi centrifuga (7000 xg, 10 min) per rimuovere eventuali aggregati. Determinare la concentrazione delle nanoparticelle da un UV-Vis spettro di assorbimento. Questa soluzione di QD puri deve essere usato entro 3 ore, come i tioli di superficie può lentamente ossidare in condizioni ambientali in aria.
- Diluire la soluzione QD a 10 pm o meno con DMSO e trasferirla in un pallone tarato da 50 ml. Preparare a 5 mg / ml soluzione di tiolato acido poliacrilico (sintesi descritta in appendice) in DMSO. Aggiungere la soluzione di polimero (0,15 mg di polimero per nmol QD) goccia a goccia alla soluzione sotto agitazione QD e degassare la soluzione a temperatura ambiente per 5 min.
- Spurgare il QD / polimero soluzione con argon e scaldare a 80 ° C per 90 min. Quindi raffreddare la soluzione a temperatura ambiente und gocciolata aggiungere un volume uguale di 50 mM di sodio borato, pH 8. Agitare per 10 min.
- Purificare le QDs tramite dialisi (20 kDa cutoff) in 50 mM di sodio borato, pH 8, e quindi concentrare le particelle utilizzando un filtro centrifugo (10 kDa cutoff). Determinare la concentrazione di raggi UV-Vis spettro di assorbimento.
4. PEG Rivestimento
- In una fiala di vetro da 4 ml con stirbar, mescolare 1 nmol QDs in tampone borato con un eccesso molare di 40.000 x 750 Da monoamino-polietilene glicole (30 mg, 40 umol). Se una funzionalità chimica specifica deve essere aggiunta ai nanocristalli (es idrazide o maleimide), esso può essere introdotto sostituendo una frazione del ammino-PEG con un eterobifunzionale amino-PEG (frazione molare 30% lavora generalmente bene). Diluire la soluzione nanocristalli a 1 micron con tampone borato. Questa reazione può essere ridotta come desiderato.
- Preparare una soluzione fresca di DMTMM (20 mg, 72 umol) in DMSO (144 microlitri). Questa soluzione può essere brevemente riscaldata under un flusso di acqua corrente calda o immersi in un bagno di sonicazione per sciogliere completamente il DMTMM. Aggiungere rapidamente un eccesso molare 25.000 x di questa soluzione 0,5 M DMTMM (50 microlitri) alla soluzione QD ed agitare a temperatura ambiente per 30 min.
- Ripetere il passaggio 4,2 più quattro volte per saturare la superficie nanocristalli con PEG. Infine, aggiungere 200 microlitri di tampone Tris 1 M per placare la reazione e purificare i nanocristalli con dialisi, filtri centrifughi, o ultracentrifugazione.
- I nanocristalli possono essere analizzati per monodispersity, dimensione idrodinamica, e carica superficiale usando cromatografia liquida, elettroforesi su gel di agarosio, e microscopia a fluorescenza. Per determinare la dimensione idrodinamica e distribuzione dimensionale usando un sistema automatizzato cromatografia liquida (GE AKTAprime Plus), utilizzare una colonna Superose 6, una velocità di flusso di 0,5 ml / min con eluente tampone PBS, e rilevazione assorbimento a 260 o 280 nm. Confrontare i tempi di eluizione nanoparticelle con quelli di standard di peso molecolare. Per gel di agarosio electrophoresistenza, preparare un gel di agarosio 0,5% in tampone borato di sodio 50 mM (pH 8,5) o 50 mM tampone fosfato di sodio (pH 7,4), miscelare 1 pM campioni con il 10% di glicerolo e di carico in pozzi, e correre a 100 V per 30 min . Immagine i nanocristalli nel gel con una bacchetta UV mano o transilluminatore UV e per l'eccitazione di fluorescenza. Per le immagini a livello di nanocristalli singola molecola mediante microscopia a fluorescenza, diluire le particelle di 0,2 nM in tampone fosfato 10 mM, goccia 2,5 pl della soluzione su un vetrino di vetro, e depositarla un coprioggetto secondo sopra il tallone liquido di diffondere un film tra i coprioggetti. Immagine della superficie-bound particelle utilizzando un obiettivo ad alta apertura numerica (idealmente almeno 1.40) sia in modalità a epifluorescenza o TIRF con eccitazione a lunghezze d'onda tra 400-580 nm e un elettrone moltiplicatore di telecamere CCD. Parametri di imaging esatto varierà tra installazione microscopia.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
La figura 2 mostra l'assorbimento di rappresentanza e spettri di fluorescenza per nanocristalli CdSe Hg, Cd x 1-x nanocristalli di Se dopo di scambio cationico, Hg e Cd x 1-x Se / Zn Cd y 1-y S nanocristalli dopo la crescita della conchiglia. I nanocristalli CdSe nucleo ha una resa quantica di fluorescenza vicino a 15% (compreso lunghezza d'onda di emissione deep-trap) ma questa efficienza scende a meno di 1% dopo mercurio scambio, probabilmente a causa di addebitare trappole vettore introdotte attraverso distruzione superficie atomo 9. Tuttavia la crescita di un sottile guscio di Zn Cd y 1-y S aumenta questa efficienza a più del 70%, che è ampiamente mantenuta dopo il trasferimento di acqua (50% è tipico). Al contrario, CdSe / Zn Cd y 1-y S nanocristalli senza incorporazione mercurio perdere una parte sostanziale della loro resa quantica in acqua a meno che un guscio di spessore è cresciuto. Così incorporando mercurio nel nucleo nanocrystal, le ridotte dimensioni del nanocristallo può essere mantenuta (TEM vedere in figura 3) senza sacrificare la luminosità. È importante notare che tappatura con Zn Cd y 1-y S sposta gli spettri al rosso causa di fughe di portatori di carica elettronica nel materiale shell; questo spostamento è di circa 20-30 nm per CdSe nuclei 16, ed aumenta con aumento del contenuto di mercurio nel nucleo (fino a 100 nm).
L'uso di un 2-fase di trasferimento di fase all'acqua è essenziale per ottenere una popolazione omogenea di nanocristalli che non richiedono dimensioni maggiori smistamento per rimuovere cluster e aggregati. Nella prima fase, i nanocristalli sono trasferiti DMSO utilizzando 1-tioglicerolo, che sposta oleilammina sulla superficie del nanocristallo. Tioglicerolo viene quindi sostituito con un polimero lineare multidentati, causando particelle altamente stabili con un minimo aumento di dimensione idrodinamica risultante dal rivestimento organico (<4 nm | contributial diametro idrodinamico). L'esclusione dimensionale cromatogramma illustrato nella figura 4a conferma che la dimensione è simile a quella di conalbumina (75 kDa), e dopo modificazione con 750 Da ammino-PEG, la dimensione viene aumentata a soli 12 nm, simile a quella di un anticorpo IgG . PEG modifica neutralizza la carica di superficie, come conferma l'esperimento elettroforesi su gel di agarosio illustrato nella figura 4b. Noi abitualmente uso esclusione dimensionale cromatografia e elettroforesi su gel per la caratterizzazione rapida di dimensioni, distribuzione dimensionale, e carica superficiale. Dispersione dinamica della luce e la potenziometria zeta possono anche essere utilizzati, tuttavia la dispersione sezione trasversale di queste particelle ultrasmall è molto piccola, e abbiamo trovato che risulta da strumenti commerciali non sono riproducibili. Figura 5a mostra una micrografia epifluorescenza di questi nanocristalli depositato su un vetrino coprioggetto ed eccitato con 545 nm di luce visibile. Questi nanocristalli sono facilmente o. Figura 5b bserved a singola molecola a 30 frame al secondo con un elettrone moltiplicatore di camera CCD mostra che il numero di particelle fluorescenti osservati in ciascun frame varia nel tempo con eccitazione continuo: ciò è dovuto ad una combinazione di lampeggiare e fotodegradazione . Lampeggiante domina per la prima ~ 7 min prima di fotodegradazione ossidativa lentamente diventa evidente.

Figura 1. Rappresentazione schematica del procedimento di sintesi di nanoparticelle. (A) precursori cadmio e selenio reagire per produrre nanocristalli CdSe, che sono trattati con mercurio octanethiolate, inducendo parziale Cd → scambio cationico Hg a cedere Hg Cd x 1-x SE nanocristalli lega ternaria. Un guscio di Zn Cd y 1-y S viene poi cresciuto sul nucleo usando acetato di cadmio, acetato di zinco, e zolfo. (B) Come synthesized, questi nanocristalli sono rivestiti con leganti organici non polari (oleilammina). Per solubilizzare queste particelle in tamponi acquosi, i leganti sono sostituiti con un ligando multidentati polimero, che è covalentemente accoppiato amino-PEG.

Figura 2. Proprietà ottiche di Hg Cd x 1-x Se / Zn Cd y 1-y S nanocristalli. (A) Assorbimento (nero) e spettri di fluorescenza (rosso) di nanocristalli CdSe core, Hg Cd x 1-x anime di Se dopo scambio cationico, e Hg Cd x 1-x Se / Zn Cd y 1-y S nanocristalli dopo la crescita della conchiglia . Gli spettri sono compensate per chiarezza (b), spettri di fluorescenza di Hg Cd x 1-x Se / Zn Cd y 1-y S con diverse quantità relative di incorporazione mercurio. Lo spettro blu raffigura nuclei con zero contenuto di mercurio (x = 0, CdSe).

Figura 3. Microscopio elettronico a trasmissione (a) e la distribuzione granulometrica (b) di Hg Cd x 1-x Se / Zn Cd y 1-y S nanocristalli, mostrando un diametro medio ± deviazione standard di 3,2 ± 0,6 nm.

Figura 4. Caratterizzazione idrodinamica di Hg Cd x 1-x Se / Zn Cd y 1-y S QD in soluzione acquosa. (A) esclusione cromatogramma Dimensione di nanocristalli rivestiti in un legante polimerico multidentati prima (rosso) e dopo (blu) coniugazione di amino-PEG. Molecolari standard di proteine di peso sono indicate sopra le trame. (B) Gel di agarosio esperimento elettroforesi dei QDs in tampone borato di sodio (pH ~ 8,5) prima (a sinistra) E dopo (a destra) coniugazione di amino-PEG. Il pozzo è contrassegnato con una freccia e polarità di elettrodo sono indicati sulla destra, mostrando che prima coniugazione dei nanocristalli migrare come particelle anionici e le nanocristalli pegilati sono elettrostaticamente neutro.

Figura 5. Hg Cd x 1-x Se / Zn Cd y 1-y QD S adsorbiti su un vetrino di vetro in tampone fosfato, ripreso con epifluorescenza. (A) QD immagine ottenuta a 33 fotogrammi al secondo. Immagine è di 15 micron x 15 micron. (B) Numero di QD fluorescenti per campo visivo durante illuminazione continua per 20 minuti con lampada ad arco di mercurio di 545 nm banda passante (30 nm) e un filtro di eccitazione 625 nm banda passante (20 nm) di emissione filtro e 100x 1,4 obiettivo NA. Misure da 3 campi di vista sono stati una media di oltre 20 minuti a 12,5 fotogrammi al secondo.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Rispetto ai tradizionali CdSe punti quantici, in lega ternaria Hg Cd x 1-x nanocristalli SE può essere sintonizzato per dimensioni e lunghezza d'onda di fluorescenza in modo indipendente. La dimensione viene prima selezionata durante la sintesi di nanocristalli CdSe nuclei, e la lunghezza d'onda di fluorescenza viene scelto in una fase secondaria di scambio cationico mercurio, che non alteri sostanzialmente le dimensioni nanocristallo 9. È importante permettere purificato Hg Cd x 1-x nanocristalli SE a incubare a temperatura ambiente per almeno 24 ore prima della tappatura. Questo consente alcuni dei cationi debolmente adsorbite mercurio a diffondere nel reticolo nanocristallo. Senza lasciarsi il processo avvenga, una seconda banda di fluorescenza nel vicino infrarosso è spesso osservato a causa di nucleazione omogenea di nanocristalli HGS da ioni di mercurio dissociate.
Nell'esempio mostrato in questo lavoro, abbiamo preparato nuclei CdSe con un vicino 2,3 nm, che può esseresintonizzato fluorescenza tra 550-800 nm dopo la riduzione alterando la quantità di mercurio incorporato nel reticolo nucleo. Con un guscio 2,5 monostrato, il diametro finale di questi era vicino QD 3,2 nm, che è essenzialmente la nanoparticella dimensione più piccola che si può preparare che sia sufficientemente fotostabile e sufficientemente luminoso per singola molecola di imaging (coefficiente di estinzione in prossimità 350000 M -1 cm -1 a 400 nm e la resa quantica vicino al 50% in acqua). Questi nanocristalli sono sostanzialmente più luminoso e più fotostabili di nanocristalli precedentemente descritti con dimensioni simili che emettono in questo intervallo spettrale (ad esempio CdTe, InAs, InP). Come la maggior parte fluorofori, la fluorescenza di queste particelle a livello di singola molecola è intermittente (lampeggiante) 5,6.
Per alcune applicazioni, può essere vantaggioso utilizzare nanocristalli po 'più grandi. Utilizzando più grande CdSe nanocristallo nucleo, il bandwi fluorescenzadth è più stretto dopo scambio cationico mercurio. Tipiche larghezze del picco di fluorescenza per Hg Cd x 1-x nanocristalli SE con emissione nella finestra 600-650 nm sono 50-70 nm per 2,3 nuclei nm e 40-50 nm per 3,2 nuclei nm. In tal modo, più grandi nanocristalli consentire una maggiore capacità di multiplexing spettrale. Inoltre, aumentando la dimensione sarà altresì aumentare l'assorbimento sezione dei nanocristalli. Aumentando lo spessore dello strato intermedio shell CdS aumenterà anche la luminosità, e prolungare ulteriormente la stabilità durante l'eccitazione di fluorescenza. Le dimensioni del nucleo CdSe può essere aumentata semplicemente estendendo la durata della sintesi nucleo CdSe, e monitorare la dimensione effettiva mediante spettrofotometria UV-Vis assorbimento.
Abbiamo trovato che QDs acquose rivestiti con acidi carbossilici sono inclini ad adsorbimento non specifico di cellule e proteine, e che la neutralizzazione del loro forte carica negativa in tamponi fisiologici è critical per minimizzare le interazioni aspecifiche 17. Negli esempi qui, abbiamo usato catena corta PEG per neutralizzare la carica superficiale e mantenere la stabilità in acqua. PEG può essere introdotto nello scheletro del polimero sia prima attaccamento alle QD o dopo il rivestimento. Entrambe le procedure, particelle quasi neutro, ma quelle rivestite prima con il carbossile-polimero sono sostanzialmente più piccole, presumibilmente a causa di una migliore interazione con la superficie multidentati. Per superficie completa neutralizzazione con PEG, abbiamo trovato che l'aggiunta di agenti ripetuta attivanti acido carbossilico è necessaria a causa della breve emivita delle specie reattive. Usiamo DMTMM in luogo di altri reagenti comuni carbodiimmide (EDC esempio) per la migliore stabilità di stoccaggio e DMTMM in causa migliorata efficienza di reazione in acqua 18.
Infine, è importante notare che punti quantici e molti altri tipi di nanocristalli contengonoelementi citotossici 5. Ioni cadmio e il mercurio può influenzare i normali processi di cellule viventi e degli organismi e può essere cancerogeno 19-21. Tuttavia la citotossicità di CdSe convenzionale / nanocristalli ZnS è stato ampiamente studiato ed è stato riportato che nanocristalli robustamente rivestite con ligandi organici stabili non inducono risposte apertamente citotossiche rispetto ai loro elementi costitutivi, semplicemente perché i loro elementi tossici sono efficientemente sequestrati lontano da agenti ossidanti 5. Inoltre, per la singola molecola applicazioni di imaging, effetti tossici sono improbabili a causa delle concentrazioni estremamente piccole utilizzate per l'imaging (tipicamente 1 nm o meno) che sono ordini di grandezza inferiore a l'insorgenza di effetti tossici rilevabili (50-100 nM). La maggior parte degli esperimenti a singola molecola di attuazione QDs finora hanno utilizzato CdSe commercialmente disponibile / nanocristalli ZnS, che sono sostanzialmente più grandi di quelli qui descritti. Minimizzando il nanocrystal dimensioni, il numero totale di atomi di superficie per particella e il numero totale di atomi tossici per particella sono sostanzialmente ridotti, riducendo così il potenziale totale di impatto tossicologico. L'incorporazione di mercurio nel nanocristallo dovrebbe ridurre ulteriormente il potenziale tossicità, come mercurio bivalente è noto per essere meno tossici di cadmio bivalente in molti tipi di cellule 19-21.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Nessun conflitto di interessi dichiarati.
Acknowledgments
Gli autori desiderano ringraziare il Dr. Hong Yi presso la Emory University di Microscopia di base integrata per l'imaging microscopia elettronica. Questo lavoro è stato sponsorizzato dal NIH (PN2EY018244, R01 CA108468, U54CA119338 e 1K99CA154006-01).
Materials
| Name | Company | Catalog Number | Comments |
| Selenium | Sigma-Aldrich | 229865 | |
| Tri-n-octylphosphine | Strem | 15-6655 | 97% pure, unstable in air |
| Cadmium oxide | Sigma-Aldrich | 202894 | Highly toxic: use caution |
| Tetradecylphosphonic acid | PCI Synthesis | 4671-75-4 | |
| Octadecene | Alfa Aesar | L11004 | Technical grade |
| Hexadecylamine | Sigma-Aldrich | H7408 | |
| Diphenylphosphine | Sigma-Aldrich | 252964 | Pyrophoric |
| Mercury acetate | Sigma-Aldrich | 456012 | Highly toxic: use caution |
| 1-Octanethiol | Sigma-Aldrich | 471836 | Strong odor |
| Oleic acid | Sigma-Aldrich | W281506 | |
| Zinc acetate | Alfa Aesar | 35792 | |
| Cadmium acetate hydrate | Sigma-Aldrich | 229490 | Highly toxic: use caution |
| Oleylamine | Fisher Scientific | AC12954 | Unstable in air |
| Sulfur | Sigma-Aldrich | 344621 | |
| Trioctylphosphine oxide | Strem | 15-6661 | 99% |
| Pyridine | VWR | EM-PX2012-6 | Anhydrous |
| Thioglycerol | Sigma-Aldrich | M1753 | Strong odor |
| Triethylamine | Sigma-Aldrich | 471283 | Anhydrous |
| Dialysis tubing | Spectrum Labs | 131342 | 20 kDa cutoff |
| Centrifugal filter | Millipore | UFC801024 | 10 kDa cutoff |
| Monoamino-PEG | Rapp Polymere | 12 750-2 | 750 Da |
| DMTMM, 4-(4,6-Dimethoxy-1,3,5-triazin-2-yl)-4-methylmorpholinium chloride hydrate | Alfa Aesar | H26333 | |
| AKTAprime Plus Chromatography System | GE HealthCare | ||
| Superose 6 10/300 GL chromatography column | GE HealthCare | 17-5172-01 | |
| Agarose, OmniPur | VWR | EM-2120 | |
Appendix Synthesis of mercury octanethiolate: Slowly add a methanol solution of mercury acetate (1 eq.) to a stirring solution of 1-octanethiol (3 eq.) and potassium hydroxide (3 eq.) in methanol at room temperature. Isolate the mercury(II) octanethiolate precipitate via filtration, wash two times with methanol and once with ether, and then dry under vacuum. Synthesis of multidentate polymer: Dissolve polyacrylic acid (1 g, 1,773 Da) in 25 ml dimethylformamide (DMF) in a 150 ml three-necked flask and bubble with argon for 30 min. Add an anhydrous solution of cysteamine (374 mg, 4.87 mmol) in 10 ml DMF. At room temperature with vigorous stirring, slowly add anhydrous diisopropylcarbodiimide (DIC, 736 mg, 5.83 mmol) over 30 min, followed by triethylamine (170 μl, 1.22 mmol), and allow the reaction to proceed for 72 hr at 60 °C. Add mercapt–thanol (501 mg, 6.41 mmol) to quench the reaction, and stir for 2 hr at room temperature. Remove DMF via rotary evaporation and isolate the polymer with the addition of a 2:1 mixture of ice-cold acetone:chloroform, followed by centrifugation. Dissolve the polymer in ~5 ml anhydrous DMF, filter, precipitate again with diethyl ether, and repeat. Dry the product under vacuum and store under argon. Determination of CdSe core diameter: From the UV-Vis absorption spectrum determine the wavelength of the first exciton peak (λ, in nm), which is the longest-wavelength peak (e.g. roughly 498 nm for CdSe in Figure 2a), and use the sizing curve of Mulvaney and coworkers 12:
Determination of CdSe nanocrystal concentration: From a background-subtracted UV-Vis spectrum of an optically clear solution of CdSe nanocrystals, determine the absorption at 350 nm wavelength. Serial dilutions can be used to determine if the optical absorption is within the linear range of Beer's Law. The nanocrystal concentration (QD, in M) can be determined by plugging in the nanocrystal diameter (D, in nm), the optical absorption value (A3sa), and the cuvette path length (l, in cm) into the following equation from the empirical correlation of Bawendi and coworkers 13:
|
|||
References
- Toprak, E., Selvin, P. R. New fluorescent tools for watching nanometer-scale conformational changes of single molecules. Annu. Rev. Biophys. Biomol. Struct. 36, 349-369 (2007).
- Joo, C., Balci, H., Ishitsuka, Y., Buranachai, C., Ha, T. J. Advances in single molecule fluorescence methods for molecular biology. Annu. Rev. Biochem. 77, 51-76 (2008).
- Pinaud, F., Clarke, S., Sittner, A., Dahan, M. Probing cellular events, one quantum dot at a time. Nat. Method. 7, 275-285 (2010).
- Smith, A. M., Wen, M. M., Nie, S. M. Imaging dynamic cellular events with quantum dots. Biochemist. 32, 12-17 (2010).
- Smith, A. M., Duan, H. W., Mohs, A. M., Nie, S. M. Bioconjugated quantum dots for in vivo molecular and cellular imaging. Adv. Drug Deliv. Rev. 60, 1226-1240 (2008).
- Smith, A. M., Nie, S. M. Next-generation quantum dots. Nature Biotech. 27, 732-733 (2009).
- Groc, L., Lafourcade, M., Heine, M., Renner, M., Racine, V., Sibarita, J. -B., Lounis, B., Choquet, D., Cognet, L. Single trafficking of neurotransmitter receptor: comparison between single-molecule/quantum dot strategies. J. Neurosci. 27, 12433-12437 (2007).
- Smith, A. M., Nie, S. M. Minimizing the hydrodynamic size of quantum dots with multifunctional multidentate polymer ligands. J. Am. Chem. Soc. 130, 11278-11279 (2008).
- Smith, A. M., Nie, S. M. Bright and compact alloyed quantum dots with broadly tunable near-infrared absorption and fluorescence spectra through mercury cation exchange. J. Am. Chem. Soc. 133, 24-26 (2011).
- Shriver, D. F., Drezdzon, M. A. The Manipulation of Air-Sensitive Compounds. , 2nd edn, Wiley-Interscience. (1986).
- Errington, R. J. Advanced Practical Inorganic and Metalorganic Chemistry. , Blackie. (1997).
- Jasieniak, J., Smith, L., van Embden, J., Mulvaney, P., Califano, M. Re-examination of the size-dependent absorption properties of CdSe quantum dots. J. Phys. Chem. C. 113, 19468-19474 (2009).
- Leatherdale, C. A., Woo, W. K., Mikulec, F. V., Bawendi, M. G. On the absorption cross section of CdSe nanocrystal quantum dots. J. Phys. Chem. B. 106, 7619-7622 (2002).
- Smith, A. M., Mohs, A. M., Nie, S. M. Tuning the optical and electronic properties of colloidal nanocrystals by lattice strain. Nature Nanotech. 4, 56-63 (2009).
- Demas, J. N., Crosby, G. A. The measurement of photoluminescence quantum yields. A review. J. Phys. Chem. 75, 991-1024 (1971).
- Van Embden, J., Jasieniak, J., Mulvaney, P. Mapping the optical properties of CdSe/CdS heterostructure nanocrystals: the effects of core size and shell thickness. J. Am. Chem. Soc. 131, 14299-14309 (2009).
- Smith, A. M., Duan, H. W., Rhyner, M. N., Ruan, G., Nie, S. M. A systematic examination of surface coatings on the optical and chemical properties of semiconductor quantum dots. Phys. Chem. Chem. Phys. 8, 3895-3903 (2006).
- Zhang, X., Mohandessi, S., Miller, L. W., Snee, P. T. Efficient functionalization of aqueous CdSe/ZnS nanocrystals using small-molecule chemical activators. Chem. Comm. 47, 3532-3534 (2011).
- Bucio, L., Souza, V., Albores, A., Sierra, A., Chavez, E., Carabez, A., Guiterrez-Ruiz, M. C. Cadmium and mercury toxicity in a human fetal hepatic cell line (WRL-68 cells). Toxicol. 102, 285-299 (1995).
- Han, S. G., Castranova, V., Vallyathan, V. J. Comparative cytotoxicity of cadmium and mercury in a human bronchial epithelial cell line (BEAS-2B) and its role in oxidative stress and induction of heat shock protein 70. J. Toxicol. Environ. Health Part A. 70, 852-860 (2007).
- Strubelt, O., Kremer, J., Tilse, A., Keogh, J., Pentz, R. J. Comparative studies on the toxicity of mercury, cadmium, and copper toward the isolated perfused rat liver. J. Toxicol. Environ. Health Part A. 47, 267-283 (1996).