Introduction
L'obiettivo dei metodi descritti è stato quello di sviluppare un protocollo di lavoro per confrontare i segnali di compiti multi-modali simili fMRI (risonanza magnetica funzionale) e fNIRS (funzionale spettroscopia nel vicino infrarosso). In particolare abbiamo cercato di sviluppare una procedura di imaging funzionale per l'uso con gli individui controindicati per le scansioni fMRI tradizionali causata dal tremore, discinesia, o più dispositivi impiantati. Mentre molti programmi di formazione e riabilitazione efficaci esistono per gli individui a rischio di caduta, non vi è alcuna conferma dei meccanismi neurali alla base dell'efficacia di questi programmi. Spesso, le persone che partecipano a questi programmi di formazione sono controindicati per i motivi citati. La nostra motivazione per questo studio è stato quello di determinare l'efficacia di funzionale spettroscopia nel vicino infrarosso (fNIRS) per determinare i modelli di attività cerebrale associata con un compito motorio naturalistico che coinvolge i movimenti di tutto il corpo. Obiettivi a lungo termine comprendono lo sviluppo di uno strumento per stalloney non solo paradigmi di apprendimento motorio, ma servono anche per confermare l'adeguatezza di fNIRS per una più ampia varietà di compiti che non sono possibili per eseguire in maniera naturalistica con metodi tradizionali.
attività fNIRS è già stato dimostrato essere altamente correlati (r = 0,77-0,94) per le regioni omologhe con fMRI (livello di ossigeno nel sangue a carico) BOLD registrazioni del segnale in studi limitati che misuravano fNIRS concorrenti e l'attività funzionale fMRI utilizzando classico dito psicologico e semplice toccando paradigmi 1-3. I risultati di questi studi confermano fNIRS è valido e affidabile per determinare l'attività corticale associata con un compito ambientale ridotto compatibile con fMRI. Tuttavia, fNIRS ha numerosi vantaggi rispetto fMRI come metodo neuroimaging. fNIRS, soprattutto, è molto meno sensibile al movimento artefatto di fMRI e permette ai soggetti di comportarsi come farebbero in un ambiente naturalistico in contrasto con gli studi fMRI che limitano paradig motorems 4. La precisione temporale associato fNIRS consente per la determinazione delle variazioni di funzioni di risposta neurali con maggiore granularità a causa della maggiore frequenza di campionamento. Infine, il costo di fNIRS è inferiore scansione fMRI e consente di studi da condurre a costi inferiori. Tuttavia, ci sono svantaggi di fNIRS rispetto alla fMRI compreso limitata profondità di penetrazione, risoluzione spaziale limitata, e più recentemente è stato dimostrato che alcuni fenomeni fisiologici come la pressione sanguigna, la frequenza cardiaca, e cuoio effetti del flusso sanguigno può introdurre falsi positivi al corticale segnale emodinamico 5-9. Mentre sono attualmente in fase di sviluppo una serie di metodologie e sviluppi hardware specifici per NIRS, tra cui l'elaborazione del segnale, hardware per fornire gradienti optode ad alta densità, è comunque importante sviluppare metodologie miste che permettano fMRI e procedure fNIRS di completarsi a vicenda.
Questo studio serve per verificareun metodo di fNIRS per determinare i meccanismi neurali coinvolti durante un compito di danza videogiochi naturalistico. Lo scopo dello studio era di confrontare l'attività in un centro di integrazione del cervello (il giro temporale superiore e centrale) tra un gruppo di individui ripreso utilizzando fMRI ad un altro gruppo di soggetti utilizzando una versione naturalistica del compito ripreso con fNIRS. Il nostro gruppo ha già esaminato questo settore con simili paradigmi di gioco interattivo e ha mostrato attività nel lobo temporale risponde ad entrambe le cromofori dell'ossigeno e de-oxyHb in conformità con le attivazioni corticali 10. Abbiamo anche già tentato di controllare gli artefatti sistemiche precedentemente mostrando risposte in questo settore sono modulati in ampiezza rispetto al carico corticale del compito e non risposte sistemiche relative all'attività stessa 11. Il giro temporale superiore e mezzo ha conosciuto l'attività associata con l'integrazione di stimoli sensoriali multimodali e noi abbiamo giàdimostrato questa zona ad essere attiva in Dance Dance Revolution (DDR) il gioco in studi pilota fMRI oltre ai nostri fNIRS pubblicazioni 10-12. La nostra ipotesi per lo studio era che l'attività funzionale in questo settore, come registrati utilizzando fNIRS sarebbe significativamente correlata con l'attività funzionale registrati usando fMRI in un protocollo gioco di ballo simile ma limitata.
Il protocollo qui descritto comprende come modificare un video gioco di ballo per essere usato come un paradigma di neuroimaging sia fNIRS e protocolli fMRI. Tuttavia, la procedura generale non è specifico per il paradigma del gioco del video gioco e potrebbe essere adatto per qualsiasi numero di compiti che non sono possibili ad esibirsi in vincoli di un protocollo fMRI, tra lingua e locomotore compiti. Questo protocollo illustra ulteriormente la procedura per utilizzare la specificità anatomica fMRI sviluppare specifiche regioni di interesse (ROI) che può essere ulteriormente studiato durante compiti mondo reale reale utilizzando fNIRS.
Protocol
Prima della partecipazione, tutti i soggetti fornire il consenso informato in accordo con le linee guida istituzionali. In questo caso, il protocollo è stato approvato dal programma di protezione umana istituzionale da Meiji University (Kanagawa, Giappone), Columbia University Medical Center (trasferito alla Yale School of Medicine per l'analisi dei dati), e Long Island University, Brooklyn Campus per questo studio.
1. Software e modifica hardware e sviluppo per neuroimaging funzionale (fMRI e fNIRS)
- Modificare il gioco Dance Dance Revolution (DDR) modificando i dettagli dei file di configurazione (.sm) utilizzando il clone open source di DDR, Stepmania, cambiare tempi, grafica e musica per la regione di interesse utilizzando studi fMRI prima di imaging fNIRS .
- Nel file .sm specificare le variabili: sfondo, musica, offset (avviare la musica al tempo di scansione), samplestart, samplelength, bpm, e bgchanges. Specificare la freccia pattErns per ciascuna misura nel file .sm definendo frecce per misura come valore di "1", "0" o "M". Definire sinistra, su, giù, destra o presse pulsanti per ciascuna misura. Usare "1" per una freccia, utilizzare "0", per il bianco, e l'uso "M" per una miniera nelle epoche di riposo.
- Utilizzando il gioco-canzone "Butterfly" (originariamente interpretato da Smile.dk e disponibile sul Dance Dance Revolution 3 ° Mix CD gioco originale per Sony PlayStation), permettono di giocare i soggetti con un disegno a blocchi alternati costruita sulle meccaniche di gioco, come modificato il file di configurazione .sm. Tempi alterni 30 sec di gioco con i periodi di riposo 30 sec con grafica di sfondo che indica al giocatore quando si gioca (verde), e quando per rilassarsi (rosso, Figura 1).
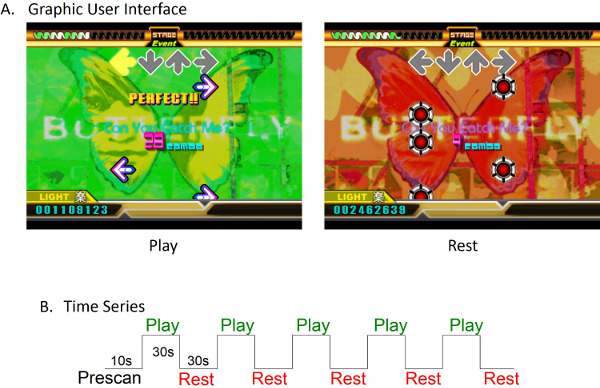
Ficoure 1:. Paradigm Design (A) DDR Graphic User Interface. Frecce nella parte inferiore della schermata spostato verso la parte superiore dello schermo. Queste frecce indicano ai soggetti quale pulsante da premere. Quando le frecce raggiunto l'area di azione superiore (frecce grigie nella parte superiore dello schermo), i soggetti hanno risposto premendo il tasto corretto. Tempo del gioco è stato indicato con uno sfondo verde. Tempo di riposo è stato indicato da uno sfondo rosso. Durante il tempo di riposo, le frecce sono stati sostituiti con animazioni "bomba". Questi non avevano funzione rispetto al gioco o il punteggio, ma sono stati usati per servire come supporto durante le epoche di riposo. (B) il disegno a blocchi utilizzato per la scansione era costituito da un totale di 5 minuti di gioco e di riposo epoche. La pre-scan è stato di 10 secondi di lunghezza, seguito da alternando 30 secondi di gioco e blocca riposare. Clicca qui per vedere una versione più grande di questa figura.
- Ripetere l'intervallo alternato cinque volte alla corsa per garantire la specificità in contrasto tra riposo e periodi attivi.
- In caso di raccolta di dati fMRI, limitare i movimenti di freccia sinistra e destra dei pulsanti presse a registrazioni di fMRI utilizzando i pulsanti del piede. Il numero complessivo di pressioni di tasti dovrebbe rimanere uguale per entrambe le attività (Figura 2).
- Prima della procedura di scansione, di spiegare i rudimenti del gioco per i soggetti e consentire soggetti qualche pratica corre prima di imaging. Istruire soggetti a premere il tasto corrispondente freccia con il loro piede più vicino al momento perfetto delineato nella parte superiore del percorso della freccia in movimento, ma per minimizzare il movimento della testa, per quanto possibile.

Figura 2:. Apparato sperimentale per fMRI (A) I soggetti si trovava nello scanner MRI, mentre observing nell'ambiente interattivo proiettata mediante uno specchio montato alla bobina testa sopra il soggetto. Figura 2B. Una pedana modificato costituito da due pulsanti permesso soggetti a rispondere con rubinetti punta a destra oa sinistra in tempo reale durante il gioco. Clicca qui per vedere una versione più grande di questa figura.
2. fMRI Testing and Analysis
- Ottenere un immagine strutturale per ogni soggetto prima di gameplay con un 3D imbarazzo sequenza gradient echo (SPGR) (124 fette, 256 x 256, il campo visivo = 220 mm), con un tempo di scansione totale di 10 min 38 sec.
- Ottenere funzionali immagini di risonanza magnetica durante la scansione utilizzando le seguenti impostazioni per planare eco (EPI) T2 * gradient pesate echo: echo time = 51 msec, ripetizione tempo = 3 sec, flip angle = 83 °. Acquisire 27 consecutivi immagini assiali fetta del cervello con le seguenti dimensioni: 192 x campo 192 millimetridi vista con una griglia di 128 x 128 di risoluzione totale di 1,56 x 1,56 millimetri e una risoluzione asse z di 4,5 mm.
- Istruire i soggetti di giocare gioco utilizzando il paradigma di cui sopra, ma utilizzando le frecce destra e sinistra solo per ridurre artefatti da movimento.
- Eseguire segnale BOLD fMRI analisi utilizzando SPM8 5, implementato in MATLAB 7.0.
- Eliminare i primi 10 secondi della serie EPI per ridurre al minimo il T2 * relax artefatto, dati funzionali sono moto corretto tramite il metodo dei minimi quadrati 6-parametro 'corpo rigido' di trasformazione del territorio.
- Normalizzare le scansioni EPI riallineati a MNI (Montreal Neurological Institute) modello che ha una risoluzione di 2 mm 3 seguito da smoothing spaziale con kernel gaussiano di 8 mm larghezza a metà massimo (FWHM).
- Eseguire a livello di materia analisi statistiche utilizzando il modello lineare generale (GLM) per creare mappe parametriche statistiche per confrontare la condizione attiva (DDR) confrontato con la condizione di riposo. </ Li>
- Eseguire l'analisi di gruppo con i singoli risultati utilizzando statistical parametric mapping standard (SPM) di secondo livello approccio effetti casuali. Ottenere regione di interesse sulla base dei risultati di analisi di gruppo con una soglia di p <0.01 e grappolo soglia dimensionale di 100 voxel.
- Definire la regione di interesse come la congiunzione tra il cluster funzionale e la maschera anatomica del giro temporale superiore e medio, ottenuto da strumento WFU PickAtlas 13,14
3. fNIRS Configurazione e acquisizione dati
- Utilizzare un sistema topografia fNIRS 22 canali per registrare i dati provenienti da optodes disposti in una matrice 3 x 5. La distanza inter-optode per ogni coppia sorgente-rivelatore è di 3 cm (Figura 3A, B).
- Posizionare il tappo elastico contenente la matrice di sensori ottici in modo che sia allineato dalla corteccia prefrontale sinistra al lobo temporale sinistro (figura 3A, B). Assicurare la optode nella fila più in bassonella posizione più anteriore è centrato sulla Fpz del sistema internazionale 10-10 15. Allineare la fila inferiore di optodes in parallelo alla linea tra punti di riferimento anatomici Fpz e T7.
- Stringere la matrice sonda ottica alla testa del soggetto e assicuro che sia ben fissato con le cinghie e il sottogola. Occorre prestare attenzione allo spostamento del optodes dalla superficie testa in modo che le coppie sorgente-rivelatore sono stretto alla testa, ma non a disagio per il soggetto (Figura 3C).
- Esempi grezzo optode analogico coppia sorgente-detector dati luce all'interno del computer a 7,9 Hz utilizzando l'interfaccia grafica utente di computer.

Figura 3:. Installazione optode per registrazioni NIRS (A) Il tappo è costituito da un foglio elastico dotato di plastica pieghevole accoppiato e holding 3 centimetri distanziati titolari optode. Cinghie sono montate sul tappo per permettere che sia saldamente montato alla testa. Il tappo è maggiore e consente una maggiore optodes rispetto al 3 x 5 array (mostrato in giallo) utilizzato in questo studio, ma è necessaria per fissarlo saldamente ai capi di soggetti. (B) Il tappo optode e posizionata sopra il prefrontale sinistra ai lobi temporali. Esempio del tappo optode sulla testa del fornire copertura oggetto di 3 x 5 array sull'area prefrontale sinistra al lobo temporale sinistro. (C) optode collocamento in berretto mostrando cap fissato a testa con le cinghie di serraggio e sottogola. Cliccate qui per vedere una versione più grande di questa figura.
- Calibrazione Test e potenza del segnale e rapporto segnale rumore utilizzando il software di controllo del sistema fornito dal produttore prima della registrazione. In caso di elevato rumore essere rilevato, roptodes imuovi e tutti i capelli interferire dal canale utilizzando un LED accesi asta di plastica (Figura 4).

Figura 4:.. Ottimizzazione dei segnali optode capelli è stata spostata da ciascun canale utilizzando uno strumento di plastica illuminato per spostare i capelli dal centro del canale per assicurare la qualità ottimale del segnale Clicca qui per vedere una versione più grande di questa figura.
- Utilizzare una penna digitalizzazione 3D per determinare valori spaziali delle posizioni di origine e rilevatore optode in ogni canale del cappuccio elastico. Utilizzare il digitalizzatore per identificare le coordinate spaziali di nasion, inion, atri e Cz di ogni soggetto subito prima della raccolta dei dati e il gioco (Figura 5). Salvare i file di testo con la fonte e rilevareo luoghi di others.txt e coordinate anatomiche di origin.txt file.

Figura 5:.. Calibrazione di posizione optode uno strumento di digitalizzazione magnetica è stata utilizzata per determinare il posizionamento di 10-20 punti di riferimento sulla testa e la posizione dei canali optode Clicca qui per vedere una versione più grande di questa figura.
- Processo coordinate 3D acquisita con l'opzione di registrazione in NIRS-SPM 16,17 all'interno di MATLAB 7.0 (Figura 6). Dal menu principale di SPM, pick stand-alone registrazione spaziale. Nella schermata successiva, selezionare "Con scanner 3D" e scegliere gli altri precedentemente salvati e file di testo di origine utilizzando la finestra corrispondente. Dalla finestra del software, scegliere l'opzione "Espletamentn (utilizzare la funzione NFRI) "per determinare rappresentazione spaziale

Figura 6:. Esempio di output dei dati di calibrazione NIRS dati digitalizzatore stata utilizzata per determinare la probabilità di ciascun canale in regioni specifiche del cervello. Canale 22 in questa materia ha mostrato una probabilità di 0,4129 in Medio temporale Gyrus, e 0,47419 in Superior temporale Gyrus. Il canale è definita dalla zona tra emettitore e rivelatore coppie. Il cerchio intorno al canale 22 in figura rappresenta un'approssimazione del territorio contribuendo al segnale registrato dalle coppie optode di questo argomento. Clicca qui per vedere una versione più grande di questa figura.
- Quando tutte le posizioni di programma optode sono digitalizzati e ciascun canale offre sla potenza del segnale ufficient come indicato nella grafica dell'interfaccia software fornita dal produttore, chiedere soggetti riposare e prepararsi per i test DDR (Figura 7A, B).

Figura 7:. Raccolta dati fNIRS durante il gioco di ballo (A) I soggetti stand per giocare utilizzando il paradigma blocco su una stuoia di gioco di ballo standard, mentre essere legato alla macchina NIRS. (B) vista alternativo di raccolta dei dati che mostra i dati grezzi su schermo sfondo raccolti in tempo reale da soggetto. Cliccate qui per vedere una versione più grande di questa figura.
4. fNIRS Data Collection
- Prima di impostare i fNIRS registrazione optodes, fornire i soggetti con una breve introduzioneal gioco e consentire la pratica per la familiarità con il gioco, come nei test fMRI.
- Per il test fNIRS, utilizzare un paradigma identica a quella del test fMRI, con l'aggiunta delle frecce su / giù rispetto al frecce solo destra e sinistra utilizzate per fMRI. Assicurarsi che il numero totale di freccia presse sono identici tra fMRI e fNIRS compiti e che solo il modello è diverso.
- Utilizzare un tappetino sistema di risposta Pulsante 4 standard per il gioco durante fNIRS test (Figura 7A).
- Una volta comodi nelle basi del gameplay, istruiscono i soggetti di giocare 30 volte secondi di gioco con i periodi di riposo 30 sec come al punto 1.2. Ripetere questo 5 min gioco due volte con ogni soggetto.
- Istruire soggetti specificatamente di non toccare la loro faccia o il naso, in particolare i loro capelli o la testa vicino alle optodes. Istruire i soggetti per ridurre al minimo i movimenti di rotazione, yawl o di catrame di testa durante il gioco.
5. fNIRS analisi dei dati
ΔoxyHb = -1,4887 × AAbs 780 + 0,5970 × AAbs 805 + 1,4847 × AAbs 830
ΔdeoxyHb = 1,8545 × AAbs 780 + (-0,2394) × AAbs 805 + (-1,0947) × AAbs 830
ΔtotalHb = ΔoxyHb + ΔdeoxyHb;
dove AAbs indica cambiamenti di assorbimento della luce alla lunghezza d'onda corrispondente.
6. Confronto di fMRI e fNIRS Segnali
- Utilizzare la funzione dei risultati in SPM8 per determinare voxel super-soglia a T> 2.6 o un corrispondente valore di P <0,01. Determinare la regione di interesse (ROI) utilizzando sovrapposti voxel super-soglia per definire un gruppo all'interno di una regione anatomica.
- In questo caso, definire i giro temporale superiore e medie con l'atlante AAL incluse nel pick WFU Atlas. In this caso, il cluster risultante ha 572 2 x 2 x 2 mm voxel situati nel giro temporale medio con un voxel picco a coordinate (-66, -24, 0) e il picco T = 5.73 fNIRS.
- Determinare il canale di interesse da dati fNIRS utilizzando 3D coordinate digitalizzati che vengono convertiti in coordinate MNI utilizzando NIRS-SPM nel passaggio 3.5.1. In questo caso, il canale 22 nella maggior parte dei soggetti ha avuto la più alta probabilità di attività nel ROI definita nella fase 6.1.
- Determinare la media, risposta su evento nella ROI per fMRI e il canale corrispondente in fNIRS per tutta la durata del 60 blocco sec (attiva e riposo, combinato).
- Per ogni soggetto, la media dei dipendenti (BOLD) segnali grezzi livello di ossigeno nel sangue per i voxel all'interno del cluster per generare evento fMRI attivato dati medi.
- Confronta fMRI e fNIRS scalando fMRI dati per abbinare in modo ottimale i dati fNIRS utilizzando una regressione lineare utilizzando fNIRS = b * fMRI, dove il metodo di regressione ottiene il valore b così that il valore quadratico medio di fNIRS -b * fMRI è ridotto al minimo.
- Confronta fNIRS e segnali fMRI per correlazione dei due gruppi.
Representative Results
I risultati dell'esperimento indicano l'attività ottenute da centri di integrazione nelle gyri temporale superiore e media utilizzando la risonanza magnetica funzionale (fMRI) hanno un'elevata correlazione funzionale per la spettroscopia nel vicino infrarosso (fNIRS) segnali formano la stessa area in versione naturalistica del compito . Figura 8 mostra i dati grezzi normalizzati e mediate da 16 soggetti dalla procedura fMRI scansione (traccia blu) e 26 soggetti del protocollo fNIRS (traccia rossa). I dati sono stati riposte al tempo 0 e la fase attiva di interazione gioco ha avuto luogo nel primo 30 sec del grafico (task etichettato). La linea verticale tratteggiata indica la transizione del verde a sfondo rosso nel compito e l'inizio della fase di riposo (indicata come riposo) Entrambi i set di dati mostrano aumenti risposte in fase attiva e declino nella fase di riposo con maggiore variabilità visto in il segnale fMRI. I confronti sono stati effettuati tra le tracce dal primo regressing il segnale fMRI per minimizzare la radice quadrata differenza media tra le due tracce. Il coefficiente di correlazione risultante tra i due segnali era 0,78 e il valore p per la correlazione era 0,03.
Figura 9 rappresenta un cervello di rendering con le posizioni dei canali sovrapposti da un unico soggetto. Una media di tracce da canali 1 e 22 sono indicati con linee continue rappresentano i segnali ossiemoglobina e linee che rappresentano segnali deossiemoglobina deluse. Rosso e blu rappresentano le tracce due variazioni sul gameplay, la musica e non la musica, rispettivamente. I segnali del canale 1 servono come esempio di controllo per confrontare con la regione di interesse. Segnali in queste due regioni si differenziano rispetto alla task-risposta.

Figura 8:. Correlazione tra fNIRS e segnali fMRI di Medio temporale Gyrus I fNIRS(Rosso) e fMRI (blu) i segnali sono riportati per ogni gruppo di ± SEM rappresentato da bordi sfumati. Il coefficiente di regressione tra i due è 0,78; p = 0,03. L'inserto mostra un rendering del ROI determinata dall'attività in fMRI con picco di attività a MNI coordinate (-66, -24, 0) con una dimensione di cluster = 571, picco t = 5.73. Cliccate qui per vedere una versione più grande questa cifra.

Figura 9: Le differenze a segnali nel temporale e lobi frontali Time-corso di ΔoxyHb (linea continua) e ΔdeoxyHb (linea tratteggiata) risposte di un singolo soggetto di due singole prove del gioco di ballo che mostra due condizioni "con la musica (rosso). "e" senza musica (blu) "condizioni. Questo dato è stato modificato da Ono et al. 10.
Discussion
fNIRS è una tecnica di imaging funzionale del cervello che ha la promessa di consentire lo studio dei correlati neurali di attività naturali. Lo sviluppo di queste tecniche è una direzione di ricerca attiva. Noi delineiamo qui una metodologia che è stata efficace per la registrazione di attività cerebrale funzionale in una singola regione di interesse associato con la partecipazione in un videogioco di ballo.
Il numero di pubblicazioni che indagano paradigmi di apprendimento del motore con fNIRS sono aumentati rapidamente negli ultimi anni con l'introduzione di fNIRS unità multicanale da Hitachi e Shimadzu (così come gli altri) in grado di registrare le attività funzionali in più regioni del cervello simultaneamente 20,21 . Abbiamo precedentemente dimostrato che è possibile determinare la specificità anatomica segnali fNIRS nonché ad utilizzare i segnali per determinare come le variazioni nei tempi e ampiezza dei segnali contribuiscono a prestazioni comportamentali di compiti motori
I risultati indicano una forte correlazione tra i gruppi per fNIRS e segnali fMRI in una zona di integrazione del lobo temporale e la correlazione tra i segnali è in linea con quella mostrata prima in concomitanti fMRI / fNIRS studi 3. Figura 9 indica che l'attività in fNIRS il lobo temporale, non è soltanto di natura corticale with oxy- differenziale e deoxyHb chromofore assorbanza, ma anche che l'attività nel lobo temporale è molto diverso da quello visto nel lobo frontale non correla con l'attività fMRI nel lobo temporale. Sottolineiamo alcuni aspetti critici dello studio che permettono ai dati di essere confrontati tra le due tecniche. Innanzitutto, la taratura delle posizioni optode stata delineata come una strategia chiave nel confermare anatomia e interpretazione dei risultati corticale. Le modifiche che abbiamo fatto di software e hardware ci ha permesso di sincronizzare il nostro paradigma con un protocollo di progettazione blocco ottimizzato per produrre forti risposte corticali in entrambe le procedure. Abbiamo anche delineare strategie chiave per garantire elevato rapporto segnale-rumore (depilazione dalla superficie optode) e la riduzione degli artefatti, tra cui il movimento e la stimolazione del viso (i soggetti sono stati appositamente istruiti a non toccare la testa o del viso).
Questi risultati e i risultati di precedenti studi che indagano fNIRS concorrenti / FMProcedure di imaging RI confermano una forte correlazione tra i segnali come teoricamente previsto 1-3. Un limite per l'interpretazione dei dati presentati è che siamo stati in grado di utilizzare nuove tecniche di ottimizzazione della registrazione NIRS che vederlo è possibile aumentare la risoluzione dei dati di canale individuali utilizzando le registrazioni ad alta densità. Questa tecnica ad alta densità è stata anche utilizzata per separare le componenti superficiali dai segnali corticale NIRS 27, oltre ad altre tecniche che rimuovono gli artefatti da pressione arteriosa, frequenza cardiaca e altre variabili sistemiche 6,7,28. E 'stato anche dimostrato che il posizionamento della sonda e chromaphore scelta può essere usato per controllare per i falsi positivi 29 e il filtraggio adattativo dei segnali NIRS può essere utilizzata efficacemente in caso di elevato rapporto segnale-rumore. Il compito che abbiamo assunto qui e in precedenza con sistemi NIRS commerciali con paradigmi presentati in blocco disegno 10,11ha prodotto dati con grandi segnali e non ha richiesto ulteriori tecniche di analisi o l'hardware per mostrare analogie tra segnali. Tuttavia, è possibile che i dati presentati qui potrebbe essere migliorata ulteriormente attraverso l'uso di queste e di altre tecniche di elaborazione del segnale in NIRS.
Metodologie attualmente in NIRS funzionale non sostituisce la necessità per la scansione fMRI; piuttosto, come suggeriamo qui, le due procedure di imaging (oltre a EEG e altri) possono essere utilizzate per completarsi a vicenda. Nel caso di un gruppo di individui che sono controindicati per la scansione fMRI, fNIRS possono rivelarsi l'unica tecnica praticabile per accertare i benefici di un programma di formazione, come i programmi di prevenzione dei rischi di caduta per le persone con malattia di Parkinson. Inoltre, fNIRS ha un certo numero di direzioni future che possono anche essere utilizzati per aggiungere informazioni al dettaglio anatomico fornito attraverso la scansione MR. Optodes ad alta densità di collocamento optode e l'aumento produrrà più altorisoluzione temporale che può essere utilizzato per la connettività e l'analisi delle componenti principali, nonché una maggiore accuratezza della modellazione segnale BOLD.
Disclosures
Spese di pubblicazione di questo articolo sono sponsorizzati da S himadzu.
Acknowledgments
Questa ricerca è stata sostenuta in parte dalle seguenti fonti di finanziamento: JSPS Grant-in-Aid per la ricerca scientifica (C) 25.350.642 (AT), un assegno di ricerca da Hayao Nakayama Fondazione per la Scienza e Tecnologia e Cultura (SS & YO), e un Salute Giochi assegno di ricerca da Robert Wood Johnson Foundation (Grant # 66729) (SB e JAN).
Materials
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Shimadzu OMM-3000 |  Shimadzu Shimadzu |
The OMM-3000 used in this study has been replaced by the LABNIRS | |
| Polhemus Patriot 3D Digitizer |  Polhemus Polhemus |
||
| GE Twin-Speed 1.5T MRI scanner |  General Electric General Electric |
The Twin-Speed 1.5 T scanner has been retired. A number of new scanners are available to replicate this procedure | |
| Software | |||
| Stepmania |  Stepmania Stepmania |
||
| Matlab |  MathWorks MathWorks |
||
| NIRS-SPM |  BISPL BISPL |
||
| WFU Pick Atlas |  ANSIR ANSIR |
||
References
- Heinzel, S., et al. Variability of (functional) hemodynamics as measured with simultaneous fNIRS and fMRI during intertemporal choice. NeuroImage. 71, 125-134 (2013).
- Cui, X., Bray, S., Bryant, D. M., Glover, G. H., Reiss, A. L. A quantitative comparison of NIRS and fMRI across multiple cognitive tasks. Neuroimage. 54, 2808-2821 (2011).
- Sato, H., et al. A NIRS–fMRI investigation of prefrontal cortex activity during a working memory task. Neuroimage. 83, 158-173 (2013).
- Piper, S. K., et al. A wearable multi-channel fNIRS system for brain imaging in freely moving subjects. NeuroImage. 85 (Part 1), 64-71 (2014).
- Funane, T., et al. Quantitative evaluation of deep and shallow tissue layers' contribution to fNIRS signal using multi-distance optodes and independent component analysis). NeuroImage. 85 (Part 1), 150-165 (2014).
- Tachtsidis, I., et al. Ch. 46. Oxygen Transport to Tissue XXX Vol. 645 Advances in Experimental Medicine and Biology. Liss, P., Hansell, P., Bruley, D. F., Harrison, D. K. , Springer. New York, NY. 307-314 (2009).
- Scholkmann, F., et al. A review on continuous wave functional near-infrared spectroscopy and imaging instrumentation and methodology. NeuroImage. 85 (Part 1), 6-27 (2014).
- Saager, R., Berger, A. Measurement of layer-like hemodynamic trends in scalp and cortex: implications for physiological baseline suppression in functional near-infrared spectroscopy). Journal Of Biomedical Optics. 13 (3), 034017-034017 (2008).
- Takahashi, T., et al. Influence of skin blood flow on near-infrared spectroscopy signals measured on the forehead during a verbal fluency task. Neuroimage. 57, 991-1002 (2011).
- Ono, Y., et al. Frontotemporal oxyhemoglobin dynamics predict performance accuracy of dance simulation gameplay: Temporal characteristics of top-down and bottom-up cortical activities. NeuroImage. 85, 461-470 (2014).
- Tachibana, A., Noah, J. A., Bronner, S., Ono, Y., Onozuka, M. Parietal and temporal activity during a multimodal dance video game: an fNIRS study. Neuroscience Letters. 503 (2), 125-130 (2011).
- Annual Society for Neuroscience Conference. Noah, J., Tachibana, A., Bronner, S. 2010 Nov 13-17, San Diego, CA, , (2010).
- Maldjian, J. A., Laurienti, P. J., Burdette, J. H. Precentral gyrus discrepancy in electronic versions of the Talairach atlas. Neuroimage. 21, 450-455 (2004).
- Maldjian, J. A., Laurienti, P. J., Kraft, R. A., Burdette, J. H. An automated method for neuroanatomic and cytoarchitectonic atlas-based interrogation of fMRI data sets. Neuroimage. 19, 1233-1239 (2003).
- Chatrian, G. E., Lettich, E., Nelson, P. L. Ten percent electrode system for topographic studies of spontaneous and evoked EEG activity. Am J EEG Technol. 25, 83-92 (1985).
- Okamoto, M., Dan, I. Automated cortical projection of head-surface locations for transcranial functional brain mapping. Neuroimage. 26, 18-28 (2005).
- Ye, J. C., Tak, S., Jang, K. E., Jung, J., Jang, J. NIRS-SPM statistical parametric mapping for near-infrared spectroscopy. Neuroimage. 44, 428-447 (2009).
- Cope, M., Delpy, D. System for long-term measurement of cerebral blood and tissue oxygenation on newborn infants by near infra-red transillumination. Medical and Biological Engineering and Computing. 26 (3), 289-294 (1988).
- Savitzky, A., Golay, M. J. Smoothing and differentiation of data by simplified least squares procedures. Analytical Chemistry. 36 (8), 1627-1639 (1964).
- Okamoto, M., et al. Multimodal assessment of cortical activation during apple peeling by NIRS and fMRI. NeuroImage. 21, 1275-1288 (2004).
- Suzuki, M., et al. Prefrontal and premotor cortices are involved in adapting walking and running speed on the treadmill: an optical imaging study. Neuroimage. 23, 1020-1026 (2004).
- Boas, D. A., Elwell, C. E., Ferrari, M., Taga, G. Twenty years of functional near-infrared spectroscopy: introduction for the special issue. NeuroImage. 85, 1-5 (2014).
- Holtzer, R., et al. fNIRS study of walking and walking while talking in young and old individuals. The Journals of Gerontology Series A: Biological Sciences and Medical Sciences. 66 (8), 879-887 (2011).
- Suzuki, M., Miyai, I., Ono, T., Kubota, K. Activities in the frontal cortex and gait performance are modulated by preparation. An fNIRS study. Neuroimage. 39, 600-607 (2008).
- Shimada, S., Hiraki, K., Oda, I. The parietal role in the sense of self-ownership with temporal discrepancy between visual and proprioceptive feedbacks. Neuroimage. 24, 1225-1232 (2005).
- Matsuda, G., Hiraki, K. Sustained decrease in oxygenated hemoglobin during video games in the dorsal prefrontal cortex: a NIRS study of children. Neuroimage. 29, 706-711 (2006).
- Gregg, N. M., White, B. R., Zeff, B. W., Berger, A. J., Culver, J. P. Brain specificity of diffuse optical imaging: improvements from superficial signal regression and tomography. Frontiers in Neuroenergetics. 2, 14 (2010).
- Kirilina, E., et al. The physiological origin of task-evoked systemic artefacts in functional near infrared spectroscopy. Neuroimage. 61, 70-81 (2012).
- Strangman, G., Franceschini, M. A., Boas, D. A. Factors affecting the accuracy of near-infrared spectroscopy concentration calculations for focal changes in oxygenation parameters. NeuroImage. 18, 865-879 (2003).



