Introduction
成功的肾移植肾功能衰竭的治疗在1955年首次被描述同卵双胞胎1之间,从那时起,它已成为患者在世界各地的终末期肾功能衰竭的一种革命性的治疗,提供了长寿命2质量均提高。但是长期移植物的存活已经阻碍了许多导致慢性移植物损伤3病理过程。
在人类的移植肾排斥仍发病率的主要原因,尽管在immunosupporessive方案显著改进。发展肾移植小鼠模型的目的是密切复制人类肾移植4中发现的过程和病理。 Skoskiewicz 等人首先描述肾移植的小鼠模型,1973年5。虽然先进的显微外科技巧是必需的,它是一个有价值的吨OOL有以下几个原因:小鼠基因组中已经得到很好的特点,并有很大的不同的实验方法和可用于小鼠实验技术。
使用肾移植的小鼠模型中的许多团体已经使用的移植肾的生命支持器官,但在其他研究中,并在我们所描述的受体小鼠的天然肾脏的方法1留在原位进行实验4的持续时间。这样做的好处是,鼠标经过一个单一的麻醉和手术从而降低了发病率的鼠标和死亡的第二个步骤的风险。此外,该鼠标不从逐步肾功能衰竭的不利影响受害。
虽然在其他器官,如心脏和皮肤存在异体排斥反应的模型,这并不总是直接相关的肾移植。有证据表明,这些模型引出不同的模式和dy排斥的动力学性能,例如拒绝在心脏同种异体移植物和肾移植的时间过程中的某些菌株的组合6显著不同。我们在BALB / c小鼠的捐助者说明移植肾急性排斥反应的模式到非转基因FVB / NJ小鼠,这种模式表现出与T细胞和巨噬细胞7积聚的细胞介导的损伤。另外,我们也描述了慢性移植物损伤模型,展示间质纤维化和肾小管萎缩,这将导致从移植肾的C57BL / 6 BM12捐助者到C57BL / 6受,因为这些小鼠的特点是一个单一的MHC II类基因位点错-match 8。
移植的多个方面使用肾移植的小鼠模型中,包括急性排斥反应,细胞免疫和体液排斥,局部缺血再灌注损伤,以及试用新治疗剂进行了研究。 我们已修改的手术吨echnique,以减少操作时间,提高了易用性手术。特别是我们所描述的同时供体和受体的准备,并利用连续的主动脉修补吻合简化的血管吻合技术。此视频稿件和提供的关键点在建立这种技术的帮助。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
适当的国家和地方机构的伦理应该在的地方进行动物实验前。具体而言,在英国进行了下列实验下的动物(科学程序)法1986如果两microsurgeons可同时操作的施主外科医生应该执行进行步骤1.1到1.16,然后3.1至3.5,而收件人外科医生进行2.1至2.8 。对于单个操作步骤可以顺序执行。
1,捐赠者准备
注:这里介绍的程序是供体C57BL / 6 BM12和收件人年龄8〜16周龄之间有体重大于20克C57BL / 6雄性小鼠。然而这个过程可以在各种小鼠品系可再现地进行。在代表性的结果部分给出的数据是从C57BL / 6,C57BL / 6 BM12和BALB / c小鼠获得的。
- 行为的程序使用设克无菌手术器械和耗材(灭菌),以努力保持工作区无菌越好。同时与收件人的准备如果两个医生都可以进行捐赠准备。
- 麻醉小鼠用美托咪定(0.5毫克/千克)和盐酸氯胺酮(200毫克/千克)的腹膜内注射(31G针)。这个结果在麻醉平面内保持4小时提供足够的时间用于整个过程被执行。补充麻醉是没有必要的。
- 确认鼠标麻醉(无回应脚趾捏)。
- 剃须鼠标的腹部,并移除任何松散的头发用一条胶带。
- 把鼠标放在其上的无菌披加热垫回来,松松固定用无菌遮蔽胶带四肢。
- 监控整个热烧伤的程序鼠标。如果可能的话使用非电热源。
- 敷上眼部润滑剂和SAnitize腹壁用稀碘溶液。
- 请在腹部进入腹膜腔,并插入一个3厘米宋体腹部拉钩正中切口。
- 适用于温热的盐水,以保持肠道和手术区域湿润,避免内脏不必要的干燥。
- 覆盖鼠标,用无菌巾和移动肠向操作者的左(小鼠的右侧),以暴露主动脉,腔静脉和左肾。
- 应用逐步加大钳子胃和优拉,露出大血管和左肾完全。包受潮无菌拭子(2毫米x 2毫米)到腹部缩回组织远离手术区,如肝叶,精囊,和肠。
- 隔离从周围的外膜,脂肪和左肾上腺在腹膜腔通过使用细尖镊子直截了当地解剖结缔组织左肾。把镊子的封闭技巧,网元之间的区域编辑要被分离并慢慢使钳子的提示开到解剖空间。
- 结扎,然后除以左肾上腺静脉与左性腺静脉9 / O的尼龙隔离左肾静脉。放置缝合靠近肾静脉。
- 结扎和分输尿管与7 / O丝线缝合靠近膀胱离开缝合结束漫长。这些长缝合线端部时,将使用的肾收获和所必需的输尿管吻合术。
- 要动员和优劣势,并全面剖析了主动脉和腔静脉至肾动脉和静脉用细尖镊子直言不讳地剖析淋巴管和脂肪血管的正面和侧面。
- 发现主动脉和腔静脉和慢慢扩散钳子之间的组织平面。慢慢打开细尖镊子的尖端传播以最小创伤的组织。
- 通过传递一个角度细绑在主动脉上,下到肾动脉松散7 / O丝血管周围的背面,并通过绘制缝合尖镊子。这些缝合之前将肾脏检索收紧允许威斯康辛大学解决方案逆行灌注。
2,收件人准备
按捐赠者准备的后续步骤1.2〜1.8。
- 将肠向操作者的权利(鼠标左键),以暴露主动脉,腔静脉。用无菌生理盐水浸湿棉签肠子。
- 结扎右肾动脉进行正确的性肾切除术,并与7/0丝线缝合静脉在一起,然后分开。
- 结扎右侧输尿管有7 / O的丝线和鸿沟。
- 动员和如在步骤1.14和1.15中所述完全解剖主动脉和下腔静脉的肾动脉和静脉。确保主动脉和腔静脉之间的完全切除。小心保护它运行到前腔静脉和aort的精索内动脉à随着淋巴丛。
- 确定在从腔静脉和静脉脊柱腹膜后运行腰椎血管,结扎带9 / O蚕丝中的连续性,也没有必要分割的血管。
- 确定有足够的空间来放置微血管钳与血管吻合之间的空间。
- 管理通过阴茎背静脉静脉注射肝素(5台)。
三体肾检索
拧紧7 / O丝束已经周围放置劣和优越主动脉分离从动脉循环的肾脏。
- 逆行注入冷0.2 - 0.5毫升威斯康辛大学液用针(31G)进入主动脉。
- 分缝线内主动脉和划分肾静脉在其与腔静脉交界以除去肾和肾动脉和主动脉的长度。分从主动脉而产生腰部容器,如果它们存在,瓦特ithout结扎。
- 发生在冷盐水肾脏在培养皿无菌棉签。
- 安乐死的供体小鼠颈椎脱位。
4,肾移植 - 肾准备
- 通过纵向直接除以主动脉壁的肾动脉对面创建主动脉修补。确定在补丁任何容器流明需要被连接或避免在执行动脉吻合时。
- 将来自外部10 / O的缝合肾静脉管腔优和第二分别缝合下方内侧。缝线用于划分肾上腺静脉和性腺静脉可用于定向的容器。
- 将在收件人( 图1.1)的右侧肾脏,确保缝线都处于有利地位,以保证血管吻合,而不变得纠缠在棉签或其他工具的缝线完成。
5,肾Transplan塔季翁 - 血管吻合术
应用微血管夹下方先优后包围腔静脉和主动脉。
- 请用针(31G)穿刺的腔静脉前墙ventomy。从腔静脉注射约50微升的0.9%NaCl冲洗血液。
- 用细尖镊子由venotomy中打开它们,这样的长度相当于供体肾静脉的直径扩大venotomy。
- 将10 /输出卓越的缝合(这已经是在肾静脉腔)首次在venotomy( 图1.2)的顶点,并加入了连续缝合吻合口后壁,直到劣顶点到达( 图1.3)。
- 将10 / O的劣质缝合并用单结( 图1.4)先绑然后从后墙绑在连续缝合。
- 使用劣质缝线营造正面沃尔玛升吻合( 图1.5),用连续缝合,并配合上级缝合月底在上级顶点( 图1.6)。
- 创建一个织脉切开术通过拿起主动脉壁与钳和切割用剪刀椭圆形片(约在织脉切开术应该是主动脉的周长和长度的三倍肾动脉管腔的五分之一)。
- 将10 / O的缝合处优越点的主动脉修补,从外到内( 图1.7),并通过主动脉在织脉切开术的优越顶点血管外打结。
- 创建动脉吻合了连续缝合起优( 图1.8)吻合的捐赠者的补丁给收件人主动脉,注意不要通过把缝线太紧( 图1.9),以收缩吻合。
- 取出劣质血管钳先则优于钳reperfuse肾脏(图1.10和1.11)。输尿管可见蠕动也许观察,如果充足的血液供应,输尿管实现。
6,肾移植 - 输尿管吻合术
- 划分膀胱任何附件从腹壁。
- 通过两个壁通过从左侧到膀胱的右边的针(21G)。
- 放置直钳子提示在针内腔,并同时通过回通过膀胱,使得镊子正从右到左出膀胱的左侧的传递。
- 利用通过使得所述输尿管通过在左膀胱缺陷然后出右侧的膀胱施主输尿管缝合。
- 缝合输尿管至膀胱的外膜的外膜与周围的入口点三个单间断缝合与9 / O尼龙缝线上的圆的健全针。
- 切输尿管近端结扎,从而揭开日ë输尿管允许尿液流动并允许输尿管端缩回到膀胱的主体。可见生产的尿可被与从周围输尿管血管出血观察沿。
- 关闭右侧气囊缺陷与单个中断9 / O的丝线。
7,恢复和术后护理
重新装上消化道内脏到原始方向的腹部和近似直肌与6 / O的可吸收线缝合关闭腹壁。
- 近似与金属皮肤片段的皮肤。
- 部分逆转了皮下注射atipamazole盐酸(10微升/克)的麻醉。
- 通过皮下注射盐酸丁丙诺啡(0.05毫克/千克)和用于流体支撑注射1毫升皮下的0.9%NaCl中施用镇痛。
- 恢复鼠标在变暖内阁在28℃,24〜48小时。观察小鼠的疾病达实验完成。
- 去除金属皮肤剪辑7 - 11天后操作性。
- 一旦试验完成安乐死的小鼠颈椎脱臼。
- 取出并收集对侧肾和移植的组织学分析。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
肾同种异体移植物排斥可以通过methacarn固定,石蜡包埋的组织的移植肾( 图2)的部分的组织学分析来评估。结果小鼠肾缺血再灌注损伤的同系之间的肾脏移植同基因移植,但4周肾小管已经恢复,并在组织学上相当于本地肾脏。急性排斥反应可以通过C57BL / 6肾移植到BALB / C收件人为蓝本,在1周内有与肾实质弥漫性单核细胞浸润,累及间质,肾小球和肾小管。慢性同种异体移植物损伤可以由C57BL / 6 BM12肾脏移植到C57BL / 6的收件人进行建模,这将导致在人体病理学由间质纤维化和肾小管逐渐丧失中的典型特征。每高倍场(×200倍)毛小管数允许的功能肾单位质量的定量( 网络gure 3),小管的亏损反映因拒绝肾小管损伤。纤维化可以使用泛胶原染色天狼猩红( 图4)进行识别。正常的内源性胶原被观察到的,但在慢性损伤的新的胶原蛋白沉积导致进行性纤维化。在慢性损伤变为周表观8和12之间移植后( 图5)。
甲显著学习曲线需要,以建立模型( 图6),以被克服。据估计,40的程序是在小鼠回收可重复血管吻合时间,免费并发症可接受生存期达到之前进行。最常见的原因实施安乐死的小鼠是由于后肢麻痹继发于下肢和脊髓缺血和动脉血栓形成有关,但是在我们的经验全身heparization减少这种发病率。小鼠常规MO根据终止实验本地商定的标准nitored。在学习曲线的平台期进行生存实验,导致了28.9±0.47分,平均血管吻合时间。
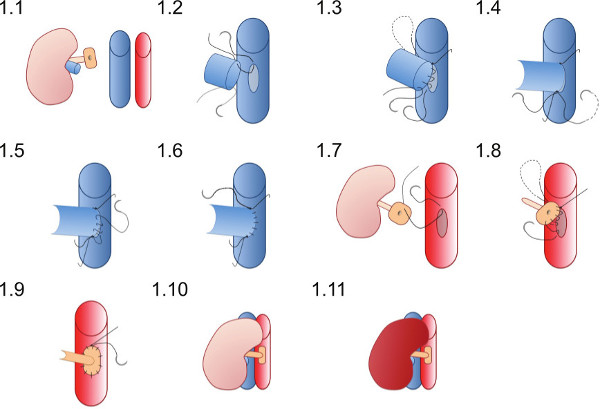
血管吻合技术的图1中的图解表示。供体肾脏被放置在受体小鼠的右侧腹。供体肾静脉吻合在端至端的方式和供体肾动脉在主动脉的补丁吻合到受体主动脉。

图2:代表肾小管病理损伤移植肾。固定在甲基Carnoyl的解决方案后,组织包埋于石蜡的4μm的鳍和组织切片进行苏木精和曙红染色。在4周后移植同基因移植的肾脏没有表现出肾小管损伤,可媲美在外观上本机的肾脏。 C57BL / 6 BM12的肾脏移植到BALB / C收件人接受急性排斥反应与弥漫性单核细胞浸润(*)和肾小管坏死(**)和小管炎。 C57BL / 6 BM12的肾脏移植到C57BL / 6的结果特点是血管周围淋巴细胞浸润(块箭头⬆)慢性移植物损伤和间质纤维化和肾小管萎缩(空心箭头⇧)。 请点击这里查看该图的放大版本。

图3:量化在TR肾小管损伤 ansplanted肾脏。健康小管(由一个完整的基底膜,完整的管腔,健康的细胞质体积和保持根尖微绒毛刷状缘的存在定义)反映正常肾单位质量可通过计数每场小管的平均数目来量化(X200倍率)组(n = 6,平均10个连续场的,** P <0.01)。

图4。慢性移植物损伤可以通过间质纤维化(代表图像)。胶原沉积鉴定中的移植肾脏是由检测胶原天狼猩红染色明显。 请点击这里查看该图的放大版本。
gure 5“SRC =”/文件/ ftp_upload / 52163 / 52163fig5highres.jpg“/>
图5定量间质纤维化。红色积极提高对C57BL / 6BM12天狼猩红测量间质纤维化⇒C57BL / 6受12周下移植组(n = 6,平均连续10场,** P <0.01,* P < 0.05)。

图6的学习曲线。在末梢麻醉小鼠的初步非回收实验进行开发的手术技术。其次是回收实验,实现了成功的重新灌注移植肾有幸存的鼠标,无并发症。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
最充分描述的方式来执行的动脉吻合术是使用供体的远端主动脉,与肾动脉中继续,在一个端部到另一侧的方式向收件人主动脉。我们描述了使用主动脉补丁,类似于人类肾脏移植,我们认为是比较方便执行的“Carrell补丁'镜像。虽然在供体和受体手术时间的文献报道是稀疏我们相信,利用端 - 侧供体主动脉的主动脉补丁到收件人主动脉而不是向收件人主动脉是优选的。使用补丁否定,要剖析的所有捐助者的腰动脉的分支,并且也采取了单独将它们连接起来的时候,由于吻合了一个补丁,自然不包括这些。
关键的步骤来实现这个模型,包括照顾,以确保没有其他动脉管腔比动脉修补吻合的内肾动脉等他们当微细血管夹被删除会泄露。构建anastamoses缝线可捆紧,但要注意的荷包效果,可以缩小吻合而导致缺血或阻止任何血液流量,在所提供的椭圆形织脉切开术的实用性,我们观察到的是一个具有相当规模的荷包效果是不是遇到过。该venotomy是用针,然后用钳子伸展扩大,我们相信这是最好的切割钳拉伸造成静脉组织可以很容易地看到和援助缝合环创造一个稳定的吻合。输尿管膀胱吻合是要考虑的重要组成部分,我们主张此处描述而非膀胱圆顶到膀胱重新构造已与尿漏和输尿管狭窄可能是由于局部缺血有关的技术。我们所描述的技术允许使用更短的供体输尿管长度,因为它是直接吻合的bladd呃5。通过利用这些技术的改进,我们已经能够显著减少的时间来完成该实验模型中所需的量。事实上,有两个运营商同时工作5移植受者每天可进行足够的时间,使复苏的老鼠和监控。
所描述的模型和方法在本文的一个主要限制是,在鼠标左边的原位其天然肾脏1,使得鼠标是不依赖于肾的存活。一些作者已经紧接在移植时或移植后五到十日内通知去除所述第二本地肾的,因而留下了鼠标依赖于移植肾。这将允许存活用作实验结果以及采样血液以测量肾功能的标志物,如血清肌酸酐或尿素。但是没有在组织学结果无差异小鼠比较依赖于移植和有一个原生肾9时。我们描述的协议并不排除此,实际上,第二本机肾脏可以在给定的时间间隔被删除。一个附加的限制是,先进的微外科专业知识是必需的,以便执行一个动脉和静脉吻合,尽管与训练和通过利用用于指令的技术数字这是可以克服的。血管并发症可发生,这是肾动脉或静脉血栓形成,这必然导致显示恶化的迹象,健康欠佳或特别后肢瘫痪的老鼠。因此,利用该模型时,严格的管理和监控小鼠势在必行。
肾移植急性排斥反应在很大程度上是由治疗和免疫诱导疗法耗尽外周血淋巴细胞,但细胞介导的排斥反应发作仍然会出现在整个肾移植生活。因此这背后的机制研究还针对性和可识别的新途径处理。在完全MHC错配,如C57BL / 6到BALB / c小鼠,平均存活依赖于肾移植已被报道为低至7.4天10。组织学急性细胞和血管性排斥反应可以通过淋巴细胞浸润,出血和水肿的间质,小管炎,血管炎,肾小球和肾小管坏死鉴别。合并过程有助于慢性移植物损伤作出这方面很难研究。组织学特征包括间质纤维化,肾小管萎缩,肾小球硬化和内膜增生。渐进损伤与持久性T细胞的浸润有关,然而,人们越来越认识到,许多其它因素可能参与。持续性伤害的潜在介导包括补体沉积,由于供体特异性抗体,B细胞,自然杀伤细胞,巨噬细胞和细胞固有的接枝如内皮3。因此,该模型可以拒绝这些不同方面的研究。
已经有利用此模型大约70发表的研究报告,尽管其早期的描述4,这是相较于肾缺血再灌注损伤的小鼠模型,其中已经有几百篇。腹内肾移植该小鼠模型的重要性在于,它直接再现人类肾脏移植的过程中,还受益于使用良好定义的近交小鼠品系中,可以被用来建模排斥的不同机制。因此,采用这种模式的研究具有很强的翻译。该模型的其他未来的应用包括通过移植肾脏与来自敲除模型的特定的表型为野生型小鼠或转基因相反地野生型肾脏研究内在肾异常改变收件人。
这个模型可以成功地复制人类肾移植的过程。利用近交系小鼠品系允许选择不同的MHC差异的供受体结合。此外,使用鼠标时,可以使用各种技术,包括基因敲除和诱导系统探测排斥反应的不同方面。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
作者什么都没有透露。
Acknowledgments
从肾脏研究英国资助,爱丁堡和器官移植的欧洲社会皇家外科学院赞助这项研究。
Materials
| Name | Company | Catalog Number | Comments |
| Surgical Instruments | |||
| Blunt Dissecting Scissors | Fine Science Tools | 14072-10 | For skin cutting |
| Curved Castoviejo scissors | Fine Science Tools | 15017-10 | For tissue cutting |
| Spring Scissors – straight | Fine Science Tools | 15000-08 | For suture cutting |
| Toothed forceps 1x2 teeth | Fine Science Tools | 11021-12 | |
| 2 x Fine Tip forceps (Dumont No.5) | Fine Science Tools | 11251-20 | |
| Angled Fine Tip forceps (Dumont No. 5/45) | Fine Science Tools | 11253-25 | For blunt dissecting |
| Curved Fine Tip forcep (Dumont No.7) | Fine Science Tools | 11273-22 | Useful to pass around vessels |
| Curved Crile Haemostat | Fine Science Tools | 1300-04 | |
| Micro clip applicator with lock | Fine Science Tools | 18056-14 | |
| 2 x Micro serrefines spring width 2mm, jaw length 4mm | Fine Science Tools | 18055-04 | Microvascular clamps |
| 2 x Colibri 3cm wire retractor | Fine Science Tools | 17000-03 | |
| Castroviejo needle holder with lock | Fine Science Tools | 120660-01 | |
| Wound clip applicator | Fine Science Tools | 12031-07 | |
| 7mm wound clips | Fine Science Tools | 12032-07 | Remove 7 to 10 days after surgery |
| Equipment | |||
| OPMI pico microscope | Carl Zeiss | S100 | |
| Thermal cautery unit with fine tip | Geiger | 150A | |
| Heat electronic pad | Cozee Cumfort | n/a | |
| Euroklav 23-S | Melag | n/a | Autoclave |
| Disposable equipment | |||
| 7/O Silk braided suture | Pearsall | 30514 | |
| 10/O Dafilon (polyamide) suture | B-Braun | G1118099 | |
| 6/O Vicryl (plygalectin) | Ethicon | W9537 | |
| Regular bevel needle, 1 inch, 21G | Bection, Dickinson and Company | 305175 | For ureteric anastamosis |
| Regular bevel needle, 5/8 inch, 25G | Bection, Dickinson and Company | 305122 | |
| Regular bevel needle, 1/2 inch, 30G | Bection, Dickinson and Company | 304000 | |
| Insulin needle 1ml, 29G | Bection, Dickinson and Company | 324827 | |
| Insulin needle 0.3ml, 30G | Bection, Dickinson and Company | 324826 | |
| 1 ml syringe slip tip | Bection, Dickinson and Company | 300184 | |
| 5 ml syringe slip tip | Bection, Dickinson and Company | 302187 | |
| Wypall paper swabs | Kimberley-Clark | L40 | sterilised by autoclave |
| Cotton wool buds | Johnson and Johnson | n/a | sterilised by autoclave |
| Plain drapes | Guardian | CB03 | sterilised by autoclave |
| Cell culture dish 60mm x 15mm | Corning Incorporated | 430166 | |
| Dispensing Pin | B-Braun | DP3500L / 413501 | Used with NaCl 0.9% |
| Re-agents and Drugs | |||
| (Lacri-Lube) White soft paraffin 57.3%, mineral oil 42.5% and lanolin alcohols 0.2% | Allergan Ltd | 21956GB10X | |
| (Videne) Povidone-iodine 10% | Ecolab Ltd | PL 04509/0041 | |
| (Vetalar V) Ketamine hydrochloride | Pfizer Animal Health | Vm 42058/4165 | 100mg/ml solution (dose 200mg/kg) |
| (Domitor) Medetomidine hydrochloride | Orion Pharma | Vm 06043/4003 | 1mg/ml (dose 0.5mg/kg) |
| (Vetergesic) Bupernorphine hydrochloride | Alsto Animal Health | Vm 00063/4002 | 0.3mg/ml (dose 0.05mg/kg) |
| (Antisedan) Atipamezole hydrochoride | Orion Pharma | Vm 06043/4004 | 5mg/ml (dose 2mg/kg) |
| University of Wisconsin Solution | Belzer Bridge to Life | n/a | dose approximately 500 microlitres/mouse |
| NaCl 0.9% | Baxter | FKE1323 | |
| Heparin Sulphate | non-proprietary | n/a | 5000units/ml (dose 5units/mouse) |
References
- Guild, W. R., Harrison, J. H., Merrill, J. P., Murray, J. Successful homotransplantation of the kidney in an identical twin. Trans. Am. Clin. Climatol Assoc. 67, 167-173 (1955).
- Wolfe, R. A., et al. Comparison of mortality in all patients on dialysis, patients on dialysis awaiting transplantation, and recipients of a first cadaveric transplant. N. Engl. J. Med. 341, 1725-1730 (1999).
- Nankivell, B. J., Alexander, S. I. Rejection of the Kidney Allograft. N. Engl. J. Med. 363, 1451-1462 (2010).
- Tse, G. H., Hughes, J., Marson, L. P. Systematic review of mouse kidney transplantation. Transplant International. 26, 1149-1160 (2013).
- Skoskiewicz, M., Chase, C., Winn, H. J., Russell, P. S. Kidney transplants between mice of graded immunogenetic diversity. Transplant. Proc. 5, 721-725 (1973).
- Zhang, Z., et al. Pattern of liver, kidney, heart, and intestine allograft rejection in different mouse strain combinations. Transplantation. 62, 1267-1272 (1996).
- Qi, F., et al. Depletion of cells of monocyte lineage prevents loss of renal microvasculature in murine kidney transplantation. Transplantation. 86, 1267-1274 (2008).
- Dang, Z., Mackinnon, A., Marson, L. P., Sethi, T. Tubular atrophy and interstitial fibrosis after renal transplantation is dependent on galectin-3. Transplantation. 93, 477-484 (2012).
- Jabs, W. J., et al. Heterogeneity in the Evolution and Mechanisms of the Lesions of Kidney Allograft Rejection in Mice. Am. J. Transplant. 3, 1501-1509 (2003).
- Lin, T., et al. Deficiency of C4 from Donor or Recipient Mouse Fails to Prevent Renal Allograft Rejection. Am. J. Pathol. 168, 1241-1248 (2006).



