Introduction
השתלת כליה מוצלחת לטיפול באי ספיקת כליות תוארה לראשונה בשנת 1955 בין תאומים מונוזיגוטיים 1, מאז זה הפך להיות טיפול מהפכני בחולים עם אי ספיקת כליות סופנית בכל רחבי העולם, המציע גם שיפור באורך ואיכות החיים 2. עם זאת הישרדות שתל לטווח ארוך כבר הקשתה על ידי מספר רב של תהליכים פתולוגיים וכתוצאה מכך לנזק של שתל כרוני 3.
דחיית הכליה המושתלת בבני אדם עדיין אחד גורמים עיקריים לתחלואה, למרות שיפור משמעותי במשטרי טיפול immunosupporessive. המטרה לפתח מודל עכבר של השתלת כליה היא לשכפל את התהליך ופתולוגיה מצא בהשתלת הכליה אנושית 4 מקרוב. Skoskiewicz et al. תואר לראשונה מודל העכבר של השתלת כליה בשינה 1973 5. למרות כישורי מייקרו מתקדמים נדרשים, זה לא יקרOOL מכמה סיבות: גנום העכבר כבר מאופיין היטב, ויש מגוון גדול של שיטות וטכניקות זמינות ללימודי עכבר ניסיוניים.
קבוצות רבות משתמשים במודל העכבר של השתלת הכליה השתמשו הכליה המושתלת כאיבר התומך בחיים, לעומת זאת במחקרים אחרים ובמתודולוגיה שלנו תיארה את אחת מהכליות הטבעיות של עכבר הנמען הושאר באתר לתקופת הניסוי 4. היתרון הוא שהעכבר עובר הרדמה ופעולה אחת ובכך להפחית את התחלואה לעכבר ואת הסיכון למוות מהליך שני. בנוסף העכבר לא סובל מתופעות הלוואי של אי ספיקת כליות הדרגתית.
למרות שמודלים של דחייה אלוגנאית קיימים באיברים אחרים, כגון לב ועור, אלה לא תמיד רלוונטיים ישירות להשתלת כליה. יש ראיות לכך מודלים אלה לעורר מצבים וdy שוניםnamics של דחייה, למשל הקורס של דחיית שתל בלב ושל שתל הכליה הזמן שונה באופן משמעותי בשילובי זן מסוימים 6. שתארנו דפוסי דחייה של שתל כליות חריפים בתורמים / ג BALB לעכברי FVB / ניו ג'רזי שאינן מהונדסים, מודל זה הראה פגיעה בתיווך סלולרית עם הצטברות של תאי T ומקרופאגים 7. לחלופין יש לנו גם תיארנו מודל של נזק שתל כרוני המציג סיסטיק ביניים וניוון צינורי, זה נובע מהשתלת כליה מC57BL / 6 BM12 תורמים לC57BL / 6 המקבלים, כעכברים אלה מאופיינים בmis לוקוסים בודד MHC class II -התאם 8.
היבטים רבים של השתלה נחקרו תוך שימוש במודל העכבר של השתלת כליה כוללים דחייה חריפה, דחייה סלולרית ולחות, פגיעת reperfusion איסכמיה, וtrialing סוכנים טיפוליים חדשניים. יש לנו שונה לא הניתוחייםechnique כדי לקצר את זמן הפעלה ולשפר את הקלות של ניתוח. במיוחד שתארנו תורם בו זמנית והכנת נמען וטכניקת השקה כלי דם פשוטה, תוך ניצול השקה תיקון אב העורקים רציפה. וידאו וכתב יד זה יספק נקודות מפתח כדי לסייע בהקמתה של טכניקה זו.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
אתיקה מוסדית מקומית ולאומית מתאימה צריכה להיות במקום לפני ביצוע ניסויים בבעלי חיים. באופן ספציפי בבריטניה הניסויים הבאים נערכו תחת בעלי חיים (הליכים מדעיים) Act 1986. איפה שתי microsurgeons זמין להפעלה בו זמנית מנתח התורם צריך לבצע צעדים 1.1-1.16 אז 3.1-3.5, בעוד מנתח הנמען מבצע 2.1-2.8 . למפעיל יחיד יכולים להיות אחרי הצעדים ברצף.
.1 תורם הכנה
הערה: ההליך שהוצג כאן הוא לתורם C57BL / 6 BM12 ונמען / 6 עכברי זכרי C57BL בגילים שבין 8 עד 16 שבועות ישנים עם משקל גוף גדול יותר מ20 גרם. עם זאת הליך זה יכול להתבצע reproducibly על מגוון רחב של זני עכבר. הנתונים שהוצגו בסעיף תוצאות הנציג הושגו מC57BL / 6, עכברי C57BL / 6 / ג BM12 וBALB.
- usin נהלי התנהגותמכשירים גרם סטרילי כירורגים ומתכלים (autoclaved), עם מאמצים כדי לשמור על אזור ההפעלה סטרילי ככל האפשר. בצע הכנת התורם בו זמנית עם הכנת הנמען אם שני מנתחים זמינים.
- להרדים את העכבר עם זריקת intraperitoneal (מחט 31G) של medetomidine (0.5 מ"ג / קילוגרם) וקטמין הידרוכלוריד (200 מ"ג / קילוגרם). תוצאות זה במטוס הרדמה שנשמרה במשך 4 שעות מתן מספיק זמן לכל התהליך שיש לבצע. הרדמה נוספת אינה הכרחית.
- ודא שהעכבר מורדם (לא תגובה לקמצוץ הבוהן).
- לגלח הבטן של העכבר ולהסיר כל שיער רופף עם סרט דביק.
- מניחים את העכבר על גבה על מזרן מחומם עטוף sterilely ורופף לשתק את הגפיים בנייר דבק סטרילי.
- לפקח על העכבר בכל ההליך לכוויות תרמיים. אם אפשר להשתמש במקור חום לא חשמלי.
- החל סיכה עין וsanitize דופן הבטן עם תמיסת יוד מהולה.
- לעשות חתך קו האמצע בבטן כדי להיכנס לחלל הצפק והכנס מפשק בטן 3 סנטימטר Calibri.
- החל מלוח חימם לשמור המעיים ואזור ניתוח לחים ולהימנע מייבוש מיותר של הקרביים.
- כסה את העכבר בסדינים מעוקרים ולהעביר את המעיים לשמאלו של המפעיל (מהימין של העכבר) כדי לחשוף את אב העורקים, וריד נבוב וכליות עזבו.
- החל מלקחיים הגבירו בבטן ולמשוך superiorly לחשוף את כלי המרכזיים וכליות עזבו באופן מלא. לארוז לח מטליות סטרילי (2 מ"מ x 2 מ"מ) לתוך הבטן לחזור מאזור הניתוח, כגון אונה של הכבד, שלפוחית זרע, ובמעי גס רקמות.
- לבודד את הכליות יצאו מadventia שמסביב, שומן ובלוטת יותרת הכליה השמאלית בחלל הצפק על ידי בוטות לנתח רקמת החיבור באמצעות מלקחיים קצה קנס. הנח את הטיפים סגורים של המלקחיים בין האזורים שneed להיות מופרד ומאפשר לאט הטיפים מלקחיים כדי לפתוח לנתח את המרחב.
- לבודד את וריד הכליה השמאלי על ידי ligating ולאחר מכן חלוקת שמאל וריד יותרת הכליה ווריד אשכים נשאר עם 9 / O ניילון. מניחים את התפר הקרוב לוריד הכליה.
- לקשור ולחלק את השופכן עם 7 / O תפר משי קרוב לשלפוחית השתן והשאיר את התפר מסתיים ארוך. קצות תפר ארוך אלה ישמשו כאשר הכליות שנקטפו ונחוצים להשקת ureteric.
- לגייס ולנתח את אב עורקים ונבוב באופן מלא superiorly ונחות מעורק הכליה ווריד להשתמש במלקחי קצה קנס לנתח בצורה בוטה כלים ושומן הלימפה מהחזית והצדדים של כלי הדם.
- מצא את מטוס הרקמות בין אב העורקים והווריד נבוב והתפשטו לאט המלקחיים. לאט לאט לפתוח את קצות המלקחיים הקנס היטה כדי להפיץ את הרקמה עם טראומה מינימאלית.
- לקשור 7 / O משי רופף סביב אב העורקים עליונים ונחותים לעורק הכליה על ידי העברת קנס בזוויתמלקחיים קצה סביב החלק האחורי של כלי השיט וציור תפר דרך. תפרים אלה התהדקו לפני שליפת כליה כדי לאפשר זלוף המדרדר של אוניברסיטת ויסקונסין פתרון.
.2 נמען הכנה
לפי מעקב הכנת תורם צעדים 1.2-1.8.
- הזז את המעיים לזכותו של המפעיל (משמאל של העכבר) כדי לחשוף את אב העורקים, וריד נבוב. כסה את המעיים עם ספוגית טבולה תמיסת מלח סטרילית.
- לבצע כריתת כליה תקין על ידי ligating עורק הכליה הימני ווריד יחד עם 7/0 תפר משי ולאחר מכן לחלק.
- ולקשור את השופכן תקין עם 7 / O תפר משי ומתחלקים.
- לגייס ולנתח באופן מלא את אב העורקים ונבוב נחות לעורק ווריד הכליה כמתואר בשלב 1.14 ו1.15. להבטיח לנתיחה מלאה בין אב העורקים והווריד נבוב. דואג לשמר את עורק הזרע הפנימי אשר פועל קדמית לווריד הנבוב וaortיחד עם חבילת הלימפה.
- לזהות כלי המותני פועלים בretroperitoneum מהווריד הנבוב ווריד לעמוד השדרה, ולקשור עם 9 / O משי בהמשכיות, אין צורך לחלק את הכלים.
- לזהות מספיק מקום למקום מלחציים כלי דם עם רווח בין לanastomoses כלי דם.
- לנהל הפרין תוך ורידי (5 יחידות) דרך וריד פין גב.
אחזור כליות .3 תורמים
להדק את קשרי משי 7 / O שהוצבו סביב אב העורקים הנחות ומעולים לבודד את הכליות ממחזור הדם.
- להשרות 0.2 קר מדרדר - 0.5 מ"ל של תמיסת אוניברסיטת ויסקונסין עם מחט (31G) לאב העורקים.
- לחלק את אב העורקים בתפרים ולחלק את וריד הכליה בצומת שלה עם הווריד הנבוב כדי להסיר את הכליות ואת עורק הכליה באורך של אב העורקים. לחלק כלי המותני הנובעים מאב העורקים, אם הם קיימים, wקשירת ithout.
- מניחים את הכליות במלח קר על מקלון סטרילי בצלחת תרבות.
- להרדים את עכבר תורם נקע בצוואר הרחם.
הכנת כליות - השתלת כליה .4
- צור תיקון אב העורקים על ידי חלוקת קיר אב העורקים אורכים ישירות מול עורק הכליה. לזהות כל לומן כלי בתיקון שצריך ligated או להימנע בעת ביצוע ההשקה העורקים.
- הנח תפר 10 / O מחוץ אל פן לומן הכליה וריד superiorly ותפר נפרד שני inferiorly. התפרים המשמשים לחלק את וריד יותרת הכליה ווריד אשכים יכול לשמש כדי להתמצא הכלי.
- מניחים את הכליות באגף הימני של הנמען (איור 1.1) ולהבטיח את התפרים הם גם להציב כדי להבטיח ניתן להשלים anastomoses כלי דם ללא התפרים הופכים לובים זה בזה במטליות או מכשירים אחרים.
.5 כליות Transplantation - כלי הדם Anastomosis
החל מלחציים כלי דם ראשון inferiorly אז superiorly מקיפים את הווריד הנבוב ואב עורקים.
- הפוך ventomy עם מחט (31G) על ידי ניקוב הקיר הקדמי של וריד נבוב. דם סומק מהווריד הנבוב על ידי הזרקה כ 50 μl של .0.9% NaCl.
- להרחיב את venotomy באמצעות מלקחיים קצה קנס על ידי פתיחתם בתוך venotomy כך שהאורך שווה לקוטר של וריד הכליה התורם.
- מניחים את התפר מעולה 10 / O (שכבר נמצא בלומן של וריד הכליה) הראשונה בשיא venotomy (איור 1.2) ולהצטרף לקיר האחורי של ההשקה בתפר פועל עד שיגיע לשיא הנחות (איור 1.3).
- מניחים את התפר הנחותים 10 / O ולקשור ראשון עם קשר יחיד (איור 1.4) אז לקשור לתפר פועל מהקיר האחורי.
- שימוש בתפר הנחותים ליצור ול הקדמיl של ההשקה (איור 1.5) עם תפר ריצה ולקשור לקצה התפר מעולה בשיא מעולה (איור 1.6).
- צור aortotomy ידי הרמת קיר אב העורקים עם מלקחיים וחיתוך תיקון סגלגל עם מספריים (כ aortotomy צריך להיות חמישי מההיקף של אב העורקים ושלוש פעמים לומן עורק הכליה באורך).
- הנח תפר 10 / O בנקודה מעולה של תיקון אב העורקים מחוץ אל פנים (איור 1.7) ועובר דרך אב העורקים לקשור מחוץ לכולים בשיא מעולה של aortotomy.
- צור השקה עורקים עם תפר פועל החל superiorly (איור 1.8) anastomosing תיקון התורם לאב עורקי הנמען, לדאוג שלא להצר ההשקה על ידי קשירת התפר ההדוק מדי (איור 1.9).
- הסר את ווי התלייה כלי דם הנחות ראשון ולאחר מכן את המהדק מעולה לreperfuse הכליות (איור 1.10 ו1.11). תנועה פריסטלטית גלויה של השופכן אולי ראתה אם אספקת דם נאותה לשופכן מושגת.
.6 השתלת כליה - Anastomosis Ureteric
- לחלק כל קבצים מצורפים של שלפוחית השתן מדופן הבטן.
- עובר מחט (21G) מהשמאל לימין של שלפוחית השתן דרך שני הקירות.
- הנח טיפים מלקחיים ישרים בלומן המחט ולהעביר את שני בחזרה דרך שלפוחית השתן כך שהמלקחיים כעת עוברים מימין לשמאל מהצד השמאלי של שלפוחית השתן.
- צייר את התפר בשופכן התורם דרך שלפוחית השתן כך ששופכן עובר בפגם בשלפוחית השתן השמאל אז מתוך הצד הימני.
- תפר את adventitia של השופכן לadventitia של שלפוחית השתן עם שלושה תפרי קטע יחידים סביב נקודת הכניסה עם 9 / O תפר ניילון במחט עגולה בעל גוף.
- חותך את הפרוקסימלי השופכן לקשירת ה, ובכך פתחהשופכן דואר כדי לאפשר שתן לזרום ולאפשר סוף השופכן לחזור לתוך הגוף של שלפוחית השתן. ייצור גלוי של שתן יכול להיות שנצפה יחד עם דימום מפרי ureteric כלי.
- סגור את הפגם בשלפוחית השתן צד ימין עם תפר משי יחיד שהופסק 9 / O.
שחזור .7 וטיפול שלאחר ניתוח
החלף את הקרביים של מערכת העיכול לתוך הבטן בכיוון המקורי שלהם ולסגור את דופן הבטן על ידי קירוב שרירי rectus עם 6 / O תפר נספג.
- משוער העור עם קליפים עור מתכת.
- חלקית להפוך את ההרדמה עם הזרקה תת עורית של hydrochloride atipamazole (10 μl / g).
- לנהל שיכוך כאבים על ידי hydrochloride תת עורי עצירות (0.05 מ"ג / קילוגרם) ולהזרקת תמיכת נוזל 1 מ"ל של .0.9% תת עורית NaCl.
- לשחזר את העכבר בארון התחממות ב28 מעלות צלזיוס במשך 24 עד 48 שעה. שים לב לעכבר למחלה עדהשלמת הניסוי.
- הסר קליפים עור מתכת 7 - 10 ימי הודעה אופרטיבית.
- ברגע שהניסוי הושלם להרדים את העכבר על ידי נקע בצוואר הרחם.
- הסר ולאסוף את הכליה הנגדית ושל שתל לניתוח היסטולוגית.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
דחייה של שתל כליה ניתן להעריך על ידי ניתוח היסטולוגית של חלקי רקמות קבועות methacarn המוטבע פרפין של הכליה המושתלת (איור 2). השתלת Isograft של כליות בין תוצאות עכברי syngeneic בפגיעה reperfusion איסכמי כליות, אולם ב -4 שבועות tubules התאוששה ונמצאת בהיסטולוגיה דומה לכליות ילידים. דחייה חריפה יכולה להיות מודל על ידי C57BL השתלת כליה / 6 למקבלי BALB / ג, בתוך השבוע 1 יש חדירת תא mononuclear מפוזרת ברחבי parenchyma הכליות, מעורב interstitium, glomeruli וצינוריות. נזק של שתל כרוני יכול להיות מודל על ידי C57BL / 6 BM12 כליות הושתלו C57BL / 6 נמענים, זה גורם טיפוסי התכונות שנמצאות בהפתולוגיה אנושית המורכבת מסיסטיק ביניים ואובדן אבובית ההדרגתי. ספירת אבובית ברוטו לשדה רב עוצמה (הגדלה X200) מאפשרת כימות של מסת נפרון הפונקציונלי (Fiתרשים 3), אובדן של צינוריות משקף פציעה צינורי בשל דחייה. סיסטיק ביניים ניתן לזהות באמצעות אדום picrosirius כתם מחבת-קולגן (איור 4). קולגן אנדוגני הנורמלי הוא ציין, עם זאת בקולגן חדש נזק כרוני מופקד וכתוצאה מכך סיסטיק המתקדם. הנזק הכרוני הופך, לכאורה, בין 8 ו12 שבועות לאחר ההשתלה (איור 5).
עקום למידה משמעותית צריך להתגבר על מנת להקים את המודל (איור 6). 40 נהלים מוערכים בוצעו בעכברים התאוששו לפני שהגיע זמן השקה של כלי דם לשחזור עם מקובלת הישרדות ללא סיבוכים. הסיבה השכיחה ביותר להרדמת חסד העכבר הייתה עקב שיתוק גפיים האחורי המשני לגפיים תחתונים ואיסכמיה בחוט השדרה הקשורים לעורקים פקקת, אולם בheparization המערכתי הניסיון שלנו מפחיתה את השכיחות של זה. עכברים היו באופן שיגרתי מוnitored על פי קריטריונים מוסכמים באופן מקומי להפסקת הניסויים. ניסויי הישרדות שבוצעו בשלב הרמה של העקומה למידה הביאו זמן השקה של כלי דם ממוצע של 28.9 ± 0.47 דקות.
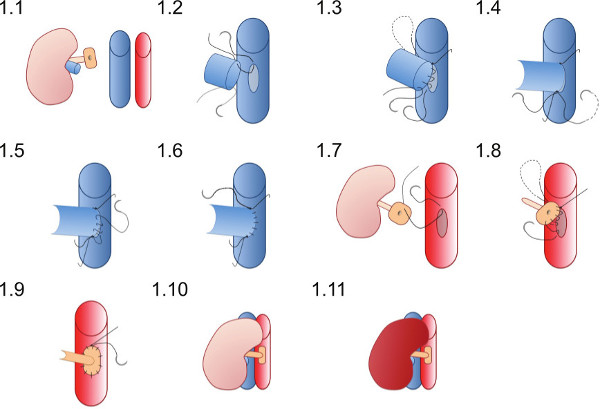
איור 1 ייצוג תרשים של טכניקת השקה כלי דם. הכליות התורמות ממוקמת באגף הימני של עכבר הנמען. וריד הכליה תורם anastomosed באופנה מקצה לצד ועורק הכליה התורם על תיקון של אב העורקים הוא anastomosed לאב עורקי הנמען.

איור 2 פציעת נציג היסטולוגית צינורי בכליה המושתלת. לאחר קיבוע ברקמות הפתרון של מתיל Carnoyl היו משובץ בparafחלקי סנפיר ורקמות של 4μm הוכתמו על ידי Hemotoxylin וEosin. ב 4 שבועות לאחר השתלת isograft כליות אינן מציגות פציעת צינורי ודומות לכליות ילידים בהופעה. C57BL / 6 BM12 כליות תושתלנה / ג BALB לעבור דחיית שתל חריפה עם מחלחל מפוזר תא mononuclear (*) וצינוריות נימקי (**) וtubulitis. C57BL / 6 BM12 כליות הושתלו C57BL / 6 תוצאות בנזק כרוני של שתל מתאפיין במחלחל perivascular ימפוציטית (חץ בלוק ⬆) וסיסטיק ביניים וניוון צינורי (חיצים חלולים ⇧). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 3 כימות פציעה צינורי בTR כליות ansplanted. tubules בריא (שהוגדרו על ידי הנוכחות של קרום שלם מרתף, לומן אבובית שלם, נפח cytoplasmic בריא וגבול מברשת microvilli הפסגה נשמר) משקפים המוני נפרון מתפקד ניתן לכמת על ידי ספירת המספר הממוצע של צינוריות לכל שדה (הגדלה X200 ) (N = 6, ממוצע של 10 שדות ברציפות, ** p <0.01).

איור 4 נזק שתל כרוני יכול להיות מזוהה על ידי סיסטיק ביניים (תמונות מייצגות). תצהיר קולגן בתוך הכליה המושתלת היא לכאורה על ידי זיהוי של כתמים אדומים picrosirius של קולגן. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
"Src =" תרשים 5 "/> / קבצים / ftp_upload / 52163 / 52163fig5highres.jpg
איור 5 כימות סיסטיק ביניים. סיסטיק ביניים שנמדד על ידי picrosirius חיוביות אדום מונף בC57BL / 6BM12 ⇒ C57BL / 6 מקבלי עשרה שבועות לאחר השתלה (n = 6, ממוצע של 10 שדות ברציפות, ** p <0.01, * p < 0.05).

עקומת למידה .6 איור. ניסויים הלא התאוששות ראשוניות בעכברים מורדמים סופני בוצעו לפתח הטכניקה הניתוחית. זאת בעקבות ניסויי התאוששות כדי להשיג בהצלחה מחדש perfused כליה מושתלת עם עכבר ששרד ללא סיבוכים.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
האופן ביותר המתואר היטב כדי לבצע את ההשקה העורקים הוא להשתמש באב העורקים הדיסטלי של התורם, עם עורק הכליה בהמשך, באופן מקצה לצד לאב עורקי הנמען. אנו מתארים את השימוש בתיקון אב העורקים, דומה לשיקוף 'Carrell תיקון' שבוצע בהשתלת כליה אנושית שאנו מאמינים שהוא נוח יותר. למרות דיווחים בספרות של תורם ואופרטיבי נמען זמן הם דלילים אנו מאמינים כי ניצול תיקון אב העורקים לאב עורקי נמען במקום אב העורקים תורם מקצה לצד לנמען אב העורקים הוא עדיף. באמצעות תיקון שולל את הצורך לנתח את כל ענפי אב העורקים התורם המותני, וגם את הזמן שלוקח וללקשור אותם באופן אישי, כanastomosing תיקון באופן טבעי אינו כולל אלה.
צעדים קריטיים להשגת מודל זה כוללים טיפול על מנת להבטיח שאין לומן עורקים אחר מלבד עורק הכליה בתוך ההשקה תיקון עורקים כפי שהםידלוף כאשר מהדק מיקרו כלי דם יוסרו. תפרי בניית anastamoses יכולים להיות קשורים בחוזקה אבל להיות מודעים להשפעת ארנק המחרוזת אשר יכול לצמצם את איסכמיה ההשקה והסיבה או לאסור כל זרימת דם, במעשיות שראינו שספקו את aortotomy הסגלגל הוא בגודל מספיק ארנק המיתרים ההשפעה לא נתקלה. Venotomy הוא עשה עם מחט אז התרחבה על ידי מתיחה עם מלקחיים, אנחנו מאמינים שזה עדיף על חיתוך כמו מתיחה עם מלקחיים יוצר טבעת של רקמת ורידים שניתן לראות בקלות ובתפירת סיוע ליצור השקה יציבה. ההשקה ureteric לשלפוחית השתן היא מרכיב מאוד חשוב להביא בחשבון, אנחנו דוגלים בשיטה שתוארה כאן ולא בשלפוחית השתן כיפה לבנייה מחדש בשלפוחית השתן שנקשר עם דליפת שתן והיצרות ureteric כנראה איסכמיה עקב. הטכניקה המתוארת שלנו מאפשרת אורך ureteric תורם קצר יותר לשימוש כפי שהוא anastomosed ישירות לbladdאה 5. על ידי ניצול שיפורים הטכניים אלה הצלחנו לצמצם את כמות הזמן הנדרשת להשלמת מודל ניסיוני זה באופן משמעותי. ואכן עם שני מפעילים לעבוד בו זמנית חמישה מושתלים יכול להתבצע בכל יום עם מספיק זמן כדי לאפשר התאוששות וניטור של העכברים.
מגבלה העיקרית של המודל שתואר וטכניקה במאמר זה היא שהעכבר נשאר עם אחת מהכליות המקוריות שלו באתר כך שהעכבר אינו תלוי בכליות להישרדות. חלק מהחברים דיווחו הסרת הכליה הילידים השנייה מייד בעת ההשתלה או חמישה עד עשרה ימים לאחר השתלה, ובכך עוזבים את העכבר סומך על הכליה המושתלת. היכולת זו תאפשר הישרדות כדי לשמש כתוצאה ניסיונית, כמו גם דם דגימה למדידת סמנים של תפקוד הכלייתי כגון קריאטינין בדם או אוריאה בדם. עם זאת, אין הבדל בתוצאות היסטולוגיתכאשר משווים עכברים תלויים בשתל ואלה עם כליה אחת האם של 9. הפרוטוקול שלנו תאר אינו מונע את זה ואכן בכליות ילידים השניה ניתן להסירו במרווח זמן נתון. מגבלה נוספת היא שמומחיות מיקרו כירורגית מתקדמת נדרשת על מנת לבצע את עורקים וורידי השקה, למרות שעם אימונים ועל ידי שימוש בדמות הטכנית להוראה זו ניתן להתגבר. סיבוכים בכלי הדם יכולים להתרחש, פקקת בעורק או וריד הכליה להיות אלה, זה תמיד גורם לעכבר בו מוצגות סימני מצוקה, בריאות לקויה או לייתר שיתוק אחורי גפיים. לכן ממשל וניטור של עכברים קפדן הכרחי כאשר ניצול מודל זה.
טופלה דחייה חריפה של השתלת הכליה במידה רבה על ידי לימפוציטים דיכוי חיסוני והמרוקנים טיפול אינדוקציה במחזור, אולם פרקים של דחייה בתיווך תא עדיין יכולים להתרחש בכל שתלי הכליהחיים. לכן מחקרים של המנגנונים שבבסיס זה עדיין רלוונטיים ויכולים לזהות מסלולים חדשים לטיפול. בחוסר התאמת MHC מלא, כגון C57BL / 6 לBALB / ג, אומר הישרדות תלויה בהשתלת הכליה כבר דיווחה להיות נמוך כמו 7.4 ימים 10. היסטולוגיה דחייה סלולרית וכלי דם אקוטי יכולה להיות מזוהה על ידי חדירה לימפוציטית, דימום ובצקת בinterstitium, tubulitis, וסקוליטיס, עם נמק גלומרולרי וצינורי. התהליכים בשילוב תרומה לנזק של שתל כרוני הפכו את האיזור הזה קשה ללמוד. התכונות היסטולוגית כוללות סיסטיק ביניים, ניוון צינורי, פקעיות כליה והתפשטות אינטימה. הפגיעה המתקדמת קשורה לחדירת תאי T מתמשכת, אולם זה הוא מוערך יותר ויותר כי גורמים רבים אחרים עשויים להיות מעורבים. מתווכי פוטנציאל של פגיעה מתמשכת כולל תצהיר משלים בשל נוגדני תורם ספציפי, תאי B, תאי הרג טבעיים, מקרופאגים, ותאים פנימיים לשתל כגון האנדותל 3. לכן מודל זה מאפשר הלימוד של אלה היבטים השונים של דחייה.
יש כבר כ 70 מחקרים שפורסמו ניצול מודל זה למרות התיאור המוקדם שלה 4, זאת בהשוואה לעכברי מודל של פגיעת איסכמיה reperfusion כליות שבו היו כמה מאה מאמרים. חשיבותו של מודל עכבר זה של השתלת כליה תוך בטן היא שזה ישירות משחזר את התהליך של השתלת כליה אנושית, יתר על כן היא נהנה מהשימוש בזנים טהורים עכבר מוגדר היטב שיכול לשמש מודל מנגנונים שונים של דחייה. לפיכך המחקרים באמצעות מודל זה הם תרגום מאוד. יישומים עתידיים אחרים של מודל זה כוללים לימוד מומי כליות פנימיים על ידי השתלת כליות עם פנוטיפים מסוימים ממודלים בנוקאאוט לעכברי wild-type או לחלופין כליות wild-type בגנטיהמקבלים שונים.
מודל זה יכול לשכפל בהצלחה את התהליך של השתלת כליה אנושית. השימוש בזנים טהורים עכבר מאפשר בחירה של שילובי תורם מקבל משתנה הבדלי MHC. יתר על כן השימוש בעכברים מאפשר שימוש בטכניקות שונות, כולל בנוקאאוט ומערכות מושרה לחקור את ההיבטים השונים של דחייה.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
יש לי המחברים אין לחשוף.
Acknowledgments
מימון מכליות המחקר בבריטניה, מכללת מנתחים המלכותית של אדינבורו והאיגוד האירופי להשתלות איברים נתמכות מחקר זה.
Materials
| Name | Company | Catalog Number | Comments |
| Surgical Instruments | |||
| Blunt Dissecting Scissors | Fine Science Tools | 14072-10 | For skin cutting |
| Curved Castoviejo scissors | Fine Science Tools | 15017-10 | For tissue cutting |
| Spring Scissors – straight | Fine Science Tools | 15000-08 | For suture cutting |
| Toothed forceps 1x2 teeth | Fine Science Tools | 11021-12 | |
| 2 x Fine Tip forceps (Dumont No.5) | Fine Science Tools | 11251-20 | |
| Angled Fine Tip forceps (Dumont No. 5/45) | Fine Science Tools | 11253-25 | For blunt dissecting |
| Curved Fine Tip forcep (Dumont No.7) | Fine Science Tools | 11273-22 | Useful to pass around vessels |
| Curved Crile Haemostat | Fine Science Tools | 1300-04 | |
| Micro clip applicator with lock | Fine Science Tools | 18056-14 | |
| 2 x Micro serrefines spring width 2mm, jaw length 4mm | Fine Science Tools | 18055-04 | Microvascular clamps |
| 2 x Colibri 3cm wire retractor | Fine Science Tools | 17000-03 | |
| Castroviejo needle holder with lock | Fine Science Tools | 120660-01 | |
| Wound clip applicator | Fine Science Tools | 12031-07 | |
| 7mm wound clips | Fine Science Tools | 12032-07 | Remove 7 to 10 days after surgery |
| Equipment | |||
| OPMI pico microscope | Carl Zeiss | S100 | |
| Thermal cautery unit with fine tip | Geiger | 150A | |
| Heat electronic pad | Cozee Cumfort | n/a | |
| Euroklav 23-S | Melag | n/a | Autoclave |
| Disposable equipment | |||
| 7/O Silk braided suture | Pearsall | 30514 | |
| 10/O Dafilon (polyamide) suture | B-Braun | G1118099 | |
| 6/O Vicryl (plygalectin) | Ethicon | W9537 | |
| Regular bevel needle, 1 inch, 21G | Bection, Dickinson and Company | 305175 | For ureteric anastamosis |
| Regular bevel needle, 5/8 inch, 25G | Bection, Dickinson and Company | 305122 | |
| Regular bevel needle, 1/2 inch, 30G | Bection, Dickinson and Company | 304000 | |
| Insulin needle 1ml, 29G | Bection, Dickinson and Company | 324827 | |
| Insulin needle 0.3ml, 30G | Bection, Dickinson and Company | 324826 | |
| 1 ml syringe slip tip | Bection, Dickinson and Company | 300184 | |
| 5 ml syringe slip tip | Bection, Dickinson and Company | 302187 | |
| Wypall paper swabs | Kimberley-Clark | L40 | sterilised by autoclave |
| Cotton wool buds | Johnson and Johnson | n/a | sterilised by autoclave |
| Plain drapes | Guardian | CB03 | sterilised by autoclave |
| Cell culture dish 60mm x 15mm | Corning Incorporated | 430166 | |
| Dispensing Pin | B-Braun | DP3500L / 413501 | Used with NaCl 0.9% |
| Re-agents and Drugs | |||
| (Lacri-Lube) White soft paraffin 57.3%, mineral oil 42.5% and lanolin alcohols 0.2% | Allergan Ltd | 21956GB10X | |
| (Videne) Povidone-iodine 10% | Ecolab Ltd | PL 04509/0041 | |
| (Vetalar V) Ketamine hydrochloride | Pfizer Animal Health | Vm 42058/4165 | 100mg/ml solution (dose 200mg/kg) |
| (Domitor) Medetomidine hydrochloride | Orion Pharma | Vm 06043/4003 | 1mg/ml (dose 0.5mg/kg) |
| (Vetergesic) Bupernorphine hydrochloride | Alsto Animal Health | Vm 00063/4002 | 0.3mg/ml (dose 0.05mg/kg) |
| (Antisedan) Atipamezole hydrochoride | Orion Pharma | Vm 06043/4004 | 5mg/ml (dose 2mg/kg) |
| University of Wisconsin Solution | Belzer Bridge to Life | n/a | dose approximately 500 microlitres/mouse |
| NaCl 0.9% | Baxter | FKE1323 | |
| Heparin Sulphate | non-proprietary | n/a | 5000units/ml (dose 5units/mouse) |
References
- Guild, W. R., Harrison, J. H., Merrill, J. P., Murray, J. Successful homotransplantation of the kidney in an identical twin. Trans. Am. Clin. Climatol Assoc. 67, 167-173 (1955).
- Wolfe, R. A., et al. Comparison of mortality in all patients on dialysis, patients on dialysis awaiting transplantation, and recipients of a first cadaveric transplant. N. Engl. J. Med. 341, 1725-1730 (1999).
- Nankivell, B. J., Alexander, S. I. Rejection of the Kidney Allograft. N. Engl. J. Med. 363, 1451-1462 (2010).
- Tse, G. H., Hughes, J., Marson, L. P. Systematic review of mouse kidney transplantation. Transplant International. 26, 1149-1160 (2013).
- Skoskiewicz, M., Chase, C., Winn, H. J., Russell, P. S. Kidney transplants between mice of graded immunogenetic diversity. Transplant. Proc. 5, 721-725 (1973).
- Zhang, Z., et al. Pattern of liver, kidney, heart, and intestine allograft rejection in different mouse strain combinations. Transplantation. 62, 1267-1272 (1996).
- Qi, F., et al. Depletion of cells of monocyte lineage prevents loss of renal microvasculature in murine kidney transplantation. Transplantation. 86, 1267-1274 (2008).
- Dang, Z., Mackinnon, A., Marson, L. P., Sethi, T. Tubular atrophy and interstitial fibrosis after renal transplantation is dependent on galectin-3. Transplantation. 93, 477-484 (2012).
- Jabs, W. J., et al. Heterogeneity in the Evolution and Mechanisms of the Lesions of Kidney Allograft Rejection in Mice. Am. J. Transplant. 3, 1501-1509 (2003).
- Lin, T., et al. Deficiency of C4 from Donor or Recipient Mouse Fails to Prevent Renal Allograft Rejection. Am. J. Pathol. 168, 1241-1248 (2006).



