Introduction
それらは食品又は食品接触面と器具1に病原体を広げることができるので、昆虫、食品関連疾患の伝達に重要な役割を果たしている。昆虫、ハエ、ゴキブリ、アリ食品媒介病原体の拡散を好む展示行動の中で。これらの動作は、減衰の問題との関連を含んで拒否し、糞、endophily(建物に入る)、およびsynanthropy(人間と同居)2。そのようなサルモネラなどの食中毒の病原体、 リステリア菌 、 カンピロバクター 、 大腸菌 O157:H7、および属クロノバクター属 (以前はエンテロバクター·サカザキ )のメンバーは、昆虫3-5によって送信されることが報告されている。 Synanthropic汚物は、汚染された身体の表面から病原体を転送することによって機械的に普及食中毒菌を飛ぶ。しかし、ハエの消化管における食品媒介病原体の存在は、3回までとすることができる自分の体の表面(ボディ、頭、脚、翼)5で観察されるものよりも大きい。食品媒介病原体は、体表面6,7に比べて時間の大きい長さのためのハエの消化管にとどまることができるといくつかの例では、それらが増殖することができます、ハエの消化管4,8,9に定着。彼らはさらに排便と逆流10,11を通じて食品媒介病原体を広げることができるので、これはハエのベクトルポテンシャルを向上させます。
今日では、より迅速に食中毒の発生を検出することができる改良された監視システムがある。食品媒介アウトブレイク調査を行っている間、公衆衛生当局は感染源(S)または車両であってもよい食品(S)を探してください。研究者らは、食品が汚染されていた方法を見つけるために関係する施設(または施設)の環境アセスメントを実施することができると調査12の一部としてのサンプルを収集することがあります。 Desp科学文献、食品媒介病原体のキャリアとしての昆虫に関する特定の食中毒の発生が挑戦している原因となる病原体のベクトルとして昆虫をリンクするの膨大な量をITE。昆虫は無菌的に食品媒介アウトブレイク調査時の環境サンプリングプログラムの一環として収集されていないので、これは主にです。昆虫、環境サンプリング手順は、単一の昆虫が所定の位置にする必要があるから、食品媒介病原体を検出するために、標準化された迅速、高感度かつ信頼性のあるプロトコルの一部として、食品媒介病原体の拡散を有利挙動を示すこと、特にそれらを含めます。
昆虫からの食品媒介病原体の検出のための従来のメッキ技術は面倒であり、昆虫の生得的な共生微生物の急速な成長を克服するために別の培養培地中の標的細菌の競争力の成長に依存。 BAに昆虫を関連付けた研究のほとんどcterial病原体は、一緒に、いくつかの昆虫をプールではなくごと個別に病原体の存在を同定することにより方法の感度が増加している。したがって、これらの研究は、病原体が13-18発見された昆虫の体の部分を区別しませんでした。これは、疫学的な意味を有していてもよいし、異なる緩和戦略につながる可能性がある食品媒介病原体を体表面に、または個々の昆虫の消化管に位置しているかどうかを同定する能力が重要である。機械的なベクターとしては、逆流および食品に排便ものハエは感染の潜在的に高いレベルで病原体を伝達する確率を増加させるのに対し、短時間食品土地のみ、自分の体の表面から細菌の低レベルを移すことが飛ぶ。したがって、個々の昆虫あたり食品媒介病原体の有病率を推定し、その昆虫、細菌のpの身体部分を区別することが重要である athogenが位置しています。
食品媒介病原体を検出するために培養非依存的方法の使用がますます実施されているにもかかわらず、それらは商業的に単一の昆虫からの食品媒介病原体を検出するために使用されていない。現在、業界や規制当局によって使用されている食品からの食品媒介病原体の迅速な検出のために市販されている検証済みの分子のプロトコルがあります。これらの方法は、食品サンプルの様々な病原体の検出のためのDNAベースのシステムを含む。分子のプロトコルは、従来のメッキ法よりも高速であるが、試料の濃縮は、依然として、ポリメラーゼ連鎖反応(PCR)に必要な細菌性病原体の10 2コロニー形成単位(CFU)に基づく方法19の感度レベルを得るために必要とされる。また、PCR陽性試料からの純粋な細菌コロニーの単離は、適切な方法を使用して病原体を確認するために必要とされる。
コンテンツ ">このプロトコルの目的は、体表面からの食中毒菌の検出および単ハエの消化管のための食品及び環境試料から病原体を検出し、さらにそれらを単離するために使用される市販のPCRベースのシステムを標準化することであるプロトコルのsamples.The感度からの病原体は、ここで説明した第1の実験的に各細菌性病原体の連続希釈を与えた実験室で飼育大人のイエバエ( イエバエ )で較正した。標準化されたプロトコルは、その後100野生捕獲を調査するために使用された自分の体の表面および/または消化管からの食品媒介病原体の存在のために飛ぶ。これは標準化されたプロトコルは、公衆衛生研究所の食品媒介を行う際に環境サンプリングプログラムの一部としてそれらを収集する可能性を考慮して、昆虫によってもたらされる健康上の脅威を検出することを可能にするアウトブレイク調査。Protocol
ハエの1コレクション
- 無菌昆虫学スイープネットを使用して、個々のハエを収集します。クーラーにネットを入れて、ラボに転送。
ハエの2解剖
- 7分 - 5 -20℃でそれらを配置することにより、無菌的に収集したハエを固定。
- 予め温めた(37℃)の緩衝化ペプトン水(BPW)1 mlを含む無菌の2mlチューブに滅菌ピンセットを場所1のフライを使用する。 2分間の反転により穏やかにチューブを混ぜる。これは、ハエの体表面(S)上に存在する微生物叢はBPW(BPW-S)に転送されるように、ハエの全身が媒体と接触することが必須である。ハエの数と身体の部分( すなわち、1S)でチューブにラベルを付けます。
注:このプロトコルに記載された材料および試薬の詳細な説明に特異的な試薬/機器の表を参照してください。 - 滅菌ピンセットを使用すると、BPW-Sメディアと転送からフライを削除空ときれいな2ミリリットルチューブにそれはハエの駆除表面に。消毒と解剖のプロトコルを実行しながら、37℃でBPW-Sメディアを含むチューブをインキュベートします。
- 新たに調製した0.05%(v / v)の漂白剤溶液1ml中に浸漬する前に、滅菌蒸留水ですすぎ、続いて1分間、70%エタノール、1ml中に浸漬してフライを表面消毒する。滅菌蒸留水で3回すすいでください。オートクレーブし2ミリリットルチューブに最後のすすぎの水を移す。
注:フライ、チューブの内側に残っていることを確認しながら、千μlのマイクロピペットを使用するか、チューブを反転させた液体を毎回捨てる。表面消毒プロセスの各段階での反転により穏やかに混合。 - 、消毒プロセスの有効性を評価するトリプチケースソイ寒天(TSA)プレートの最後のすすぎ水を100μlを転送し、無菌のL字型使い捨てスプレッダーを用いて拡散した。 24時間、37℃でプレートをインキュベート。イン後cubation、任意の細菌コロニーの存在を登録します。
NOTE:TSAプレート上の細菌コロニーの存在は、非効率的な表面殺菌プロセスを示す。この場合は、体表面および消化管間の交差汚染を排除することはできないため、食品媒介病原体の存在は、ハエの体表面に報告されるべきである。
- 新たに調製した0.05%(v / v)の漂白剤溶液1ml中に浸漬する前に、滅菌蒸留水ですすぎ、続いて1分間、70%エタノール、1ml中に浸漬してフライを表面消毒する。滅菌蒸留水で3回すすいでください。オートクレーブし2ミリリットルチューブに最後のすすぎの水を移す。
- ハエを表面が-消毒した後、過剰の水を除去した後、滅菌した60ミリメートルの使い捨てペトリ皿にするためにオートクレーブペーパータオルの一片に転送します。
- 解剖顕微鏡下でペトリ皿を置き、双翅目家族20,21のための二値キーを使用して、種レベルにフライを識別する。
- 穏やかに無菌的にハエから肛門および全消化管(A)を引くし、オートクレーブ先端の細い鉗子を使用すると、0.5ミリメートルのジルコニア/シリカに予め温めておいた(37℃)BPW 1 mlを含む別の無菌の2mlチューブに移すビーズ(BPW-A)。ラベル番目個々のフライとフライ( すなわち、1A)の身体部分のために選択したのと同じ数の電子管。
- 細胞破壊を用いて10分 - 5徹底的にBPW-Aを含むチューブを混ぜる。プロトコールの残りを行いながら36±1℃でインキュベートする。
- バウチャーおよび/または長期的試料を保存する、新しい2 mlチューブにハエの残りの部分を配置し、1追加する - 95%エタノール2 mlを。
3.プライマリおよびセカンダリ濃縮
- サンプル数とフライのボディ部によると、メディアを含むすべてのプライマリおよびセカンダリ濃縮管にラベルを付けます。
- 無菌フードの下では、次のメディアを含む2ミリリットルのチューブを無菌にするBPW-S(表面)の300μlのを転送する:
- サルモネラの場合は 、予め加温した(42℃)BPWの1ミリリットルを使用しています。 24時間 - 22 42.5℃の循環水浴中でインキュベートする。二次濃縮のために、400&#に濃縮されたBPW100μlのを転送181;予め滅菌クラスターチューブに入れ、予め温めた(37℃)ブレインハートインフュージョン(BHI)ブロスリットル。 3時間37℃でインキュベートする。
- クロノバクター属の場合は 、ノボビオシンに予め温めた(37℃)BPWの1ミリリットル(;ウォレス、M.、私信は10mg / L)を使用します。あるいは、一次濃縮などのサプリメント(バンコマイシンおよびセフスロジン)でR&F エンテロバクター·サカザキ濃縮培養液の1ミリリットルを使用しています。 26時間 - 22、37℃でインキュベートする。二次濃縮のために、以前に滅菌クラスターチューブに配置された予め温めた(37℃)BHIブロスの400μlにノボビオシンで強化しBPW100μlのを転送する。 3時間37℃でインキュベートする。
- L.のためにリステリア 、選択的なサプリメントで新たに調製したRT 24 リステリア増菌培養液(24 LEB)の1ミリリットルを使用しています。 44±5時間、37℃でインキュベートする。二次濃縮はLの検出に必要とされないリステリア 。 BPW-Aとしてラベルチューブを使用して、上記3.2.3 - を繰り返して、3.2.1を繰り返します。
ターゲット食中毒病原体の増幅および検出のためのPCRベースのシステムの4準備
ステップ4-8は、コンピュータ·ワークステーションを商業PCRサイクラー/検出器システムを使用し、すぐに使用できるキットは、 サルモネラ菌 ( サルモネラ 2標準アッセイキット)をスクリーニングするために、 クロノバクター属種(E.サカザキ標準アッセイキット)、およびリステリア·モノサイトゲネス(L.は 24Eアッセイキットリステリア )。標準的なアッセイは、PCR終点検出を使用しています。各キットには、二本鎖DNAに結合する際に蛍光シグナルを発する挿入色素を用いたPCR-準備錠が含まれています。信号が正または負のソフトウェアによって解釈される融解曲線を生成し、PCRシステムプログラムの検出フェーズ中に取得される。
- のmanufactuで指定された試薬および機器を準備各ターゲット食品媒介病原体当たりRERのプロトコル。
NOTE: サルモネラとクロノバクター属を検出するためのプロトコルは、Lを検出するためのプロトコルのに対して一段階溶解法を必要とするリステリア (それぞれ、セクション5および6を参照)は、2段階の溶解法を必要とする。 - 標的病原体のために特定のプログラムを選択する自動化された加熱ブロックをオンにします。 ( -ステップ6.2を参照してくださいLに溶解の一部2 リステリア用)と加熱ブロックが手動であれば別の方法として、(。 サルモネラのため、 クロノバクター属種、およびL.モノサイトゲネス )〜37℃または55±2℃までの温度を設定95±3℃。
- 少なくとも2時間8℃ - そうでなければ2でそれらを冷やし、冷却ブロックがO / Nを冷蔵されていることを確認してください。
- PCRベースの検出システムのコンピュータソフトウェアを使用して、製造者の指示に従ってラックファイルを作成。
- ラベルとクラスタを手配チューブは、ラックファイルに従って、ラック内の溶解試薬を含む。
- PCRベースの検出システム機器を初期化する。
5. サルモネラとクロノバクター属を検出するための溶解を実行します
- 溶解バッファーの1 12ミリリットルボトルにプロテアーゼ150μlのを追加することによって、溶解試薬を準備します。
- 以前にラベルクラスターチューブのそれぞれに溶解試薬200μlのを転送します。
注: - 最大2週間、8℃、溶解試薬を含むクラスタ·チューブは2で保存することができる。 - 長いピペットチップを使用して、溶解試薬200μlのを含むクラスターチューブを対応する(ステップ3.2.1と3.2.2を参照)、二次濃縮サンプルの20μlのを転送する。各サンプルのために新しいピペットチップを使用してください。
注:PCR陽性/陰性サンプルのさらなる確認分析のための冷蔵庫( サルモネラ )またはRT( クロノバクター属 )で一次および二次濃縮から管を保管してください。 溶解試薬200μlのを含むクラスタチューブに無菌のBHI培地20μlのを追加することによって、ネガティブコントロールを準備します。 - 溶解試薬200μlのを含むクラスターチューブに任意の既知のサルモネラやクロノバクター属菌株の(BHIで栽培)O / N細菌培養物の20μlのを追加することによって、ポジティブコントロールを準備します。
- キャップクラスターチューブと緊密にキャッピングツールを使用して固定します。
- 標的病原体のために特定のプログラムを選択した後、自動化された加熱ブロック中クラスターチューブのラックを配置します。代替的に、10分間、95±3℃でインキュベートし、20分間37±2℃、クラスターチューブをインキュベートする。 5分間 - (8℃2)最後に、ブロックを冷却するクラスターチューブを転送する。
注:ライセートを含むクラスターチューブは2週間まで-20℃で保存することができる。
6. L.を検出するための溶解を実行しますリステリア
- 一部のいずれかを実行としての溶解は、以下の通り:
- 完全に解凍した溶解剤1のボトルに滅菌脱イオン水の1.8ミリリットルを追加します。
注:ストアは2で剤1を溶解する - 使用する準備まで、8℃。開いて希釈した後、室温で店 - 最大6ヶ月間(20〜30℃)。 - 1の比率(各サンプルあたり剤2を溶解希釈した溶解剤40μlのは1と10μL):4のエージェント1と2を溶解結合します。クラスターチューブへの転送組み合わせた溶解剤を50μl。 4時間以内に混合物を使用してください。
- 主な濃縮されたサンプルの500μl加え組み合わせた溶解剤の50μlのを含むクラスタチューブに(ステップ3.2.3を参照)。
- 組み合わせた溶解剤の50μlに無菌の24 LEB500μlのを追加することによって、ネガティブコントロールを準備します。
- O / N Lの500μlのを追加してポジティブコントロールを準備しますリステリア文化が組み合わさ溶解剤の50μlに24 LEBで栽培。
- クラスターチューブに蓋を、穏やかに混合し、場所30分間37±1℃の加熱ブロック中。
注:PCR陽性/陰性サンプルのさらなる確認の解析のために冷蔵庫に主要濃縮から管を保管してください。
- 完全に解凍した溶解剤1のボトルに滅菌脱イオン水の1.8ミリリットルを追加します。
- 次のように溶解のパート2を実行します。
- ステップ5.1および5.2の指示に従って溶解試薬を準備します。
- 使用して長いピペットチップは、溶解試薬200μlのを含むクラスタ管に部品1の溶解物の20μlのを転送する。各サンプルのために新しいピペットチップを使用してください。
- キャップクラスターチューブと緊密にキャッピングツールを使用して固定します。
- L.ための特定のプログラムを選択する自動化された加熱ブロック中のクラスタチューブを入れるリステリア 。代替的に、10分間、95±3℃でインキュベートし、30分間55±2℃、クラスターチューブをインキュベートする。 5分間 - (8℃2)最後に、ブロックを冷却するクラスターチューブを転送する。
注:ライセートを含むクラスターチューブは2週間まで-20℃で保存することができる。
7.水和物PCR-レディ錠
- チルド(4℃)のPCR冷却ブロックを選択して、挿入の上にPCRチューブラックを配置。
- ラックファイルに従って、ホルダー内のターゲット食品媒介病原体のために(各キットに付属)PCR-準備錠を含むPCRチューブに対応置きます。
- 脱キャップツールを使用して、慎重にPCR-チューブからキャップを取り外します。キャップを廃棄し、各チューブは、タブレットが含まれていることを確認。
- 特定のPCRチューブに溶解物の転送( リステリア菌の場合)50( サルモネラとクロノバクター属の場合)μlあるいは30μlの。新たな光のキャップを使用して、キャッピングツールを使用してPCRチューブにしっかりと固定します。
注:PCR-準備タブレットに溶解液を添加した後、サンプルは2で冷やしたままでなければならない - PCRベースの検出システムにロードされるまで、8℃。 PCRチューブは、ボリューム全体が底トンにあることを保証するために数秒間、2500×gで遠心分離することができる彼はチューブ。 - 楽器の引き出しを開くことによって、PCRサイクラー/検出システムの機器にPCRチューブをロードします。
- 引き出しにウェルにPCRチューブのラックを配置し、チューブが正しく装着されていることを確認。
- 引き出しを閉じて、製造業者のプロトコルに記載されているように、プログラムを開始する。
注:PCRベースの機器は、それぞれの食品媒介病原体のためのサイクリングパラメータを事前に設定している。 - PCRサイクリングのステータスバーは、プログラムの増幅部分が実行されていることを示す青いバーが表示されていることを確認します。
注: - 完了に3.5時間、標準的なPCRアッセイのために、完全なプログラム(増幅および検出)の処理時間は、約3を取る。
8.結果
- 処理が完了すると、画面はサンプルとレビュー結果を除去するためのPCRベースのシステム機器からの指示に従います。
- ターゲット食品媒介病原体は、試料中に存在する場合(いずれか表面またはハエの消化管)ウェルは、プラス記号(正)と赤です。病原体が存在しない場合、ウェルは「マイナス」記号(負)と緑です。
- 井戸はセンター全体赤いバーのある黄色の場合、信号エラーを示します。
PCR陽性の結果から細菌性病原体の9の単離
- ( リステリア菌の場合)プライマリまたはセカンダリからのPCR陽性であったこれらのサンプルの濃縮( サルモネラとクロノバクター属の場合)を選択し、チューブ。 :PCR-陰性であったサンプルの5%と、以下のように進む - また、ランダムに3を選択
- サルモネラの場合:
- ラパポート·バシリアディス(RV)培地と(TT)ブロス四チオンの1ミリリットルの10ミリリットルに二次濃縮メディアの100μlのを追加します。 24時間 - 22のための再循環水浴中で42.5℃でチューブをインキュベートします。
- インキュベーション後、各ストリーク3ミリメートルの白金耳(10μL)、RV ANビスマス亜硫酸塩(BS)寒天、キシロースリジンデソキシコール(XLD)寒天上のD TTメディア、およびHektoenの腸溶性(HE)寒天。 24時間 - 22 35±1℃でプレートをインキュベートする。
- インキュベーション後、各メディア上の典型的なサルモネラコロニーの存在のためにプレートを調べます。孤立コロニーは、いくつかのサブ培養工程後に得られない場合は、PCRベースのシステムのための偽陽性を陰性と報告などの試料を検討する。
注:典型的なサルモネラのために特定のメディア上のコロニーが22を参照してください。 5推定典型的なサルモネラコロニーを選択して、孤立した/単一コロニーの純粋培養が得られるまで、BS、XLD、またはHEにそれらを継代培養。 - 1純粋なコロニーを選択し、製造者の指示に従って、そのようなVITEK 2識別カードまたはAPI生化学識別システムなどの生化学的、商業試験を使用して推定サルモネラを識別します 。
- クロノバクター属の場合:<OL>
- ストリークようなR&F エンテロバクター·サカザキ ( クロノバクター属 )発色性メッキ媒体、および/ またはChromID サカザキ寒天などの発色性培地の二つのプレート上の二次濃縮メディアの3ミリメートルの白金耳(10μL)。 24時間 - 22、35℃でプレートをインキュベートする。
- インキュベーションの後、典型的なクロノバクター属のコロニー(ブルーブラックブルーグレーに)の存在のためにプレートを調べます。 5推定クロノバクター属のコロニーを選択して、孤立した/単一コロニーの純粋培養が得られるまで、R&F エンテロバクター·サカザキ ( クロノバクター属 )発色性メッキ媒体、ChromID サカザキ寒天、またはTSA上にそれらを継代培養。
注記:孤立したコロニーは、いくつかのサブ培養工程後に得られない場合は、PCRベースの検出システムのための偽陽性を陰性と報告などの試料を検討する。 - 1純粋なコロニーを選択し、生化学コマーを使用して推定クロノバクター属を識別製造者の指示に従ってそのようなVITEK 2識別カードまたはAPI 20E生化学識別システムとして金融試験。
- ストリークブリリアンスリステリア寒天の二つのプレート上の主要な濃縮メディアの3ミリメートルの白金耳(10μL)(BLA)。 26時間 - 22 36±1℃でプレートをインキュベートする。
- インキュベーション後、推定L.の存在についてプレートを調べるリステリア (青緑色)コロニー。 5推定L.を選択リステリア コロニーと孤立/単一コロニーの純粋培養を得るまでBLAにそれらを継代培養。 26時間 - 追加の22のための36±1℃での負極板を再インキュベートする。
- 1純粋なコロニーを選択し、推定Lを識別するメーカーの私以下、そのようなVITEK 2識別カードまたはAPIリステリア生化学識別システムなどの商用生化学試験を使用することによりリステリアnstructions。
Representative Results
C.の- (10 8 CFU / mlの10 2)このプロトコルは、最初に実験的に連続希釈を含む液体フライ食品(2%の粉末ミルク)で24時間飼育した実験室で飼育イエバエのセットに校正したサカザキ、S.エンテリカ、L.リステリア 、またはC.ジェジュニ (N = 21、各細菌性病原体のために)。 PCRベースのシステムは、身体の表面および実験供給する単一の消化管からの細菌の最低レベル(10 2 CFU / ml)を検出することになるまで濃縮媒体、ならびにインキュベーションの時間および温度は、それぞれの食品媒介病原体のために調整した飛ぶ。プロトコルセクションに記載の濃縮培地および条件を用いて、PCRベースのシステムはCを検出サカザキ、S.エンテリカ 、及びL.細菌の接種材料> 10 3 CFU / mlである( 図1A)が供給されるハエの100パーセントの体表面からリステリア 。ハエは、10を与えたとき2 CFU / mlで、Cの検出の割合サカザキ、S.エンテリカ 、及びL.彼らの体表面からのリステリアは、それぞれ100%、66%、33%、( 図1A)であった。 PCRベースのシステムは、また、割合≥33%( 図1B)でのすべての細菌の濃度を与えたハエの消化管からこれら3食品媒介病原体を検出した。しかし、Cの検出実験室で飼育ハエが実験最高細菌接種(10 8 CFU / ml)を含む液体食品を与えたときジェジュニにのみ達成された。したがって、C.ジェジュニは 、このPCRベースの検出システムを使用して、個々のハエsynanthropic汚物から試験することができる食品媒介病原体の群から除外した。
この標準化されたプロトコルでは、我々はクロノバクター属属の有病率を決定することができました。、S.エンテリカ、及びL.体表面および/ または目のリステリア個別に無菌的ワシントン首都圏に位置して10都市のレストランの収集のエリアから摘発された100野生のハエのE消化管、DC 5収集された汚物のハエはM.を含む少なくとも6種の代表だったイエバエ (47%)、 ルシリアヒツジキンバエ(33%)、L.セリカータ(14%)、Cochliomyiaのmacellaria(2%)、ニクバエhaemorrhoidalis(2%)、及びOphyraのleucostoma(1%)。 Oneフライのみファミリーレベルに同定された(ハナバエ科; 1%)。表面消毒プロトコルは、細菌の増殖は、各個々のハエの最後の消毒すすぎ水のためのTSAプレート上で観察されなかったので、フライの身体部分との間の交差汚染を回避することに有効であった。このように、区別は、各ハエの体の部分に存在する食品媒介細菌の間で行うことができた。
偽陽性は、体表面のサンプルおよび消化管からは検出されなかった個々のハエS.の検出のためにこの市販のPCRベースのシステムを使用してエンテリカとL.リステリア 、寒天プレート上の生存可能な病原体の確認は、PCR陽性の結果と一致した。しかし、 クロノバクター属種の純粋培養物を単離することは不可能であった。全てのPCR陽性検体から。 PCRベースによるこの病原体のため、検出 (; 9/18 50%)及び消化管(48%; 33分の16)は、単一の野生捕獲ハエのシステムは、体表面からの偽陽性を示した。特定のメディア上にプレートしたランダムに選択されたPCR陰性サンプルは、食品媒介病原体が存在しないことを確認した。 クロノバクター属種を検出するために、この市販のPCRベースのシステムを使用する場合したがって、偽陰性サンプルのいずれからも検出されなかった。、S.エンテリカ 、またはL.リステリア 。
唯一の病原体が単離され、確認されたそれらのPCR陽性検体は陽性とみなしたと統計分析のために含まれています。野生捕獲汚物ハエの消化管における食品媒介病原体の全体的な存在は(DF = 1、P = 0.0087、χ2 = 6.8772)、体表面上よりも有意に高かった。消化管の22%、回収野生ハエの体表面の8%の三食品媒介病原体( 図2)の少なくとも1つについて陽性であった。全体的に、 クロノバクター属種の有病率。 S.の有病率よりも、体表面または収集されたハエの消化管のいずれかで(フィッシャーの正確確率検定p = 0.0165 19%)、統計的に高かったエンテリカ (7%)とリステリア菌 (4%)。各細菌性病原体( 図3のためのハエの体の部分の間の一対比較を行うときしかし、統計的な差異は観察されなかった。 クロノバクター属のためのフィッシャーの正確検定p = 0.1464、P = 0.1184およびp = 0.6212属、S.エンテリカ 、及びL.モノサイトゲネス 、それぞれ)。ハエのいずれも、評価され、3つすべての病原体について陽性であったなかった。しかし、ハエ(2 L.のヒツジキンバエと1 のL.セリカータ )を搭載してサルモネラ属菌の3。とL.表面上または消化管におけるリステリア 。
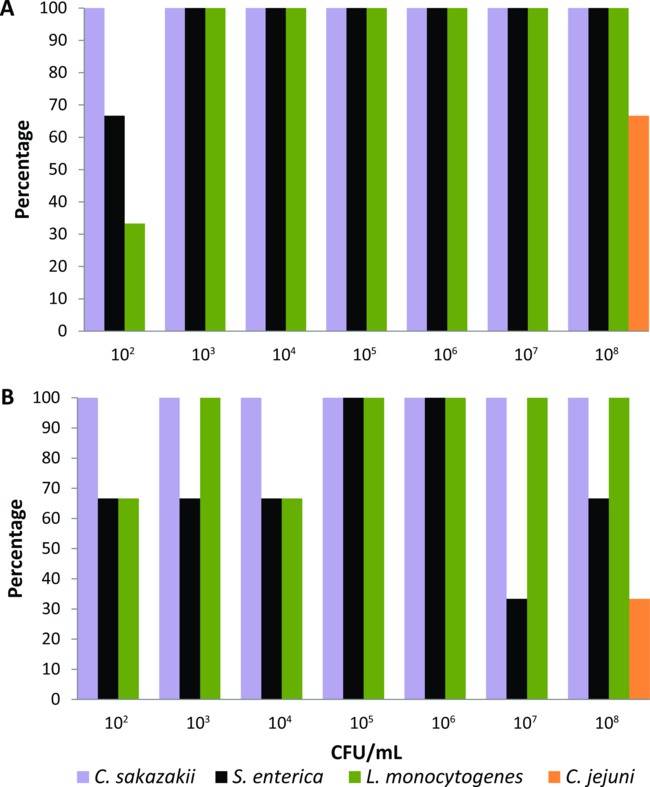
(A)は、本体表面と(B)の異なる細菌接種材料を含有する液体飼料を与えた個々の実験室飼育イエバエの消化管からクロノバクター属のサカザキ 、 サルモネラ菌、リステリア菌、およびカンピロバクター·ジェジュニの図1.検出レベル (N =各細菌性病原体のための21、N =各細菌濃度あたり3)。
ボディ表面および個々のハエの消化管の図2.パーセンテージは、ターゲット食品媒介病原体のいずれかのための肯定的な発見した。

クロノバクター属属の図3.有病率。、 サルモネラ菌、体表面からのリステリア菌とsynanthropic野生捕獲ハエの消化管。報告されたp値は、体表面と各細菌病原体のために消化管間の対比較からのものである(フィッシャーの正確確率検定、p値 <0.05は、統計的有意性を示す)。著作権©アメリカ微生物学会、応用のジャーナルと環境微生物学78(22):7891から902、2012、DOI:10.1128 / AEM.02195-12。
Discussion
野生の昆虫から食品由来の病原体を検出した以前の研究では、正確に食品や食品関連環境13,15内の単一のハエの存在の食品関連リスクを評価するために必要な情報が含まれない場合がありますプロトコルの多種多様を使用していた23,24。ここでは、この標準化されたプロトコルを使用して、それを検出し、 クロノバクター属種を単離することが可能であることを実証した。、S.エンテリカ、及びL.体表面と野生に巻き込まシングルハエの消化管からリステリア 。昆虫が標的食品媒介病原体の数が少ないと他の土着微生物25,26の高い番号を搬送することができるので、このプロトコルは、ターゲット食品媒介病原体の検出の感度を高めるために特定の培養培地中のサンプルの一次(時には二次)の濃縮を必要とする。 PCRベースの検出システムからの結果がDETEために(約30時間以内に得られた。クロノバクター属属の ction。とS.エンテリカ )と、当初のサンプルを処理した後() リステリア菌の検出のために48時間。したがって、このプロトコルは、信頼性、ならびに迅速および食品媒介病原体の存在のための単一のハエをスクリーニングするのに十分な感度である。
生菌のPCR陽性結果の確認および単離は、多くの研究室の標準操作手順の一部である。また、疫学のために、PCR陽性試料からの純粋な細菌培養物をさらに確認し、生化学的、免疫学的、または遺伝的方法を使用して、食品媒介病原体の血清型が要求される。 S.を検出する際に偽陽性は観察されなかったもののエンテリカとL.シングル野生捕獲ハエの体の部分からリステリアは 、このプロトコルを使用して、我々はクロノバクター属属のための偽陽性の50%の税率にまで見つけた。このことは、属CronobactためのPCRベースの検出システムERハエによって運ばれる非常に複雑な細菌叢の中に存在する他の腸内細菌と交差反応することができる。このように、PCR陽性検体から属クロノバクター属の純粋なコロニーの単離および精製は、評価した他の病原体よりも選択メッキを必要とする。
このプロトコルは、主にクロノバクター属種の存在について、個々の野生捕獲ハエをスクリーニングするために標準化されている。、S.エンテリカ、及びL.商業的PCRベースの検出システムを使用してリステリア 。しかし、このプロトコルはまた、容易にそのような腸管出血性大腸菌 O157などの他の食品媒介病原体の存在のために、単一のハエのスクリーン本体部分に適合させた:H7(いずれかの大腸菌 O157を使用して:H7 MP標準アッセイキット又はE.コリ O157:H7リアルタイムアッセイキット)と志賀毒素原性E.非公開大腸菌 (STEC)グループ(リアルタイムSTECスイートを使用)、取得感度> 80%(編データ)。また、このプロトコルは、潜在的疾患(ゴキブリ、アリ)のベクターが知られている他の昆虫からの食品媒介病原体を検出するように構成することができるが、この分野におけるさらなる研究が必要である。
食中毒アウトブレイクの調査は非常に動的であり、特定の状況及び12,27を検討されてローカル環境によって異なる場合があり、多段階のプロセスを含む。それらは将来の病気を予防することによって直ちに公衆衛生の保護を提供するため、これらの研究は重要である。さらに、これらの調査は、食品媒介微生物が広がっていることによって、新しい機構を解明し、研究28のための新しい分野につながる重要な問題を提起することができます。捜査技術ならびに標準化された迅速、かつ高感度なプロトコルは、個々の昆虫からの食品媒介病原体を検出するために必要である。この標準化されたプロトコルは、ワット、無菌的にハエのような虫を収集する機会を開くHICHは環境サンプリングプログラムの一環として、食品媒介病原菌をベクトルできます。このことから得ることができる疫学的情報は昆虫による食品媒介病原体の伝達のメカニズムの正確な状況を作成するのに使うであろう( すなわち、露光時間の長さ:、着陸ハエ対着陸排便、と吐き戻すことによってフライ)。
決して唯一の適切なシステムを意味することで、最終的に、ここで説明する商業PCRベースの検出システムで使用することは実用的であり、PCR増幅および属レベルのアンプリコンの可視化を簡素化にもかかわらず、それはない。濃縮されたサンプルからの溶解物は、あるいは公的に入手可能な種特異的プライマー対を使用して、食品媒介病原体の存在をスクリーニングするために使用することができる。しかし、検出感度は、それらの使用の前に実証されるべきである。
Materials
| Name | Company | Catalog Number | Comments |
| Bismuth sulfite (BS) agar | Fisher Scientific | R452402 | *Multiple suppliers. |
| Brain heart infusion (BHI) broth | Becton, Dickson and Company | 299070 | *Pre-warmed to 37°C. Multiple suppliers. |
| Brilliance Listeria agar (BLA) | Fisher Scientific | CM1080B | *Multiple suppliers. |
| Buffered peptone water (BPW) | Becton, Dickson and Company | 212367 | *Pre-warmed to 37°C or 42°C. Multiple suppliers. |
| Brilliance Cronobacter agar (Druggan-Forsythe-Iversen formulation/DFI) | Fisher Scientific | CM1055B | *Multiple suppliers. |
| chromID Sakazakii Agar | bioMérieux | 43741 | *Call for information: 800.682.2666 |
| R & F Enterobacter sakazakii (Cronobacter) Chromogenic Plating Medium | R & F Laboratories | Various | *Call for information: +1.630.969.530 |
| R & F Enterobacter sakazakiii Enrichment Broth and supplement | R & F Laboratories | Various | *Call for information: +1.630.969.530 |
| Hektoen enteric (HE) agar | Fisher Scientific | OXCM0419B | *Multiple suppliers. |
| 24 Listeria enrichment broth (24LEB) | Oxoid | CM1107 | *Freshly prepared at room-temperature. Multiple suppliers. |
| Listeria selective enrichment supplement | Oxoid | SR0243 | *Multiple suppliers. |
| Novobiocin | Fisher Scientific | OXSR0181E | *Multiple suppliers. Store at 2-8 °C |
| Vancomycin hydrochloride hydrate | Sigma Aldrich | 861987 | Store at 2-8 °C |
| Cefsulodin sodium salt hydrate | Sigma Aldrich | C8145 | Store at 2-8 °C |
| Rappaport-Vassiliadis (RV) medium | Fisher Scientific | CM0669B | *Multiple suppliers. |
| Tetrathionate (TT) Broth | Becton, Dickson and Company | 249120 | *Multiple suppliers. |
| Trypticase soy agar (TSA) | Becton, Dickson and Company | 236930 | *Multiple suppliers. |
| Xylose lysine desoxycholate (XLD) agar | Becton, Dickson and Company | 221284 | *Multiple suppliers. |
| API Biochemical identification system | bioMérieux | Various | *Call for information: +1.800.682.2666 |
| VITEK 2: Product Safety | bioMérieux | Various | *Call for information: +1.800.682.2667 |
| BAX System Q7 | DuPont | ||
| BAX E. sakazakii Standard assay kit | DuPont | D11801836 | |
| BAX L. monocytogenes 24E assay kit | DuPont | D13608125 | |
| BAX Salmonella 2 Standard assay kit | DuPont | D14368501 | |
| Capping tool | DuPont | D11677028 | |
| Decapping tool | DuPont | D11134095 | |
| PCR tube rack/holder | DuPont | D12701663 | |
| Featherweight forceps, wide tip | BioQuip | 4750 | Sterilize before use. Multiple suppliers. |
| Fine point, straight tip forceps | BioQuip | 4731 | Sterilize before use. Multiple suppliers. |
| Zirconia/silica beads, 0.5 mm | Bio Spec Products, Inc. | 11079105z | Multiple suppliers. |
| Petri dishes - 60X15mm | Fisher Scientific | 08-772B | Multiple suppliers. |
| Disposable inoculating loops, 10µL | Fisher Scientific | 22-363-606 | Multiple suppliers. |
| L-shaped cell spreaders | Fisher Scientific | 14-665-230 | Multiple suppliers. |
| Microcentrifuge tubes, 2 ml | Fisher Scientific | Various | Sterilize before use when needed. Secure lid is preferred. Multiple suppliers. |
| Cluster tubes | Fisher Scientific | 05-500-13 | |
| Cluster tubes caps | Fisher Scientific | 05-500-23 | |
| Sodium hypochlorite (Liquid chlorine bleach) | *Dilute to 0.05% with water. Multiple suppliers. | ||
| Sterile deionized water | Multiple suppliers. | ||
| Sterile distilled water | Multiple suppliers. | ||
| Ethyl alcohol 190 proof | *Dilute to 70% with water when needed. Multiple suppliers. | ||
| Genie cell disruptor, 120V - for 1.5ml and 2.0ml microtubes | Scientific Industries, Inc. | SI-D238 | Multiple suppliers. |
| Heating block | Multiple suppliers. | ||
| Cooling block | Multiple suppliers. | ||
| Recirculating water bath | Multiple suppliers. | ||
| Stereo microscope | Multiple suppliers. | ||
| Centrifuge | Multiple suppliers. | ||
| Incubator | Multiple suppliers. |
References
- Voeller, J. G. Wiley Handbook of Science and Technology for Homeland Security. , Wiley Inc. 1-16 (2008).
- Olsen, A. R., Gecan, J. S., Ziobro, G. C., Bryce, J. R. Regulatory action criteria for filth and other extraneous materials V. Strategy for evaluating hazardous and nonhazardous filth. Regulatory Toxicology and Pharmacology. 33 (3), 363-392 (2001).
- Hald, B., Skovgård, H., Pedersen, K., Bunkenborg, H. Influxed insects as vectors for Campylobacter jejuni and Campylobacter coli in Danish broiler houses. Poultry Science. 87 (7), 1428-1434 (2008).
- Kobayashi, M., et al. Houseflies: Not simple mechanical vectors of enterohemorrhagic Escherichia coli O157:H7. American Journal of Tropical Medicine and Hygiene. 61 (4), 625-629 (1999).
- Pava-Ripoll, M., Pearson, R. E. G., Miller, A. K., Ziobro, G. C. Prevalence and relative risk of Cronobacter spp., Salmonella spp., and Listeria monocytogenes associated with the body surfaces and guts of individual filth flies. Applied and Environmental Microbiology. 78 (22), 7891-7902 (2012).
- Hewitt, C. G. Houseflies and how they spread disease. , Cambridge University Press. (1912).
- Rochon, K., Lysyk, T. J., Selinger, L. B. Retention of Escherichia coli by house fly and stable fly (Diptera:Muscidae) during pupal metamorphosis and eclosion. Journal of Medical Entomology. 42 (3), 397-403 (2005).
- Greenberg, B., Kowalski, J. A., Klowden, M. J. Factors affecting the transmission of Salmonella by flies: natural resistance to colonization and bacterial interference. Infection and Immunity. 2 (6), 800-809 (1970).
- Mramba, F., Broce, A. B., Zurek, L. Vector competence of stable flies, Stomoxys calcitrans L. (Diptera:Muscidae), for Enterobacter sakazakii. Journal of Vector Ecology. 32 (1), 134-139 (2007).
- Ekdahl, K., Normann, B., Andersson, Y. Could flies explain the elusive epidemiology of campylobacteriosis. Bmc Infectious Diseases. 5 (11), 11 (2005).
- Nayduch, D., Noblet, G. P., Stutzenberger, F. J. Vector potential of houseflies for the bacterium Aeromonas caviae. Medical and Veterinary Entomology. 16 (2), 193-198 (2002).
- Multistate and Nationwide Foodborne Outbreak Investigations: A Step-by-Step Guide. , CDC. Atlanta, GA. Available from: http://www.cdc.gov/foodsafety/outbreaks/investigating-outbreaks/investigations/index.html (2013).
- Sievert, K., Messler, S., Klimpel, S., Feffer, K. Comprehensive study on the occurrence and distribution of pathogenic microorganisms carried by synanthropic flies caught at different rural locations in Germany. Journal of Medical Entomology. 46 (5), 1164-1166 (2009).
- Hernández-Escareño, J. J., et al. Presence of Enterobacteriaceae, Listeria spp., Vibrio spp. and Staphylococcus spp. in house fly (Musca domestica L.), collected and macerated from different sites in contact with a few animals species. Revista Cientifica-Facultad De Ciencias Veterinarias. 22 (2), 128-134 (2012).
- Mian, L. S., Maag, H., Tacal, J. V. Isolation of Salmonella from muscoid flies at commercial animal establishments in San Bernardino county, California. Journal of Vector Ecology. 27 (1), 82-85 (2002).
- Olsen, A. R., Hammack, T. S. Isolation of Salmonella spp. from the housefly, Musca domestica L., and the dump fly, Hydrotaea aenescens (Wiedemann) (Diptera:Muscidae), at caged-layer houses. Journal of Food Protection. 63 (7), 958-960 (2000).
- Holt, P. S., Geden, C. J., Moore, R. W., Gast, R. K. Isolation of Salmonella enterica serovar Enteritidis from houseflies (Musca domestica) found in rooms containing Salmonella serovar Enteritidis-challenged hens. Applied and Environmental Microbiology. 73 (19), 6030-6035 (2007).
- Mramba, F., Broce, A., Zurek, L. Isolation of Enterobacter sakazakii from stable flies, Stomoxys calcitrans L. (Diptera:Muscidae). Journal of Food Protection. 69 (3), 671-673 (2006).
- Koyuncu, S., Andersson, M. G., Haggblom, P. Accuracy and Sensitivity of Commercial PCR-Based Methods for Detection of Salmonella enterica in Feed. Applied and Environmental Microbiology. 76 (9), 2815-2822 (2010).
- Gagné, R. Insect and mite pests in food, an illustrated. 1, U.S. Department of Agriculture and U.S. Department of Health and Human Service. 269-296 (1991).
- Greenberg, B. Flies and disease, Vol I. Ecology, classification and biotic associations. , Princeton University Press. (1971).
- Wallace, H. A., Jacobson, A., Hammack, T. S. Chapter 5 Salmonella. Bacteriological Analytical Manual. , Available from: http://www.fda.gov/downloads/Food/FoodScienceResearch/UCM244774.pdf (2007).
- Barro, N., Aly, S., Tidiane, O. C. A., Sababenedjo, T. A. Carriage of bacteria by proboscises, legs, and feces of two species of flies in street food vending sites in Ouagadougou, Burkina Faso. Journal of Food Protection. 69 (8), 2007-2010 (2006).
- Ugbogu, O. C., Nwachukwu, N. C., Ogbuagu, U. N. Isolation of Salmonella and Shigella species from house flies (Musca domestica L.) in Uturu, Nigeria. African Journal of Biotechnology. 5 (11), 1090-1091 (2006).
- Brownlie, J. C., Johnson, K. N. Symbiont-mediated protection in insect hosts. Trends in Microbiology. 17 (8), 348-354 (2009).
- Feldhaar, H. Bacterial symbionts as mediators of ecologically important traits of insect hosts. Ecological Entomology. 36 (5), 533-543 (2011).
- Foodborne disease outbreaks: Guidelines for investigation and control. , World Health Organization. Available from: http://www.who.int/foodsafety/publications/foodborne_disease/outbreak_guidelines.pdf (2008).
- Wright, A. P., Gould, L. H., Mahon, B., Sotir, M. J., Tauxe, R. V. Overview of the Impact of Epidemic-Assistance Investigations of Foodborne and Other Enteric Disease Outbreaks, 1946-2005. American Journal of Epidemiology. 174, S23-S35 (2011).



