Introduction
Insetti svolgono un ruolo importante nella trasmissione di malattie legate perché possono diffondersi patogeni alle superfici e utensili 1 alimenti o contatto con gli alimenti. Tra gli insetti, mosche, scarafaggi, formiche e mostrano comportamenti che favoriscono la diffusione di agenti patogeni di origine alimentare. Questi comportamenti sono una associazione con la materia in decomposizione, rifiuti e feci, (edifici entrano) endophily, e synanthropy (convivente con gli esseri umani) 2. .. Patogeni come Salmonella spp, Listeria monocytogenes, Campylobacter spp, Escherichia coli O157: H7, e membri del genere Cronobacter (ex Enterobacter sakazakii) sono stati segnalati per essere trasmessa da insetti 3-5. Sporcizia sinantropici vola sviluppa meccanicamente batteri di origine alimentare trasferendo patogeni dalle loro superfici corporee contaminate. Tuttavia, la presenza di patogeni nel canale alimentare di linea può essere fino a tre voltesuperiore a quella osservata sulle superfici del corpo (il corpo, testa, gambe e ali) 5. Patogeni possono rimanere nel canale alimentare della mosca per una maggiore lunghezza di tempo che sulla superficie del corpo 6,7 e in alcuni casi, sono in grado di moltiplicarsi, colonizzando digerente 4,8,9 tratto della mosca. Questo aumenta il potenziale vettore di mosche perché possono diffondere ulteriormente patogeni di origine alimentare attraverso la defecazione e rigurgito 10,11.
Oggi, ci sono migliorati i sistemi di sorveglianza in grado di rilevare le epidemie di origine alimentare malattie più rapidamente. Durante l'esecuzione di indagini sui focolai di origine alimentare, funzionari della sanità pubblica cercano il cibo che può essere la fonte (s) o veicolo (s) di infezione. Gli investigatori possono anche eseguire una valutazione ambientale della struttura (o servizi) coinvolti per scoprire come il cibo è stato contaminato e possono raccogliere campioni nell'ambito delle indagini 12. Despite la vasta letteratura scientifica riguardante insetti come vettori di agenti patogeni di origine alimentare, che collega gli insetti come vettori del patogeno causando un focolaio di infezione particolare malattia è stato impegnativo. Questo è principalmente perché gli insetti non vengono asettico raccolti come parte di programmi di campionamento ambientale durante indagini sui focolai di origine alimentare. Per includere gli insetti, in particolare quelli che presentano comportamenti che favoriscono la diffusione di agenti patogeni di origine alimentare, nell'ambito di una procedura di campionamento ambientale, un protocollo standardizzato, veloce, sensibile e affidabile per rilevare patogeni di origine alimentare da un singolo insetto deve essere a posto.
Tecniche di placcatura tradizionali per l'individuazione di agenti patogeni di origine alimentare da insetti sono laboriosi e dipendono la crescita competitiva dei batteri bersaglio in terreni di coltura diverse per superare la rapida crescita del microbiota commensale innata dell'insetto. La maggior parte degli studi che hanno associato gli insetti con bapatogeni cterial hanno aumentato la sensibilità del metodo, raggruppando insieme più insetti piuttosto che identifica la presenza di patogeni su una base per individuo. Così, questi studi non hanno differenziare la parte del corpo dell'insetto dove sono stati trovati i 13-18 patogeni. La capacità di identificare se patogeni di origine alimentare si trovano sulla superficie del corpo o nel canale alimentare di un individuo insetto è importante in quanto ciò potrebbe avere implicazioni epidemiologiche e può portare a diverse strategie di mitigazione. Come vettori meccanici, mosche quella terra sul cibo per breve tempo possono trasferire i bassi livelli di batteri dal loro superficie corporea, mentre quelle mosche che rigurgitano e defecare sul cibo aumentare la probabilità di patogeni trasferimento a livelli potenzialmente più elevati di infezione. Di conseguenza, è importante stimare la prevalenza di un agente patogeno alimentare per un individuo insetti e differenziare la parte del corpo di insetto che dove il p batterica athogen si trova.
Anche se l'uso di metodi di coltura indipendente per rilevare patogeni sono sempre in fase di attuazione, non sono stati utilizzati commercialmente per rilevare patogeni da un unico insetto. Attualmente, ci sono convalidate protocolli molecolari che sono disponibili in commercio per la rapida individuazione di agenti patogeni di origine alimentare dagli alimenti che vengono utilizzati dall'industria e agenzie di regolamentazione. Questi metodi includono sistemi basati sul DNA per il rilevamento di agenti patogeni in una varietà di campioni alimentari. Sebbene i protocolli molecolari sono più veloci rispetto ai metodi tradizionali di placcatura, arricchimento del campione è ancora necessaria per ottenere il livello di sensibilità di 10 2 unità formanti colonie (CFU) del batterio patogeno necessaria reazione a catena della polimerasi (PCR) Metodi basati 19. Inoltre, è necessario l'isolamento di colonie batteriche pure da campioni PCR-positivi per confermare l'agente patogeno con metodi adeguati.
content "> Lo scopo di questo protocollo è di standardizzare un sistema basato su PCR disponibile in commercio usato per rilevare patogeni dai campioni alimentari e ambientali per la rilevazione di batteri alimentari dalla superficie del corpo e del canale alimentare di una mosca e per isolare ulteriormente quelli patogeni dalla sensibilità samples.The del protocollo qui descritto è stato prima tarati con mosche domestiche adulti laboratorio allevati (Musca domestica) che sono stati sperimentalmente alimentati con diluizioni seriali di ogni patogeno batterico. Il protocollo standardizzato è stato successivamente utilizzato per rilevare 100 catturati vola per la presenza di agenti patogeni di origine alimentare dalle loro superfici del corpo e / o canali alimentari. Questo protocollo standardizzato consentirà laboratori di sanità pubblica per rilevare minacce per la salute derivanti da insetti, consentendo la possibilità di raccoglierle come parte del programma di campionamento ambientale durante l'esecuzione di origine alimentare indagini sui focolai.Protocol
1. Raccolta di mosche
- Raccogliere singoli mosche sterili utilizzando reti spazzata entomologiche. Mettere le reti in un dispositivo di raffreddamento e trasferirli al laboratorio.
2. Dissection of Flies
- Immobilizzare mosche asetticamente raccolti mettendoli a -20 ° C per 5-7 min.
- Utilizzando una pinza sterile luogo una mosca in una provetta sterile da 2 ml contenente 1 ml di pre-riscaldato (37 ° C), acqua peptonata tamponata (BPW). Mescolare il tubo delicatamente per inversione per 2 min. È essenziale che l'intero corpo della mosca sia a contatto con il materiale in modo che la flora batterica presente sulla superficie del corpo (S) della mosca sarà trasferito al BPW (BPW-S). Etichettare la provetta con un numero e parte del corpo del fly (cioè 1S).
NOTA: Si prega di vedere la tabella di reagenti specifici / Attrezzature per una descrizione dettagliata dei materiali e reagenti citati in questo protocollo. - Utilizzando pinze sterili rimuovere al volo da parte dei media e il trasferimento BPW-Sad un tubo vuoto e pulito 2 ml di superficie disinfettare la mosca. Incubare la provetta contenente il supporto BPW-S a 37 ° C durante l'esecuzione del protocollo di disinfezione e dissezione.
- Surface-disinfettare la mosca immergendolo in 1 ml di etanolo al 70% per 1 min, seguiti da un risciacquo con acqua distillata sterile prima immergendola in 1 ml di preparato fresco 0,05% (v / v) soluzione di candeggina. Lavare 3 volte con acqua distillata sterile. Trasferire l'acqua dall'ultimo risciacquo ad un tubo autoclavato 2 ml.
NOTA: Eliminare il liquido ogni volta utilizzando una micropipetta 1.000 ml o invertendo il tubo, assicurandosi che il volo è all'interno del tubo. Mescolare delicatamente capovolgendo in ogni fase del processo di superficie di disinfezione. - Per valutare l'efficacia del processo di disinfezione, trasferire 100 ml di acqua dal dell'ultimo risciacquo ad una piastra TSA (TSA) e diffondere mediante un sterile ad L spreader monouso. Incubare la piastra a 37 ° C per 24 ore. Dopo incubation, registrare la presenza di eventuali colonie batteriche.
NOTA: La presenza di colonie batteriche sulle piastre TSA indica un processo di superficie-disinfezione inefficiente. In questo caso, la presenza di patogeni deve essere riportato solo sulla superficie del corpo della mosca perché la contaminazione incrociata tra la superficie corporea e il canale alimentare non può essere esclusa.
- Surface-disinfettare la mosca immergendolo in 1 ml di etanolo al 70% per 1 min, seguiti da un risciacquo con acqua distillata sterile prima immergendola in 1 ml di preparato fresco 0,05% (v / v) soluzione di candeggina. Lavare 3 volte con acqua distillata sterile. Trasferire l'acqua dall'ultimo risciacquo ad un tubo autoclavato 2 ml.
- Dopo superficie disinfezione al volo, il trasferimento a un pezzo di carta assorbente per eliminare autoclavato acqua in eccesso e quindi ad un 60 millimetri piastra di Petri sterile monouso.
- Porre la capsula di Petri in un ambito di dissezione e di identificare al volo per il livello di specie mediante i tasti dicotomiche per le famiglie ditteri 20,21.
- Utilizzando autoclave pinze punta fine tirare delicatamente l'ano e l'intero canale alimentare (A) fuori al volo e asetticamente trasferisca ad un altro tubo 2 ml sterile contenente 1 ml di pre-riscaldato (37 ° C), BPW con 0,5 millimetri zirconia / silicio perline (BPW-A). Label the tubo con lo stesso numero selezionato per la mosca individuale e la parte del corpo della mosca (cioè, 1A).
- Mescolare il tubo contenente la BPW-A accuratamente per 5 - 10 minuti con un distruttore cellulare. Incubare a 36 ± 1 ° C durante l'esecuzione del resto del protocollo.
- Per buono e / o conservare il campione per lungo termine, posizionare il resto della mosca in una provetta pulita 2 ml e aggiungere 1 - 2 ml di etanolo al 95%.
3. Arricchimento primaria e secondaria
- Etichettare tutti i tubi di arricchimento primaria e secondaria contenenti supporti secondo il numero del campione e la parte del corpo della mosca.
- Sotto una cappa sterile, trasferire 300 ml di BPW-S (di superficie) a sterili 2 ml provette contenenti i seguenti supporti:
- Per Salmonella, utilizzare 1 ml di pre-riscaldato (42 ° C) BPW. Incubare a bagnomaria ricircolo a 42,5 ° C per 22 - 24 ore. Per arricchimento secondario, trasferire 100 ml di BPW arricchito a 400 & #181; l di pre-riscaldato (37 ° C) per infusione cuore cervello (BHI) brodo precedenza immesso in provette sterili di cluster. Incubare a 37 ° C per 3 ore.
- Per Cronobacter, utilizzare 1 ml di pre-riscaldato (37 ° C) BPW con novobiocina (10 mg / l; Wallace, M., comunicazione personale). In alternativa, utilizzare 1 ml di R & F Enterobacter sakazakii brodo di arricchimento con supplemento (vancomicina e cefsulodina) come arricchimento primario. Incubare a 37 ° C per 22-26 ore. Per arricchimento secondario, trasferire 100 ml di BPW arricchito con novobiocina a 400 ml di pre-riscaldato (37 ° C) BHI brodo precedentemente collocati in provette sterili a grappolo. Incubare a 37 ° C per 3 ore.
- Per L. monocytogenes, utilizzare 1 ml di appena preparato RT 24 brodo di arricchimento di Listeria (24 LEB) con supplemento selettivo. Incubare a 37 ° C per 44 ± 5 ore. Non è richiesto alcun arricchimento secondario per la rilevazione di L. monocytogenes. Ripetere i punti 3.2.1 - 3.2.3 utilizzando il tubo etichettato come BPW-A.
4. Preparazione del sistema PCR-Based per l'amplificazione e la rilevazione del target di origine alimentare patogeni
I passaggi 4-8 utilizzare un sistema commerciale PCR cycler / detector, una postazione computer, e kit pronti per l'uso per lo screening per Salmonella (Salmonella 2 kit di analisi standard), specie Cronobacter (E. sakazakii kit test standard), e Listeria monocytogenes (L. monocytogenes kit assay 24E). Test standard utilizzano PCR rilevamento end-point. Ogni kit contiene compresse PCR-ready con un colorante intercalante che emette un segnale di fluorescenza quando legame al DNA a doppia elica. Il segnale viene acquisito durante la fase di rilevamento del programma di sistema PCR, generando una curva di fusione che viene interpretato dal software come positivi o negativi.
- Preparare reagenti e attrezzature, come specificato dal ManufactuProtocollo di rer per ogni patogeno bersaglio di origine alimentare.
NOTA: I protocolli per il rilevamento di Salmonella e Cronobacter richiedono una procedura di lisi un passo, mentre il protocollo per la rilevazione L. monocytogenes richiede una procedura di lisi due fasi (vedere paragrafi 5 e 6, rispettivamente). - Attivare il blocco automatico di riscaldamento selezionare il programma specifico per il patogeno bersaglio. In alternativa, se i blocchi di riscaldamento sono manuali, impostare temperature fino a 37 ° C (per Salmonella, Cronobacter spp, e L. monocytogenes.) Oppure a 55 ± 2 ° C (per L. monocytogenes parte 2 di lisi - vedere il punto 6.2) e 95 ± 3 ° C.
- Assicurarsi che i blocchi di raffreddamento sono stati refrigerati O / N, altrimenti li rilassarsi a 2 - 8 ° C per almeno 2 ore.
- Utilizzando il software del sistema di rilevamento basato su PCR, creare un file di rack di seguendo le istruzioni del produttore.
- Etichettare e disporre di clustertubi contenente il reagente di lisi nel rack, in base al file rack.
- Inizializzare lo strumento sistema di rilevamento basato su PCR.
5. Eseguire Lysis per il rilevamento di Salmonella e Cronobacter
- Preparare il reagente di lisi aggiungendo 150 ml di proteasi a una bottiglia 12 ml di tampone di lisi.
- Trasferire 200 ml di reagente di lisi a ciascuno dei tubi di cluster precedentemente etichettati.
NOTA: provette cluster contenente il reagente di lisi possono essere conservati a 2 - 8 ° C fino a 2 settimane. - Utilizzando puntali per pipette lunghi, il trasferimento di 20 ml di campioni arricchiti secondari (vedere i passi 3.2.1 e 3.2.2) per corrispondenti provette di cluster contenenti 200 ml di reagente di lisi. Utilizzare nuovi puntali per pipette per ciascun campione.
NOTA: Mantenere tubi da arricchimento primaria e secondaria in frigorifero (Salmonella) o RT (Cronobacter) per ulteriori analisi conferma di campioni PCR-positive / negative. Preparare controlli negativi con l'aggiunta di 20 ml di mezzi BHI sterile tubi a grappolo contenenti 200 ml di reagente di lisi. - Preparare controlli positivi con l'aggiunta di 20 ml di O / N colture batteriche (cresciute in BHI) di qualsiasi Salmonella conosciuto o ceppo Cronobacter ai tubi di cluster contenenti 200 ml di reagente di lisi.
- Tubi di cluster Cap e fissare saldamente con lo strumento di tappatura.
- Inserire la griglia di tubi di cluster nel blocco automatico di riscaldamento dopo la selezione del programma specifico per il patogeno bersaglio. In alternativa, incubare tubi di cluster a 37 ± 2 ° C per 20 minuti, seguita da incubazione a 95 ± 3 ° C per 10 min. Infine, trasferire i tubi di cluster per blocchi di raffreddamento (2 - 8 ° C) per 5 min.
NOTA: provette cluster contenente il lisato possono essere conservati a -20 ° C fino a 2 settimane.
6. Eseguire Lysis per il rilevamento di L. monocytogenes
- Eseguire prima parte dilisi come segue:
- Aggiungere 1,8 ml di acqua deionizzata sterile per la bottiglia di completamente scongelati agente lisi 1.
NOTA: Conservare agente 1 lisi a 2 - 8 ° C fino al momento dell'uso. Dopo l'apertura e la diluizione, conservare a RT (20 - 30 ° C) per un massimo di 6 mesi. - Combina agenti lisi 1 e 2 in un rapporto di 4: 1 (40 ml di diluito agente lisante 1 e 10 ml di agente 2 per ogni campione di lisi). Trasferire 50 ml di agenti lisi combinati a grappolo tubi. Utilizzare l'impasto entro 4 ore.
- Aggiungere 500 microlitri di campione arricchito primaria (vedi punto 3.2.3) per il tubo cluster contenente 50 ml di agenti lisi combinate.
- Preparare un controllo negativo con l'aggiunta di 500 ml di sterile 24 LEB a 50 ml di agenti lisi combinate.
- Preparare un controllo positivo con l'aggiunta di 500 ml di O / N L. cultura monocytogenes coltivato in 24 LEB a 50 ml di agenti lisi combinate.
- Tappare le provette a grappolo, mescolare delicatamente e luogonel blocco di riscaldamento a 37 ± 1 ° C per 30 min.
NOTA: Mantenere i tubi di arricchimento primario in frigorifero per ulteriori analisi conferma di campioni PCR-positivi / negativi.
- Aggiungere 1,8 ml di acqua deionizzata sterile per la bottiglia di completamente scongelati agente lisi 1.
- Eseguire parte 2 di lisi come segue:
- Preparare il reagente di lisi come indicato nei punti 5.1 e 5.2.
- Utilizzando punte per pipette lungo trasferimento 20 l di parte un lisato di tubi a grappolo contenenti 200 ml di reagente di lisi. Utilizzare nuovi puntali per pipette per ciascun campione.
- Tubi di cluster Cap e fissare saldamente con lo strumento di tappatura.
- Tubi Luogo di cluster in blocco automatico di riscaldamento la selezione del programma specifico di L. monocytogenes. In alternativa, incubare tubi di cluster a 55 ± 2 ° C per 30 minuti, seguita da incubazione a 95 ± 3 ° C per 10 min. Infine, trasferire i tubi di cluster per blocchi di raffreddamento (2 - 8 ° C) per 5 min.
NOTA: provette cluster contenente il lisato possono essere conservati a -20 ° C fino a 2 settimane.
Compresse 7. Hydrate PCR-Ready
- Selezionare un (4 ° C), blocco di raffreddamento PCR refrigerata e posizionare un tubo cremagliera PCR sull'inserto.
- Posizionare corrispondente provette PCR contenenti le compresse PCR-ready (in dotazione con ogni kit) per il patogeno bersaglio di origine alimentare nel supporto, in base al file rack.
- Utilizzando lo strumento decapping, rimuovere con attenzione i tappi di PCR-tubi. Eliminare i tappi e verificare che ogni tubo contiene una compressa.
- Trasferire 50 ml (per Salmonella e Cronobacter) o 30 ml (per L. monocytogenes) del lisato di provette PCR specifici. Utilizzare nuovi tappi ottici e fissare saldamente sulle provette PCR utilizzando lo strumento di tappatura.
NOTA: Dopo aver aggiunto il lisato di PCR-ready tablet, i campioni devono rimanere fresco a 2-8 ° C fino a quando caricato nel sistema di rilevazione basato su PCR. I tubi PCR possono essere centrifugati a 2500 xg per alcuni secondi per assicurare che il volume totale è nel fondo tegli tubo. - Caricare le provette PCR nello strumento sistema cycler / rilevamento PCR aprendo il cassetto dello strumento.
- Inserire la griglia di tubi PCR nei pozzetti nel cassetto e controllare che i tubi sono posizionati correttamente.
- Chiudere il cassetto e avviare il programma, come descritto dal protocollo del produttore.
NOTA: Lo strumento basato su PCR ha preimpostato parametri ciclistici per ogni agente patogeno di origine alimentare. - Verificare che la barra di stato ciclismo PCR visualizza una barra blu che indica che la parte di amplificazione del programma è in esecuzione.
NOTA: per PCR standard, il tempo di elaborazione del programma completo (amplificazione e rivelazione) dura circa 3-3,5 ore per completare.
8. Verifica dei risultati
- Al termine dell'elaborazione, seguire le istruzioni sullo schermo dello strumento sistema basato su PCR per rimuovere campioni e risultati del riesame.
- Se il patogeno bersaglio origine alimentare è presente nel campione (sia lasuperficie o il canale alimentare del volo) il pozzo è di colore rosso con un segno 'più' (positivo). Se l'agente patogeno è assente, il pozzo è verde con un segno 'meno' (negativo).
- Se il bene è di colore giallo con la barra trasversale rossa al centro, indica un errore di segnale.
9. Isolamento di Bacterial Pathogens da risultati PCR-positivi
- Selezionare i tubi dal primario (per L. monocytogenes) o secondaria (per Salmonella e Cronobacter) arricchimento di quei campioni che erano PCR-positivi. Inoltre, selezionare casualmente 3 - 5% dei campioni che erano PCR-negativi e procedere come segue:
- Per Salmonella:
- Aggiungere 100 ml di media arricchimento secondario a 10 ml di Rappaport-Vassiliadis (RV) medium e 1 ml di Tetrathionate (TT) brodo. Incubare le provette a 42,5 ° C in un bagno d'acqua di ricircolo per 22 - 24 ore.
- Dopo l'incubazione, striscia un'ansata 3 mm (10 ml) di ciascuno, un RVd supporto TT su solfito di bismuto (BS) agar, xilosio lisina desossicolato (XLD) agar, e Hektoen enterica (HE) agar. Incubare le piastre a 35 ± 1 ° C per 22 - 24 ore.
- Dopo l'incubazione, esaminare le piastre per la presenza di colonie tipiche di Salmonella su ogni supporto. Se non colonie isolate possono essere ottenuti dopo diversi passaggi sub-coltura, considerare il campione come negativo e riferire come un falso positivo per il sistema basato su PCR.
NOTA: Per colonie tipiche di Salmonella su supporti specifici vedono 22. Selezionare cinque presunte colonie tipiche di Salmonella e subcoltura su BS, XLD, o HE fino ad ottenere colture pure di isolati / singole colonie. - Selezionare una colonia pura e identificare Salmonella presuntiva utilizzando test commerciali biochimici, come la carta di VITEK 2 identificazione o API sistema di identificazione biochimica, seguendo le istruzioni del produttore.
- Per Cronobacter: <ol>
- Streak un'ansata 3 mm (10 ml), dei mezzi di comunicazione di arricchimento secondario su due lastre di terreni di coltura cromogeni come R & F Enterobacter sakazakii (Cronobacter) medio placcatura cromogeno, e / o chromID sakazakii Agar. Incubare le piastre a 35 ° C per 22 - 24 ore.
- Dopo l'incubazione, esaminare le piastre per la presenza di colonie Cronobacter tipiche (blu-nero al blu-grigio). Selezionare 5 colonie Cronobacter presunte e sottocultura su R & F Enterobacter sakazakii (Cronobacter) medio placcatura cromogeno, chromID sakazakii Agar, o TSA fino colture pure di isolati / singole colonie sono ottenuti.
NOTA: Se non colonie isolate possono essere ottenuti dopo vari passaggi sub-coltura, considerare il campione come negativo e riferire come un falso positivo per il sistema di rilevamento basato su PCR. - Selezionare una colonia pura e identificare Cronobacter presuntiva utilizzando commer biochimicaTest ciali come la carta VITEK 2 identificazione o API 20E sistema di identificazione biochimica, seguendo le istruzioni del produttore.
- Streak un'ansata 3 mm (10 ml), dei mezzi di comunicazione di arricchimento primario su due lastre di Brilliance Listeria agar (BLA). Incubare le piastre a 36 ± 1 ° C per 22-26 ore.
- Dopo l'incubazione, esaminare le piastre per la presenza di presunta L. monocytogenes (blu-verde) colonie. Selezionate 5 presuntiva L. monocytogenes colonie e loro sottocultura su BLA fino ad ottenere colture pure di isolati / singole colonie. Re-incubare le piastre negative a 36 ± 1 ° C per un ulteriore 22-26 ore.
- Selezionare una colonia pura e identificare presuntiva L. monocytogenes utilizzando test biochimici commerciali come la carta VITEK 2 identificazione o API Listeria sistema di identificazione biochimica, seguendo i del costruttoreSTRUZIONI.
Representative Results
Questo protocollo è stato tarato su un insieme di casa mosche laboratorio allevati che sono stati alimentati sperimentalmente per 24 ore con alimenti liquidi fly (2% di latte in polvere) contenente diluizioni seriali (10 Febbraio-10 agosto CFU / ml) di C. sakazakii, S. enterica, L. monocytogenes, o C. jejuni (n = 21 per ciascun batterio patogeno). Mezzi di arricchimento così come i tempi e temperature di incubazione sono stati adeguati per ogni agente patogeno di origine alimentare fino a quando il sistema basato su PCR è stato in grado di rilevare i livelli più bassi di batteri (10 2 CFU / ml) dalla superficie del corpo e del canale alimentare di un solo sperimentalmente alimentato volare. Utilizzando i mezzi e le condizioni di arricchimento descritte nella sezione del protocollo, il sistema basato su PCR rilevato C. sakazakii, S. enterica, e L. monocytogenes dalla superficie corporea del 100% di mosche alimentati con inoculi batterici> 10 3 UFC / ml (Figura 1A). Quando le mosche sono stati alimentati con 102 CFU / ml, la percentuale di rilevamento di C. sakazakii, S. enterica, e L. monocytogenes dalla loro superficie corporea è stata del 100%, 66%, e 33%, rispettivamente (Figura 1A). Il sistema basato su PCR anche rilevato questi tre agenti patogeni di origine alimentare dal canale alimentare di mosche alimentati con tutte le concentrazioni batteriche in percentuali ≥33% (Figura 1B). Tuttavia, la rilevazione di C. jejuni stata raggiunta solo quando le mosche laboratorio allevati stati sperimentalmente alimentati con cibo liquido contenente l'inoculo batterico più alto (10 8 UFC / ml). Quindi, C. jejuni è stato escluso dal gruppo di agenti patogeni di origine alimentare che potrebbe essere testato da individuo sporcizia sinantropica mosche con questo sistema di rilevazione basato sulla PCR in.
Con questo protocollo standardizzato, siamo stati in grado di determinare la prevalenza di Cronobacter spp., S. enterica, e L. monocytogenes dalla superficie del corpo e / o the canale alimentare di 100 mosche selvatici che erano individualmente e asetticamente catturati dalla zona cassonetto di dieci ristoranti urbani situati nell'area metropolitana di Washington, DC 5 mosche sporcizia raccolti sono stati rappresentativi di almeno sei specie, tra cui M. domestica (47%), Lucilia cuprina (33%), L. sericata (14%), Cochliomyia macellaria (2%), Sarcophaga haemorrhoidalis (2%), e Ophyra Leucostoma (1%). Una mosca è stato identificato solo a livello familiare (Anthomyiidae; 1%). Il protocollo superficie disinfezione è stata efficace ad evitare la contaminazione incrociata tra le parti del corpo della mosca, perché non è stata osservata crescita batterica su piastre TSA per l'acqua dall'ultimo disinfezione risciacquo di ogni singolo volo. Così, una distinzione può essere fatta tra batteri alimentari presenti sulle parti del corpo di ciascun volo.
Senza falsi positivi sono stati rilevati da campioni di superficie corporea e il canale alimentare diindividuali linea quando si utilizza questo spot sistema basato su PCR per il rilevamento di S. enterica e L. monocytogenes, e la conferma dei patogeni vitali su piastre di agar era in accordo con i risultati PCR-positivi. Tuttavia, non è stato possibile isolare colture pure di Cronobacter spp. da tutti i campioni PCR-positivi. Quindi, il rilevamento di questo patogeno dal PCR-based sistema ha mostrato falsi positivi dalla superficie del corpo (50%, 9/18) e il canale alimentare (48%, 16/33) di singoli mosche catturati. Campioni PCR-negativi selezionati in modo casuale che sono stati placcati su supporti specifici, hanno confermato l'assenza di agenti patogeni di origine alimentare. Pertanto, senza falsi negativi sono stati rilevati da qualsiasi dei campioni quando si usa questo sistema basato PCR-commerciale per rilevare Cronobacter spp., S. enterica, o L. monocytogenes.
Solo i campioni PCR-positivi in cui l'agente patogeno è stato isolato e confermato sono stati considerati positivie incluso per l'analisi statistica. La presenza globale degli agenti patogeni di origine alimentare nel canale alimentare di mosche Filth catturati era significativamente più alta che sulla superficie del corpo (χ 2 = 6,8772, df = 1, p = 0,0087). 22% dei canali alimentari e 8% delle superfici del corpo di mosche selvatici raccolti erano positive per almeno uno dei tre patogeni (Figura 2). In generale, la prevalenza di Cronobacter spp. né sulla superficie del corpo o canali alimentari di mosche raccolti era statisticamente superiore (19%; p test esatto di Fisher = 0,0165) rispetto alla prevalenza di S. enterica (7%) e L. monocytogenes (4%). Tuttavia, non sono state osservate differenze statisticamente significative durante l'esecuzione di confronti a coppie tra le parti del corpo di linea per ogni batterio patogeno (Figura 3; p test esatto di Fisher = 0,1464, p = 0,1184, e p = 0,6212 per Cronobacterspp., S. enterica, e L. monocytogenes, rispettivamente). Nessuna delle mosche erano positivi per tutti e tre gli agenti patogeni valutati. Tuttavia, tre delle mosche (due L. cuprina e uno sericata L.) portato Salmonella spp. e L. monocytogenes sulla superficie o nel canale alimentare.
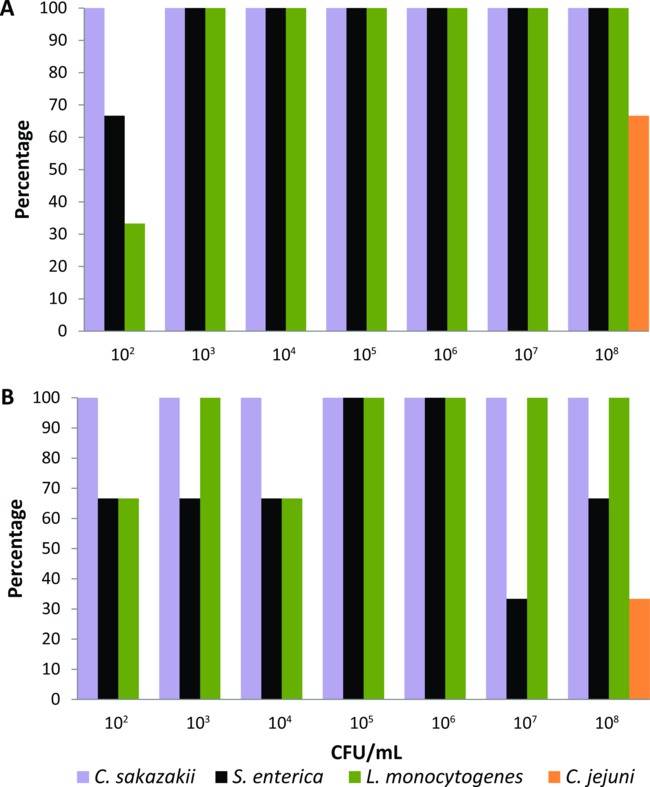
Figura 1. Livelli di rilevazione di Cronobacter sakazakii, Salmonella enterica, Listeria monocytogenes e Campylobacter jejuni da (A) la superficie del corpo e (B) il canale alimentare dei singoli casa mosche in laboratorio allevati alimentato con cibo liquido contenente inoculi batteriche (n = 21 per ciascun batterio patogeno, n = 3 per ogni concentrazione batterica).
Figura 2. Percentuale di superfici del corpo e canali alimentari dei singoli mosche trovato positivo per uno dei patogeni bersaglio di origine alimentare.

Figura 3. Prevalenza di Cronobacter spp., Salmonella enterica e Listeria monocytogenes dalla superficie del corpo e del canale alimentare di sinantropici mosche catturati. I valori di p riportati sono da confronti a coppie tra la superficie del corpo e del canale alimentare per ogni batterio patogeno (test esatto di Fisher, valore p <0.05 indica significatività statistica). Copyright © American Society for Microbiology, Journal of Applied and Environmental Microbiology 78 (22): 7891-902, 2012. doi: 10,1128 / AEM.02195-12.
Discussion
Studi precedenti che hanno rilevato gli agenti patogeni di origine alimentare dagli insetti selvatici hanno utilizzato una grande varietà di protocolli che potrebbero non includere le informazioni necessarie per valutare con precisione i rischi alimentari legati alla presenza di una mosca in alimenti o ambienti legati all'alimentazione 13,15, 23,24. Qui, abbiamo dimostrato che l'utilizzo di questo protocollo standardizzato, è possibile rilevare e isolare Cronobacter spp., S. enterica, e L. monocytogenes dalla superficie del corpo e del canale alimentare dei singoli mosche catturati in natura. Poiché gli insetti possono trasportare un numero ridotto di patogeno bersaglio di origine alimentare e un numero elevato di altri microbiota indigeno 25,26, questo protocollo richiede arricchimento primario (e talvolta secondaria) dei campioni in terreni di coltura specifici per aumentare la sensibilità di rilevamento del patogeno bersaglio di origine alimentare . I risultati del sistema di rilevazione basato sulla PCR sono stati ottenuti entro circa 30 ore (per il detection di Cronobacter spp. e S. enterica) e 48 ore (per il rilevamento di L. monocytogenes) dopo l'elaborazione iniziale dei campioni. Così, questo protocollo è affidabile e rapido ed abbastanza sensibile per lo screening una mosca per la presenza di patogeni.
Conferma dei risultati PCR-positivi e l'isolamento di batteri vitali è parte della procedura standard di molti laboratori. Inoltre, a fini epidemiologici, colture batteriche pure da campioni PCR-positivi sono tenuti a confermare ulteriormente e il sierotipo del patogeno di origine alimentare utilizzando biochimici, immunologici, o metodi genetici. Anche se non sono state osservate falsi positivi quando rileva S. enterica e L. monocytogenes dalle parti del corpo dei singoli mosche catturati, con questo protocollo, abbiamo trovato fino ad un tasso del 50% di falsi positivi per Cronobacter spp. Ciò suggerisce che il sistema di rilevazione basato sulla PCR per il genere CronobactER possono attraversare-reagire con altre Enterobacteriaceae presente tra il molto complesso microbiota portato dalle mosche. Pertanto, l'isolamento e la purificazione di colonie puri del Cronobacter genere da campioni PCR-positivi richiedono placcatura più selettivo rispetto agli altri patogeni valutati.
Questo protocollo è stato soprattutto standardizzato per lo screening individuale mosche-selvatici catturati per la presenza di Cronobacter spp., S. enterica, e L. monocytogenes utilizzando un sistema di rilevamento basato su PCR commerciale. Tuttavia, questo protocollo è stato anche facilmente adattato per schermare singole parti del corpo di mosche per la presenza di altri patogeni quali enteroemorragica E. coli O157: H7 (utilizzando E. coli O157: H7 MP kit di dosaggio standard o E. coli O157: H7 kit di analisi in tempo reale) e la E. shiga-tossigenici coli (STEC) gruppo (utilizzando la suite di STEC in tempo reale), sensibilità ottenendo> 80% (Annulla pubblicazionedati ndr). Inoltre, questo protocollo può potenzialmente essere adattata per rilevare patogeni di origine alimentare da altri insetti che sono noti vettori di malattie (scarafaggi e formiche), ma più ricerca in questo campo è necessario.
Origine alimentare indagini malattia focolai sono molto dinamici e comprendono un processo multi-step che può variare a seconda della situazione specifica e l'ambiente locale indagato 12,27. Queste indagini sono importanti perché forniscono immediata protezione della salute pubblica prevenendo malattie future. Inoltre, queste indagini possono chiarire nuovi meccanismi con cui i microrganismi di origine alimentare sono diffuse, e sollevare questioni importanti che portano a nuove aree di ricerca 28. Tecniche investigative nonché protocolli standardizzati, rapidi, e sensibili sono necessari per la rilevazione di agenti patogeni di origine alimentare dai singoli insetti. Questo protocollo standardizzato apre la possibilità di raccogliere in modo asettico insetti come mosche, which può vettore del batterio patogeno di origine alimentare, come parte di un programma di campionamento ambientale. Le informazioni epidemiologiche che si possono ottenere da questo sarebbe di impiego nella costruzione di un quadro preciso dei meccanismi di trasmissione di agenti patogeni di origine alimentare dagli insetti (cioè, la durata del tempo di esposizione: una mosca atterrando contro mosche atterraggio, defecare, e rigurgitare).
Infine, anche se il sistema di rilevamento basato su PCR commerciale qui descritto è pratico da usare e semplifica amplificazione PCR e visualizzazione di un amplicone-livello di genere, è affatto l'unico sistema appropriato. Il lisato da campioni arricchiti potrebbe in alternativa essere usato per individuare la presenza di agenti patogeni di origine alimentare utilizzando pubblicamente disponibili coppie di primer specifici per specie. Tuttavia, la sensibilità di rilevazione deve essere dimostrata prima del loro utilizzo.
Materials
| Name | Company | Catalog Number | Comments |
| Bismuth sulfite (BS) agar | Fisher Scientific | R452402 | *Multiple suppliers. |
| Brain heart infusion (BHI) broth | Becton, Dickson and Company | 299070 | *Pre-warmed to 37°C. Multiple suppliers. |
| Brilliance Listeria agar (BLA) | Fisher Scientific | CM1080B | *Multiple suppliers. |
| Buffered peptone water (BPW) | Becton, Dickson and Company | 212367 | *Pre-warmed to 37°C or 42°C. Multiple suppliers. |
| Brilliance Cronobacter agar (Druggan-Forsythe-Iversen formulation/DFI) | Fisher Scientific | CM1055B | *Multiple suppliers. |
| chromID Sakazakii Agar | bioMérieux | 43741 | *Call for information: 800.682.2666 |
| R & F Enterobacter sakazakii (Cronobacter) Chromogenic Plating Medium | R & F Laboratories | Various | *Call for information: +1.630.969.530 |
| R & F Enterobacter sakazakiii Enrichment Broth and supplement | R & F Laboratories | Various | *Call for information: +1.630.969.530 |
| Hektoen enteric (HE) agar | Fisher Scientific | OXCM0419B | *Multiple suppliers. |
| 24 Listeria enrichment broth (24LEB) | Oxoid | CM1107 | *Freshly prepared at room-temperature. Multiple suppliers. |
| Listeria selective enrichment supplement | Oxoid | SR0243 | *Multiple suppliers. |
| Novobiocin | Fisher Scientific | OXSR0181E | *Multiple suppliers. Store at 2-8 °C |
| Vancomycin hydrochloride hydrate | Sigma Aldrich | 861987 | Store at 2-8 °C |
| Cefsulodin sodium salt hydrate | Sigma Aldrich | C8145 | Store at 2-8 °C |
| Rappaport-Vassiliadis (RV) medium | Fisher Scientific | CM0669B | *Multiple suppliers. |
| Tetrathionate (TT) Broth | Becton, Dickson and Company | 249120 | *Multiple suppliers. |
| Trypticase soy agar (TSA) | Becton, Dickson and Company | 236930 | *Multiple suppliers. |
| Xylose lysine desoxycholate (XLD) agar | Becton, Dickson and Company | 221284 | *Multiple suppliers. |
| API Biochemical identification system | bioMérieux | Various | *Call for information: +1.800.682.2666 |
| VITEK 2: Product Safety | bioMérieux | Various | *Call for information: +1.800.682.2667 |
| BAX System Q7 | DuPont | ||
| BAX E. sakazakii Standard assay kit | DuPont | D11801836 | |
| BAX L. monocytogenes 24E assay kit | DuPont | D13608125 | |
| BAX Salmonella 2 Standard assay kit | DuPont | D14368501 | |
| Capping tool | DuPont | D11677028 | |
| Decapping tool | DuPont | D11134095 | |
| PCR tube rack/holder | DuPont | D12701663 | |
| Featherweight forceps, wide tip | BioQuip | 4750 | Sterilize before use. Multiple suppliers. |
| Fine point, straight tip forceps | BioQuip | 4731 | Sterilize before use. Multiple suppliers. |
| Zirconia/silica beads, 0.5 mm | Bio Spec Products, Inc. | 11079105z | Multiple suppliers. |
| Petri dishes - 60X15mm | Fisher Scientific | 08-772B | Multiple suppliers. |
| Disposable inoculating loops, 10µL | Fisher Scientific | 22-363-606 | Multiple suppliers. |
| L-shaped cell spreaders | Fisher Scientific | 14-665-230 | Multiple suppliers. |
| Microcentrifuge tubes, 2 ml | Fisher Scientific | Various | Sterilize before use when needed. Secure lid is preferred. Multiple suppliers. |
| Cluster tubes | Fisher Scientific | 05-500-13 | |
| Cluster tubes caps | Fisher Scientific | 05-500-23 | |
| Sodium hypochlorite (Liquid chlorine bleach) | *Dilute to 0.05% with water. Multiple suppliers. | ||
| Sterile deionized water | Multiple suppliers. | ||
| Sterile distilled water | Multiple suppliers. | ||
| Ethyl alcohol 190 proof | *Dilute to 70% with water when needed. Multiple suppliers. | ||
| Genie cell disruptor, 120V - for 1.5ml and 2.0ml microtubes | Scientific Industries, Inc. | SI-D238 | Multiple suppliers. |
| Heating block | Multiple suppliers. | ||
| Cooling block | Multiple suppliers. | ||
| Recirculating water bath | Multiple suppliers. | ||
| Stereo microscope | Multiple suppliers. | ||
| Centrifuge | Multiple suppliers. | ||
| Incubator | Multiple suppliers. |
References
- Voeller, J. G. Wiley Handbook of Science and Technology for Homeland Security. , Wiley Inc. 1-16 (2008).
- Olsen, A. R., Gecan, J. S., Ziobro, G. C., Bryce, J. R. Regulatory action criteria for filth and other extraneous materials V. Strategy for evaluating hazardous and nonhazardous filth. Regulatory Toxicology and Pharmacology. 33 (3), 363-392 (2001).
- Hald, B., Skovgård, H., Pedersen, K., Bunkenborg, H. Influxed insects as vectors for Campylobacter jejuni and Campylobacter coli in Danish broiler houses. Poultry Science. 87 (7), 1428-1434 (2008).
- Kobayashi, M., et al. Houseflies: Not simple mechanical vectors of enterohemorrhagic Escherichia coli O157:H7. American Journal of Tropical Medicine and Hygiene. 61 (4), 625-629 (1999).
- Pava-Ripoll, M., Pearson, R. E. G., Miller, A. K., Ziobro, G. C. Prevalence and relative risk of Cronobacter spp., Salmonella spp., and Listeria monocytogenes associated with the body surfaces and guts of individual filth flies. Applied and Environmental Microbiology. 78 (22), 7891-7902 (2012).
- Hewitt, C. G. Houseflies and how they spread disease. , Cambridge University Press. (1912).
- Rochon, K., Lysyk, T. J., Selinger, L. B. Retention of Escherichia coli by house fly and stable fly (Diptera:Muscidae) during pupal metamorphosis and eclosion. Journal of Medical Entomology. 42 (3), 397-403 (2005).
- Greenberg, B., Kowalski, J. A., Klowden, M. J. Factors affecting the transmission of Salmonella by flies: natural resistance to colonization and bacterial interference. Infection and Immunity. 2 (6), 800-809 (1970).
- Mramba, F., Broce, A. B., Zurek, L. Vector competence of stable flies, Stomoxys calcitrans L. (Diptera:Muscidae), for Enterobacter sakazakii. Journal of Vector Ecology. 32 (1), 134-139 (2007).
- Ekdahl, K., Normann, B., Andersson, Y. Could flies explain the elusive epidemiology of campylobacteriosis. Bmc Infectious Diseases. 5 (11), 11 (2005).
- Nayduch, D., Noblet, G. P., Stutzenberger, F. J. Vector potential of houseflies for the bacterium Aeromonas caviae. Medical and Veterinary Entomology. 16 (2), 193-198 (2002).
- Multistate and Nationwide Foodborne Outbreak Investigations: A Step-by-Step Guide. , CDC. Atlanta, GA. Available from: http://www.cdc.gov/foodsafety/outbreaks/investigating-outbreaks/investigations/index.html (2013).
- Sievert, K., Messler, S., Klimpel, S., Feffer, K. Comprehensive study on the occurrence and distribution of pathogenic microorganisms carried by synanthropic flies caught at different rural locations in Germany. Journal of Medical Entomology. 46 (5), 1164-1166 (2009).
- Hernández-Escareño, J. J., et al. Presence of Enterobacteriaceae, Listeria spp., Vibrio spp. and Staphylococcus spp. in house fly (Musca domestica L.), collected and macerated from different sites in contact with a few animals species. Revista Cientifica-Facultad De Ciencias Veterinarias. 22 (2), 128-134 (2012).
- Mian, L. S., Maag, H., Tacal, J. V. Isolation of Salmonella from muscoid flies at commercial animal establishments in San Bernardino county, California. Journal of Vector Ecology. 27 (1), 82-85 (2002).
- Olsen, A. R., Hammack, T. S. Isolation of Salmonella spp. from the housefly, Musca domestica L., and the dump fly, Hydrotaea aenescens (Wiedemann) (Diptera:Muscidae), at caged-layer houses. Journal of Food Protection. 63 (7), 958-960 (2000).
- Holt, P. S., Geden, C. J., Moore, R. W., Gast, R. K. Isolation of Salmonella enterica serovar Enteritidis from houseflies (Musca domestica) found in rooms containing Salmonella serovar Enteritidis-challenged hens. Applied and Environmental Microbiology. 73 (19), 6030-6035 (2007).
- Mramba, F., Broce, A., Zurek, L. Isolation of Enterobacter sakazakii from stable flies, Stomoxys calcitrans L. (Diptera:Muscidae). Journal of Food Protection. 69 (3), 671-673 (2006).
- Koyuncu, S., Andersson, M. G., Haggblom, P. Accuracy and Sensitivity of Commercial PCR-Based Methods for Detection of Salmonella enterica in Feed. Applied and Environmental Microbiology. 76 (9), 2815-2822 (2010).
- Gagné, R. Insect and mite pests in food, an illustrated. 1, U.S. Department of Agriculture and U.S. Department of Health and Human Service. 269-296 (1991).
- Greenberg, B. Flies and disease, Vol I. Ecology, classification and biotic associations. , Princeton University Press. (1971).
- Wallace, H. A., Jacobson, A., Hammack, T. S. Chapter 5 Salmonella. Bacteriological Analytical Manual. , Available from: http://www.fda.gov/downloads/Food/FoodScienceResearch/UCM244774.pdf (2007).
- Barro, N., Aly, S., Tidiane, O. C. A., Sababenedjo, T. A. Carriage of bacteria by proboscises, legs, and feces of two species of flies in street food vending sites in Ouagadougou, Burkina Faso. Journal of Food Protection. 69 (8), 2007-2010 (2006).
- Ugbogu, O. C., Nwachukwu, N. C., Ogbuagu, U. N. Isolation of Salmonella and Shigella species from house flies (Musca domestica L.) in Uturu, Nigeria. African Journal of Biotechnology. 5 (11), 1090-1091 (2006).
- Brownlie, J. C., Johnson, K. N. Symbiont-mediated protection in insect hosts. Trends in Microbiology. 17 (8), 348-354 (2009).
- Feldhaar, H. Bacterial symbionts as mediators of ecologically important traits of insect hosts. Ecological Entomology. 36 (5), 533-543 (2011).
- Foodborne disease outbreaks: Guidelines for investigation and control. , World Health Organization. Available from: http://www.who.int/foodsafety/publications/foodborne_disease/outbreak_guidelines.pdf (2008).
- Wright, A. P., Gould, L. H., Mahon, B., Sotir, M. J., Tauxe, R. V. Overview of the Impact of Epidemic-Assistance Investigations of Foodborne and Other Enteric Disease Outbreaks, 1946-2005. American Journal of Epidemiology. 174, S23-S35 (2011).



