Introduction
חרקים לשחק תפקיד חשוב בהעברת מחלות הקשורות למזון, כי הם יכולים להתפשט פתוגנים על משטחי מזון או במגע עם מזון וכלי 1. בין חרקים, זבובים, תיקנים, נמלים והתנהגויות המעדיפות את התפשטות פתוגנים foodborne. התנהגויות אלה כוללות שיתוף עם עניין מתפורר, מסרבים וצואה, (בניינים שנכנסו) endophily, וsynanthropy (הלא נשוא עם בני אדם) 2. .. פתוגנים foodborne כגון סלמונלה spp, חיידקים ליסטריה, קמפילובקטר spp, Escherichia coli O157: H7, וחברי Cronobacter (לשעבר sakazakii Enterobacter) הסוג דווח להיות מועבר על ידי חרקים 3-5. זוהמת קרבת אדם זבובים מכאנית להפיץ חיידקי foodborne ידי העברת פתוגנים מהמשטחים המזוהמים בגוף שלהם. עם זאת, הנוכחות של פתוגנים foodborne בתעלת העיכול של זבובים יכולה להיות עד שלוש פעמיםגדול יותר מזה שנצפה בשטח שלהם הגוף (גוף, ראש, רגליים, וכנפיים) 5. פתוגנים foodborne יכולים גם להישאר בתעלת העיכול של הזבוב לזמן ארוך יותר מאשר על פני השטח גוף 6,7 ובמקרים מסוימים, הם יכולים להתרבות, ומיישבי 4,8,9 מערכת העיכול של הזבוב. זה מגדיל את פוטנציאל הווקטור של זבובים, כי הם עוד יכולים להתפשט פתוגנים foodborne דרך עשיית הצרכים וregurgitation 10,11.
כיום, יש שיפור מערכות מעקב שמסוגלים לזהות התפרצויות המחלה foodborne במהירות רבות יותר. בעת ביצוע חקירות פרוץ foodborne, פקידי בריאות ציבור לחפש מזון שעשוי להיות מקור (ים) או הרכב (ים) של זיהום. חוקרים יכולים גם לבצע הערכה סביבתית של המתקן (או מתקנים) המעורב כדי לברר כיצד האוכל היה מזוהם ועשויים לאסוף דגימות כחלק מהחקירה 12. DespITE הכמות העצומה של ספרות מדעית הנוגע לחרקים כנישאים של פתוגנים foodborne, המקשר חרקים כוקטורים של הפתוגן גורם להתפרצות המחלה foodborne מסוימת הייתה מאתגרת. זה בעיקר בגלל חרקים אינם נאספים סביבה נקיה מחיידקים, כחלק מתוכניות דגימה סביבתית במהלך חקירות פרוץ foodborne. כדי לכלול חרקים, במיוחד אלה שמפגינים התנהגויות המעדיפות את התפשטות פתוגנים foodborne, כחלק מהליך דגימה סביבתי, פרוטוקול סטנדרטי, מהיר, רגיש ואמין לגילוי פתוגנים foodborne מחרקים יחידים צריך להיות במקום.
טכניקות ציפוי מסורתיות לגילוי של פתוגנים foodborne מחרקים הן מייגע ותלויות בצמיחה התחרותית של חיידקי היעד בתקשורת ותרבות שונה כדי להתגבר על הצמיחה המהירה של חיידקי commensal המולדים של החרקים. רוב המחקרים שקשורים עם החרקים baפתוגנים cterial הגדילו את הרגישות של השיטה על ידי איגום יחד כמה חרקים ולא מזהה את הנוכחות של פתוגנים לבסיס פרטני. כך, מחקרים אלו לא הבדילו חלק הגוף של החרקים שבו פתוגנים נמצאו 13-18. היכולת לזהות אם פתוגנים foodborne נמצאים על פני השטח הגוף או בתעלת העיכול של חרק בודד היא חשובה כמו זה עשוי להיות השלכות אפידמיולוגיים ועשוי להוביל לאסטרטגיות להפחתת סיכון שונות. כוקטורים מכאניים, זבובי אדמה שעל מזון לזמן קצר עלולים רק להעביר רמות נמוכות של חיידקים ממשטח גופם, בעוד שאלו שזבובים להקיא ולעשות את צרכיו על המזון להגדיל את ההסתברות של פתוגנים העברה ברמות גבוהות יותר פוטנציאל לזיהום. כתוצאה מכך, חשוב להעריך את השכיחות של הפתוגן foodborne לחרק בודד ולהבדיל חלק הגוף של חרקים שבי p החיידקים athogen ממוקם.
למרות שהשימוש בשיטות תרבות עצמאית כדי לזהות פתוגנים foodborne יותר ויותר להיות מיושם, הם לא היו בשימוש מסחרי כדי לזהות פתוגנים foodborne מחרקים בודדים. נכון לעכשיו, יש תוקף פרוטוקולים מולקולריים כי הם זמינים מסחריים לזיהוי המהיר של פתוגנים foodborne ממזונות הנמצאים בשימוש על ידי תעשייה ורשויות רגולטוריות. שיטות אלה כוללות מערכות מבוססות DNA לצורך זיהוי של פתוגנים במגוון רחב של דוגמאות מזון. למרות שפרוטוקולים מולקולריים הם מהירים יותר מאשר שיטות ציפוי מסורתיות, העשרה של המדגם היא עדיין נדרשה להשיג את רמת הרגישות של 10 2 יחידות מושבה להרכיב (CFU) של הפתוגן חיידקי צורך בתגובת השרשרת של פולימראז (PCR) שיטות מבוססות 19. בנוסף, יש צורך בבידוד של מושבות חיידקים טהורות מדגימות PCR החיוביות כדי לאשר את הפתוגן בשיטות מתאימות.
תוכן "> המטרה של פרוטוקול זה הוא כדי לתקן מערכת מבוססת PCR זמינה מסחרי המשמשת לאיתור גורמי מחלה מדגימות מזון ואיכות הסביבה לצורך זיהוי של חיידקי foodborne ממשטח הגוף ואת מערכת העיכול של זבוב בודד ולבודד נוסף אלה פתוגנים מרגישות samples.The של הפרוטוקול המתואר כאן היה מכוילים ראשון עם זבובים שגדל במעבדה הבית המבוגר (domestica Musca) שהואכלו בניסוי עם דילולים סדרתי של כל פתוגן חיידקים. הפרוטוקול הסטנדרטי היה לאחר מכן נהג לסקור 100 ניצוד עף לנוכחות של פתוגנים foodborne מהשטח שלהם הגוף ו / או תעלות עיכול. פרוטוקול סטנדרטי זה יאפשר מעבדות בריאות הציבור כדי לזהות איומי בריאות מציבים חרקים, המאפשרים לאפשרות של איסוף אותם כחלק מתכנית הדגימה הסביבתית בעת ביצוע foodborne חקירות פרוץ.Protocol
1. אוסף של זבובים
- לאסוף זבובים בודדים באמצעות רשתות לטאטא אנטומולוגיה סטרילי. שים את הרשתות בצידנית ולהעביר אותם למעבדה.
2. Dissection של זבובים
- לשתק זבובי הסביבה נקיה מחיידקים שנאספו על ידי הצבת אותם ב -20 ° C ל5-7 דקות.
- בעזרת מלקחיים סטרילית לטוס מקום אחד בצינור 2 מיליליטר סטרילי המכיל 1 מיליליטר של מים מחוממים מראש (37 ° C) peptone נאגר (BPW). מערבבים את הצינור בעדינות על ידי היפוך למשך 2 דקות. זה חיוני כי כל הגוף של הזבוב להיות במגע עם התקשורת, כך שהחיידקים על פני השטח הגוף (S) של הזבוב יועברו לBPW (BPW-S). תווית הצינור עם מק"ט והגוף של הזבוב (כלומר, 1S).
הערה: נא ראה טבלה של חומרים כימיים מסוימים / ציוד לתיאור מפורט של חומרים וחומרים כימיים שהוזכרו בפרוטוקול זה. - בעזרת מלקחיים סטריליות להסיר את הזבוב מתקשורת BPW-S וההעברהאותו לצינור 2 מיליליטר ריק ונקי על פני השטח לחטא את הזבוב. דגירה הצינור המכיל את תקשורת BPW-S על 37 מעלות צלזיוס בעת ביצוע פרוטוקול החיטוי ונתיחה.
- משטח-לחטא את הזבוב על ידי טבילתו ב 1 מיליליטר של אתנול 70% דקות 1, ואחריו שטיפה עם מים מזוקקים סטריליים לפני הטבילה זה ב 1 מיליליטר של 0.05% מוכנים טרי (v / v) פתרון אקונומיקה. לשטוף 3 פעמים עם מים מזוקקים סטריליים. העבר את המים מהשטיפה האחרונה לצינור מיליליטר 2 autoclaved.
הערה: מחק את הנוזל בכל פעם על ידי שימוש micropipette 1,000 μl או על ידי צינור היפוך, לוודא הזבוב נשאר בתוך הצינור. מערבבים בעדינות על ידי היפוך בכל שלב של תהליך המשטח-החיטוי. - כדי להעריך את היעילות של תהליך החיטוי, העברת המים 100 μl מהשטיפה האחרונה לצלחת אגר סויה trypticase (TSA) ולהפיץ באמצעות מפזר חד פעמי בצורת L סטרילי. דגירה את הצלחת על 37 מעלות צלזיוס למשך 24 שעות. לאחר בcubation, לרשום את הנוכחות של כל מושבות חיידקים.
הערה: הנוכחות של מושבות חיידקים על צלחות TSA מציינת תהליך משטח-חיטוי יעיל. במקרה זה, הנוכחות של פתוגנים foodborne יש לדווח רק על פני השטח הגוף של הזבוב בגלל הזיהום צולב בין משטח גוף ואת מערכת העיכול לא ניתן לשלול.
- משטח-לחטא את הזבוב על ידי טבילתו ב 1 מיליליטר של אתנול 70% דקות 1, ואחריו שטיפה עם מים מזוקקים סטריליים לפני הטבילה זה ב 1 מיליליטר של 0.05% מוכנים טרי (v / v) פתרון אקונומיקה. לשטוף 3 פעמים עם מים מזוקקים סטריליים. העבר את המים מהשטיפה האחרונה לצינור מיליליטר 2 autoclaved.
- לאחר משטח-חיטוי לטוס, להעביר אותו לפיסת מגבת נייר autoclaved כדי להסיר את עודפי מים ולאחר מכן בצלחת פטרי חד פעמית סטרילי 60 מ"מ.
- מניחים את צלחת פטרי תחת בהיקף לנתח ולזהות את הזבוב לרמת המין באמצעות מפתחות דיכוטומית למשפחות dipteran 20,21.
- בעזרת מלקחיים טיפ נאה autoclaved משוך בעדינות את פי הטבעת ואת כל מערכת העיכול () מתוך הזבוב והסביבה נקיה מחיידקים להעביר אותו לעוד צינור 2 מיליליטר סטרילי המכיל 1 מיליליטר של BPW המחומם מראש (37 ° C) עם 0.5 מ"מ zirconia / סיליקה חרוזים (BPW-A). ה Labelצינור דואר עם אותו המספר שנבחר לזבוב הפרט והחלק בגוף של הזבוב (כלומר, 1A).
- מערבבים את השפופרת המכילה BPW-יסודי ל5-10 דקות באמצעות משבש תא. לדגור על C ° 36 ± 1 בעת ביצוע שאר הפרוטוקול.
- לשובר ו / או לאחסן את הדגימה לטווח ארוך, למקם את שארית לטוס בצינור 2 מיליליטר נקי ולהוסיף 1-2 מיליליטר של אתנול 95%.
3. העשרה ראשונית ושניונית
- לייבל כל צינורות ההעשרה ראשונית ומשנית המכילים תקשורת לפי מספר המדגם והחלק בגוף של הזבוב.
- מתחת למכסת מנוע סטרילי, להעביר 300 μl של BPW-S (משטח) לסטרילי 2 מיליליטר צינורות המכילים את המדיה הבאה:
- לסלמונלה, להשתמש 1 מיליליטר של BPW המחומם מראש (42 ° C). דגירה באמבט מים הסירקולציה מחודשת על 42.5 מעלות צלזיוס במשך 22-24 שעות. להעשרה משנית, העברת BPW המועשר 100 μl 400 & #181; l של עירוי לב המוח (37 ° C) מראש חימם מרק (BHI) ממוקם בעבר בצינורות אשכול סטרילי. לדגור על 37 מעלות צלזיוס במשך 3 שעות.
- לCronobacter, להשתמש 1 מיליליטר של BPW המחומם מראש (37 ° C) עם novobiocin (10 מ"ג / ליטר; וואלאס, מ ', תקשורת אישית). לחלופין, להשתמש 1 מיליליטר של R & מרק העשרת sakazakii F Enterobacter עם תוספת (vancomycin וcefsulodin) כהעשרה העיקרית. לדגור על 37 מעלות צלזיוס במשך 22-26 שעות. להעשרה משנית, העברת BPW המועשר 100 μl עם novobiocin 400 μl של (37 ° C) מרק BHI המחומם מראש להציב בעבר בצינורות אשכול סטרילי. לדגור על 37 מעלות צלזיוס במשך 3 שעות.
- לL. חיידקים, להשתמש 1 מיליליטר של מרק מוכן טרי RT 24 ליסטריה העשרה (24 LEB) עם תוספת סלקטיבית. לדגור על 37 מעלות צלזיוס במשך 44 ± 5 שעות. אין העשרה משנית נדרשת לצורך זיהוי של L. חיידקים. חזור על שלבים 3.2.1 - 3.2.3 לעיל באמצעות הצינור שכותרתו כBPW-.
4. הכנת המערכת מבוססת PCR להגברה ואיתור של יעד foodborne פתוגן
צעדי 4-8 להשתמש במערכת מסחרית PCR Cycler / גלאי, תחנת עבודה מחשב, וערכות לשימוש מוכנות למסך לסלמונלה (Salmonella 2 ערכת assay סטנדרטית), מיני Cronobacter (א 'ערכת assay סטנדרטית sakazakii), וחיידקים ליסטריה (L. חיידקים לערכת assay 24E). מבחני סטנדרטיים להשתמש בזיהוי נקודת סיום PCR. כל ערכה מכילה טבליות PCR-מוכנות עם צבע intercalating שפולט אותות הקרינה כאשר מחייבים את ה- DNA פעמיים תקועים. האות שנתפסה בשלב זיהוי של תכנית מערכת PCR, יצירת עקומת התכה שמתפרשת על ידי התוכנה כחיובית או שלילי.
- הכן חומרים כימיים וציוד כמפורט על ידי manufactuהפרוטוקול של RER לכל פתוגן foodborne היעד.
הערה: הפרוטוקולים לאיתור סלמונלה וCronobacter דורשים הליך תמוגה צעד אחד ואילו הפרוטוקול לאיתור L. חיידקים דורש הליך תמוגה שני שלבים (ראה סעיפים 5 ו -6, בהתאמה). - הפעל את בלוק החימום האוטומטי בחירת התכנית הספציפית לפתוגן היעד. לחלופין, אם בלוקים החימום הם ידניים, להגדיר טמפרטורות עד 37 ° C (לסלמונלה, חיידקי Cronobacter spp, ול '.) או עד 55 ± 2 ° C (לL. חיידקים לחלק 2 של תמוגה - ראה שלב 6.2) ו 95 ± 3 מעלות צלזיוס.
- ודא שלוקי הקירור כבר בקירור O / N, אחרת לצנן אותם ב2-8 מעלות צלזיוס לפחות 2 שעות.
- שימוש בתוכנת המחשב של מערכת האיתור מבוססת PCR, ליצור קובץ מדף הבא הוראות יצרן.
- תווית ולארגן אשכולצינורות המכילים מגיב תמוגה במעמד, בהתאם לקובץ המדף.
- לאתחל את מכשיר מערכת איתור מבוסס PCR.
.5 בצע תמוגה לצורך זיהוי של סלמונלה וCronobacter
- הכן את מגיב תמוגה על ידי הוספת 150 μl של פרוטאז לבקבוק מיליליטר 12 אחד ממאגר תמוגה.
- העבר את 200 μl של מגיב תמוגה לכל אחד מצינורות האשכול שכותרתו בעבר.
ניתן לאחסן צינורות אשכול המכילים מגיב תמוגה ב2-8 מעלות צלזיוס עד 2 שבועות: הערה. - בעזרת הטיפים פיפטה ארוכים, להעביר 20 μl דגימות מועשרים המשניות (ראה צעדים 3.2.1 ו3.2.2) למתאימים צינורות אשכול המכילים 200 μl של מגיב תמוגה. השתמש בעצות פיפטה חדשות עבור כל דגימה.
הערה: שמור על צינורות מהעשרה ראשונית ומשנית במקרר (סלמונלה) או ב RT (Cronobacter) לניתוח אישור נוסף של דגימות PCR חיוביים / שליליות. הכן בקרות שליליות על ידי הוספת 20 μl של תקשורת BHI סטרילי לצינורות אשכול המכילים 200 μl של מגיב תמוגה. - הכן בקרות חיוביות על ידי הוספת 20 μl של O / תרבויות חיידקים N (גדל בBHI) של כל סלמונלה ידועה או מתח Cronobacter לצינורות אשכול המכילים 200 μl של מגיב תמוגה.
- צינורות אשכול כובע ולהבטיח בחוזקה באמצעות כלי מכסת.
- הנח את המדף של צינורות אשכול בבלוק החימום האוטומטי לאחר בחירת התכנית הספציפית לפתוגן היעד. לחלופין, דגירה צינורות אשכול בC 37 ± 2 ° במשך 20 דקות, ואחריו דגירה על 95 ± 3 מעלות צלזיוס במשך 10 דקות. לבסוף, להעביר את צינורות אשכול לקירור בלוקים (2 - C ° 8) במשך 5 דקות.
ניתן לאחסן צינורות אשכול המכילים את lysate ב -20 ° C עד 2 שבועות: הערה.
.6 בצע תמוגה לצורך זיהוי של L. חיידקים
- לבצע חלק אחד שלתמוגה כדלקמן:
- הוסף 1.8 מיליליטר של מים סטריליים deionized לבקבוק סוכן lysing מופשר לחלוטין 1 של.
הערה: חנות lysing סוכן 1 ב2-8 מעלות צלזיוס עד מוכן לשימוש. לאחר פתיחה ומדללת, חנות בRT (20 - 30 מעלות צלזיוס) במשך עד 6 חודשים. - לשלב lysing סוכנים 1 ו -2 ב-4: 1 (40 μl בדילול סוכן lysing 1 של 10 וμl של lysing סוכן 2 לכל מדגם). ההעברה 50 μl של סוכני lysing המשולבים לאשכול צינורות. השתמש בתערובת בתוך 4 שעות.
- הוסף 500 μl של מדגם מועשר העיקרי (ראה שלב 3.2.3) לצינור האשכול המכיל 50 μl של סוכני lysing המשולבים.
- הכן בקרה שלילית על ידי הוספת 500 μl של LEB 24 סטרילי 50 μl של סוכני lysing המשולבים.
- הכן ביקורת חיובית על ידי הוספת 500 μl של O / N L. תרבות חיידקים גדלה ב -24 LEB 50 μl של סוכני lysing המשולבים.
- שווי צינורות האשכול, מערבב בעדינות ומקוםבבלוק חימום בC ° 37 ± 1 למשך 30 דקות.
הערה: שמור על צינורות מהעשרה העיקרית במקרר לניתוח אישור נוסף של דגימות PCR חיוביים / שליליות.
- הוסף 1.8 מיליליטר של מים סטריליים deionized לבקבוק סוכן lysing מופשר לחלוטין 1 של.
- לבצע חלק 2 של תמוגה כדלקמן:
- הכן את מגיב תמוגה כפי שהורה בשלבים 5.1 ו -5.2.
- טיפים פיפטה ארוכים באמצעות העברת 20 μl של lysate חלק אחד לצינורות אשכול המכילים 200 μl של מגיב תמוגה. השתמש בעצות פיפטה חדשות עבור כל דגימה.
- צינורות אשכול כובע ולהבטיח בחוזקה באמצעות כלי מכסת.
- צינורות אשכול מקום בבלוק חימום אוטומטי בחירת התכנית הספציפית לL. חיידקים. לחלופין, דגירה צינורות אשכול בC 55 ± 2 ° למשך 30 דקות, ואחריו דגירה על 95 ± 3 מעלות צלזיוס במשך 10 דקות. לבסוף, להעביר את צינורות אשכול לקירור בלוקים (2 - C ° 8) במשך 5 דקות.
ניתן לאחסן צינורות אשכול המכילים את lysate ב -20 ° C עד 2 שבועות: הערה.
לוחות 7. סודה PCR-Ready
- בחר לחסום מצונן (4 מעלות צלזיוס) PCR קירור ומקום מתלה צינור PCR על ההוספה.
- הנח מקביל צינורות PCR המכילים את לוחות PCR-מוכנים (מצורפים לכל ערכה) לפתוגן foodborne היעד בבעל, לפי קובץ המדף.
- שימוש בכלי decapping, להסיר בזהירות את הכובעים מPCR-צינורות. מחק את הכובעים, ולוודא שכל צינור מכיל לוח.
- העברה 50 μl (לסלמונלה וCronobacter) או 30 μl (לחיידקי L.) של lysate לצינורות PCR ספציפיים. השתמש בכמוסות אופטיות חדשות ובטוחים בחוזקה על צינורות PCR באמצעות כלי מכסת.
הערה: לאחר הוספת lysate לטבליות PCR-מוכן, דגימות חייבת להישאר מקורר ב2-8 מעלות צלזיוס עד נטענים לתוך מערכת האיתור מבוססת PCR. ניתן centrifuged צינורות PCR ב 2500 XG במשך כמה שניות כדי להבטיח כי ההיקף המלא הוא בt התחתוןהוא הצינור. - טען את צינורות PCR למכשיר מערכת Cycler / זיהוי PCR על ידי פתיחת מגירת המכשיר.
- הנח את המדף של צינורות PCR לתוך הבארות במגירה ולבדוק שהצינורות יושבים בצורה נכונה.
- סגור את המגירה וליזום את התכנית כפי שתואר על ידי הפרוטוקול של היצרן.
הערה: המכשיר המבוסס על PCR קבע מראש פרמטרים רכיבה על אופניים לכל פתוגן foodborne. - ודא ששורת מצב רכיבה על אופניים PCR מציגה פס כחול מצביע על כך שחלק ההגברה של התכנית פועל.
הערה: למבחני PCR סטנדרטיים, זמן העיבוד של התכנית המלאה (הגברה וזיהוי) לוקחת כ 3-3.5 שעות כדי להשלים.
8. תוצאות סקירה
- לאחר העיבוד יושלם, בצע את המסך ומבקש ממכשיר המערכת מבוסס PCR כדי להסיר דגימות ותוצאות בדיקה.
- אם הפתוגן foodborne היעד הוא הווה במדגם (אומשטח או תעלת העיכול של הזבוב) גם הוא אדום עם סימן 'פלוס' (חיובי). אם הפתוגן נעדר, גם הוא ירוק עם סימן 'מינוס' (שלילי).
- אם גם הוא צהוב עם פס אדום על פני המרכז, הוא מציין שגיאת אות.
9. בידוד של פתוגנים חיידקיים מתוצאות PCR-חיוביות
- צינורות בחרו מהראשי (לחיידקי L.) או המשני (לסלמונלה וCronobacter) העשרה של אלה דגימות שהיו PCR חיובי. כמו כן, תבחר באופן אקראי 3 - 5% מהדגימות שהיו PCR-שליליים והמשך כדלהלן:
- לסלמונלה:
- הוספה של תקשורת ההעשרה המשנית 100 μl עד 10 מיליליטר של רפפורט-Vassiliadis בינוני (RV) ועד 1 מיליליטר של tetrathionate מרק (TT). דגירה צינורות ב 42.5 מעלות צלזיוס באמבט מים הסירקולציה מחודשת ל22-24 שעות.
- לאחר דגירה, פס loopful 3 מ"מ (10 μl) של כל RV,תקשורת ד TT על אגר sulfite יסמוט אגר (BS), desoxycholate ליזין קסילוז (XLD), וenteric Hektoen (HE) אגר. דגירה צלחות על C ° 35 ± 1 ל22-24 שעות.
- לאחר דגירה, לבחון צלחות לנוכחות של מושבות סלמונלה טיפוסיות בכל אמצעי תקשורת. אם לא ניתן להשיג מושבות מבודדות אחרי כמה צעדי culturing-משנה, לשקול את המדגם כשלילי ולדווח עליה ככוזב חיובי למערכת מבוססת PCR.
הערה: למושבות סלמונלה טיפוסיות בתקשורת ספציפית לראות 22. בחר חמש מושבות סלמונלה טיפוסיות משוערות ותת-תרבותם על BS, XLD, או שהוא עד תרבויות טהורות של מושבות מבודדות / אחת מתקבלות. - בחר מושבה אחת טהורה ולזהות סלמונלה המשוערת באמצעות בדיקות מסחריות ביוכימיים כגון מערכת זיהוי ביוכימיים API כרטיס VITEK 2 זיהוי או, הבאים להוראות היצרן.
- לCronobacter: <ol>
- Streak loopful 3 מ"מ (10 μl) של תקשורת ההעשרה המשנית בשתי צלחות של תקשורת בתרבות chromogenic כגון sakazakii Enterobacter R & F (Cronobacter) בינוני ציפוי chromogenic, ו / או ChromID Sakazakii אגר. דגירה צלחות על C ° 35 ל22-24 שעות.
- לאחר דגירה, לבחון צלחות לנוכחות של מושבות אופייניות Cronobacter (כחולות-שחורות לכחול-אפור). בחר 5 מושבות Cronobacter משוערות ותת-תרבותם על sakazakii Enterobacter R & F (Cronobacter) בינוני ציפוי chromogenic, ChromID Sakazakii אגר, או TSA עד תרבויות טהורות של מושבות מבודדות / אחת מתקבלות.
הערה: אם לא ניתן להשיג מושבות מבודדות אחרי כמה צעדי culturing-משנה, לשקול את המדגם כשלילי ולדווח עליה ככוזב חיובי למערכת האיתור מבוססת PCR. - בחר מושבה אחת טהורה ולזהות Cronobacter המשוער באמצעות commer ביוכימייםבדיקות cial כגון מערכת זיהוי ביוכימיים 20E API כרטיס VITEK 2 זיהוי או, הבאים להוראות היצרן.
- Streak loopful 3 מ"מ (10 μl) של תקשורת ההעשרה הראשונית על שתי צלחות של אגר Brilliance ליסטריה (BLA). דגירה צלחות על C ° 36 ± 1 ל22-26 שעות.
- לאחר דגירה, לבחון צלחות לנוכחותו של ל 'משוער חיידקים למושבות (כחול-ירוקות). בחר 5 L. המשוער חיידקים מושבות ותת-תרבותם בBLA עד לקבלת תרבויות טהורות של מושבות מבודדות / יחיד. דגירה מחדש צלחות שליליות ב 36 ± 1 מעלות צלזיוס במשך 22 נוספות - 26 שעות.
- בחר מושבה אחת טהורה ולזהות L. המשוער חיידקים באמצעות בדיקות ביוכימיות מסחרית כגון מערכת זיהוי ביוכימיים API ליסטריה כרטיס VITEK 2 זיהוי או, הבאים i של היצרןnstructions.
Representative Results
פרוטוקול זה היה מכויל ראשון על סט של זבובי בית שגדל במעבדה שהואכלו באופן ניסיוני עבור שעות 24 עם מזון נוזלי זבוב (2% אבקת חלב) המכיל דילולים סדרתי (פבואר 10 - אוגוסט 10 CFU / ml) של ג sakazakii, S. enterica, ל ' חיידקים, או C. jejuni (n = 21 לכל פתוגן חיידקים). תקשורת העשרה, כמו גם פעמים דגירה וטמפרטורות הותאמו לכל פתוגן foodborne עד שהמערכת מבוססת PCR הייתה מסוגלת לזהות הרמות הנמוכים ביותר של חיידקים (10 2 CFU / ml) ממשטח הגוף ואת מערכת העיכול של אחת האכיל בניסוי לטוס. שימוש במדיה ההעשרה ותנאים שתוארו בסעיף הפרוטוקול, המערכת מבוססת PCR זוהתה ג sakazakii, S. enterica, ול ' חיידקים ממשטח הגוף של זבובים מוזנים עם> 10 3 CFU / ml חיידקי inocula (איור 1 א) 100%. כאשר זבובים הואכלו עם 102 CFU / ml, אחוז הגילוי של ג sakazakii, S. enterica, ול ' חיידקים ממשטח גופם היו 100%, 66%, ו -33%, בהתאמה (איור 1 א). המערכת מבוססת PCR גם זוהתה שלושה פתוגנים foodborne אלה מהתעלה העיכול של זבובים נמאס עם כל ריכוזי החיידקים בשיעורים ≥33% (איור 1). עם זאת, זיהוי של ג jejuni היה רק מושגת כאשר זבובים שגדל במעבדה הואכלו בניסוי עם מזון נוזלי המכיל הבידוד הגבוה ביותר בקטריאלי (10 8 CFU / ml). לפיכך, ג jejuni לא נכלל בקבוצה של פתוגנים foodborne שאפשר לבדוק את זוהמה מקרבת אדם בודדת זבובים באמצעות מערכת איתור מבוסס PCR זה.
עם פרוטוקול סטנדרטי זה, היינו יכול לקבוע את השכיחות של spp Cronobacter., Enterica ס, ול ' חיידקים ממשטח הגוף ו / או הדואר תעלת עיכול של 100 זבובים פראיים שהיו בנפרד וסביבה נקיה מחיידקים נתפסו מאזור המזבלה של עשר מסעדות עירוניות הממוקמים באזור המטרופולין של וושינגטון 5 זבובי זוהמה שנאספו היה נציג של לפחות שישה מינים הכוללים מ ' domestica (47%), cuprina Lucilia (33%), ל ' sericata (14%), macellaria Cochliomyia (2%), (2%) haemorrhoidalis Sarcophaga, וleucostoma Ophyra (1%). זבוב אחד זוהה רק לרמת משפחה (אנתומיתיים; 1%). פרוטוקול משטח-החיטוי היה יעיל במניעת זיהום צולב בין חלקי הגוף של הזבוב, כי אין צמיחת חיידקים נצפתה על צלחות TSA למים משטיפת החיטוי האחרונה של כל זבוב בודד. לפיכך, הבחנה יכולה להתבצע בין חיידקי foodborne הווה בחלקי הגוף של כל זבוב.
אין תוצאות חיוביות שגויות התגלו מדגימות של משטח הגוף ואת מערכת העיכול שלזבובים בודדים בעת שימוש במערכת מבוססת PCR מסחרי זה לגילויו של ס ' enterica ול ' חיידקים, והאישור של פתוגנים קיימא על צלחות אגר היו בהסכם עם תוצאות PCR חיוביות. עם זאת, לא ניתן היה לבודד תרבויות טהורות של spp Cronobacter. מכל המדגמים PCR החיוביים. לפיכך, המבוסס על PCR זיהוי של הפתוגן זאת על ידי מערכת הראתה תוצאות חיוביות שגויות ממשטח הגוף (50%; 9/18) ועיכול (48%; 16/33) של זבובים-נתפס פראיים אחת. דגימות PCR שלילי שנבחרו באקראי שהיו מצופות על תקשורת ספציפית, אישרו את היעדר פתוגנים foodborne. לפיכך, לא שליליים שווא התגלו מכל הדגימות בעת השימוש במערכת מבוססת PCR מסחרית זו כדי לזהות spp Cronobacter., ס ' enterica, או L. חיידקים.
רק מי דגימות PCR החיוביות שבו הפתוגן היה מבודדת ואישרו נחשבו חיוביותוכלל לניתוח סטטיסטי. הנוכחות הכוללת של פתוגנים foodborne בתעלת העיכול של זבובי זוהמה ניצודים הייתה גבוהה יותר באופן משמעותי מאשר על פני השטח הגוף (χ 2 = 6.8772, df = 1, p = .0087). 22% מתעלות העיכול ו -8% ממשטחי הגוף של זבובים פראיים שנאספו היו חיוביים לפחות אחד משלוש גורמי המחלה foodborne (איור 2). בסך הכל, השכיחות של spp Cronobacter. שני משטחי הגוף או תעלות עיכול של זבובים שנאספו היה סטטיסטי גבוה יותר (19%; p של פישר המדויק בדיקה = .0165) מאשר שכיחותו של ס ' enterica (7%) וחיידקי L. (4%). עם זאת, לא נמצא הבדלים סטטיסטיים נצפו בעת ביצוע השוואות pairwise בין חלקי הגוף של הזבובים לכל פתוגן חיידקים (איור 3; p של פישר המדויק בדיקה = .1464, p = .1184, וp = .6212 לCronobacterspp., ס ' enterica, ול 'חיידקים, בהתאמה). אף אחד מהזבובים היו חיוביים לכל שלושת גורמי המחלה מוערכים. עם זאת, שלושה מהזבובים (שתי cuprina L. ואחד sericata L.) spp סלמונלה ביצע. ול ' חיידקים על פני השטח או בתעלת העיכול.
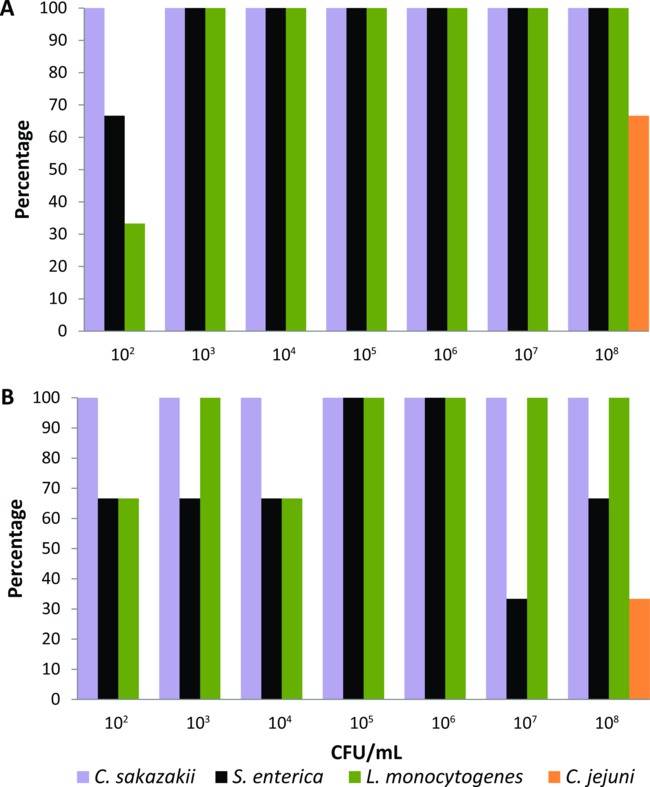
רמות איור 1. איתור של sakazakii Cronobacter, enterica סלמונלה, חיידקים ליסטריה, וקמפילובקטר jejuni ממשטח הגוף () ותעלת העיכול של זבובי בית שגדל במעבדה בודדת מואכלת באוכל נוזלי המכיל חיידקים שונה inocula (B) (n = 21 לכל פתוגן חיידקים, n = 3 לכל ריכוז חיידקים).
אחוז איור 2. משטחי גוף ותעלות עיכול של זבובים בודדים נמצא חיוביות לכל אחד מגורמי מחל foodborne היעד.

שכיחות איור 3. spp Cronobacter., Enterica סלמונלה, וחיידקים ליסטריה ממשטח הגוף ואת מערכת העיכול של זבובים ניצודים קרבת אדם. ערכי p המדווחים מהשוואות pairwise בין משטח גוף ואת מערכת העיכול לכל פתוגן חיידקים (מבחן המדויק של פישר, ערך p <0.05 מציין מובהקים סטטיסטי). חברת Copyright © האמריקנית למיקרוביולוגיה, Journal of Applied והסביבה מיקרוביולוגיה 78 (22): 7,891-902, 2012. doi: 10.1128 / AEM.02195-12.
Discussion
מחקרים קודמים שגילו פתוגנים foodborne מחרקים פראיים השתמש במגוון גדול של פרוטוקולים שאולי לא כולל את המידע הדרוש כדי להעריך נכון את הסיכון הקשורות למזון של הנוכחות של זבוב אחד במזונות או סביבות הקשורות למזון 13,15, 23,24. הנה, הראינו כי שימוש בפרוטוקול סטנדרטי זה, ניתן לזהות ולבודד spp Cronobacter., ס ' enterica, ול ' חיידקים ממשטח הגוף ואת מערכת העיכול של זבובים יחידים שנלכדו בטבע. בגלל חרקים עשויים לשאת מספרים נמוכים של הפתוגן foodborne היעד ומספרים גבוהים של חיידקי ילידים אחרים 25,26, פרוטוקול זה דורש העשרה העיקרית (ולפעמים שני) של הדגימות בתקשורת והתרבות הספציפית כדי להגדיל את הרגישות של זיהוי של הפתוגן foodborne היעד . תוצאות ממערכת האיתור מבוסס PCR התקבלו בתוך כ -30 שעות (לDetection של spp Cronobacter. וס enterica) ו -48 שעות (לצורך זיהוי של חיידקי L.) לאחר התחלת עיבוד הדגימות. כך, פרוטוקול זה הוא אמין כמו גם מהיר ורגיש מספיק כדי להקרין זבוב אחד לנוכחות של פתוגנים foodborne.
אישור לתוצאות PCR חיובי ובידוד של חיידקי קיימא הוא חלק מהליך ההפעלה הסטנדרטי של מעבדות רבות. בנוסף, למטרות אפידמיולוגיה, תרבויות חיידקים טהורות מדגימות PCR החיוביות נדרשות לאשר נוסף וסרוטיפ הפתוגן foodborne באמצעות יוכימיים, חיסוני, או שיטות גנטיות. למרות שאף תוצאות חיוביות שגויות נצפו כאשר גילוי S. enterica ול ' חיידקים מחלקי הגוף של זבובים-נתפס פראיים אחת, תוך שימוש בפרוטוקול זה, שמצאנו עד לשיעור של 50% של תוצאות חיוביות שגויות לspp Cronobacter. הדבר מצביע על כך מערכת האיתור מבוסס PCR לCronobact הסוגאה יכול לחצות להגיב עם Enterobacteriaceae אחר הנמצא בין החיידקים המורכבים ביותר שבוצעו על ידי זבובים. לפיכך, בידוד וטיהור של מושבות טהורות של Cronobacter הסוג מדגימות PCR החיוביות דורשים ציפוי סלקטיבית יותר מ פתוגנים האחרים שנבדקו.
פרוטוקול זה בעיקר היה סטנדרטי למסך זבובים ניצודים פרט לנוכחות של spp Cronobacter., ס ' enterica, ול ' חיידקים באמצעות מערכת איתור מבוססת PCR מסחרית. עם זאת, פרוטוקול זה גם להתאים בקלות למסך חלקי גוף של זבובים יחידים לנוכחות של פתוגנים foodborne האחרים כגון O157 enterohemorrhagic החיידק: H7 (באמצעות E. coli O157: H7 ערכת assay הסטנדרטי MP או החיידק O157: H7 ערכת assay בזמן אמת) וא 'השיג-toxigenic coli קבוצה (STEC) (באמצעות חבילת STEC בזמן אמת), רגישויות קבלת> 80% (ללא פרסוםנתונים ed). כמו כן, פרוטוקול זה יכול להיות מותאם פוטנציאלי כדי לזהות פתוגנים foodborne מחרקים אחרים שידועים כי הם וקטורים של מחלות (מקקים ונמלים), אך יש צורך במחקר נוסף בתחום זה.
חקירות פרוץ המחלה foodborne הן דינמיות מאוד ומהוות תהליך רב שלבים שעשויים להשתנות בהתאם למצב הספציפי ולהיות הסביבה המקומית חקרו 12,27. חקירות אלה חשובות משום שהם מספקים הגנה על בריאות הציבור מיידית על ידי מניעת מחלות בעתיד. בנוסף, חקירות אלה יכולים להבהיר מנגנונים חדשים על ידי מיקרואורגניזמים הfoodborne מפוזרים, ומעלות שאלות חשובות שיובילו לתחומים חדשים למחקר 28. טכניקות חקירה, כמו גם פרוטוקולים סטנדרטיים, מהירים, ורגישים הנדרשות לאיתור גורמי המחלה foodborne מחרקים בודדים. פרוטוקול סטנדרטי זה מפותח את ההזדמנות כדי לאסוף סביבה נקיה מחיידקי חרקים כמו זבובים, which יכול וקטור הפתוגן חיידקי foodborne, כחלק מתכנית דגימה סביבתית. המידע אפידמיולוגיים שניתן להשיג מזה יהיה שימוש בבניית תמונה מדויקת של המנגנונים של העברת פתוגנים foodborne על ידי חרקים (כלומר, משך זמן חשיפה: זבוב על ידי נחיתה לעומת זבובי נחיתה, עושים את צרכיהם, ומעלה גירה).
לבסוף, למרות שמערכת האיתור מבוססת PCR המסחרי שתוארה כאן היא מעשית לשימוש ומפשטת הגברה PCR ויזואליזציה של amplicon ברמת סוג, זה בשום אופן לא את המערכת המתאימה בלבד. Lysate מדגימות מועשרות לחלופין יכול לשמש מסך לנוכחות של פתוגנים foodborne באמצעות זוגות פריימר מינים ספציפיים זמינים בפומבי. עם זאת, רגישות זיהוי צריכה להיות הפגינה לפני השימוש בם.
Materials
| Name | Company | Catalog Number | Comments |
| Bismuth sulfite (BS) agar | Fisher Scientific | R452402 | *Multiple suppliers. |
| Brain heart infusion (BHI) broth | Becton, Dickson and Company | 299070 | *Pre-warmed to 37°C. Multiple suppliers. |
| Brilliance Listeria agar (BLA) | Fisher Scientific | CM1080B | *Multiple suppliers. |
| Buffered peptone water (BPW) | Becton, Dickson and Company | 212367 | *Pre-warmed to 37°C or 42°C. Multiple suppliers. |
| Brilliance Cronobacter agar (Druggan-Forsythe-Iversen formulation/DFI) | Fisher Scientific | CM1055B | *Multiple suppliers. |
| chromID Sakazakii Agar | bioMérieux | 43741 | *Call for information: 800.682.2666 |
| R & F Enterobacter sakazakii (Cronobacter) Chromogenic Plating Medium | R & F Laboratories | Various | *Call for information: +1.630.969.530 |
| R & F Enterobacter sakazakiii Enrichment Broth and supplement | R & F Laboratories | Various | *Call for information: +1.630.969.530 |
| Hektoen enteric (HE) agar | Fisher Scientific | OXCM0419B | *Multiple suppliers. |
| 24 Listeria enrichment broth (24LEB) | Oxoid | CM1107 | *Freshly prepared at room-temperature. Multiple suppliers. |
| Listeria selective enrichment supplement | Oxoid | SR0243 | *Multiple suppliers. |
| Novobiocin | Fisher Scientific | OXSR0181E | *Multiple suppliers. Store at 2-8 °C |
| Vancomycin hydrochloride hydrate | Sigma Aldrich | 861987 | Store at 2-8 °C |
| Cefsulodin sodium salt hydrate | Sigma Aldrich | C8145 | Store at 2-8 °C |
| Rappaport-Vassiliadis (RV) medium | Fisher Scientific | CM0669B | *Multiple suppliers. |
| Tetrathionate (TT) Broth | Becton, Dickson and Company | 249120 | *Multiple suppliers. |
| Trypticase soy agar (TSA) | Becton, Dickson and Company | 236930 | *Multiple suppliers. |
| Xylose lysine desoxycholate (XLD) agar | Becton, Dickson and Company | 221284 | *Multiple suppliers. |
| API Biochemical identification system | bioMérieux | Various | *Call for information: +1.800.682.2666 |
| VITEK 2: Product Safety | bioMérieux | Various | *Call for information: +1.800.682.2667 |
| BAX System Q7 | DuPont | ||
| BAX E. sakazakii Standard assay kit | DuPont | D11801836 | |
| BAX L. monocytogenes 24E assay kit | DuPont | D13608125 | |
| BAX Salmonella 2 Standard assay kit | DuPont | D14368501 | |
| Capping tool | DuPont | D11677028 | |
| Decapping tool | DuPont | D11134095 | |
| PCR tube rack/holder | DuPont | D12701663 | |
| Featherweight forceps, wide tip | BioQuip | 4750 | Sterilize before use. Multiple suppliers. |
| Fine point, straight tip forceps | BioQuip | 4731 | Sterilize before use. Multiple suppliers. |
| Zirconia/silica beads, 0.5 mm | Bio Spec Products, Inc. | 11079105z | Multiple suppliers. |
| Petri dishes - 60X15mm | Fisher Scientific | 08-772B | Multiple suppliers. |
| Disposable inoculating loops, 10µL | Fisher Scientific | 22-363-606 | Multiple suppliers. |
| L-shaped cell spreaders | Fisher Scientific | 14-665-230 | Multiple suppliers. |
| Microcentrifuge tubes, 2 ml | Fisher Scientific | Various | Sterilize before use when needed. Secure lid is preferred. Multiple suppliers. |
| Cluster tubes | Fisher Scientific | 05-500-13 | |
| Cluster tubes caps | Fisher Scientific | 05-500-23 | |
| Sodium hypochlorite (Liquid chlorine bleach) | *Dilute to 0.05% with water. Multiple suppliers. | ||
| Sterile deionized water | Multiple suppliers. | ||
| Sterile distilled water | Multiple suppliers. | ||
| Ethyl alcohol 190 proof | *Dilute to 70% with water when needed. Multiple suppliers. | ||
| Genie cell disruptor, 120V - for 1.5ml and 2.0ml microtubes | Scientific Industries, Inc. | SI-D238 | Multiple suppliers. |
| Heating block | Multiple suppliers. | ||
| Cooling block | Multiple suppliers. | ||
| Recirculating water bath | Multiple suppliers. | ||
| Stereo microscope | Multiple suppliers. | ||
| Centrifuge | Multiple suppliers. | ||
| Incubator | Multiple suppliers. |
References
- Voeller, J. G. Wiley Handbook of Science and Technology for Homeland Security. , Wiley Inc. 1-16 (2008).
- Olsen, A. R., Gecan, J. S., Ziobro, G. C., Bryce, J. R. Regulatory action criteria for filth and other extraneous materials V. Strategy for evaluating hazardous and nonhazardous filth. Regulatory Toxicology and Pharmacology. 33 (3), 363-392 (2001).
- Hald, B., Skovgård, H., Pedersen, K., Bunkenborg, H. Influxed insects as vectors for Campylobacter jejuni and Campylobacter coli in Danish broiler houses. Poultry Science. 87 (7), 1428-1434 (2008).
- Kobayashi, M., et al. Houseflies: Not simple mechanical vectors of enterohemorrhagic Escherichia coli O157:H7. American Journal of Tropical Medicine and Hygiene. 61 (4), 625-629 (1999).
- Pava-Ripoll, M., Pearson, R. E. G., Miller, A. K., Ziobro, G. C. Prevalence and relative risk of Cronobacter spp., Salmonella spp., and Listeria monocytogenes associated with the body surfaces and guts of individual filth flies. Applied and Environmental Microbiology. 78 (22), 7891-7902 (2012).
- Hewitt, C. G. Houseflies and how they spread disease. , Cambridge University Press. (1912).
- Rochon, K., Lysyk, T. J., Selinger, L. B. Retention of Escherichia coli by house fly and stable fly (Diptera:Muscidae) during pupal metamorphosis and eclosion. Journal of Medical Entomology. 42 (3), 397-403 (2005).
- Greenberg, B., Kowalski, J. A., Klowden, M. J. Factors affecting the transmission of Salmonella by flies: natural resistance to colonization and bacterial interference. Infection and Immunity. 2 (6), 800-809 (1970).
- Mramba, F., Broce, A. B., Zurek, L. Vector competence of stable flies, Stomoxys calcitrans L. (Diptera:Muscidae), for Enterobacter sakazakii. Journal of Vector Ecology. 32 (1), 134-139 (2007).
- Ekdahl, K., Normann, B., Andersson, Y. Could flies explain the elusive epidemiology of campylobacteriosis. Bmc Infectious Diseases. 5 (11), 11 (2005).
- Nayduch, D., Noblet, G. P., Stutzenberger, F. J. Vector potential of houseflies for the bacterium Aeromonas caviae. Medical and Veterinary Entomology. 16 (2), 193-198 (2002).
- Multistate and Nationwide Foodborne Outbreak Investigations: A Step-by-Step Guide. , CDC. Atlanta, GA. Available from: http://www.cdc.gov/foodsafety/outbreaks/investigating-outbreaks/investigations/index.html (2013).
- Sievert, K., Messler, S., Klimpel, S., Feffer, K. Comprehensive study on the occurrence and distribution of pathogenic microorganisms carried by synanthropic flies caught at different rural locations in Germany. Journal of Medical Entomology. 46 (5), 1164-1166 (2009).
- Hernández-Escareño, J. J., et al. Presence of Enterobacteriaceae, Listeria spp., Vibrio spp. and Staphylococcus spp. in house fly (Musca domestica L.), collected and macerated from different sites in contact with a few animals species. Revista Cientifica-Facultad De Ciencias Veterinarias. 22 (2), 128-134 (2012).
- Mian, L. S., Maag, H., Tacal, J. V. Isolation of Salmonella from muscoid flies at commercial animal establishments in San Bernardino county, California. Journal of Vector Ecology. 27 (1), 82-85 (2002).
- Olsen, A. R., Hammack, T. S. Isolation of Salmonella spp. from the housefly, Musca domestica L., and the dump fly, Hydrotaea aenescens (Wiedemann) (Diptera:Muscidae), at caged-layer houses. Journal of Food Protection. 63 (7), 958-960 (2000).
- Holt, P. S., Geden, C. J., Moore, R. W., Gast, R. K. Isolation of Salmonella enterica serovar Enteritidis from houseflies (Musca domestica) found in rooms containing Salmonella serovar Enteritidis-challenged hens. Applied and Environmental Microbiology. 73 (19), 6030-6035 (2007).
- Mramba, F., Broce, A., Zurek, L. Isolation of Enterobacter sakazakii from stable flies, Stomoxys calcitrans L. (Diptera:Muscidae). Journal of Food Protection. 69 (3), 671-673 (2006).
- Koyuncu, S., Andersson, M. G., Haggblom, P. Accuracy and Sensitivity of Commercial PCR-Based Methods for Detection of Salmonella enterica in Feed. Applied and Environmental Microbiology. 76 (9), 2815-2822 (2010).
- Gagné, R. Insect and mite pests in food, an illustrated. 1, U.S. Department of Agriculture and U.S. Department of Health and Human Service. 269-296 (1991).
- Greenberg, B. Flies and disease, Vol I. Ecology, classification and biotic associations. , Princeton University Press. (1971).
- Wallace, H. A., Jacobson, A., Hammack, T. S. Chapter 5 Salmonella. Bacteriological Analytical Manual. , Available from: http://www.fda.gov/downloads/Food/FoodScienceResearch/UCM244774.pdf (2007).
- Barro, N., Aly, S., Tidiane, O. C. A., Sababenedjo, T. A. Carriage of bacteria by proboscises, legs, and feces of two species of flies in street food vending sites in Ouagadougou, Burkina Faso. Journal of Food Protection. 69 (8), 2007-2010 (2006).
- Ugbogu, O. C., Nwachukwu, N. C., Ogbuagu, U. N. Isolation of Salmonella and Shigella species from house flies (Musca domestica L.) in Uturu, Nigeria. African Journal of Biotechnology. 5 (11), 1090-1091 (2006).
- Brownlie, J. C., Johnson, K. N. Symbiont-mediated protection in insect hosts. Trends in Microbiology. 17 (8), 348-354 (2009).
- Feldhaar, H. Bacterial symbionts as mediators of ecologically important traits of insect hosts. Ecological Entomology. 36 (5), 533-543 (2011).
- Foodborne disease outbreaks: Guidelines for investigation and control. , World Health Organization. Available from: http://www.who.int/foodsafety/publications/foodborne_disease/outbreak_guidelines.pdf (2008).
- Wright, A. P., Gould, L. H., Mahon, B., Sotir, M. J., Tauxe, R. V. Overview of the Impact of Epidemic-Assistance Investigations of Foodborne and Other Enteric Disease Outbreaks, 1946-2005. American Journal of Epidemiology. 174, S23-S35 (2011).



