Abstract
Electroretinogram (ERG) הוא שיטה לא פולשנית אלקטרו לקביעת תפקוד רשתית. באמצעות המיקום של האלקטרודה על פני השטח של הקרנית, פעילות חשמלית שנוצרה בתגובה לאור ניתן למדוד ומשמש להערכת הפעילות של תאים ברשתית in vivo. כתב יד זה מתאר את השימוש של ERG למדוד תפקוד ראייה של דג הזברה. דג הזברה ארוכה כבר נוצל כמודל לפיתוח חוליות בשל הקלות של דיכוי גן על ידי oligonucleotides morpholino ומניפולציה תרופתית. ב5-10 DPF, רק קונוסים הם פונקציונליים ברשתית הזחל. לכן, דג הזברה, בניגוד לבעלי חיים אחרים, היא מערכת מודל עוצמה לחקר תפקוד הראייה קונוס in vivo. פרוטוקול זה משתמש הרדמה סטנדרטית, מיקרומניפולציה ופרוטוקולי stereomicroscopy כי הם נפוצים במעבדות המבצעות מחקר דג הזברה. שיטות שתוארו לעשות שימוש בEQ אלקטרופיזיולוגיה הסטנדרטיuipment ומצלמה אור נמוך כדי להנחות את המיקום של microelectrode ההקלטה על גבי קרנית הזחל. לבסוף, אנו מדגימים כיצד ממריץ / מקליט ERG זמין מסחרי שנועד במקור לשימוש עם עכברים יכול בקלות להיות מותאם לשימוש עם דג הזברה. ERG של דג הזברה זחל מספק שיטה מצוינת שלו מנסה לאמוד פונקציה חזותית חרוט בבעלי חיים ששונו על ידי הזרקת oligonucleotide morpholino כמו גם בשיטות של הנדסה גנטית חדשות יותר כגון אצבע nucleases (ZFNs) האבץ, תמלול Activator-כמו מפעיל nucleases (TALENs), ו חזרות התקבצו באופן קבוע Interspaced הקצר Palindromic (CRISPR) / Cas9, אשר כולם בצורה ניכרת את היעילות והיעילות של גן המיקוד בדג זברה. בנוסף, אנו מנצלים את היכולת של סוכנים תרופתיים לחדור זחלי דג הזברה להעריך את המרכיבים המולקולריים התורמים לphotoresponse. פרוטוקול זה מתאר התקנה שיכולה להיות משונית ושימוש על ידי חוקריםעם מטרות ניסוי שונות.
Introduction
Electroretinogram (ERG) הוא שיטה לא פולשנית אלקטרו שכבר נעשה שימוש נרחב במרפאת לקביעת התפקוד של הרשתית בבני אדם. הפעילות החשמלית בתגובה לגירוי אור נמדדת על ידי הנחת אלקטרודות הקלטה על פני השטח החיצוניים של הקרנית. המאפיינים של הפרדיגמה הגירוי וצורת גל התגובה להגדיר את תאי העצב ברשתית תורמים לתגובה. שיטה זו הותאמה לשימוש עם מספר המודלים של בעלי חיים, כולל עכברים ודג זברה. יש תגובת ERG חוליות הטיפוסית ארבעה מרכיבים עיקריים: א-גל, שהוא פוטנציאל קרנית-שלילית הנגזר מפעילות תאי קולטי אור; ב-הגל, פוטנציאל קרנית-חיובית הנגזר מON תאים דו קוטביים; ד-הגל, פוטנציאל קרנית-חיובית להתפרש כפעילות של התאים דו קוטביים OFF; וג-הגל, אשר מתרחש כמה שניות לאחר b-הגל ומשקף פעילות בגליה מולר והמילאפיתל הפיגמנט INAL 1-4. אזכור נוסף להבנת ההיסטוריה והעקרונות של ניתוח ERG בבני אדם ובעלי חיים מודל הוא ספר הלימוד המקוון, Webvision, מאוניברסיטת יוטה וטקסטים כגון עקרונות ותרגול של אלקטרופיזיולוגיה הקלינית של 4 Vision, 5.
rerio Danio (דג הזברה) כבר העדיף ארוך כמודל לפיתוח חוליות, בשל ההבשלה המהירה שלה ושקיפות, אשר מאפשרת ניתוח לא חודרני המורפולוגי של מערכות איברים, מבחני התנהגות והן קדימה לאחור מסכי גנטיים (לסקירה, ראה Fadool ו דאולינג 6). זחלי דג הזברה הם נוחים מאוד למניפולציה גנטית ותרופתית, אשר, כאשר יחד עם הפוריות הגבוהה שלהם, לגרום להם מודל חיה מצוין לניתוחים ביולוגיים תפוקה גבוהה. היחס גבוה יותר של קונוסים למוטות בדג הזברה זחל - בערך 1: 1 בהשוואה לעכברים (~ קונוס 3%ים) - להפוך אותם שימושי במיוחד ללימוד הפונקציה חרוט 7-9.
ברשתית החוליות, קונוסים לפתח לפני מוטות 10. מעניין, קונוסים דג הזברה הם אופרטיביים מוקדם ככל 4 DPF, המאפשרים ניתוח אלקטרו סלקטיבית של קונוסים בשלב זה 6, 11,12. בניגוד לכך, תגובות ERG במוטות מופיעות בין 11 ל 21 DPF 13. לכן, זחלי דג הזברה ב4-7 DPF לשרת תפקודי כרשתית כל-קונוס. עם זאת, תגובת ERG photopic יליד 4-7 זחלי DPF נשלט על ידי b-הגל. יישום של סוכנים תרופתיים, כגון L - (+) - 2-אמינו-4-phosphono-butyric חומצה (L-AP4), אגוניסט לגלוטמט metabotropic קולט (mGluR6) בא לידי ביטוי בON תאים דו קוטביים, חוסם ביעילות את הדור של ב-הגל ומגלה את הפוטנציאל המבודד ההמוני קונוס קולט, ("גל") 14-17.
כאן אנו מתארים פשוטים וreliablשיטת דואר לניתוח ERG באמצעות ציוד ERG זמין מסחרי מיועד לשימוש עם עכברים שהותאמו לשימוש עם זחלי דג הזברה. מערכת זו יכולה להיות מנוצלת על זחלי דג הזברה של משתנה רקע גנטי, כמו גם אלו שטופלו בסוכנים תרופתיים, כדי לסייע לחוקרים בזיהוי של מסלולי איתות שתורמים לרגישות חזותית והסתגלות אור 16. הפרוצדורות מפורטות בפרוטוקול זה תדריך את החוקרים בשימוש בניתוח ERG כדי לענות על מגוון של שאלות ביולוגיות הנוגעות לראייה, ומדגימות את הבנייה של התקנת ERG גמישה.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
אחזקת בעלי חיים ופרוטוקולי ניסוי אושרו על ידי ועדות הטיפול ושימוש בבעלי חיים המוסדיים של אוניברסיטת צפון קרוליינה בצ'אפל היל, ולעמוד בכל הדרישות של משרד NIH של בעלי חיים במעבדת רווחה והאגודה להערכה והסמכה של מעבדה טיפול בבעלי חיים בינלאומיים.
הערה: פרוטוקולים כדי להשיג זחלים לניתוח ERG, שפורסם לגידול דג הזברה סטנדרטי ותחזוקה הועסקו 18. זחלים שהושגו באמצעות רבייה טבעית, ושוכנו בשעה 14 מחזור אור / חושך 10 שעות. פרוטוקול זה כבר מותאם לזחלים ב5-7 ימים לאחר הפריה (DPF), אבל יכול להתבצע באופן אידיאלי על דגים מבוגרים עם שינויים קטנים להליך. כאן, להשתמש בלחץ TL של זחלי דג הזברה wild-type בשעה 5 DPF.
1. Micropipette הפקה
- משוך כמה micropipettes באמצעות 1.5 x 0.86 מ"מ (קוטר חיצוני על ידי קוטר פנימי) נימי זכוכית בורוסיליקט אש מלוטשת עםחוט להט (טמפרטורת התכה, 821 ° C) וFlaming / בראון micropipette פולר P-97 מצויד בנימת חום תיבה. השתמש בתכנית לעיצוב micropipettes המתואר בטבלה 1.
- בדוק כל micropipette תחת מיקרוסקופ עם שליט graticule מתאים כדי להבטיח שטיפים הם 10-15 מיקרומטר בקוטר ויש לו טיפ פתיחה חלקה (כלומר, ללא קצוות משוננים).
- לאחסן בזהירות micropipettes כדי למנוע נזק קצה וחשיפה לאבק. אפשרויות אחסון כוללות צלחות פטרי עם מעבדה קלטת, קופסות מרופדות קצף, או מיכלי אחסון micropipette זמין מסחרי.
ניתן להשתמש בנימי מושכי micropipette אחרים וזכוכית ארוכות כמו הקוטר הנכון של micropipette וקצה באיכות גבוהה מושגת: הערה.
| לחץ | חום | משוך | Velocity זמן | |
| 500 | 560 | - | 30 | 200 |
| 500 | 450 | - | 30 | 200 |
| 500 | 410 | 55 | 40 | 200 |
טבלת 1: תכנית לייצור micropipettes באמצעות / micropipette פולר חום P-97 Flaming המצויד בנימת חום תיבת Micropipettes מבוצעים באמצעות 1.5 x 1.0 מ"מ 2 (קוטר חיצוני על ידי קוטר פנימי) נימי זכוכית בורוסיליקט אש מלוטשת עם נימה. (טמפרטורת היתוך, C 821 °).
2. הצפת הכנה
- השתמש מסונן, המאגר של רינגר דג זהב מחומצן 19 בנימי microelectrode וכדי להרוות את ספוג אלכוהול פוליוויניל (PVA) על שהזחלים ממוקמים לניסויים. לחלופין, השתמש ב- E3 תקשורת עובר או תמיסת מלח מאוזנת של האנק.
- הכן פתרון 10x רינגר דג זהב כפי שמתואר בטבלה 2. התאימו לpH 7.8, ולעקר באמצעות מסנן 0.22 מיקרומטר ולאחסן את המניה 10x על 4 מעלות צלזיוס.
- ליצור פתרון עבודה ביום של הניסוי על ידי דילול הפתרון של רינגר 10x ל1X עם מים ללא יונים, מזוקקים. לסנן באמצעות מערכת סינון 0.22 מיקרומטר. חמצן על ידי מבעבע עם 95% O גז 2 CO 2/5% במשך 10 דקות. כובע בחוזקה לאחר מכן על מנת להבטיח שהפתרון נותר מחומצן.
| NaCl | 1.25 M |
| KCl | 26 מ"מ |
| CaCl 2 | 25 מ"מ |
| MgCl 2 | 10 מ"מ |
| גלוקוז | 100 מ"מ |
| HEPES | 100 מ"מ |
3. electroretinogram פלטפורמה
- לבצע ניסויי ERG על שולחן נגד רעידות בתוך כלוב פאראדיי כדי לשפר את יחס האות לרעש. צרף פלטפורמת פלדה מותאמת אישית לשולחן נגד הרעידות באמצעות אגוזי משושה. הנח פלטפורמת פלסטיק מטלטלין עם תחתית viscoelastic פולימר urethane הלם קליטה על השולחן מתחת למקור האור.
- מקם את המצלמה עם מעמד ממוגנט, שמטרה למטה בפלטפורמת פלסטיק מטלטלין. מקם את micromanipulator (אשר יחזיק microelectrode ההקלטה) עם מעמד ממוגנט שני מהימין לפלטפורמת פלסטיק מטלטלין. ודא שהמצלמה וmicromanipulator לא יופרעו על ידי התנועה של ציוד אחר ושהם לא לחסום תאורה ממקור האור.
- חבר את המצלמה לצג וידאו ולמקם אותו כדי להציג את עינו שלזחל להצבת אלקטרודה במיקום הנכון.
- ודא שההגדרה היא מוארקת כראוי עם חוטי נחושת. כדי לבדוק את הרעש, למקם את האלקטרודה התייחסות וקצה microelectrode ההקלטה בגודל 35 מ"מ צלחת פטרי מלא עם הפתרון של רינגר. בדוק את רמות הרעש החשמלית של ההתקנה עם אוסצילוסקופ או תכונה מובנית של מנגנון ERG. רמות רעש צריכה להיות לא יותר מ ± 10 μV מנקודת ההתחלה.
4. ספוג הכנה
- לחתוך מלבן קטן של ספוג PVA היבש שיתאים בנוחות בצלחת פטרי 35 מ"מ. העובי של הספוג לא צריך להיות גדול יותר מהעומק של המנה. השתמש בסכין יפני בסכין גילוח נקי לחיתוך.
- הפוך קיצוץ נוסף לתוך הספוג כדי להתאים את האלקטרודה ההתייחסות (או לחתוך רדוד לאורך בחלק התחתון של הספוג או פרפר לחתוך אנכי דרך אחד הקצוות הקטנים יותר).
- השתמש סמן עמיד כימיכדי לסמן נקודה קטנה על ספוג (שבו הזחל יוצב) שיכול לשמש למיצוב המצלמה.
- משרים את ספוג PVA בפתרון של רינגר עד רווי. הסר ולמחוק במהירות על מגבת נייר 2-3 פעמים. מניחים את הספוג בצלחת פטרי 35 מ"מ נקייה.
- מקם את צלחת פטרי המכילה את הספוג על פלטפורמת הפלסטיק כך שהסימן יכול להיות דמיין ידי המצלמה.
5. אלקטרודה הכנה
הערה: התקנת דג הזברה מורכבת אלקטרודה התייחסות במגע עם ספוג רינגר-רווי פתרון PVA והאלקטרודה הקלטה במגע עם הקרנית. האלקטרודה ההתייחסות מורכבת מגלולת Ag / AgCl. האלקטרודה ההקלטה היא micropipette זכוכית משך מלא בפתרון של רינגר ומוחזק על ידי בעל microelectrode מכיל חוט Ag.
- כלוריד אלקטרודות ידי טבילתם ב6-9 hypochlorite נתרן% (אקונומיקה) במשך 5 דקות (MICR ההקלטהחוט oelectrode) או 15 דקות (האלקטרודה ההתייחסות). אוויר יבש על Kimwipe במשך 5 דקות.
- בהתאם לסגנון של חתך שנעשה בשלב 4.2, למקם את כדור Ag / AgCl של האלקטרודה ההתייחסות ל( לקיצוץ הפרפר האנכי) או מתחת (לחתך הרדוד לאורך בתחתית) את הספוג. צרף להוביל אלקטרודה התייחסות למערכת ההקלטה.
- לחלופין, אם יש לו את התקנת ERG אילוצי שטח או שיש חפצי פוטו חזקים במיוחד מן האלקטרודה Ag / AgCl, לחבר את האלקטרודה ההתייחסות לספוג באמצעות גשר מלח אגר להעביר את האלקטרודה מנתיב האור.
- צרף ~ 40 סנטימטרים של צינורות בגודל המתאים ל5 מיליליטר מזרק מנעול שאינו Luer. מלא את המזרק עם הפתרון של רינגר. בעלי microelectrode בעל יציאות לחץ בדרך כלל ספינה עם מתאמים כדי להתאים צינורות בקטרים פנימיים של 1/16 ", 3/32", 1/8 "או 5/32".
- מלא שאינו Luer מזרק 1 מיליליטר מנעול עםהפתרון של רינגר ו, באמצעות מיקרו-fil, למלא בקפידה את בעל microelectrode. למנוע היווצרות של בועות.
- צרף את מזרק 5 מיליליטר ליציאת הלחץ של בעל microelectrode עם צינורות ולהשתמש בו כדי להבטיח כי בעל microelectrode מלא של הפתרון של רינגר. השימוש במייקרו-fil ומזרק 1 מ"ל מלא הפתרון של רינגר, למלא את כוס micropipette מהקצה ולהבטיח כי אין בועות נמצאות.
- צרף micropipette הזכוכית לבעל microelectrode, להיות זהיר, כדי לשמור על ישר חוט האלקטרודה. ברגע שהשיג, להשתמש במזרק 5 מיליליטר לכפות זהירות הפתרון של רינגר דרך microelectrode עד כמות זעירה של פתרון נראית לעין בקצה. יישום מזדמן של לחץ למזרק (כאשר לא חל על קרנית) ימנע היווצרות של בועות אוויר, כמו גם חסימות בשל אבק או הצטברות מלח, בקצה micropipette.
- אם הפתרון יוצא כזרם, להחליף את gmicropipette ילדה, כפתיחת טיפ גדולה מדי או פגומה.
- זהירות במקום microelectrode ההקלטה בmicromanipulator ולצרף את יתרון מערכת ההקלטה.
6. ניתוח electroretinogram
הערה: עקב הדומיננטיות חרוט של רשתית הזחל, ניתן להשיג תוצאות ERG באיכות גבוהה כאשר הכנות להקלטה מתבצעות תחת רמות נמוכות של אור לבן עקיף (<סוויטה דה לוקס 1) או לתקופות קצרות (<1 דקות) בעוצמה גבוהה יותר ( ≤250 אור סוויטה דה לוקס) עובד. תקופה קצרה של הסתגלות כהה עדיין נדרשת לפני ההקלטה (ראה שלב 6.7). עם זאת, ניתן לבצע ניסויים באור אדום או באינפרא האדום עמום באמצעות מצלמת אינפרא אדום רגישה. כל הניסויים בוצעו במי מערכת עיקור מסנן (0.22 מיקרומטר) ממתקן UNC דג הזברה חקלאות המים אך יכול לשמש אמצעי תקשורת חלופי עובר.
- ריבועי נייר מגבת לחתוך מדידה כ 12 סנטימטר.
- אם מדידת פוטנציאל קולט המוני קונוס מבודד, דגירה 3-5 זחלים במי מערכת עם 500 מיקרומטר (±) -2--4-phosphonobutyric חומצת אמינו (APB) במשך 5 דקות.
הערה: בעוד APB הוא תערובת של רצמית הפעיל (L) וצורות לא פעילים (R) של AP4, זה יעיל כמו L-AP4 ופחות יקר. - הרדימי 3-5 זחלים במי מערכת עם 0.02% (w / v) Tricaine עד, כ 1-2 דקות להגיב.
- השתמש במשאבת פיפטה ופיפטה פסטר להעביר בזהירות זחלים בודדים על ריבועי נייר מגבת תחת stereoscope לנתח באמצעות תאורה מינימאלית (≤250 סוויטה דה לוקס ל< 1 דקות). בדוק את המיקום של כל זחל ולבחור מועמד שהוא למעלה בצד גב עם עין unoccluded.
- להקלטות ארוכות (> 30 דקות), לשמור את הזחל לח על ידי זיגוג הגוף עד, אבל לא כולל את הראש עם methylcellulose 3% בעזרת מברשת משיער הגמל בסדר.
- בעזרת מלקחיים, להעביר את squar מגבת ניירדואר עם הזחל לספוג PVA הלח.
- להקלטות ארוכות (> 30 דקות), יחול זרם רציף של O 100% רוויי מים 2 גז על הזחל ידי מבעבע הגז דרך airstone בבקבוק בצד זרוע המכיל מים מזוקקים. מקם את צינור יציאה בצד זרוע הבקבוק שמעביר את חמצן humidified ליד ראשו של הזחל.
הערה: שלב 6.4.1 וצעד 6.5.1 יהיה להאריך את החיים של הדגים 16.
- להקלטות ארוכות (> 30 דקות), יחול זרם רציף של O 100% רוויי מים 2 גז על הזחל ידי מבעבע הגז דרך airstone בבקבוק בצד זרוע המכיל מים מזוקקים. מקם את צינור יציאה בצד זרוע הבקבוק שמעביר את חמצן humidified ליד ראשו של הזחל.
- תחת תאורה מינימאלית, להשתמש micromanipulator ומצלמה לעמדת קצה microelectrode בנקודת האמצע בין האף וקצות הזנב של העין ולחץ בעדינות על גבול הגב של הקרנית.
הערה: מיקום שגוי של קצה האלקטרודה לאזורים הרחוק הדיסטלי של הקרנית יכול לגרום לגל ERG של קוטביות הפוכה. - לאפשר זחל אל dark-להסתגל למשך 5-10 דקות.
- שיא תגובות הבזק מבחן לאור הניתן ממקור אור LED או ממריץ אופטי באמצעות avaiציוד גירוי והקלטת lable. להתאים את הפרמטרים פרוטוקול כגון עוצמת הבזק, אורך הבזק, הבזק צבע, עוצמת רקע והגדרות צבע ומסנן כדי להתאים את הניסוי.
- כאשר סיימו עם הניסוי, להרדים זחלים על פי הנחיות AVMA / IACUC.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
בדרך כלל, ERGs נרשמים מזחלי דג הזברה בשעה 5 DPF, מאז מספר מחקרים שפורסמו הקלטות ERG בשלב זה 9, 16,20. תגובות הזחל נמדדו בתנאים כהים מותאם ללא תאורת רקע באמצעות גירוי msec 20 אור LED הלבן. אנו מנוצלים מערכת זמינה מסחרי בהיקף של ERG ממריץ Ganzfeld אור ובקר / צורב במחשב. ממריץ משתמש אפנון רוחב מערכת פיקוח הדוק דופק קניינית (PWM) כדי לשלוט בעוצמת ההארה של שני הרקע ופלאש גירוי. תגובות נרשמו באמצעות מגבר ההפרש במלואו קניינית עם מסנן אנטי-aliasing חומרת נהיגה אנלוגי 16-bit ממיר דיגיטלי (ADC) ל. הקלטות גירוי והתגובה היו נשלטו על ידי תוכנת קניינית כלולה בציוד על פי הפרוטוקול של היצרן. הציוד שלנו היה מתוכנת לנצל קצב דגימה של kHz 1 CASC, דיגיטלי בסלמסנני ADE מוגדרים bandpass של בין .312 הרץ ו -300 הרץ, ומסנן חריץ 60 הרץ להסרת רעש עודף. בזחל הכהה מותאם העליות ב-גל במשרעת עם הגדלת עוצמות אור (איור 1). הגל מוסתר בדרך כלל על ידי b-הגל ולא ניתן לאתר באופן אמין. ב-הגל יכול להיחסם על ידי דוגרים הזחלים עם אגוניסט קולטן גלוטמט metabotropic (mGluR6), חומצת 4 phosphono-butyric (APB). זה מאפשר לפוטנציאל קולט ההמוני קונוס (או "גל") כדי להתגלות. זה עולה "גל" תגובה במשרעת עם עוצמות גוברים של אור (איור 2).
יכולות להיות מנוצלת פרדיגמות נוספות כדי לבדוק את הפרמטרים חזותיים מעבר תפקוד ראייה בסיסי ורגישות. באמצעות השימוש בפרדיגמה הבזק כפולה, אחד יכול למדוד את היכולת של photoresponse קונוס להתאושש מהגירוי הראשוני (איור 3 א). כמרווח interstimulus(ISI) מגבירה, המשרעת של עליות התגובה השניה, המצביעה על התאוששות מהגירוי הראשוני (איור 3). העקבות מבודדת-APB "גל" שהוצגו הן ממוצעת של שלושה מטאטא ותואמות את הדיווחים שפורסמו בERGs זחל דג הזברה ניצול פרדיגמות דומות גירוי 2, 9,16.
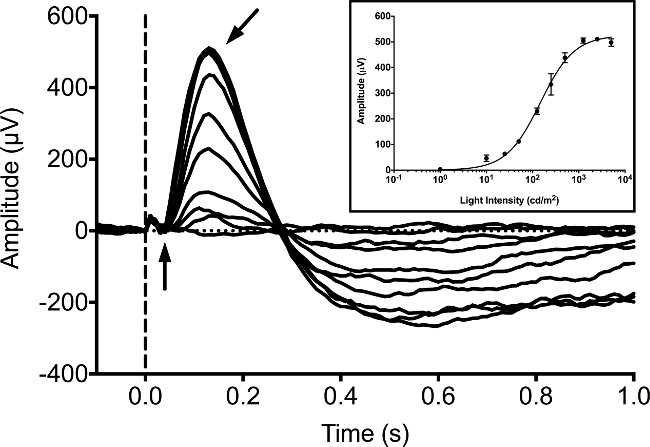
איור 1: הקלטת ERG אופיינית ב5 DPF דג הזברה זחל. סדרת עוצמת הושגה בתנאים כהים מותאמת. הדגים חשופים לאור LED הלבן למשך תקופה של 20 אלפיות שניים עם עוצמות שווה 1, 10, 25, 50 125, 250, 500, 1,250, 2,500 ו -5,000 cd / m 2. תחילתו של גירוי אור הוא כונה על ידי הקו האנכי המקווקו. גל השלילי אפשרי (חץ אנכי) קשה להבחין, ואילו החיוביב-גל פוטנציאלי (חץ זווית) הוא השיא הדומיננטי של צורת הגל. חפץ פוטו קטן ניתן לראות כסטייה חיובית קטין לפני תחילת הגל. הבלעה, בממוצע אמפליטודות תגובה ב-גל עם הגדלת עוצמות אור שכבר יתאים באמצעות משוואת Naka-ראשטון 21, 22. ברים שגיאה מייצגים SEM.

איור 2: פוטנציאל קולט המוני קונוס מבודד-APB נרשם מסדרת עצמת דג הזברה זחל שהושגה בתנאים כהים מותאם בשעה 5 DPF.. הגירוי הוא אור לבן 20 msec LED עם עוצמות שווה 1, 10, 25, 50 125, 250, 500, 1250, 2500 ו- CD 5000 / m 2. תחילתו של גירוי אור הוא כונה על ידי הקו האנכי המקווקו. קולט המבודד ההמוני קונוס הפוטנציאלי ("גל") הוא האלמנט הדומיננטי של צורת הגל (חץ). קטןחפץ פוטו ניתן לצפות כסטייה חיובית קטין לפני תחילתה של תגובת קונוס. הבלעה, בממוצע אמפליטודות תגובה עם הגדלת עוצמות אור שכבר יתאים באמצעות משוואת Naka-ראשטון. ברים שגיאה מייצגים SEM.

איור 3:.. הקלטת פוטנציאל קולט ההמוני Cone ניצול הפרדיגמה הבזק כפול 5 DPF זחל שטופל APB היה נתון לשני הבזקים 20 אלפיות שניים של אור הלבן (מקור LED), כל אחד עם עוצמה של 1,000 cd / m 2 (א) התגובה להבזקים 2 רצופים עם מרווח interstimulus (ISI) שווה ל 2 שניות. חשיפות אור מסומנות על ידי קווים אנכיים מקווקו. האמפליטודה של התגובה השנייה היא נמוכה מזה של התגובה הראשונה, המצביעה על התאוששות תגובה שלמה. (ב) היחס אין סופי קולט ההמוני קונוס המבודד המרביTiAl תגובה של הגירוי השני לזה של הגירוי הראשוני לכל ISI. ניתוח רגרסיה שאינה ליניארי מיטבית יושם. ככל שעולה ISI, התגובה לגירוי השנייה העליות במשרעת ביחס לתגובה לגירוי הראשוני המצביע על התאוששות הדרגתית של רגישות קולטי אור. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
בפרוטוקול זה הליך פשוט להקלטות ERG של דג הזברה זחל מפורט. הליך זה מאפשר לassay מהיר והמקיף של function.There החזותי מספר שלבים קריטיים בכל ההליך שצריך להיות כל הזמן בראש. זחלי דג הזברה צריכים להיות בריאים לפני הניסוי למניעת מוות בטיפולים תרופתיים פוטנציאליים ולהבטיח פרנסה ממושכת במהלך הקלטות ERG. בנוסף, חשוב שהזחלים מנוצלים בניסויים הם באופן הדוק באותו גיל. זאת בשל ההתפתחות המהירה של הרשתית (כלומר, פיתוח ההפרש של תת קונוס) וגם המורפולוגיה והפיסיולוגיה הכוללות של הזחלים. לדוגמא, לאחר 7 DPF את היעילות של דיות אפיתל ירידות ולכן קשה יותר כדי לשמור את הדגים בחיים. גורם חשוב נוסף הוא האיכות של אלקטרודות ההקלטה והתייחסות. יש לנקוט בזהירות בעת משיכת נימי זכוכית כדי למנוע t המחוספסשב"ס. Microforge micropipette יכול להיות מועסק על מנת אש-פולני משך אלקטרודות ועזרה כדי לשפר את רכישת אות. בנוסף, שמירה על איכות אלקטרודות Ag / AgCl היא מאוד חשובה. לאחר שימוש, הם חייבים לשטוף עם מים מזוקקים ואוויר היבש באופן מיידי. בעוד מחשיך של פני השטח החיצוניים של אלקטרודות יכול להתרחש עם זמן ולא משפיע על ביצועים, הכתים (צהוב לאדום כהה) או יש להימנע אלקטרודות מגולענים. הימנע אלקטרודות טיפול בידיים חשופות, כמו זיהום חלבון יכול להשפיע לרעה על התנהגות אלקטרודה. לבסוף, יש לציין כי אלקטרודות Ag / AgCl הן רגישים ויכולות להוביל חפצי הבזק אם לא מוגן. עם זאת, מצאנו ממצאים אלה כדי להיות מינימאליים (ראו אגדות לאיורי 1 ו -2) ולא להפריע למדידות של תגובות דג הזברה הזחל להבהב גירויים שלנו. לחלופין, גשר מלח יכול לשמש לחיבור האלקטרודה Ag / AgCl לספוג באמצעות sa אגרגשר lt להעביר את האלקטרודה מנתיב האור. למרות שגשר מלח משמש בהקלטות ישירות הנוכחיות (DC) כדי לייצב את האלקטרודה 23 פוטנציאליים, הקלטת ERG מנצלת זרם חילופין (AC). לכן המטרה היחידה של גשר מלח במערכת זו תהיה אם יש הגדרה המסוימת אילוצי שטח או חפצי פוטו חזקים במיוחד.
יש ERG מספר יתרונות על פני שיטות אחרות למדידת תפקוד ראייה. היתרון העיקרי הוא שזה הקלטת in vivo. החסרון הוא שהפעילות של תאים ספציפיים יש להסיק מצורת הגל ולא נמדדו באופן ישיר, כפי שניתן היה במקרה של הקלטות האלקטרודה יניקה או מהדק תיקון של קולטני אור ותאים אחרים ברשתית. בדרך כלל, יש לי ERGs הקלטות האלקטרודה יניקה, הקלטות מהדק תיקון ורשתית כל היתרון שסוכנים תרופתיים יכולים בקלות להיות מוצגות לתאים כדי להגדיר את המרכיבים המולקולרייםשל התגובה, ואילו זה יותר קשה in vivo תוך שימוש במודלים של יונקים. החדירות של זחלי דג הזברה לסוכנים כגון מתגברת על חסרון זה.
ניתוח של זחלים כהים מותאמת בהעדר סוכנים תרופתיים מייצר צורת גל ERG נשלט על ידי b-הגל, תוצאה שנצפתה על ידי מספר קבוצות אחרות 2, 9,24 -26. אנחנו מדגימים את היכולת לבודד את פוטנציאל קולט ההמוני החרוט על ידי ניצול של היכולת של סוכנים תרופתיים לחדור דג הזברה זחל. זחלים שטופלו בAPB להציג ביטול ב-הגל, המאפשר "גל" להיות דמיין 14-17. גל עם אות מצוינת ליחסי רעש התקבל על ידי ממוצע 3 מטאטא. לפעמים שינוי בגל התגובה יצוין, אבל Makhankov et al. 2 דיווחו כי השונות במדידות חוזרות ונשנות של אותו בעל חיים הוא פחותמזה ראה בין אנשים. לכן, את השונות עלולות להיות התוצאה של וריאציה ביולוגית ולא שונות בטכניקה.
כמו כן, אנו מנוצלים ניתוח ERG לבחון התאוששות קונוס in vivo באמצעות פרדיגמה הבזק כפולה, בדומה לתוצאות שפורסמו בנוכחות והיעדר תאורת רקע 9, 16. הדבר זה הושג על ידי מדידת היכולת של רשתית הזחל להגיב להבזקים רצופים של משתנה ISI. כאשר משתמש בשילוב עם סוכנים תרופתיים או אסטרטגיות הנדסת הגנום כגון TALENs כדי לדפוק את מטרות מסלול, דג הזברה היא מערכת רבת עוצמה למחקר in vivo של המכניקה המולקולרית של הסתגלות והתאוששות קונוס חזותית.
ההליך ואת הציוד שלנו יכולים בקלות להיות מותאם לבחון עיניים מבודדות זחל, דג הזברה מבוגרת או בעלי חוליות אחרות 27, 28. למעשה, מערכת הגירוי והקלטת ERGכי אנו מעסיקים היו בעיקר מיועדים לשימוש בסביבה קלינית ולאחר מכן שונה לניסויים בעכברים. התאמת הפלטפורמה לזחלי דג הזברה הייתה פשוטה ויכול היה בקלות להיות משוכפלת במעבדות אחרות עבור עלות נמוכה. הגדרות דומות בהיקף של ציוד אלקטרו הקלאסי יכולות להיות בנויות לבעלות מינימאלית, וכבר הוכיחו לספק תוצאות אמינות 16. בסך הכל, טכניקה זו היא יתרון גדול של חוקרי חקר המנגנונים של תפקוד ראייה.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
אין ניגודי האינטרסים הכריזו.
Materials
| Name | Company | Catalog Number | Comments |
| Faraday cage | 80/20 Inc | custom | Custom designed aluminum "Industrial Erector Set" for Cage framework |
| PVA sponge | Amazon | B000ZOWG1C | Provides a soft, moist platform for placement of zebrafish larvae |
| 150 ml Sterile Filter systems | Corning | 431154 | Filtering solutions to prevent small articulates from blocking micropipettes |
| Espion E2 | Diagnosys, LLC | contact | Modular electrophysiology system capable of generating visual stimuli for any stimulator and digital recording and analysis of responses using propietary software, more information at http://www.diagnosysllc.com |
| Colordome | Diagnosys, LLC | contact | Light stimulator with RGB LED and Xenon light sources for Ganzfeld ERG, more information at http://www.diagnosysllc.com |
| Micromanipulator | Drummond | 3-000-024-R | Holding and positioning the recording microelectrode |
| Magnetic ring stand | Drummond | 3-000-025-MB | Holding and positioning of the camera and refrence electrode |
| Lead extensions | Grass Technologies | F-LX | Spare female to male 1.5 mm lead cables for connecting electrodes |
| Male Pin to Female SAFELEAD Adaptor | Grass Technologies | DF-215/10 | Connecting 2 mm pins to 1.5 headboard pins |
| Window screen frame (metal) and spline | Lowes or Home Depot | various | For attaching copper mesh to Faraday cage framework |
| Steriflip 50 ml filters | Millipore | SCGP00525 | Filtering solutions to prevent small articulates from blocking micropipettes |
| BNC adaptor | Monoprice | 4127 | Connecting camera to BNC cable |
| BNC cable | Monoprice | 626 | Connecting camera to video adaptor |
| Camera lens | Navitar | 1582232 | Visualizing the positioning of the recording microelectrode onto the larval cornea |
| Camera coupler | Navitar | 1501149 | Visualizing the positioning of the recording microelectrode onto the larval cornea |
| Luna BNC to VGA + HDMI Converter | Sewell | SW-29297-PRO | BNC to VGA adaptor allowing camera image to project on computer monitor |
| APB | Sigma | A1910 | mGluR6 agonist, blocks b-wave allowing analysis of the isolated cone mass receptor potential |
| Borosilicate glass | Sutter | BF-150-86-10 | Fire- polished borosilicate glass (metling temperature = 821°C) with filament and dimensions of 1.5mm x 0.86 mm (outer diameter by inner diameter) |
| P97 Flaming/Brown puller | Sutter | P97 | For pulling glass micropipettes |
| Sorbothane sheet | Thorlabs | SB12A | Synthetic viscoelastic urethane polymer, placed under Passive Isolation Mounts and ERG platform to absorb shock and prevent slipping, can be cut to size |
| Breadboard | Thorlabs | B2436F | Vibration isolation platfrom for ERG stimulator and zebrafish specimen |
| Passive Isolation Mounts | Thorlabs | PWA074 | Provides vibration isolation to breadboard |
| Copper mesh | TWP | 022X022C0150W36T | To line Faraday Cage |
| Pipette pump | VWR | 53502-233 | Used with Pasteur pipettes to carefully transfer zebrafish larvae |
| Pasteur pipettes | VWR | 14672-608 | Used with Pipette pump to carefully transfer zebrafish larvae |
| Camera | Watec | WAT-902B | Visualizing the positioning of the recording microelectrode onto the larval cornea |
| Tricaine (MS-222) | Western Chemical | Tricaine-S | Pharmaceutical-grade anesthetic, |
| Micro-fil | WPI | MF28G-5 | Filling microelectrode holder and microelectrode glass |
| Microelectrode holder | WPI | MEH2SW15 | Holds glass microelectrode, connects to ERG equipment |
| Reference Electrode | WPI | DRIREF-5SH | Carefully break off last centimeter of casing to drain electrolyte and expose sintered Ag/AgCl pellet electrode |
| Reference Electrode (alternative) | WPI | EP1 | Alternative to DRIREF-5SH. Ag/AgCl electrode that must be wired/soldered to connecting lead |
| Low-noise cable for Microelectrode holder | WPI | 13620 | Connecting recording microelctrode holder to adaptor/headboard |
References
- Dowling, J. E. The retina: an approachable part of the brain. , Harvard University Press. Cambridge, MA. (1987).
- Makhankov, Y. V., Rinner, O., Neuhauss, S. C. An inexpensive device for non-invasive electroretinography in small aquatic vertebrates. J Neurosci. Methods. 135, 205-210 (2004).
- Wu, J., Peachey, N. S., Marmorstein, A. D. Light-evoked responses of the mouse retinal pigment epithelium. J Neurophysiol. 91, 1134-1142 (2004).
- Heckenlively, J. R., Arden, G. B. Principles and Practice of Clinical Electrophysiology of Vision. , 2nd edn, The MIT Press. Cambridge, MA. (2006).
- Perlman, I. Webvision: The Organization of the Retina and Visual System. Kolb, H., Nelson, R., Fernandez, E., Jones, B. , (1995).
- Fadool, J. M., Dowling, J. E. Zebrafish: a model system for the study of eye genetics. ProgRetin. Eye Res. 27, 89-110 (2008).
- Doerre, G., Malicki, J. Genetic analysis of photoreceptor cell development in the zebrafish retina. Mech. Dev. 110, 125-138 (2002).
- Brockerhoff, S. E., et al. Light stimulates a transducin-independent increase of cytoplasmic Ca2+ and suppression of current in cones from the zebrafish mutant nof. J Neurosci. 23, 470-480 (2003).
- Rinner, O., Makhankov, Y. V., Biehlmaier, O., Neuhauss, S. C. Knockdown of cone-specific kinase GRK7 in larval zebrafish leads to impaired cone response recovery and delayed dark adaptation. Neuron. 47, 231-242 (2005).
- Harada, T., Harada, C., Parada, L. F. Molecular regulation of visual system development: more than meets the eye. Genes Dev. 21, 367-378 (2007).
- Branchek, T. The development of photoreceptors in the zebrafish, brachydaniorerio. II. Function. J Comp Neurol. 224, 116-122 (1984).
- Schmitt, E. A., Dowling, J. E. Early retinal development in the zebrafish, Daniorerio: light and electron microscopic analyses. J Comp Neurol. 404, 515-536 (1999).
- Bilotta, J., Saszik, S., Sutherland, S. E. Rod contributions to the electroretinogram of the dark-adapted developing zebrafish. Dev Dyn. 222, 564-570 (2001).
- Wong, K. Y., Adolph, A. R., Dowling, J. E. Retinal bipolar cell input mechanisms in giant danio. I. Electroretinographic analysis. J Neurophysiol. 93, 84-93 (2005).
- Nelson, R. F., Singla, N. A spectral model for signal elements isolated from zebrafish photopicelectroretinogram. Vis Neurosci. 26, 349-363 (2009).
- Korenbrot, J. I., Mehta, M., Tserentsoodol, N., Postlethwait, J. H., Rebrik, T. I. EML1 (CNG-modulin) controls light sensitivity in darkness and under continuous illumination in zebrafish retinal cone photoreceptors. J Neurosci. 33, 17763-17776 (2013).
- Gurevich, L., Slaughter, M. M. Comparison of the waveforms of the ON bipolar neuron and the b-wave of the electroretinogram. Vision Res. 33, 2431-2435 (1993).
- Westerfield, M. The Zebrafish Book: A guide for the laboratory use of zebrafish (Daniorerio). , 5th edn, University of Oregon Press. Portland, OR. (2007).
- Kim, D. Y., Jung, C. S. Gap junction contributions to the goldfish electroretinogram at the photopic illumination level. Korean J PhysiolPharmacol. 16, 219-224 (2012).
- Brockerhoff, S. E., Dowling, J. E., Hurley, J. B. Zebrafish retinal mutants. Vision Res. 38, 1335-1339 (1998).
- Naka, K. I., Rushton, W. A. S-potentials from colour units in the retina of fish (Cyprinidae). J Physiol. 185, 536-555 (1966).
- Naka, K. I., Rushton, W. A. S-potentials from luminosity units in the retina of fish (Cyprinidae). J Physiol. 185, 587-599 (1966).
- Shao, X. M., Feldman, J. L. Micro-agar salt bridge in patch-clamp electrode holder stabilizes electrode potentials. J Neurosci. Methods. 159, 108-115 (2007).
- Brockerhoff, S. E., et al. A behavioral screen for isolating zebrafish mutants with visual system defects. ProcNatlAcadSci. U S A. 92, 10545-10549 (1995).
- Fleisch, V. C., Jametti, T., Neuhauss, S. C. Electroretinogram (ERG) Measurements in Larval Zebrafish. CSH protocols. , (2008).
- Seeliger, M. W., Rilk, A., Neuhauss, S. C. Ganzfeld ERG in zebrafish larvae. Doc Ophthalmol. 104, 57-68 (2002).
- Kainz, P. M., Adolph, A. R., Wong, K. Y., Dowling, J. E. Lazy eyes zebrafish mutation affects Müller glial cells, compromising photoreceptor function and causing partial blindness. J Comp Neurol. 463, 265-280 (2003).
- Lewis, A., et al. Celsr3 is required for normal development of GABA circuits in the inner retina. PLoS. genetics. 7, e1002239 (2011).



