Abstract
Elektroretinogrammet (ERG) er en ikke-invasiv elektrofysiologisk metode for å bestemme netthinnefunksjon. Gjennom plassering av en elektrode på overflaten av hornhinnen, som genereres elektrisk aktivitet som svar på lys som kan måles og brukes for å vurdere aktiviteten av retinale celler in vivo. Dette manuskriptet beskriver bruken av ERG å måle synsfunksjon i sebrafisk. Sebrafisk har lenge vært anvendt som en modell for vertebrate utvikling på grunn av den enkle gensuppresjon ved morfolino oligonukleotider og farmakologisk manipulasjon. På 5-10 dpf, bare kjegler er funksjonelle i larvenetthinnen. Derfor, sebrafisk, i motsetning til andre dyr, er en kraftig modellsystem for studier av kjeglen visuell funksjon in vivo. Denne protokollen bruker standard anestesi, micromanipulation og stereomikros protokoller som er vanlig i laboratorier som utfører sebrafisk forskning. De skisserte metoder gjør bruk av standard elektro equipment og en lav lys-kamera for å lede plasseringen av opptaks microelectrode på larve hornhinne. Til slutt viser vi hvordan en kommersielt tilgjengelig ERG stimulator / opptaker opprinnelig utviklet for bruk med mus kan lett tilpasses for bruk med sebrafisk. ERG av larvesebrafisk gir en utmerket metode for å analysere kjegle visuell funksjon i dyr som har blitt modifisert av morfolino- oligonukleotid injeksjon samt nyere genom engineering teknikker som sink Finger nukleaser (ZFNs), transkripsjon Activator-Like Effector nukleaser (Talens), og Gruppert regelmessig interspaced Korte palindromisk Gjentar (CRISPR) / Cas9, som alle har betydelig økt effektivitet og effekt av genet målretting i sebrafisk. I tillegg tar vi nytte av muligheten for farmakologiske midler til å trenge sebrafisk larver å evaluere de molekylære komponenter som bidrar til photoresponse. Denne protokollen skisserer et oppsett som kan endres og brukes av forskeremed ulike eksperimentelle mål.
Introduction
Elektroretinogrammet (ERG) er en ikke-invasiv elektrofysiologisk metode som har vært brukt i stor utstrekning i klinikken for å bestemme funksjonen av retina hos mennesker. Den elektriske aktivitet som svar på en lett stimulus måles ved å plassere opptakselektroder på den ytre overflaten av hornhinnen. Det karakteristiske ved stimulus paradigmet og responsen bølgeform definerer de retinale nevroner som bidrar til reaksjonen. Denne metode er blitt tilpasset for bruk med en rekke dyremodeller, inkludert mus og sebrafisk. Den typiske vertebrate ERG respons har fire hovedkomponenter: en bølge, som er en hornhinne-negativt potensial avledet fra fotoreseptoren celleaktivitet; b-bølge, en hornhinne-positive potensial avledet fra ON bipolare celler; d-bølge, en hornhinne-positive potensial tolket som aktiviteten av de av bipolare celler; og c-bølge, som forekommer i flere sekunder etter at b-bølgen og viser aktivitet i Müller gliaceller og retInal pigment epitel 1-4. Andre referanser for å forstå historien og prinsipper av ERG analyse hos mennesker og modell dyr er den elektroniske lærebok, Webvision, fra University of Utah og tekster som prinsipper og praksis for klinisk Elektro av Vision 4, 5.
Danio rerio (sebrafisk) har lenge vært foretrukket som en modell for virveldyr utvikling, på grunn av sin raske modning og åpenhet, som gjør det mulig for ikke-invasiv morfologisk analyse av organsystemer, atferdsanalyser og både framover og bakover genetiske skjermer (for oversikt, se Fadool og Dowling 6). Sebrafisk larver er svært mottagelig for genetisk manipulasjon og farmakologisk, som, når kombinert med deres høye fruktbarhet, gjør dem til et utmerket dyremodell for high-throughput biologiske analyser. Jo høyere forholdet mellom kjegler til stenger i larvesebrafisk - omtrent 1: 1 i forhold til mus (~ 3% kjeglee) - gjør dem særlig anvendelige for studium av kjeglen funksjon 7-9.
I virveldyr netthinnen, kjegler utvikle før stenger 10. Interessant, sebrafisk kjegler er operative så tidlig som 4 dpf, noe som åpner for selektiv elektrofysiologisk analyse av kjegler på det stadiet 6, 11,12. I kontrast, ERG responser i stenger vises mellom 11 og 21 dpf 13. Derfor, sebrafisk larver 4-7 dpf tjene funksjonelt som en all-cone netthinnen. Imidlertid er den native photopic ERG respons på 4-7 dpf larver dominert av b-bølge. Anvendelse av farmakologiske midler, så som L - (+) - 2-amino-4-fosfono-smørsyre (L-AP4), en agonist for metabotropic glutamat (mGluR6) reseptoren uttrykkes ved ON bipolare celler, effektivt blokkerer dannelsen av b-bølgen og avslører den isolerte membran masse reseptor potensial, ("a-bølge") 14-17.
Her beskriver vi en enkel og reliable metode for ERG analyse ved hjelp av kommersielt tilgjengelig ERG utstyr utformet for bruk med mus som har blitt tilpasset for bruk med sebrafisk larver. Dette systemet kan utnyttes på sebrafisk larver av varierende genetiske bakgrunn, så vel som de som ble behandlet med legemidler som er, for å hjelpe forskere i identifisering av signalveier som bidrar til visuell følsomhet og lys tilpasning 16. De eksperimentelle prosedyrer som er skissert i denne protokollen vil lede etterforskerne i bruk av ERG analyse for å besvare en rekke biologiske spørsmål knyttet til syn, og demonstrere bygging av en fleksibel ERG oppsett.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Animal vedlikehold og eksperimentelle protokoller ble godkjent av Institutional Animal Care og bruk komiteer ved University of North Carolina i Chapel Hill, og oppfyller alle krav i NIH Office of Laboratory Animal Welfare og Foreningen for Assessment and Accreditation of Laboratory Animal Care International.
MERK: For å få larver for ERG analyse, publisert protokoller for standard sebrafisk oppdrett og vedlikehold var ansatt 18. Larvene er innhentet gjennom naturlig avl og ligger under en 14 timers lys / 10 timers mørke syklus. Denne protokollen er optimalisert for larver på 5-7 dager etter befruktning (DPF), men kunne ideelt sett utføres på eldre fisk med små modifikasjoner til prosedyren. Her bruker TL stamme av vill-type sebrafisk larver på 5 dpf.
1. Mikropipette Produksjon
- Trekke flere mikropipetter bruker 1,5 x 0,86 mm (ytre diameter av indre diameter) brann polert borsilikatglass kapillærer medfilament (smeltetemperatur, 821 ° C) og en P-97 Flaming / Brown Mikropipette Puller utstyrt med boks varme filament. Bruke programmet for fashioning mikropipetter beskrevet i tabell 1.
- Sjekk hver mikropipette under et mikroskop med en passende graticule linjal for å sikre at tips er 10-15 mikrometer i diameter og har en glatt spiss åpning (dvs. ingen skarpe kanter).
- Nøye lagre mikropipetter å hindre spissen skader og eksponering for støv. Lagringsalternativene omfatter petriskåler med lab tape, skum-lined bokser, eller kommersielt tilgjengelige mikropipette lagercontainere.
MERK: Andre Mikropipette jekk og glasskapillærer kan brukes så lenge den riktige diameteren på mikropipette og en høy kvalitet spissen er oppnådd.
| Press | Hete | Trekk | Velocity Tid | |
| 500 | 560 | - | 30 | 200 |
| 500 | 450 | - | 30 | 200 |
| 500 | 410 | 55 | 40 | 200 |
Tabell 1: Program for fremstilling av mikropipetter ved hjelp av en P-97 Brenn / brun Mikropipette Puller utstyrt med en boks varmefilament Mikropipetter er laget ved å bruke 1,5 x 1,0 mm 2 (ytre diameter av indre diameter) brannpolerte borsilikat glasskapillærer med glødetråd. (smeltetemperatur 821 ° C).
2. Buffer Forberedelse
- Bruk filtrert, oksygenert gullfisk Ringer-buffer 19 i microelectrode kapillær og for å mette polyvinylalkohol (PVA) svamp på hvilken larven er plassert for eksperimenter. Alternativt kan du bruke E3 embryo media eller Hank balanserte saltoppløsning.
- Forberede 10x gullfisk Ringers løsning som beskrevet i Tabell 2. Juster til pH 7,8, og sterilisere ved hjelp av en 0,22 mikrometer filter og lagre 10x lager ved 4 ° C.
- Opprette en arbeidsoppløsning på dagen for forsøket ved fortynning av 10 x Ringers løsning 1x med deionisert, destillert vann. Filtrer ved anvendelse av en 0,22 um filtersystem. Oksygenat ved å boble med 95% O2 / 5% CO2-gass i 10 minutter. Cap tett etterpå for å sikre at løsningen forblir oksygenrikt.
| NaCl | 1.25 M |
| KCl | 26 mm |
| CaCl2 | 25 mM |
| MgCl2 | 10 mm |
| glukose | 100 mM |
| HEPES | 100 mM |
3. elektroretinogrammet Platform
- Utføre ERG eksperimenter på en anti-vibrasjonsbord i et Faraday-bur for å forbedre signal-til-støy-forholdet. Fest en tilpasset stålplattform til den antivibrasjonsbord med sekskantede nøtter. Plasser en bevegelig plastplattform med en viskoelastisk uretanpolymer støtabsorberende bunnen på bordet under lyskilden.
- Plasser kameraet med en magnetisk stativ, rettet ned på den bevegelige plast plattformen. Plasser mikromanipulator (som vil holde opptaks microelectrode) med en andre magnetisert stand til høyre for den bevegbare plastplattformen. Sørg for at kameraet og mikromanipluatoren ikke vil bli forstyrret av bevegelsen av annet utstyr, og at de ikke blokkerer belysning fra lyskilden.
- Koble kameraet til en videoskjerm og plassere den for å vise øyet avlarve for å plassere elektroden i riktig stilling.
- Sørg for at oppsettet er skikkelig jordet med kobbertråd. Å kontrollere støy, plasserer referanseelektrode og tips av opptaket microelectrode i en 35 mm petriskål fylt med Ringers løsning. Sjekk de elektriske støynivåer oppsettet med et oscilloskop eller en innebygd funksjon i ERG apparat. Støynivået skal ikke være mer enn ± 10 uV fra baseline.
4. Sponge Forberedelse
- Skjær et lite rektangel av tørr PVA svamp som vil passe perfekt i et 35 mm petriskål. Tykkelsen av svampen skal ikke være større enn dybden av fatet. Bruk et verktøy kniv med et rent barberblad for å kutte.
- Foreta en ytterligere kutt i svampen for å få plass til referanseelektroden (enten et grunt kutt i lengderetningen på bunnen av svamp eller en sommerfugl skjære vertikalt gjennom en av de mindre ender).
- Bruke et kjemisk motstandsdyktig markørfor å markere et lite punkt på svampen (hvor larven vil bli plassert) som kan brukes for å posisjonere kameraet.
- Bløtlegg PVA svamp i Ringers løsning inntil mettet. Ta ut og tørk raskt på et papirhåndkle 2-3 ganger. Plasser svamp i en ren 35 mm petriskål.
- Plasser petriskål inneholdende svampen på plastplattformen, slik at merket kan visualiseres ved kameraet.
5. elektrode Forberedelse
MERK: sebrafisk oppsett består av en referanseelektrode i kontakt med Ringers løsning mettet PVA svamp og en opptakselektrode i kontakt med cornea. Referanseelektroden består av en Ag / AgCl-pellet. Innspillingen elektrode er en trakk glass mikropipette fylt med Ringers løsning og holdt av en microelectrode holder som inneholder en Ag wire.
- Klorid elektrodene ved å dyppe dem i 6-9% natriumhypokloritt (blekemiddel) i 5 min (opptaks microelectrode wire) eller 15 min (referanseelektrode). Lufttørke på et Kimwipe for 5 min.
- Avhengig av stilen av kutt gjort i trinn 4.2, plasserer Ag / AgCl pellet av referansen elektrode inn i (for den vertikale sommerfugl cut) eller under (for den grunne kutt på langs på bunnen) svampen. Fest referanseelektrode føre til opptakssystemet.
- Alternativt, hvis ERG oppsettet har plassbegrensninger eller det foreligger særlig sterke photovoltaic gjenstander fra Ag / AgCl-elektrode, koble referanseelektrode til svampen via en agar salt bro å flytte elektroden ut av lysbanen.
- Fest ~ 40 cm av riktig størrelse slangen til en 5 ml ikke-Luer lock sprøyte. Fyll sprøyten med Ringers løsning. Microelectrode holdere innehar trykk portene vanligvis leveres med adaptere for å imøtekomme rør med indre diameter på 1/16 ", 3/32", 1/8 "eller 5/32".
- Fyll en 1 ml ikke-Luer lock sprøyte medRingers løsning og med en Micro-fil, fylle microelectrode holder nøye. Forhindre dannelse av bobler.
- Fest 5 ml sprøyte til trykkporten for den microelectrode holderen med slangen og bruke den til å sikre at microelectrode holderen er full av Ringers løsning. Bruker Micro-fil og en-ml sprøyte fylt med Ringers løsning, fyll mikropipette glass fra spissen og sikre at ingen luftbobler.
- Fest glass mikropipette til microelectrode holder, er forsiktig med å holde elektrodeledningen rett. Når det er sikret, bruker 5 ml sprøyte til å nøye tvinge Ringers løsning gjennom microelectrode inntil en liten mengde oppløsning er synlig på spissen. Sporadisk anvendelse av trykk på sprøyten (når den ikke brukes på hornhinnen) vil forhindre dannelse av luftbobler, samt okklusjoner på grunn av støv eller salt akkumulering, i mikropipette spissen.
- Hvis løsningen kommer ut som en bekk, erstatte glass mikropipette, idet tuppen åpningen er for stor eller er skadet.
- Plasser forsiktig opptak microelectrode i mikromanipluatoren og fest ledningen til opptakssystemet.
6. elektroretinogrammet Analyse
MERK: På grunn av kjeglen dominans av larvenetthinnen, kan høy kvalitet ERG resultater oppnås når forberedelsene til innspillingen utføres under lave nivåer av indirekte hvitt lys (<1 lux) eller med korte perioder (<1 min) av høyere intensitet ( ≤250 lux) arbeidslys. En kort periode på mørk tilpasning er fortsatt nødvendig før opptak (se trinn 6.7). Imidlertid kan eksperimenter utføres under svakt rødt eller infrarødt lys ved hjelp av en infrarød-sensitive kamera. Alle forsøkene ble utført i filter-sterilisert (0,22 mikrometer) system vann fra UNC Sebrafisk oppdrettsanlegg men alternative embryo medier kan brukes.
- Kuttet papir håndkle firkanter som måler ca. 1cm2.
- Ved måling av isolerte membran masse reseptor potensial, inkuber 3-5 larver i systemet vann med 500 pM (±) -2-amino-4-fosfonosmørsyre syre (APB) i 5 min.
MERK: Mens APB er en racemisk blanding av den aktive (L) og inaktive (R) former for AP4, er den så effektiv som L-AP4 og er rimeligere. - Bedøve 3-5 larver i system vann med 0,02% (w / v) Tricaine inntil svarer, ca 1-2 min.
- Bruk en Pasteur pipette og pipette pumpe å nøye overføre enkelte larver på papir håndkle torg under en dissekere stereoskop bruker minimal belysning (≤250 lux for <1 min). Kontroller posisjonen til hver larve og velge en kandidat som er rygg side opp med et utildekket øye.
- For lengre opptak (> 30 min), holde larven fuktig ved innglassing kroppen opp til, men ikke inkludert hodet med 3% propylmetylcellulose med en fin kamel-hårbørste.
- Bruk pinsett, overføre papirhåndkle square med larven til fuktig PVA svamp.
- For utvidede opptak (> 30 min), gjelder en kontinuerlig strøm av vannmettet 100% O 2 gass over larve ved å boble gassen gjennom en airstone i en side-arm-kolbe inneholdende destillert vann. Plasser slangen som kommer ut av flasken side-arm som formidler fuktet oksygen nær larven hode.
MERK: Trinn 6.4.1 og trinn 6.5.1 vil forlenge levetiden på fisken 16.
- For utvidede opptak (> 30 min), gjelder en kontinuerlig strøm av vannmettet 100% O 2 gass over larve ved å boble gassen gjennom en airstone i en side-arm-kolbe inneholdende destillert vann. Plasser slangen som kommer ut av flasken side-arm som formidler fuktet oksygen nær larven hode.
- Under minimal belysning, bruker mikromanipulator og kameraet for å plassere microelectrode spissen på midtpunktet mellom nasal og caudal ender av øyet og press mot ryggramme på hornhinnen.
MERK: feilplassering av elektroden tips til langt distale områder av hornhinnen kan føre til ERG bølgeformer av reversert polaritet. - Tillate larve til mørk-tilpasse for 5-10 min.
- Rekord test flash svar på lys gitt fra en LED-lyskilde eller optisk stimulator bruker tilgjenglable stimulering og opptaksutstyr. Juster protokollparametre som blitsstyrken, blits lengde, flash farge, bakgrunn intensitet og farge og filterinnstillingene for å passe eksperimentet.
- Når du er ferdig med eksperimentet, avlive larver ifølge AVMA / IACUC retningslinjer.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Vanligvis erg er registrert fra sebrafisk larver på 5 dpf, siden en rekke studier har publisert ERG opptak på dette stadiet 9, 16,20. Larve respons ble målt under mørke-tilpasset forhold uten bakgrunnsbelysning ved hjelp av en 20 msek stimulans av hvitt LED lys. Vi utnyttet en kommersielt tilgjengelig ERG system bestående av en ganzfeld lys stimulator og datamaskin kontrolleren / opptaker. Den stimulator benytter en kontrollert proprietær pulsbreddemodulasjon (PWM) system for å kontrollere lys i både bakgrunnen og flash-stimulus. Svarene ble registrert med en proprietær fullt differensial forsterker med en hardware anti-aliasing filter kjører en 16-bits analog til digital omformer (ADC). Stimulus og respons opptakene ble kontrollert av proprietær programvare som følger med utstyret i henhold til produsentens protokoll. Vårt utstyr ble programmert til å utnytte en samplingsfrekvens på 1 kHz, digital Bessel kaskadeade filtre satt til et båndpass på mellom 0,312 Hz og 300 Hz, og en 60 Hz smalbåndsfilter for å fjerne overskudd av støy. I det mørketilpasset larve de b-bølge øker i amplitude med økende lysintensitet (figur 1). Den a-bølgen er vanligvis skjult av B-bølgen og kan ikke påvises med sikkerhet. B-bølgen kan være blokkert ved inkubering av larvene med metabotropisk glutamatreseptor (mGluR6) agonist, 4-fosfono-smørsyre (APB). Dette gjør det mulig for membranen masse reseptor potensial (eller "en-bølge") som skal detekteres. Denne "a-bølge" respons øker i amplitude med økende intensitet av lys (figur 2).
Ytterligere paradigmer kan benyttes til å teste visuelle parametere utover enkel visuell funksjon og følsomhet. Ved bruk av en dual flash paradigme, kan man måle evnen av konusen photoresponse å utvinne fra den første stimulus (figur 3A). Som interstimulus intervall(ISI) øker, amplituden av de andre svar øker, noe som indikerer gjenvinning fra den første stimulus (figur 3B). De APB-isolert "en-bølge" spor som presenteres er gjennomsnittet av tre feier og i samsvar med publiserte rapporter om sebrafisk larver erg utnytte lignende stimulering paradigmer 2, 9,16.
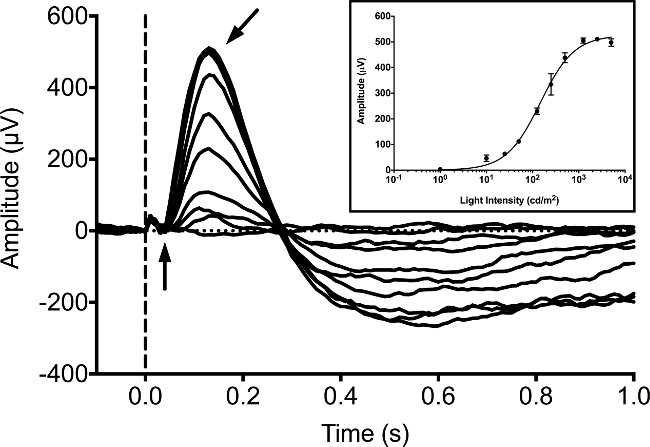
Figur 1: Typisk ERG opptak i fem dpf larvesebrafisk. Intensiteten serien ble innhentet under mørke-tilpasset forholdene. Fisken utsettes for LED hvitt lys i en varighet på 20 msek med intensitet lik 1, 10, 25, 50 125, 250, 500, 1250, 2500 og 5000 cd / m 2. Utbruddet av lys stimulus er angitt med den stiplede vertikale linjen. Det negative potensial a-bølge (vertikal pil) er vanskelig å skille, mens den positivepotensial b-bølge (vinklet pil) er den dominerende topp av bølgeformen. En liten photovoltaic artefakt kan observeres som en mindre positiv utslag før utbruddet av en bølge. Inset, gjennomsnitt b-bølge respons amplituder med økende intensitet av lys som har blitt passe hjelp av Naka-Rushton ligning 21, 22. Feilfelt representerer SEM.

Figur 2: APB-isolert kjegle masse reseptor potensial registrert fra larvesebrafisk Intensitet serie innhentet under mørke-tilpasset forholdene på 5 dpf.. Stimulus er en 20 ms LED hvitt lys med intensitet tilsvarer 1, 10, 25, 50 125, 250, 500, 1250, 2500 og 5000 cd / m 2. Utbruddet av lys stimulering er betegnet med den stiplede vertikale linjen. Det isolerte membran masse reseptor potensial ("a-bølge") er den dominerende del av bølgeformen (pil). En litenfotovoltaiske artifakt kan observeres som en mindre positiv avbøyning før utbruddet av konusen respons. Inset, gjennomsnitt respons amplituder med økende intensitet av lys som har blitt passe hjelp av Naka-Rushton ligningen. Feilfelt representerer SEM.

Figur 3:.. Cone masse reseptor potensiell opptak benytte en dobbel blits paradigme En 5 dpf APB-behandlet larve ble utsatt for to 20 msek blinker av hvitt lys (LED kilde), hver med en intensitet på 1000 cd / m 2 (A) Responsen på to påfølgende blinker med en interstimulus intervall (ISI) lik 2 sek. Lys eksponeringer er preget av stiplede vertikale linjer. Amplituden av den andre reaksjon er lavere enn den for den første reaksjon, som indikerer ufullstendig reaksjon utvinning. (B) Forholdet mellom den maksimale isolerte membran masse reseptor potensiell reaksjon av den andre stimulus som i den innledende stimulus for hver ISI. En best skikket ikke-lineær regresjonsanalyse har blitt påført. Som ISI øker, responsen til de andre stimulans øker i amplitude i forhold til responsen på den første stimulus som indikerer progressiv utvinning av fotoreseptor følsomhet. Klikk her for å se en større versjon av dette tallet.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
I denne protokollen en enkel prosedyre for ERG opptak av larvesebrafisk er detaljert. Denne prosedyren gir en rask og omfattende analyse av visuell function.There er flere kritiske trinn i hele prosedyren som bør holdes i bakhodet. Sebrafisk larver bør være frisk før forsøket å forhindre død under potensielle medikamentelle behandlinger og sikre langvarig levebrød under ERG opptak. I tillegg er det viktig at larvene benyttet i eksperimentene er tett alder-matchet. Dette er på grunn av den raske utviklingen av netthinnen (dvs. differensial utvikling av kjegle subtyper) og også den totale morfologi og fysiologi av larvene. For eksempel, etter 7 dpf effektiviteten av epitel tran avtar noe som gjør det vanskeligere å holde fisken i live. En annen viktig faktor er kvaliteten på opptaket og referanseelektroder. Hensyn må tas når trekke glasskapillærer for å hindre grov kanter tips. En mikropipette microforge kan benyttes til brann polsk trakk elektroder og bidra til å forbedre signal oppkjøpet. I tillegg opprettholder kvaliteten til Ag / AgCl-elektroder er meget viktig. Etter bruk, må de skylles med destillert vann og lufttørket umiddelbart. Mens mørkning av den ytre flate av elektrodene kan oppstå med tiden og ikke påvirke ytelsen, anløpet (gul til mørk rød) eller korroderte elektroder bør unngås. Unngå håndtering elektroder med bare hendene, som protein forurensning kan påvirke elektrode atferd. Endelig bør det bemerkes at Ag / AgCl-elektroder er lysfølsomme, og kan føre til flash gjenstander hvis den ikke er beskyttet. Men vi har funnet disse gjenstandene for å være minimal (se legender til figur 1 og 2), og ikke forstyrre våre målinger av larvesebrafisk svar til flash stimuli. Alternativt kan en salt bro brukes til å koble Ag / AgCl-elektrode til svampen via en agar salt bro for å bevege elektroden ut av lysbanen. Selv om en saltbro brukes i likestrøm (DC) opptak for å stabilisere elektrodepotensial 23, benytter ERG opptak vekselstrøm (AC). Derfor den eneste hensikten med en salt bro i dette systemet ville være hvis den spesielle oppsettet har plassbegrensninger eller særlig sterke photovoltaic gjenstander.
ERG har flere fordeler i forhold til andre teknikker for å måle synsfunksjon. Den primære fordel er at det er en in vivo opptaket. Ulempen er at aktiviteten av spesifikke celler må utledes fra bølgeformen i stedet for direkte målt, noe som vil være tilfellet for suge elektrode eller patch clamp opptak av fotoreseptorene og andre celler i retina. Normalt sugeelektrode innspillinger, patch clamp opptak og hele netthinnen erg har den fordelen at farmakologiske midler kan lett bli introdusert inn i cellene for å definere de molekylære komponenteneav responsen, mens dette er vanskeligere in vivo ved hjelp av pattedyrmodeller. Permeabiliteten av sebrafisk larver til slike midler overvinner denne ulempe.
Analyse av mørk-tilpasset larver i fravær av farmakologiske midler frembringer en bølgeform ERG dominert av B-bølgen, et resultat som er observert ved en rekke andre grupper 2, 9,24 -26. Vi demonstrere evnen til å isolere kjeglen masse reseptor potensial ved å utnytte muligheten av farmakologiske midler til å trenge larvesebrafisk. Larver behandlet med APB vise en opphevelse av b-bølge, slik at "en-bølge" for å bli visualisert 14-17. Bølgeformer med utmerket signal til støy-forhold ble oppnådd ved å ta gjennomsnittet tre sveip. Variasjon i svarbølgeformer er noen ganger bemerket, men Makhankov et al. 2 har rapportert at variansen i gjentatte målinger fra samme dyr er mindreenn det som sees mellom individer. Derfor er variansen sannsynlig å være et resultat av biologisk variasjon i stedet for variasjon i teknikken.
Vi har også benyttet ERG-analyse for å undersøke kjegle recovery in vivo ved bruk av en dual flash paradigme, i likhet med publiserte resultater i nærvær og fravær av bakgrunnsbelysningen 9, 16. Dette ble oppnådd ved å måle evnen av larve retina til å reagere på suksessive blinker av varierende ISI. Når den brukes i kombinasjon med farmakologiske midler eller genom ingeniør strategier som Talens å slå ut pathway mål, er sebrafisk kraftig system for in vivo studier av molekylære mekanikken kjegle tilpasning og visuell utvinning.
Vår fremgangsmåte og utstyr kan lett bli tilpasset for å undersøke isolerte larve øyne, eldre sebrafisk eller andre virveldyr 27, 28. Faktisk ERG stimulering og registreringssystemat vi ansetter ble hovedsakelig konstruert for bruk i en klinisk setting og deretter modifisert for eksperimentering på mus. Tilpasse plattformen for sebrafisk larver var grei og kan lett bli kopiert i andre laboratorier for lav pris. Lignende oppsett som består av klassisk elektrofysiologisk utstyr kan være konstruert for minimal kostnad, og har vist seg å gi pålitelige resultater 16. Totalt sett er denne teknikken til stor nytte for forskere som studerer mekanismene for visuell funksjon.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Ingen interessekonflikter erklært.
Materials
| Name | Company | Catalog Number | Comments |
| Faraday cage | 80/20 Inc | custom | Custom designed aluminum "Industrial Erector Set" for Cage framework |
| PVA sponge | Amazon | B000ZOWG1C | Provides a soft, moist platform for placement of zebrafish larvae |
| 150 ml Sterile Filter systems | Corning | 431154 | Filtering solutions to prevent small articulates from blocking micropipettes |
| Espion E2 | Diagnosys, LLC | contact | Modular electrophysiology system capable of generating visual stimuli for any stimulator and digital recording and analysis of responses using propietary software, more information at http://www.diagnosysllc.com |
| Colordome | Diagnosys, LLC | contact | Light stimulator with RGB LED and Xenon light sources for Ganzfeld ERG, more information at http://www.diagnosysllc.com |
| Micromanipulator | Drummond | 3-000-024-R | Holding and positioning the recording microelectrode |
| Magnetic ring stand | Drummond | 3-000-025-MB | Holding and positioning of the camera and refrence electrode |
| Lead extensions | Grass Technologies | F-LX | Spare female to male 1.5 mm lead cables for connecting electrodes |
| Male Pin to Female SAFELEAD Adaptor | Grass Technologies | DF-215/10 | Connecting 2 mm pins to 1.5 headboard pins |
| Window screen frame (metal) and spline | Lowes or Home Depot | various | For attaching copper mesh to Faraday cage framework |
| Steriflip 50 ml filters | Millipore | SCGP00525 | Filtering solutions to prevent small articulates from blocking micropipettes |
| BNC adaptor | Monoprice | 4127 | Connecting camera to BNC cable |
| BNC cable | Monoprice | 626 | Connecting camera to video adaptor |
| Camera lens | Navitar | 1582232 | Visualizing the positioning of the recording microelectrode onto the larval cornea |
| Camera coupler | Navitar | 1501149 | Visualizing the positioning of the recording microelectrode onto the larval cornea |
| Luna BNC to VGA + HDMI Converter | Sewell | SW-29297-PRO | BNC to VGA adaptor allowing camera image to project on computer monitor |
| APB | Sigma | A1910 | mGluR6 agonist, blocks b-wave allowing analysis of the isolated cone mass receptor potential |
| Borosilicate glass | Sutter | BF-150-86-10 | Fire- polished borosilicate glass (metling temperature = 821°C) with filament and dimensions of 1.5mm x 0.86 mm (outer diameter by inner diameter) |
| P97 Flaming/Brown puller | Sutter | P97 | For pulling glass micropipettes |
| Sorbothane sheet | Thorlabs | SB12A | Synthetic viscoelastic urethane polymer, placed under Passive Isolation Mounts and ERG platform to absorb shock and prevent slipping, can be cut to size |
| Breadboard | Thorlabs | B2436F | Vibration isolation platfrom for ERG stimulator and zebrafish specimen |
| Passive Isolation Mounts | Thorlabs | PWA074 | Provides vibration isolation to breadboard |
| Copper mesh | TWP | 022X022C0150W36T | To line Faraday Cage |
| Pipette pump | VWR | 53502-233 | Used with Pasteur pipettes to carefully transfer zebrafish larvae |
| Pasteur pipettes | VWR | 14672-608 | Used with Pipette pump to carefully transfer zebrafish larvae |
| Camera | Watec | WAT-902B | Visualizing the positioning of the recording microelectrode onto the larval cornea |
| Tricaine (MS-222) | Western Chemical | Tricaine-S | Pharmaceutical-grade anesthetic, |
| Micro-fil | WPI | MF28G-5 | Filling microelectrode holder and microelectrode glass |
| Microelectrode holder | WPI | MEH2SW15 | Holds glass microelectrode, connects to ERG equipment |
| Reference Electrode | WPI | DRIREF-5SH | Carefully break off last centimeter of casing to drain electrolyte and expose sintered Ag/AgCl pellet electrode |
| Reference Electrode (alternative) | WPI | EP1 | Alternative to DRIREF-5SH. Ag/AgCl electrode that must be wired/soldered to connecting lead |
| Low-noise cable for Microelectrode holder | WPI | 13620 | Connecting recording microelctrode holder to adaptor/headboard |
References
- Dowling, J. E. The retina: an approachable part of the brain. , Harvard University Press. Cambridge, MA. (1987).
- Makhankov, Y. V., Rinner, O., Neuhauss, S. C. An inexpensive device for non-invasive electroretinography in small aquatic vertebrates. J Neurosci. Methods. 135, 205-210 (2004).
- Wu, J., Peachey, N. S., Marmorstein, A. D. Light-evoked responses of the mouse retinal pigment epithelium. J Neurophysiol. 91, 1134-1142 (2004).
- Heckenlively, J. R., Arden, G. B. Principles and Practice of Clinical Electrophysiology of Vision. , 2nd edn, The MIT Press. Cambridge, MA. (2006).
- Perlman, I. Webvision: The Organization of the Retina and Visual System. Kolb, H., Nelson, R., Fernandez, E., Jones, B. , (1995).
- Fadool, J. M., Dowling, J. E. Zebrafish: a model system for the study of eye genetics. ProgRetin. Eye Res. 27, 89-110 (2008).
- Doerre, G., Malicki, J. Genetic analysis of photoreceptor cell development in the zebrafish retina. Mech. Dev. 110, 125-138 (2002).
- Brockerhoff, S. E., et al. Light stimulates a transducin-independent increase of cytoplasmic Ca2+ and suppression of current in cones from the zebrafish mutant nof. J Neurosci. 23, 470-480 (2003).
- Rinner, O., Makhankov, Y. V., Biehlmaier, O., Neuhauss, S. C. Knockdown of cone-specific kinase GRK7 in larval zebrafish leads to impaired cone response recovery and delayed dark adaptation. Neuron. 47, 231-242 (2005).
- Harada, T., Harada, C., Parada, L. F. Molecular regulation of visual system development: more than meets the eye. Genes Dev. 21, 367-378 (2007).
- Branchek, T. The development of photoreceptors in the zebrafish, brachydaniorerio. II. Function. J Comp Neurol. 224, 116-122 (1984).
- Schmitt, E. A., Dowling, J. E. Early retinal development in the zebrafish, Daniorerio: light and electron microscopic analyses. J Comp Neurol. 404, 515-536 (1999).
- Bilotta, J., Saszik, S., Sutherland, S. E. Rod contributions to the electroretinogram of the dark-adapted developing zebrafish. Dev Dyn. 222, 564-570 (2001).
- Wong, K. Y., Adolph, A. R., Dowling, J. E. Retinal bipolar cell input mechanisms in giant danio. I. Electroretinographic analysis. J Neurophysiol. 93, 84-93 (2005).
- Nelson, R. F., Singla, N. A spectral model for signal elements isolated from zebrafish photopicelectroretinogram. Vis Neurosci. 26, 349-363 (2009).
- Korenbrot, J. I., Mehta, M., Tserentsoodol, N., Postlethwait, J. H., Rebrik, T. I. EML1 (CNG-modulin) controls light sensitivity in darkness and under continuous illumination in zebrafish retinal cone photoreceptors. J Neurosci. 33, 17763-17776 (2013).
- Gurevich, L., Slaughter, M. M. Comparison of the waveforms of the ON bipolar neuron and the b-wave of the electroretinogram. Vision Res. 33, 2431-2435 (1993).
- Westerfield, M. The Zebrafish Book: A guide for the laboratory use of zebrafish (Daniorerio). , 5th edn, University of Oregon Press. Portland, OR. (2007).
- Kim, D. Y., Jung, C. S. Gap junction contributions to the goldfish electroretinogram at the photopic illumination level. Korean J PhysiolPharmacol. 16, 219-224 (2012).
- Brockerhoff, S. E., Dowling, J. E., Hurley, J. B. Zebrafish retinal mutants. Vision Res. 38, 1335-1339 (1998).
- Naka, K. I., Rushton, W. A. S-potentials from colour units in the retina of fish (Cyprinidae). J Physiol. 185, 536-555 (1966).
- Naka, K. I., Rushton, W. A. S-potentials from luminosity units in the retina of fish (Cyprinidae). J Physiol. 185, 587-599 (1966).
- Shao, X. M., Feldman, J. L. Micro-agar salt bridge in patch-clamp electrode holder stabilizes electrode potentials. J Neurosci. Methods. 159, 108-115 (2007).
- Brockerhoff, S. E., et al. A behavioral screen for isolating zebrafish mutants with visual system defects. ProcNatlAcadSci. U S A. 92, 10545-10549 (1995).
- Fleisch, V. C., Jametti, T., Neuhauss, S. C. Electroretinogram (ERG) Measurements in Larval Zebrafish. CSH protocols. , (2008).
- Seeliger, M. W., Rilk, A., Neuhauss, S. C. Ganzfeld ERG in zebrafish larvae. Doc Ophthalmol. 104, 57-68 (2002).
- Kainz, P. M., Adolph, A. R., Wong, K. Y., Dowling, J. E. Lazy eyes zebrafish mutation affects Müller glial cells, compromising photoreceptor function and causing partial blindness. J Comp Neurol. 463, 265-280 (2003).
- Lewis, A., et al. Celsr3 is required for normal development of GABA circuits in the inner retina. PLoS. genetics. 7, e1002239 (2011).



