Abstract
elektroretinogram (ERG) retina fonksiyonunu belirlemek için bir noninvaziv elektrofizyolojik yöntemdir. Kornea yüzeyi üzerinde bir elektrotun yerleşimi sayesinde, elektrik aktivitesi ölçülür ve in vivo olarak retina hücrelerinin faaliyetini değerlendirmek için kullanılabilen ışığa karşılık olarak oluşturdu. Bu makale zebrabalıkları görme fonksiyonu ölçmek için ERG kullanımını tarif eder. Balığı dolayı uzun morfolino oligonükleotitler ve farmakolojik manipülasyonu ile gen bastırma kolaylığı, omurgalı gelişimi için bir model olarak kullanılmıştır. 5-10 dpf'e, sadece konileri larva retinada işlevsel. Bu nedenle, zebra balığı ve diğer hayvanlarda farklı olarak, in vivo olarak koni görme fonksiyonu çalışma için güçlü bir model sistem. Bu protokol, standart anestezi, Mikromanipülasyondan ve zebra balığı araştırma yapmak laboratuvarlarda yaygın olan stereomikroskobi protokolleri kullanır. özetlenen yöntemler standart elektrofizyoloji eq faydalanmakuipment ve düşük ışık kamera larva kornea üzerine kayıt mikroelektrot yerleşimini rehberlik. Son olarak, ilk olarak farelerde kullanılmak üzere tasarlanmış bir ticari olarak temin edilebilir ERG uyarıcısı / kayıt cihazı kolayca zebrabalıkları ile kullanım için adapte edilebilir gösterilmektedir. Larva zebrabalıkları ERG bir morfolino oligonükleotid enjeksiyon ile tadil edilmiş olan hayvanlarda koni görme fonksiyonunu analiz etmek ve mükemmel bir yöntem olarak, örneğin çinko parmak Nükleaz (ZFNs) gibi daha yeni genom mühendislik teknikleri içerir, transkripsiyon aktivatör-gibi efektör Nükleaz (TALENS) ve Düzenli kümelenmiş interspaced Kısa yineleyen tekrarlar (CRISPR) / büyük ölçüde verimlilik ve zebrafish gen hedefleme etkinliğini artırmıştır hepsi Cas9. Ayrıca, biz photoresponse katkıda moleküler bileşenleri değerlendirmek için Zebra balığı larva nüfuz farmakolojik ajanların yeteneği yararlanmak. Bu protokol modifiye ve araştırmacılar tarafından kullanılabilecek bir kurulum özetliyorÇeşitli deneysel gol ile.
Introduction
elektroretinogram (ERG), insanlarda retina fonksiyonunu belirlemek için klinikte yaygın olarak kullanılan bir invazif olmayan elektrofizyolojik bir yöntemdir. Bir ışık uyarısına tepki olarak elektrik aktivitesi korneanın dış yüzeyi üzerinde kayıt elektrotları yerleştirilmesiyle ölçülür. uyarıcı paradigması ve tepki dalga özellikleri yanıt katkıda retina nöronlar tanımlar. Bu yöntem, fareler ve zebrabalıkları de dahil olmak üzere, hayvan modellerinde bir çok kullanım için adapte edilmiştir. Tipik omurgalı ERG tepki dört ana bileşeni vardır: fotoreseptör hücre aktivitesi türetilmiş bir kornea negatif potansiyel bir-dalga; b-dalgası, bipolar hücrelerden AÇIK türetilmiş bir kornea-pozitif potansiyeli; D-dalgası, KAPALI bipolar hücrelerin aktivitesi olarak yorumlanır bir kornea-pozitif potansiyeli; b-dalga sonra birkaç saniye içinde gerçekleştiğini ve c-dalga, Müller glia ve ret aktivite yansıtırinal pigment epiteli 1-4. İnsanlarda ve hayvanlarda modeli ERG analiz tarihini ve ilkelerini anlamak için Ek başvurular gibi İlkeleri ve Vizyon 4, 5 Klinik Elektrofizyoloji Uygulama olarak Utah ve metinlerin Üniversitesi'nden çevrimiçi ders kitabı, Webvision vardır.
Danio rerio (zebra balığı) uzun nedeniyle organ sistemlerinin, davranışsal testlerin noninvaziv morfolojik analiz ve ileri hem geri ve genetik ekranlar (inceleme için, Fadool ve görmek için izin veren hızlı olgunlaşma ve şeffaflık için, omurgalı gelişimi için bir model olarak tercih edilmiştir Dowling 6). Zebra balığı larvaları, yüksek doğurganlık ile birleştiğinde, onları yüksek verimli biyolojik analizler için mükemmel bir hayvan modeli yapmak genetik ve farmakolojik manipülasyon, son derece müsait. Larva zebrabalıkları çubuklara koni yüksek oranı - yaklaşık 1: 1 farelerinde (~% 3 koni ile karşılaştırıldığındalar) - koni fonksiyonu 7-9 çalışma için özellikle kullanışlı olmasını sağlar.
Gözdeki, koni çubuklar 10 önce gelişir. İlginç bir şekilde, zebra balığı koniler Bu aşamada 6, 11,12 koni seçici elektrofizyolojik analizine izin veren erken 4 dpf olarak işlemektedir. Buna karşılık, çubuklar ERG yanıtları 11 ve 21, 13 dpf'e arasında görünür. Bu nedenle, 4-7 de Zebra balığı larvaları dpf'e bir all-koni retina gibi fonksiyonel hizmet vermektedir. Ancak, 4-7 dpf larvaları yerli Fotopik ERG tepki b-dalgası hakimdir. (+) - - 2-amino-4-fosfono-butirik asit (L-AP4), metabotropik glutamat için bir agonist iki kutuplu hücreler üzerindeki tarafından ifade edilen (mGluR6) reseptörü, etkili bir şekilde bloke nesil L gibi farmakolojik ajanların uygulanması b-dalga ve izole koni reseptör potansiyeli kitle, ("a-dalgası") 14-17 ortaya koymaktadır.
Burada basit ve reliabl tarifzebra balığı larvası ile kullanım için adapte edilmiş fareler ile kullanım için tasarlanmış ticari olarak temin ERG ekipman kullanılarak ERG analizi e yöntemi. Bu sistem, görsel duyarlılık ve adaptasyona 16 katkı sinyal yollarının tanımlanması araştırmacılar yardımcı olmak için, bir genetik arka değişen, hem de farmakolojik maddeler ile tedavi gibi bir zebra balığı larva üzerinde kullanılabilir. Bu protokolde belirtilen deneysel prosedürler vizyona ilgili biyolojik soruları çeşitli cevap ERG analiz kullanımı araştırmacıları rehberlik ve esnek bir ERG kurulum inşaatı gösterecektir.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Hayvan bakım ve deneysel protokolleri Chapel Hill'deki North Carolina Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Komiteleri tarafından onaylanmış ve Laboratuar Hayvan Refahı NIH Ofisi ve Değerlendirme ve Laboratuar Hayvan Bakımı International Akreditasyon Derneği tüm gereksinimlerini karşılamak bulundu.
NOT: Standart Zebra balığı yetiştiriciliği ve bakım için ERG analizi için larvaları elde etmek için, yayınlanmış protokoller 18 kullanılmıştır. Larva doğal yetiştirme yoluyla elde edilen ve 14 saat ışık / 10 saat karanlık döngüsü altında muhafaza edilir. Bu protokol sonrası fertilizasyon (dpf) 5-7 gün larvaları için optimize edilmiştir, ancak ideal prosedüre küçük değişiklikler ile eski balık yapılabildi. Burada, 5 dpf'e yabani tip Zebra balığı larvalarının TL gerginlik kullanın.
1. Mikropipet Üretim
- Yangın cilalı borosilikat cam kılcal 1.5 x 0.86 mm (iç çapı ile dış çapı) kullanarak birkaç mikropipetler çekinFilament (821 ° C, erime sıcaklığı) ve P-97 Flaming / Brown Mikropipet Çektirme kutusu ısı filament ile donatılmış. Tablo 1'de açıklanan mikropipetler fashioning için programı kullanın.
- Ipuçları çapı 10-15 mikron olmasını sağlamak için uygun bir graticule cetvelle bir mikroskop altında her mikropipet kontrol edin ve düzgün bir ucu açıklığı (yani, hiçbir pürüzlü kenarlar) sahiptir.
- Dikkatle toz ucu hasarı ve maruziyetini önlemek için mikropipetler saklayın. Depolama seçenekleri laboratuvar bant, köpük kaplı kutulara ya da ticari olarak temin edilebilir mikropipet depolama kapları ile Petri kapları bulunmaktadır.
Not: diğer mikropipet çekiciler ve cam kılcal kısımların doğru mikropipet çaplı, yüksek kaliteli bir uç elde edildiği sürece kullanılabilir.
| Basınç | Isı | Çek | Hız Zaman | |
| 500 | 560 | - | 30 | 200 |
| 500 | 450 | - | 30 | 200 |
| 500 | 410 | 55 | 40 | 200 |
Tablo 1: Bir kutu sıcaklık filaman ile donatılmış, bir P-97 alevlenebilirlik / kahverengi bir Mikropipet çekici kullanılarak mikropipetler üretimi için program Mikropipetler filamanlı yangın parlatılmış borosilikat cam kılcal 1,5 x 1,0 mm 2 (iç çapı ile dış çapı) kullanılarak yapılır. (erime sıcaklığı 821 ° C).
2. Tampon hazırlama
- Mikroelektrot kılcal, oksijenli goldfish Ringer tampon 19 süzülür kullanın ve larva deneyler için yerleştirildiği üzerine polivinil alkol (PVA) sünger doyurmak için. Seçenek olarak ise, E3 kullanımı embriyo medya veya Hank'in Dengeli Tuz Çözeltisi.
- PH değeri 7.8 ayarlayın ve bir 0.22 um filtre kullanılarak sterilize edildi ve 4 ° C'de 10 x stok saklamak Tablo 2'de tarif edildiği gibi 10x balığı Ringer çözeltisi hazırlayın.
- Iyonu giderilmiş, damıtılmış su ile 1x, 10x Ringer çözeltisinin, deney gününde çalışma çözeltisi oluşturmak. 0.22 mikron filtre sistemini kullanarak Filtre. 10 dakika boyunca% 95 O ile 2/5% CO2 gazı geçirilmesi yolu ile oksijenat. Sıkıca sonradan Cap çözümü oksijenli kalmasını sağlamak için.
| NaCl | 1.25 M |
| KCI | 26 mM |
| CaCl2 | 25 mM |
| MgCI2 | 10 mM |
| glikoz | 100 mM |
| HEPES | 100 mM |
3. Elektroetinogram Platformu
- Sinyal gürültü oranı artırmak için bir Faraday kafesi içinde bir anti-vibrasyon masaya ERG deneyleri. Altıgen somunları kullanılarak anti-vibrasyon masaya özel bir çelik platformu takın. Işık kaynağı altında masaya bir viskoelastik üretan polimer şok emici alt ile bir hareketli plastik platformu yerleştirin.
- Hareketli plastik platformu aşağı amaçlayan bir manyetize standı ile kamera yerleştirin. Hareketli plastik platformunun sağ ikinci manyetize stand ile (kayıt mikroelektrot yapacak) mikromanipülatör yerleştirin. Kamera ve mikromanipülatör diğer ekipmanların hareketi tarafından rahatsız olmayacak ve onlar ışık kaynağından aydınlatmayı bloke etmediğinden emin olun.
- Bir video monitöre bağlayın ve göz görüntülemek için konumlandırmakUygun pozisyonda elektrot yerleştirmek için larva.
- Kurulum düzgün bakır tel ile topraklı emin olun. Gürültü kontrol etmek, Ringer solüsyonu ile dolu bir 35 mm Petri kabındaki kayıt mikroelektrot referans elektrodu ve bahşiş yerleştirin. Bir osiloskop veya ERG aygıtının dahili özelliği ile kurulum elektrik gürültü seviyelerini kontrol edin. Gürültü seviyeleri başlangıçtan itibaren en fazla ± 10 mV olmalıdır.
4. Sünger Hazırlık
- 35 mm'lik bir Petri tabağına sıkıca oturacak ve kuru PVA sünger küçük bir dikdörtgen kesin. sünger mm çanak derinliğinden daha büyük olmamalıdır. Kesim için temiz bir jilet ile bir maket bıçağı kullanın.
- (Sünger alt veya daha küçük uçlarından biri aracılığıyla dikey kesilmiş bir kelebeğin üzerinde uzunlamasına ya sığ kesim) referans elektrot yerleştirmek için sünger içine ek bir kesim olun.
- Bir kimyasal dirençli işaretleyici kullanınkamerayı konumlandırılması için kullanılabilen bir sünger (larva yerleştirileceği yerde) küçük bir nokta işaretleyin.
- Doyana kadar Ringer solüsyonu PVA sünger batırın. 2-3 kez kaldırın ve bir kağıt havlu üzerine hızla kurulayın. Temiz bir 35 mm Petri kabı içinde sünger yerleştirin.
- Işareti kamera tarafından görüntülendi edilecek şekilde plastik platform üzerinde sünger içeren Petri kabı yerleştirin.
5. Elektrot Hazırlanması
Not: zebra balığı kurulum Ringer çözeltisi doymuş PVA sünger ve kornea ile temas halinde bir kayıt elektrotu ile temas halinde olan bir referans elektrot içermektedir. Referans elektrodu, bir Ag / AgCİ pelet oluşur. Kayıt elektrot Ag tel içeren bir mikroelektrot sahibi tarafından Ringer solüsyonu ile doldurulmuş ve tutulan bir çekti cam mikropipet olduğunu.
- 5 dakika (kayıt micr için% 6-9 sodyum hipoklorit (çamaşır suyu) onları iliklerine elektrotlar Kloritlereoelectrode tel) veya 15 dakika (referans elektrot). 5 dakika boyunca bir Kimwipe Hava kuru.
- Adım 4.2 yapılan kesme tarzı bağlı olarak, sünger (alt uzunlamasına sığ kesim için) (dikey kelebek kesim için) veya altında içine referans elektrot Ag / AgCl pelet yerleştirin. Kayıt sistemine referans elektrot kurşun takın.
- ERG kurulum alanı kısıtlamaları vardır veya Ag / AgCl elektrot gelen özellikle güçlü fotovoltaik eserler varsa Alternatif, ışık yolu dışına elektrodu taşımak için bir agar tuz köprüsü üzerinden sünger referans elektrodu bağlayın.
- 5 ml olmayan Luer kilit şırınga ile ~ uygun büyüklükte boru 40 cm takın. Ringer solüsyonu ile şırınga doldurun. Basınç noktaları genelde adaptörleri ile gemi sahip Mikroelektrod sahipleri, "3/32" 1/8 1/16 iç çapları boru karşılamak "veya 5/32" için.
- Ile 1 ml olmayan Luer kilit şırınga doldurunMikro-fil ile Ringer çözeltisi ve dikkatlice mikroelektrot tutucu doldurun. Kabarcıklarının oluşmasını önlemek.
- Boru ile Mikroelektrot sahibinin basınç portuna 5 ml şırınga takın ve mikroelektrod sahibi Ringer solüsyonu ile dolu olmasını sağlamak için kullanabilirsiniz. Ringer solüsyonu ile dolu mikro-fil ve 1 ml şırınga kullanarak, ucundan mikropipet cam doldurmak ve hiçbir kabarcıklar mevcut olduğundan emin olun.
- Elektrot tel düz tutmak için dikkatli olmak, mikroelektrod tutucu cam mikropipet takın. Bir kez, güvenli çözümün küçük bir miktar ucunda görünür oluncaya kadar dikkatle mikroelektrot yoluyla Ringer çözeltisi zorlamak için 5 ml şırınga kullanın. Mikropipet ucu, toz ya da tuz birikimine bağlı, hava kabarcıkları ve aynı zamanda oklüzyonu oluşumunu önler (kornea yok) şırıngaya basınç sıra uygulaması.
- Çözüm akışı olarak çıkarsa, g değiştirinlass mikropipet ucu açıklığı çok büyük ya da zarar görmüş gibi.
- Dikkatle mikromanipülatör kayıt mikroelektrot yerleştirin ve kayıt sistemine kurşun takın.
6. Elektroetinogram Analizi
NOT: Kayıt için hazırlıklar dolaylı beyaz ışığın düşük seviyelerde altında yapılan zaman larva retinanın koni egemenliğine, yüksek kaliteli ERG sonuçlar elde edilebilir dolayı (<1 lux) veya kısa süreler yüksek yoğunlukta (<1 dakika) ( ≤250 lux) çalışma ışığı. Karanlık adaptasyonu kısa süre hala kayıt önce gerekli (adım 6.7 bakınız). Bununla birlikte, deneyler, kızılötesi duyarlı kamera kullanılarak loş, kızıl ötesi ışık altında gerçekleştirilebilir. Bütün deneyler, UNC balığı su ürünleri yetiştiriciliğinde bünyesinden filtre ile sterilize edilmiş (0.22 um) sistemi su yapıldı, ancak alternatif bir embriyo ortam da kullanılabilir.
- Yaklaşık 1 ölçme Kes kağıt havlu karelercm 2.
- Izole edilmiş bir koni kütle reseptör potansiyelinin ölçümü ise, 5 dakika boyunca, 500 uM, (±) -2-Amino-4-fosfonobütirik asit (APB) sistem suda 3-5 larva inkübe edilir.
Not: APB bir aktif (L) 'in rasemik karışımı AP4 inaktif (R) form iken, L-AP4 kadar etkili olduğu ve daha az pahalıdır. - % 0.02 yanıt vermeyen, yaklaşık 1-2 dakika kadar (ağırlık / hacim) Tricaine sistem suda 3-5 larva anestezisi.
- Dikkatli bir şekilde en az bir aydınlatma (<1 dakika boyunca ≤250 lux) ile bir kesme Stereoskop altında kağıt havlu kareleri üzerine tek tek larvalar aktarmak için bir Pasteur pipeti ve pipet pompası kullanın. Her larva konumunu kontrol edin ve bir kapatılmamış gözle dorsal yüzü yukarı bir aday seçmek.
- Genişletilmiş kayıtları (> 30 dk) için, vücut kadar cam ama ince deve tüyü fırça kullanarak% 3 metilselüloz ile baş dahil değil tarafından nemli larva tutun.
- Forseps kullanarak, kağıt havlu squar transferinemli PVA sünger larva e.
- Genişletilmiş kayıtları (> 30 dk) için, damıtılmış su ihtiva eden bir yan kol şişede airstone üzerinden gaz kabarcıkları geçirmek suretiyle larva üzerinde su ile doyurulmuş% 100 O2 gazı sürekli bir akış uygulanır. Larvaların kafasının yakınında nemlendirilmiş oksijen taşır şişe yan kol çıkan boru yerleştirin.
NOT: Adım 6.4.1 ve 6.5.1 adım balık 16 ömrünü uzatacaktır.
- Genişletilmiş kayıtları (> 30 dk) için, damıtılmış su ihtiva eden bir yan kol şişede airstone üzerinden gaz kabarcıkları geçirmek suretiyle larva üzerinde su ile doyurulmuş% 100 O2 gazı sürekli bir akış uygulanır. Larvaların kafasının yakınında nemlendirilmiş oksijen taşır şişe yan kol çıkan boru yerleştirin.
- Minimal aydınlatma altında, burun ve göz kaudal uçları arasında orta noktada mikroelektrod ucu konumlandırmak için mikromanipülatör ve kamera kullanımı ve korneanın dorsal sınırı üzerine yavaşça bastırın.
Not: kornea kadar uzak bölgelere elektrot ucu yanlış yerleştirilmesi ters polarite ERG dalga formları ile sonuçlanabilir. - Için larva 5-10 dakika karanlık adapte izin verin.
- Lanılabilir kullanarak bir LED ışık kaynağı ya da optik stimülatör sağlanan ışık rekor testi flaş yanıtlarıetikel stimülasyon ve kayıt cihazları. Flash yoğunluğu, flaş uzunluğu, flaş rengi, arka plan yoğunluğu ve deney uygun renkli ve filtre ayarları gibi protokol parametrelerini ayarlayın.
- Deney ile bittiğinde, AVMA / IACUC kurallarına göre larva euthanize.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Tipik olarak, ERGler bir dizi çalışma bu aşamada 9, 16,20 ile ERG kayıtları yayınlandı beri, 5 dpf'e Zebra balığı larvaları kaydedilir. Larva tepkiler beyaz LED ışık 20 msn uyaran kullanarak arka plan aydınlatma ile karanlık adapte koşullar altında ölçüldü. Biz bir Ganzfeld ışık uyarıcısı ve bilgisayar denetleyici / kaydedici oluşan piyasada mevcut ERG sistemi kullanılmaktadır. stimülatör arka plan ve flaş uyaran hem de parlaklığı kontrol etmek için sıkı bir şekilde kontrol tescilli darbe genişlik modülasyonu (PWM) sistemini kullanır. Tepkiler dijital dönüştürücü (ADC) bir 16-bit analog sürüş donanım anti-aliasing filtresi ile özel bir tam diferansiyel amplifikatör kullanarak kaydedildi. Uyarıcı ve tepki kayıtları üreticinin protokolüne göre ekipman ile birlikte özel yazılımı tarafından kontrol edildi. Bizim ekipmanları 1 kHz örnekleme hızı kullanmak için programlanmış, dijital Bessel cascade filtreler 0.312 Hz ve 300 Hz ve aşırı gürültü çıkarmak için bir 60 Hz çentik filtresi arasında bir bandpass ayarlanır. Koyu adapte larva ışık yoğunlukları artan genlikli b-dalgası artar (Şekil 1). a-dalgası genellikle b-dalgası tarafından gizlenmiş ve güvenilir bir şekilde tespit edilemez. b-dalgası, metabotropik glutamat reseptörü (mGluR6) agonisti ile larva inkübe edilmesi ile bloke edilebilir, 4-fosfono-butirik asit (APB). Bu tespit edilecek olan (veya "a-dalgası") konik kütle alıcı potansiyeli sağlar. Işık artan yoğunlukları amplitüd Bu, "a-dalgası" yanıt artar (Şekil 2).
Ek paradigmalar temel görme fonksiyonu ve duyarlılık ötesinde görsel parametreleri test etmek için kullanılabilir. Çift hızlı bir paradigma kullanımı sayesinde, bir başlangıç uyarıcısıyla (Şekil 3A) kurtarmak için koni photoresponse yeteneğini ölçer. Interstimulus aralığı olarak(ISI) ilk uyarıcı (Şekil 3B) ile ilgili iyileşmeyi gösterir, ikinci tepki artar genliğini arttırır. Sunulan APB izole "a-dalgası" izleri üç Piyango ortalama ve benzeri stimülasyon paradigmalar 2, 9,16 kullanan Zebra balığı larva erg yayınlanan raporlara uygun.
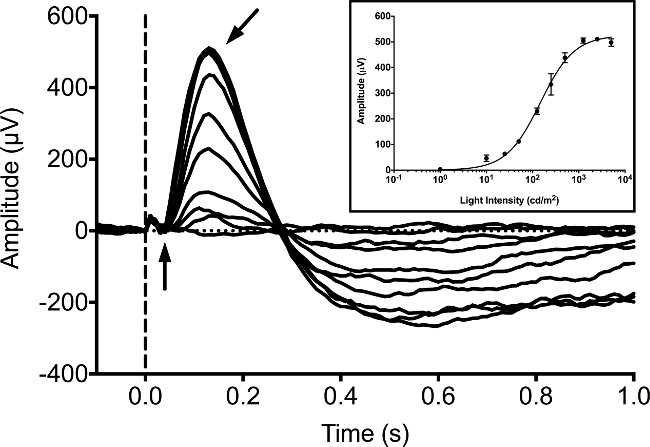
Şekil 1: Larva zebrafish dpf'e 5 Tipik ERG kaydı. yoğunluk serisi, karanlığa adapte koşullar altında elde edilmiştir. Balık yoğunlukları 1, 10, 25, 50 125, 250, 500, 1.250, 2.500 ve 5.000 cd / m 2 eşit olan 20 msn bir süre için beyaz LED ışığa maruz kalmaktadır. Işık uyarıcının başlangıcı kesik bir dikey çizgi ile gösterilmektedir. Negatif potansiyel bir dalga (dikey ok) pozitif ise, ayırt etmek zordurPotansiyel b-dalgası (açılı ok) dalga baskın zirvedir. Küçük bir fotovoltaik artefakt a dalgasının başlangıcına kadar önce küçük bir pozitif sapma olarak görülebilir. Ankastre, Naka-Rushton denklemini 21, 22 kullanılarak uygun olan ışık yoğunlukları artan b-dalgası tepki amplitüdleri ortalama. Hata çubukları SEM'i temsil etmektedir.

Şekil 2:. 5 dpf'e koyu adapte koşullar altında elde edilen larva Zebra balığı Yoğunluk serisi kaydedilen APB izole koni kitle reseptör potansiyeli. uyarıcı 1, 10, 25, 50 125, 250, 500, 1.250, 2.500 ve 5.000 cd / m 2 eşit şiddetleri ile 20 milisaniye LED beyaz ışık. Işık uyarımı başlangıcı noktalı dikey çizgi ile gösterilir. Potansiyel izole koni kitle reseptörü ("a-dalgası") dalga formu (ok) baskın unsurdur. Küçükfotovoltaik artefakt koni yanıt başlama önce küçük bir pozitif sapma olarak görülebilir. Ankastre, Naka-Rushton denklemi kullanılarak uygun olan ışık yoğunlukları artan tepki amplitüdleri ortalama. Hata çubukları SEM'i temsil etmektedir.

Şekil 3:.. Bir çift flaş paradigma kullanan Koni kitle reseptör potansiyeli kayıt APB-tedavi larva dpf'e bir 5 1,000 cd / m 2 bir yoğunluğu ile beyaz ışık (LED kaynağı) iki 20 msn basması, her tabi tutuldu (A) 2 saniyeye eşit bir interstimulus aralığı (ISI) ile 2 ardışık yanıp yanıt. Işık maruziyet noktalı dikey çizgilerle işaretlenir. İkinci tepkinin geninin eksik tepki iyileşme gösteren, birinci cevabın daha düşüktür. (B) en fazla izole edilmiş bir koni kütle reseptör Poten oranıHer ISI için ilk uyaranın bu ikinci uyaran yanıtı TIAL. Bir en uygun doğrusal olmayan regresyon analizi ile uygulanmıştır. ISI arttıkça, fotoreseptör duyarlılığı ilerici kurtarma gösteren ilk uyarana yanıt genlik akrabası ikinci uyaran artar tepki. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Bu protokol larva zebrafish ERG kayıtları için basit bir prosedür ayrıntılı. Akılda tutulmalıdır prosedür boyunca birçok kritik adımlar Bu prosedür görsel function.There hızlı ve kapsamlı bir tahlil için izin verir vardır. Deney potansiyel ilaç tedavileri sırasında ölümleri önlemek ve ERG kayıtları sırasında uzun süreli geçimini sağlamak için önce Zebra balığı larvaları sağlıklı olmalıdır. Buna ek olarak, bu deneylerde kullanılan larva yakın yaş uyumlu olması önemlidir. Bunun nedeni retina (koni alt tiplerinin yani, diferansiyel gelişim) ve aynı zamanda larva genel morfolojisi ve fizyolojisi hızlı gelişimi sağlamaktır. Örneğin, epitel terleme verimliliği dpf'e 7 sonra daha zor canlı balık tutmak için yapım azalır. Bir diğer önemli faktör kayıt ve referans elektrotlar kalitesidir. Kaba kenarlı t önlemek için cam kılcal çekerken dikkatli olunmalıdırIPS. Bir mikropipet Microforge sinyal edinimi artırmak için elektrotlar ve yardım çekti yangın lehçe için istihdam edilebilir. Ayrıca, Ag / AgCl elektrot kalitesini korumak çok önemlidir. Kullanımdan sonra, hemen kurutuldu, damıtılmış su ve hava ile durulanması gerekir. (Koyu kırmızıya) kararmış ya da çukurlu elektrotlar kaçınılmalıdır performansı etkileyen zamanla gerçekleşen olup Elektrotların dış yüzeyinin koyulaşması bulunuyor. Protein kirliliği olumsuz elektrot davranışını etkileyebilir gibi, çıplak elleriyle işleme elektrotlar kaçının. Son olarak, Ag / AgCI elektrotlar ışığa ve korunmadığı takdirde flaş eserler yol açabilir unutulmamalıdır. Ancak, en az olması için bu eserler bulduk (Şekil 1 efsaneleri ve görmek 2) ve uyaranlara flaş larva zebrabalıkları yanıtlar bizim ölçümleri ile karışmaz. Seçenek olarak ise, bir tuz köprüsü, bir agar sa ile sünger Ag / AgCI elektrot bağlamak için kullanılabilirlt köprü ışık yolu dışına elektrodu taşımak için. Bir tuz köprüsü elektrot potansiyeli 23 stabilize doğrudan akım (DC) kayıtları kullanılmasına rağmen, ERG kayıt akım (AC) alternatif kullanmaktadır. Özellikle kurulum alanı kısıtlamaları veya özellikle güçlü fotovoltaik eserler varsa nedenle bu sistemde bir tuz köprüsü tek amacı olacaktır.
ERG, görme fonksiyonu ölçmek için başka tekniklere göre bazı avantajları vardır. başlıca avantajı, bir in vivo kayıt olmasıdır. Dezavantajı retinada fotoreseptör ve diğer hücrelerin emme elektrodu ya da yama kelepçe kayıtları için söz konusu olduğu gibi, belirli hücre aktivitesi, direkt olarak ölçülebilir yerine dalga biçimi çıkarılabilir olmasıdır. Normal olarak, emme elektrodu kayıtları, yama kelepçe kayıtları ve tüm retina ERGler farmakolojik ajanlar kolayca moleküler bileşenleri tanımlamak için hücreler içine dahil edilebilir avantajıyanıtın, oysa bu memeli modelleri kullanılarak in vivo olarak daha zordur. Bu tür maddeler için zebra balığı larvası geçirgenliği bu dezavantajı ortadan kaldırır.
Farmakolojik ajanların yokluğunda, karanlığa adapte edilmiş larva analizi, b-dalgası hakim olduğu bir ERG dalga, diğer gruplar 2, 9,24 -26 bir dizi gözlenmiştir bir sonuç üretir. Biz larva zebrafish nüfuz farmakolojik ajanların yeteneği yararlanarak koni reseptör potansiyeli kitle izole yeteneği göstermektedir. APB ile muamele Larvalar "a-dalgası" 14-17 görsel sağlayan, b-dalgası bir tasfiyesini gösterir. Gürültü oranı, mükemmel bir sinyal ile dalga formları 3 temizleyicileri ortalama elde edildi. Tepki dalga formu farklılık kaydetti bazen, ama Makhankov ark. 2 aynı hayvan tekrarlanan ölçümlerde varyans az olduğu bildirilmiştirbireyler arasında görülen daha. Bu nedenle, varyans tekniği biyolojik değişim yerine değişkenlik sonucu olması muhtemeldir.
Ayrıca arka plan aydınlatması 9, 16 varlığında veya yokluğunda yayınlanan sonuçlara benzer bir çift flaş paradigma kullanılarak in vivo olarak koni kurtarma incelemek için ERG analizi kullanılmıştır. Bu ISI değişen ardışık yanıp yanıt larva retina yeteneği ölçülerek gerçekleştirilmiştir. Talens yolu hedefleri vurmak için farmakolojik maddelerin ya da genom mühendislik stratejileri ile bir arada kullanıldığında, zebra balığı koni uyum ve görsel geri moleküler mekanik in vivo çalışma için güçlü bir sistemdir.
Bizim prosedür ve ekipmanları kolayca 28 izole larva gözler, eski zebrafish veya diğer omurgalılar 27 incelemek için adapte edilebilir. Aslında, ERG stimülasyon ve kayıt sistemibiz esas fareler deney için tadil edilmiş, sonra bir klinik ortamda kullanılmak üzere tasarlanmıştır ve kullanılırken, bu buluşun bu. Zebra balığı larvaları için bir platform uyarlanması basit ve kolay bir şekilde düşük maliyetle diğer laboratuarlarda çoğaltılmış olabilir. Klasik elektrofizyolojik ekipman oluşan Benzer kurulumları minimum maliyetle inşa edilebilir ve güvenilir sonuçlar 16 sağlamak için gösterilmiştir. Genel olarak, bu teknik, görsel fonksiyon mekanizmaları okuyan araştırmacılar için büyük yarar olduğunu.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Çıkar çatışması ilan etti.
Materials
| Name | Company | Catalog Number | Comments |
| Faraday cage | 80/20 Inc | custom | Custom designed aluminum "Industrial Erector Set" for Cage framework |
| PVA sponge | Amazon | B000ZOWG1C | Provides a soft, moist platform for placement of zebrafish larvae |
| 150 ml Sterile Filter systems | Corning | 431154 | Filtering solutions to prevent small articulates from blocking micropipettes |
| Espion E2 | Diagnosys, LLC | contact | Modular electrophysiology system capable of generating visual stimuli for any stimulator and digital recording and analysis of responses using propietary software, more information at http://www.diagnosysllc.com |
| Colordome | Diagnosys, LLC | contact | Light stimulator with RGB LED and Xenon light sources for Ganzfeld ERG, more information at http://www.diagnosysllc.com |
| Micromanipulator | Drummond | 3-000-024-R | Holding and positioning the recording microelectrode |
| Magnetic ring stand | Drummond | 3-000-025-MB | Holding and positioning of the camera and refrence electrode |
| Lead extensions | Grass Technologies | F-LX | Spare female to male 1.5 mm lead cables for connecting electrodes |
| Male Pin to Female SAFELEAD Adaptor | Grass Technologies | DF-215/10 | Connecting 2 mm pins to 1.5 headboard pins |
| Window screen frame (metal) and spline | Lowes or Home Depot | various | For attaching copper mesh to Faraday cage framework |
| Steriflip 50 ml filters | Millipore | SCGP00525 | Filtering solutions to prevent small articulates from blocking micropipettes |
| BNC adaptor | Monoprice | 4127 | Connecting camera to BNC cable |
| BNC cable | Monoprice | 626 | Connecting camera to video adaptor |
| Camera lens | Navitar | 1582232 | Visualizing the positioning of the recording microelectrode onto the larval cornea |
| Camera coupler | Navitar | 1501149 | Visualizing the positioning of the recording microelectrode onto the larval cornea |
| Luna BNC to VGA + HDMI Converter | Sewell | SW-29297-PRO | BNC to VGA adaptor allowing camera image to project on computer monitor |
| APB | Sigma | A1910 | mGluR6 agonist, blocks b-wave allowing analysis of the isolated cone mass receptor potential |
| Borosilicate glass | Sutter | BF-150-86-10 | Fire- polished borosilicate glass (metling temperature = 821°C) with filament and dimensions of 1.5mm x 0.86 mm (outer diameter by inner diameter) |
| P97 Flaming/Brown puller | Sutter | P97 | For pulling glass micropipettes |
| Sorbothane sheet | Thorlabs | SB12A | Synthetic viscoelastic urethane polymer, placed under Passive Isolation Mounts and ERG platform to absorb shock and prevent slipping, can be cut to size |
| Breadboard | Thorlabs | B2436F | Vibration isolation platfrom for ERG stimulator and zebrafish specimen |
| Passive Isolation Mounts | Thorlabs | PWA074 | Provides vibration isolation to breadboard |
| Copper mesh | TWP | 022X022C0150W36T | To line Faraday Cage |
| Pipette pump | VWR | 53502-233 | Used with Pasteur pipettes to carefully transfer zebrafish larvae |
| Pasteur pipettes | VWR | 14672-608 | Used with Pipette pump to carefully transfer zebrafish larvae |
| Camera | Watec | WAT-902B | Visualizing the positioning of the recording microelectrode onto the larval cornea |
| Tricaine (MS-222) | Western Chemical | Tricaine-S | Pharmaceutical-grade anesthetic, |
| Micro-fil | WPI | MF28G-5 | Filling microelectrode holder and microelectrode glass |
| Microelectrode holder | WPI | MEH2SW15 | Holds glass microelectrode, connects to ERG equipment |
| Reference Electrode | WPI | DRIREF-5SH | Carefully break off last centimeter of casing to drain electrolyte and expose sintered Ag/AgCl pellet electrode |
| Reference Electrode (alternative) | WPI | EP1 | Alternative to DRIREF-5SH. Ag/AgCl electrode that must be wired/soldered to connecting lead |
| Low-noise cable for Microelectrode holder | WPI | 13620 | Connecting recording microelctrode holder to adaptor/headboard |
References
- Dowling, J. E. The retina: an approachable part of the brain. , Harvard University Press. Cambridge, MA. (1987).
- Makhankov, Y. V., Rinner, O., Neuhauss, S. C. An inexpensive device for non-invasive electroretinography in small aquatic vertebrates. J Neurosci. Methods. 135, 205-210 (2004).
- Wu, J., Peachey, N. S., Marmorstein, A. D. Light-evoked responses of the mouse retinal pigment epithelium. J Neurophysiol. 91, 1134-1142 (2004).
- Heckenlively, J. R., Arden, G. B. Principles and Practice of Clinical Electrophysiology of Vision. , 2nd edn, The MIT Press. Cambridge, MA. (2006).
- Perlman, I. Webvision: The Organization of the Retina and Visual System. Kolb, H., Nelson, R., Fernandez, E., Jones, B. , (1995).
- Fadool, J. M., Dowling, J. E. Zebrafish: a model system for the study of eye genetics. ProgRetin. Eye Res. 27, 89-110 (2008).
- Doerre, G., Malicki, J. Genetic analysis of photoreceptor cell development in the zebrafish retina. Mech. Dev. 110, 125-138 (2002).
- Brockerhoff, S. E., et al. Light stimulates a transducin-independent increase of cytoplasmic Ca2+ and suppression of current in cones from the zebrafish mutant nof. J Neurosci. 23, 470-480 (2003).
- Rinner, O., Makhankov, Y. V., Biehlmaier, O., Neuhauss, S. C. Knockdown of cone-specific kinase GRK7 in larval zebrafish leads to impaired cone response recovery and delayed dark adaptation. Neuron. 47, 231-242 (2005).
- Harada, T., Harada, C., Parada, L. F. Molecular regulation of visual system development: more than meets the eye. Genes Dev. 21, 367-378 (2007).
- Branchek, T. The development of photoreceptors in the zebrafish, brachydaniorerio. II. Function. J Comp Neurol. 224, 116-122 (1984).
- Schmitt, E. A., Dowling, J. E. Early retinal development in the zebrafish, Daniorerio: light and electron microscopic analyses. J Comp Neurol. 404, 515-536 (1999).
- Bilotta, J., Saszik, S., Sutherland, S. E. Rod contributions to the electroretinogram of the dark-adapted developing zebrafish. Dev Dyn. 222, 564-570 (2001).
- Wong, K. Y., Adolph, A. R., Dowling, J. E. Retinal bipolar cell input mechanisms in giant danio. I. Electroretinographic analysis. J Neurophysiol. 93, 84-93 (2005).
- Nelson, R. F., Singla, N. A spectral model for signal elements isolated from zebrafish photopicelectroretinogram. Vis Neurosci. 26, 349-363 (2009).
- Korenbrot, J. I., Mehta, M., Tserentsoodol, N., Postlethwait, J. H., Rebrik, T. I. EML1 (CNG-modulin) controls light sensitivity in darkness and under continuous illumination in zebrafish retinal cone photoreceptors. J Neurosci. 33, 17763-17776 (2013).
- Gurevich, L., Slaughter, M. M. Comparison of the waveforms of the ON bipolar neuron and the b-wave of the electroretinogram. Vision Res. 33, 2431-2435 (1993).
- Westerfield, M. The Zebrafish Book: A guide for the laboratory use of zebrafish (Daniorerio). , 5th edn, University of Oregon Press. Portland, OR. (2007).
- Kim, D. Y., Jung, C. S. Gap junction contributions to the goldfish electroretinogram at the photopic illumination level. Korean J PhysiolPharmacol. 16, 219-224 (2012).
- Brockerhoff, S. E., Dowling, J. E., Hurley, J. B. Zebrafish retinal mutants. Vision Res. 38, 1335-1339 (1998).
- Naka, K. I., Rushton, W. A. S-potentials from colour units in the retina of fish (Cyprinidae). J Physiol. 185, 536-555 (1966).
- Naka, K. I., Rushton, W. A. S-potentials from luminosity units in the retina of fish (Cyprinidae). J Physiol. 185, 587-599 (1966).
- Shao, X. M., Feldman, J. L. Micro-agar salt bridge in patch-clamp electrode holder stabilizes electrode potentials. J Neurosci. Methods. 159, 108-115 (2007).
- Brockerhoff, S. E., et al. A behavioral screen for isolating zebrafish mutants with visual system defects. ProcNatlAcadSci. U S A. 92, 10545-10549 (1995).
- Fleisch, V. C., Jametti, T., Neuhauss, S. C. Electroretinogram (ERG) Measurements in Larval Zebrafish. CSH protocols. , (2008).
- Seeliger, M. W., Rilk, A., Neuhauss, S. C. Ganzfeld ERG in zebrafish larvae. Doc Ophthalmol. 104, 57-68 (2002).
- Kainz, P. M., Adolph, A. R., Wong, K. Y., Dowling, J. E. Lazy eyes zebrafish mutation affects Müller glial cells, compromising photoreceptor function and causing partial blindness. J Comp Neurol. 463, 265-280 (2003).
- Lewis, A., et al. Celsr3 is required for normal development of GABA circuits in the inner retina. PLoS. genetics. 7, e1002239 (2011).



