Summary
Se presenta un protocolo de investigación eficiente para la identificación de pequeñas moléculas que promueven la diferenciación astroglial en células de glioblastoma (GSCs). El ensayo se basa en un reportero de la diferenciación de células madre por el que la expresión de la GFP mejorada (eGFP) es conducida por el promotor humano de GFAP.
Abstract
Glioblastoma (GBM) es el tumor cerebral primario más común y más mortal en los adultos, que causa aproximadamente 14.000 muertes cada año en los Estados Unidos solamente. Mediana de supervivencia tras el diagnóstico es menos de 15 meses con máxima quimioterapia temozolomida, la radiación y la resección quirúrgica. Los retos inherentes en el desarrollo de tratamientos más eficaces de GBM se han convertido en cada vez más evidente e incluyen su invasividad inflexible, su resistencia a los tratamientos estándar, su complejidad genética y molecular adaptabilidad y subpoblaciones de GBM células fenotípicas similares a células normales, en este documento se denomina células de glioblastoma (GSCs). Porque GSCs se necesitan para la progresión y el crecimiento del tumor, terapia basada en la diferenciación representa una modalidad de tratamiento viable para estas neoplasias incurables.
El siguiente protocolo describe una colección de procedimientos para establecer un alto rendimiento de cribado plataforma destinada a la identificación de pequeñas moléculas que promueven la diferenciación astroglial de GSC. En el núcleo del sistema es una proteína ácida fibrilosa glial (GFAP) diferenciación reportero. El protocolo contiene los siguientes procedimientos generales: (1) establecer diferenciación de GSC reportero líneas; (2) pruebas/validación de la pertinencia de la reportera a la capacidad de auto-renovación/clonogenic de GSC; y (3) alta capacidad-citometría de flujo basado en detección de drogas.
La plataforma de proyección proporciona un enfoque sencillo y de bajo costo para identificar pequeñas moléculas que promueven la diferenciación GSCs. Además, la utilización de bibliotecas de medicamentos aprobados por la FDA tiene el potencial para la identificación de agentes que pueda reutilizar más rápidamente. Además, se espera que terapias que promueven la diferenciación de células madre de cáncer funcionan en forma sinergística con las actuales terapias "estándar de atención" que han demostrado para atacar y eliminar las células de cáncer diferenciado principalmente más.
Introduction
Estudios recientes han demostrado que los tumores contienen una pequeña población de células, como las células madre cancerosas (CSCs) o las células iniciadoras del tumor, que son responsables de la progresión tumoral, metástasis y resistencia a la quimio y radio terapias 1, 2. la presencia de células madre del cáncer y su progenie más diferenciado dentro de los tumores se considera importante promover la heterogeneidad intratumoral y representa un obstáculo importante en el tratamiento de cáncer3. Jerarquía de célula tumoral, proporcionado por la teoría de la célula de vástago del cáncer, ha inspirado el desarrollo de nuevas estrategias para tratar el cáncer 4. Un enfoque para apuntar las células de vástago del cáncer es identificar e inhiben vías de señalización que se saben que son necesarios durante el desarrollo embrionario del órgano afectado. De hecho, nosotros y otros hemos publicado anteriormente varios papers describiendo la exigencia permanente de las nervios células relevantes vías de señalización Sonic Hedgehog y muesca en glioblastoma5,6,7. Este trabajo ha ayudado en la justificación de varios ensayos clínicos de GBM de solidificación. Un segundo enfoque para apuntar las células madre cancerosas es promover su diferenciación. Este enfoque ha recibido un gran apoyo debido a los resultados favorables de estudios preclínicos y clínicos en el tratamiento de la leucemia promyelocytic aguda con ácidos retinoico (ATRA, un análogo de la vitamina A). Aquí ATRA fue encontrado para quitar el bloque de maduración y promover el cáncer de la célula diferenciación8. Más recientemente, Piccirillo y colegas han demostrado elegantemente que BMP-4 promueve la diferenciación de GSC en astrocitos con anti-GBM significativos efectos in vitro e in vivo9.
La justificación para el presente estudio se basa en un enfoque de "ingeniería inversa" para apuntar GSCs. Dada la gran heterogeneidad presente en GBM y con pobre diferenciación, siendo una de las características distintivas del cáncer, preguntamos si podíamos promover un fenotipo más favorable - diferenciación en un estado de astrositos. Aquí, no tenemos conocimiento previo de las vías de señalización que mantener GSCs en un espécimen del tumor determinado sino más bien pretenden conseguir un fenotipo deseado (p. ej. positividad GFAP).
Este informe describe los procedimientos utilizados para establecer GSC diferenciación reportero-líneas de la transducción de la culturas enriquecida con GSC para selección clonal de GSC. El glioblastoma desarrolló líneas se establecieron en el laboratorio del Profesor Angelo Vescovi de pacientes con diagnóstico de glioblastoma primario en el Hospital San Raffaele - Milano, Italia. Estas líneas se han estudiado ampliamente en varias publicaciones 6,10,11,12,13,14. Se recomienda que los individuos que están interesados en la aplicación de estas técnicas en su laboratorio determinan la relevancia de la reportera a capacidad de auto-renovación de células madre de cáncer en las células que planean estudiar (esto es cierto para cualquier reportero). Se proporciona un protocolo detallado de uno de los ensayos de clonogenic en vitro aceptados en el campo para llevar a cabo este15,16. Por último, se proporciona un protocolo detallado que describe la utilización de las líneas de reportero de diferenciación en una pantalla de drogas basado en citometría de flujo al final. De nota, igualmente para el sistema de diferenciación astroglial descrito aquí, hemos correctamente establecido y validado líneas de reportero de GSC integración reportero MAP2:GFP (diferenciación neuronal). Por lo tanto, las metodologías se describen en este documento puede aplicarse para estudiar diferenciación celular en varios linajes celulares.
Algunas de las figuras en este informe se pueden encontrar en una publicación reciente: "Atracurium Besylate y otros agentes bloqueadores neuromusculares promover diferenciación astroglial y agotan glioblastoma células madre18.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Nota: Astroglial y lentivirus neuronal reportero sistemas fueron comprados como preparaciones lentivirales pre-empacados, concentradas. Se requiere conocimientos básicos de la técnica de citometría de flujo. También, para un uso completo de este protocolo, el usuario tendrá acceso a un citómetro de flujo con capacidad de alto rendimiento (acepta placas de 96 pocillos como fuente de la muestra).
1. sistema reportero transcripcional lentivirales
Nota: En los análisis de citometría de flujo, utilice células parentales, no-transduced, o vector-transduced (no fluorescente) para establecer la fluorescencia basal. También, tenga en cuenta que en todas las etapas donde se llama trituración mecánica, ser suave. Trituración áspero puede matar un número significativo de las frágil GSCs e influir en los resultados de citometría de flujo.
- Placa de 1 x 106 células en 2 mL de medio de crecimiento de células madre neuronales completo en una placa multiwell de 6.
- Transducir las células añadiendo reportero lentivirus en una multiplicidad de infección (moi) igual a 5.
- Añadir 2 μl de polibreno para una concentración final de 8 μg/mL.
- Incube las células a 37 ° C y 5% CO2 durante la noche.
- Al día siguiente, reemplazar un medio para eliminar el virus. Vuelva a colocar la placa en la incubadora a 37 ° C y 5% de CO2 e incubar durante 24 h.
- Cosecha 0.5 mL del volumen total; Desactivación de las células a 360 x g durante 5 min a temperatura ambiente en un tubo cónico de 15 mL y eliminar el sobrenadante por aspiración. Añadir 0,5 mL de medio de cultivo fresco células madre neuronales a las células restantes y vuelva la placa a la incubadora de continua expansión.
- Añadir 200 μL de reactivo de disociación e incubar 5 min a 37 ° C.
- Disociar las células transfiriendo suavemente hacia arriba y hacia abajo.
Nota: Trituración áspero puede resultar en muerte significativa de GSCs, disociación completa se logra después de 20 - 30 veces. - Para minimizar el accesorio de celular o agregación, añadir 800 μl de Hank balanceado sal solución (HBSS) para un volumen final de 1 mL.
- Transfiera 200 μL de cada suspensión celular a un pozo de una placa multiwell de 96.
- Para este procedimiento, utilice un citómetro de flujo de trabajo con capacidad de placa de 96 pocillos, equipado con un láser azul para la excitación y la capacidad de detectar la proteína verde fluorescente. Realizar el análisis cytometric del flujo con al menos 10.000 células viables para cada adquisición.
- Determinar el porcentaje de células GFP-positivas mediante citometría de flujo.
2. subclone selección, ampliación y validación
- Células de la placa en 100 μl de medio de células madre neuronales a una densidad de 0,7 células por pocillo de una placa multiwell de 96.
- Cultura clones durante 11 días a 37 ° C y 5% CO2. Este paso es altamente dependiente del tipo de la célula y probablemente requerirá un ajuste basado en la línea celular utilizada. Como regla general, una esfera de diámetro ≥ 100 μm es un buen indicador de la presencia de clonogenic GSCs en las neuroesferas.
- Utilizando un microscopio de fluorescencia equipado con un filtro FITC, marque los pocillos que contienen una sola desarrolló donde ~ 1-5% de las células son GFP-positivas.
Nota: Determinar el porcentaje exacto de células GFP-positivas no es demasiado importante en este punto. Cada uno de los subclones se evaluará más adelante por citometría de flujo. Este paso se realiza para reducir el total número de clones a analizar con énfasis en las neuroesferas que se originan por indiferenciado, GFAP-negativo, GSC. - Ampliar reportero seleccionado clones hasta que haya un número suficiente de células para el análisis por citometría de flujo. Un pozo el confluente de una placa multiwell de 6 que contienen ≤ 1.5x105 células/mL debe proporcionar un número suficiente de células.
Nota: Un procedimiento detallado para el aislamiento y expansión de GSCs está disponible 17.
3. determinación de la expresión GFAP:GFP por citometría de flujo
- Una alícuota de células (0,5 mL) de la cosecha de cada clon de reportero y no-transduced controles para determinar el porcentaje exacto de células GFP-positivas. Teniendo en cuenta clones de reportero que contienen células GFP-positivas de ~ 1-5%.
- Girar las células a 360 x g durante 5 min a temperatura ambiente y eliminar el sobrenadante por aspiración.
- Cada perdigón, añadir 200 μL de reactivo de disociación celular e incubar los tubos en un baño de agua a 37 ° C.
- Triturate células suavemente para lograr una suspensión unicelular (generalmente entre 20 y 30 veces).
- Para minimizar el accesorio de celular o agregación, añadir 800 μl HBSS a un volumen final de 1 mL.
- Transfiera 200 μL por pocillo de una placa multiwell de 96 de cada suspensión de la célula.
- Para este procedimiento, utilice un citómetro de flujo de trabajo con capacidad de placa de 96 pocillos. Realizar el análisis cytometric del flujo con al menos 10.000 células viables para cada adquisición.
4. ELDA auto-renovación análisis Clonogenic capacidad de evaluar
Nota: Para los controles, tanto los padres, no-transduced, como GFP-expresando células transduced por lentivirus, debe utilizarse para determinar el potencial relativo clonogenic de las líneas de reportero de GSC diferenciación a las culturas originales de GSC de que estaban derivados.
- Disociar los subclones de diferenciación-reportero en suspensiones celulares solo como se describe anteriormente.
- Células placa multiwell de 96 placas en 100 μl de células neuronales completos medios del crecimiento en densidad celular que oscilan entre 5 y 500 células por pocillo.
- Incube las células durante 9 a 11 días a 37 ° C y 5% CO2.
- Puntuación de pozos positivos por visualización directa de neuroesferas bajo un microscopio de luz. Un pozo se debe considerar "positivo" si contiene al menos una sola desarrolló grandes.
- Conecte los datos: total de pozos analizados y el número de pozos positivos usando la interfaz de ELDA en línea disponible en http://bioinf.wehi.edu.au/software/elda/index.html.
5. preparación de la dilución de droga biblioteca
- Quitar las placas de la biblioteca de almacenamiento a-80 ° C, cubra con papel de aluminio (protección de compuestos sensibles a la luz). Deshielo por aproximadamente 30 min a una hora a temperatura ambiente.
- Use una pipeta multicanal de 12 canales para diluir los compuestos de la biblioteca a 0,2 mM en células madre neuronales completo medio. Diluya el DMSO al 10% en un medio de
Nota: La concentración final de DMSO debe ser 0,1% cuando se añade a las células. Una mayor concentración de DMSO en la cultura puede resultar en toxicidad. Por esta razón, se recomienda probar la sensibilidad de DMSO en la línea celular utilizada, antes del tratamiento. - Uso de DMSO como control del vehículo para el tratamiento de células que se encuentran en las columnas izquierdas y derecha de cada plato (columnas 1 y 12; Pozos de A H).
- Cubrir las placas de biblioteca diluido con papel de aluminio y devolver las placas originales de la biblioteca en el congelador de-80 ° C para almacenamiento a largo plazo.
6. drug Screen
Nota: Puede usarse células tratadas con DMSO a la fluorescencia de la línea de base y ajuste de compuerta.
- Placa de 5 x 103 células en una placa multiwell de 96 99 μl de medio de cultivo de células madre neuronales completo.
- Utilizando una pipeta multicanal de 12 canales, tratar las células con compuestos biblioteca diluido a una concentración final de 2 μm (1 μl de droga de 0,2 mM en 99 μl de suspensión celular) o con DMSO (control). Incubar las placas durante 72 h a 37 ° C y 5% CO2.
- Utilizando una pipeta multicanal de 12 canales añadir 150 μL de reactivo de la disociación de células a cada pozo e incubar por 20 min a 37 ° C.
- Disociar las células por trituración suavemente con una pipeta multicanal de 12 canales hasta logra una suspensión de células individuales (generalmente entre 20 y 30 veces). La cantidad de tiempo que se requiere para disociar totalmente neuroesferas varía entre líneas de GSC. Mientras que el reactivo de disociación celular recomendado (ver materiales) es seguro e incubación durante 45 minutos no tuvo efecto sobre viabilidad en varias líneas de GSC probadas, verificar para que cada línea de GSC para utilizarse en el cribado.
Nota: El volumen final en cada una debe ser aproximadamente 250 μl (100 μl de suspensión celular + 150 μL del reactivo de disociación celular). - Determinar el porcentaje de células que expresan el reportero GFAP:GFP por citometría de flujo. Utilizar estrategia bloquea estándar. En primer lugar, trazar dispersiones laterales y hacia adelantados para tener una idea general del tamaño celular y la viabilidad. Luego coloque una puerta en la población de sola célula viable. Se trata de la población para la cual se determinará la fluorescencia verde (eGFP). Cualquier compuesto que resulta en un aumento en el porcentaje de GFP-positivas las células por más de tres desviaciones de estándar sobre el control (tratados con DMSO) se consideran como positivo "éxito." Este umbral debe ajustarse según la aplicación específica y el rigor deseado.
Nota: Para el alto rendimiento se recomienda pantalla utilizando una sola subclone de reportero de GSC. Tras la identificación de golpe, cada golpe debe validarse contra subclones adicionales del reportero de la misma línea de GSC. Para aumentar la confianza de verdaderos golpes también se recomienda probar compuestos contra reportero subclones aislado de neuroesferas de GSC diferentes líneas.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Tres líneas de neuroesferas derivadas de paciente independiente transduced con el reportero de astroglial lentivirus codifican para una proteína verde fluorescente (GFP) fundida en la estructura con cintas de resistencia Zeocin y conducidas por el elemento humano de promotor GFAP ( Figura 1). Siguiente clones individuales fueron aislados por placas 0,7 células por pocillo en una placa bien 96 (figura 2), esto fue seguido por la determinación de citometría de flujo el porcentaje de células que expresan GFP (figura 3). Desarrolló clones, derivados de las células, que contiene células GFP-positivas de ≤5% se denominan GL (GFAP baja) mientras que los clones que contienen células positivas de ≥75% GFP se conocen como GH (GFAP alto) y se consideran para ser distinguido con respecto a lo GL subclones (figura 4).
Para identificar agentes y vías que pueden controlar la diferenciación astroglial en GSCs, se realizó una pantalla de fármaco de molécula pequeña con dos bibliotecas de la colección clínica del NIH. Las células fueron tratadas por 72 horas con 727 agentes de biblioteca de la colección clínica del NIH I y II, en una concentración de 2 μm o un volumen igual de DMSO como un control. El efecto de estos agentes fue probado en la viabilidad celular en todos nuestros paciente derivado GBM desarrolló líneas en concentraciones que oscilan entre 0.2 μm y 20 μm, antes de la proyección de la droga. La concentración utilizada en el presente Protocolo nos permitidas identificar los compuestos que fueron capaces de inducir la diferenciación astroglial y al mismo tiempo, minimizar los efectos tóxicos potencialmente objetivo debido a concentraciones más altas de la droga.
Tras la incubación, se determinó el porcentaje de células que expresan el reportero GFAP-GFP mediante citometría de flujo. Las líneas de base de viabilidad y porcentaje de células GFP-positivas fueron determinados en al menos tres pozos para cada placa de la biblioteca, y un golpe positivo se determinó como un aumento en el porcentaje de células GFP-positivas de tres desviaciones estándar sobre la línea de base (DMSO) y un umbral mínimo de 25% células positivas de GFP. Se identificaron 12 medicamentos que indujo aumento suficiente en la población de GFP-positivas (tabla 1).
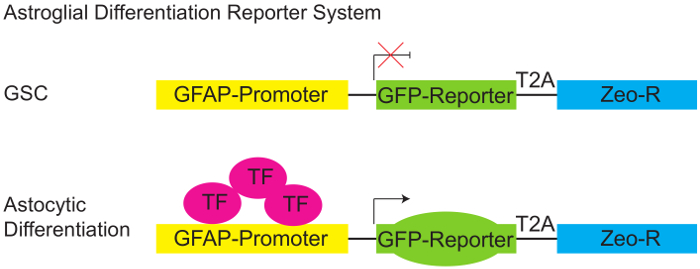
Figura 1: Astroglial diferenciación reportero sistema.
Diagrama esquemático del reportero de GFAP:GFP de pGreenZeo. GSCs no expresan la combinación adecuada de factores de transcripción necesarios para activar el promotor de la proteína ácida fibrilosa glial (GFAP) y por lo tanto no expresan GFP (panel superior). Sin embargo, cuando están presentes los factores de transcripción adecuado (por ejemplo, cuando las células adquieren un destino astroglial - diferenciar) el promotor GFAP se activa, y las células que expresan el reportero GFP (panel inferior). (GSC - células de Glioma, vinculador de T2A-proteína, Zeo-R - Zeocin gen de resistencia, TF - factor de transcripción). Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Diferenciación Astroglial - selección Subclone.
Cuadros representativos de HSR-GBM1 SGC subclones expresan niveles bajos (GL) o elevados (GH) de la periodista de GFAP:GFP utilizando microscopía de fluorescencia (figura 40 aumentos). Haga clic aquí para ver una versión más grande de esta figura.

3 figura: Citometría de flujo para la determinación de la fluorescencia verde.
HSR-GBM1 desarrolló derivados del paciente línea fue transduced con lentivirus de reportero GFAP:GFP y varios subclones fueron seleccionados en base a la expresión de GFP en la célula iniciar desarrolló y confirmado por citometría de flujo. Estos clones fueron nombrados GL (GFAP bajo) o GH (GFAP alto). Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Caracterización funcional de HSR-GBM1 GFAP:GFP subclones.
GL subclones son más clonogenic en vitro indicado por aumentar las frecuencias de la GSC que se miden por el análisis de dilución extrema limitación (ELDA). Haga clic aquí para ver una versión más grande de esta figura.
| Nombre | Aumento doble de GFP + células | Descripción | Barrera hematoencefálica | Probabilidad de banco de drogas |
| Vinorelbina | 8.97 | Anti-mitotic quimioterapia | - | 0.88 |
| Difenoxilato | 13.89 | Antidiarreico | + | 0.96 |
| Lomerizine | 10.89 | Bloqueador de canales de calcio / Cerebral vasodilatador | NA | NA |
| Phenprobamate | 10.73 | Ansiolíticos / muscular relajante, actuando centralmente | NA | NA |
| 6-Azauridine | 15.07 | Antimetabolito / antivirales | NA | NA |
| Irinotecan | 14.14 | Topisomerase inhibidor de la | + | 0,63 |
| Atracurium Besylate | 8.16 | Relajante del músculo esquelético no despolarizantes | + | 0,93 |
| Glimepirida | 8.75 | Antidiabético | + | 0.73 |
| Hexaclorofeno | 9.83 | Antiséptico | + | 0,92 |
| Digoxina | 8.23 | Glucósido cardiotónico | - | 0,72 |
| Flecainida | 10 | Agente antiarrítmico | + | 0.86 |
| Nisoldipino | 5.05 | Bloqueador de canales de calcio | - | 0.95 |
Tabla 1: Pequeñas moléculas inducen la expresión de GFAP-GFP reportero en HSR-GBM1 GL-1
Doce compuestos fueron encontrados para aumentar significativamente el porcentaje de células expresando GFP (se muestra el aumento del pliegue) y cumplieron con los criterios estrictos de ≥ 3 desviaciones de estándar sobre la línea de base, células tratadas con DMSO y con no menos de 25% GFP-positivas las células. La capacidad y probabilidad de un determinado agente para cruzar la barrera hematoencefálica (Banco de la droga (−). Abreviatura: NA (información no disponible).
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Mientras la mayoría de los estudios previos de GSCs centrados principalmente en los marcadores que los definen, en este estudio se decidió adoptar el enfoque inverso. Nos centramos principalmente en las progenies diferenciadas generadas GSCs (p. ej., células expresan marcadores neuronales y astroglial). Aquí se demuestra la utilización de un sistema, que se basa en la expresión humana de promotor dependiente GFAP de GFP de detección de drogas basadas en células de alto rendimiento. Todos los experimentos se realizaron utilizando derivados del paciente desarrolló las líneas celulares de glioblastoma. Un protocolo detallado que describe el aislamiento y la expansión de estas líneas se describe en Galli et al17.
El sistema no sólo nos ayudó en la identificación de moléculas pequeñas que son capaces de inducir la diferenciación celular de GSCs, pero también nos ayudó a determinar inequívocamente que la expresión del marcador de diferenciación astroglial GFAP determina la capacidad de clonogenic de células individuales de GBM comparando las frecuencias de GSC. El ensayo de ELDA fue desarrollado por Yifang Hu y Gordon K. Smyth. Animamos a los lectores a leer el manuscrito para una comprensión profunda de las fortalezas y limitaciones del ensayo15. La formación de la colonia que paso es altamente dependiente del tipo de la célula y probablemente requerirá un ajuste basado en la línea celular utilizada. Por otra parte, como regla general, utilizamos esfera diámetro ≥100 μm como un buen indicio de que el desarrolló se originó por un clonogenic GSC.
Además, la droga sistema se describe aquí permite la identificación de nuevos caminos (específicamente transporte acetilcolina y calcio) que están obligados a mantener GSCs en estado indiferenciado (ver tabla 1). La concentración inicial del fármaco puede variar basado en la línea de la biblioteca y de la célula utilizada. Además, el tiempo necesario para la diferenciación celular puede necesitar un ajuste. Además, validación tumorigenic de hits de drogas requiere una iniciación de tumor en vivo ensayo 18.
Potencialmente una menor limitación de esta técnica es que la diferenciación espontánea se produce inevitablemente en cualquier cultura enriquecida de células madre, y este fenómeno tiende a aumentar con el número de pasos en la cultura y la diferencia entre los subclones. De hecho, observamos diferenciación espontánea en nuestros subclones generalmente después del paso 15. Por lo tanto, nos limita nuestros análisis de la diferenciación de culturas en los números de paso no superior a cinco.
Por lo tanto, quizás el punto más crítico en esta metodología es mantener pases in vitro de estos GSCs al mínimo y cuando trabajo en vitro, mantener la densidad de cultivo por debajo de 1.5x105 células/mL. Además, se recomienda encarecidamente que cada droga "hit" es validado contra subclones adicionales del reportero de la misma línea de GSC, así como, contra reportero subclones aislados de diferentes derivados del paciente GSC neuroesferas líneas. Esto aumentará la confianza que un verdadero "golpe" a la mano.
La versatilidad de la metodología descrita en el presente Protocolo robusto fortalece el valor terapéutico de una diferenciación de células madre de cáncer inducido por la droga y debe ayudar en la identificación de nuevos fármacos como posibles estrategias terapéuticas novedosas para GBM y otros tumores. Finalmente, el ensayo puede ser optimizado para ser utilizado con no neoplásicas las células madre neurales, otros tipos de cáncer y con periodistas de diferenciación diferentes.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Los autores no tienen nada que revelar.
Acknowledgments
Este trabajo ha sido parcialmente financiado por NIH R01CA187780.
Materials
| Name | Company | Catalog Number | Comments |
| ESGRO Complete Accutase | EMD Millipore | SF006 | |
| Dimethyl Sulfoxide (DMSO) | Sigma Aldrich | D2650 | |
| HBSS (Hank's Balanced Salt Solution) | Sigma Aldrich | H6648 | |
| Human GFAP Differentiation Reporter (pGreenZeo, Virus) | SBI (System Biosciences) | SR10015VA-1 | |
| 50 ml sterile disposable reagent reservoirs | Corning | 4870 | |
| 6 well plate | Thermo Fisher Scientific | 130184 | |
| 96 well plate | Falcon | 353072 | |
| Biolite T25 cm² Flask Vented | Thermo Fisher Scientific | 130189 | |
| Biolite T75 cm² Flask Vented | Thermo Fisher Scientific | 130190 | |
| 15 ml Centrifuge tubes | Celltreat | 229411 | |
| 1.5ml Microcentrifuge tubes | Fisher Scientific | 05-408-129 | |
| Ovation Multi Channel Pipette, 12 Channel, 0.5 - 20uL | VistaLab Technologies | 1060-0020 | |
| Ovation Multi Channel Pipette, 12 Channel, 5-250uL | VistaLab Technologies | 1060-0250 | |
| Multi 12-channel pipette tips 25 μl | VistaLab Technologies | 4060-1002 | |
| Multi 12-channel pipette tips 250 μl | VistaLab Technologies | 4060-9025 | |
| Guava easyCyte 5HT Benchtop Flow Cytometer | EMD Millipore | 0500-4005 | |
| NIH Clinical Collections 1 and 2 small molecule libraries | Evotec | ||
| Name | Company | Catalog Number | Comments |
| For the preparation of neural stem cell media (500 mL) | Final concentration | ||
| BSA | GoldBio.com | A-421-250 | 0.20% |
| DMEM/F12 10X | Corning | 90-091-PB | 1X |
| Heparin sodium salt | Sigma Aldrich | H3149 | 0.0002% |
| HEPES 1M | Sigma Aldrich | H4036 | 5.4 mM |
| Insulin-Transferrin- Selenium (ITS -G) (100X) | Life Technologies | 41400-045 | 1X |
| NaHCO3 | Sigma Aldrich | S-5761 | 14.5 mM |
| Penicillin-Streptomycin (10,000 U/mL) 100X | Gibco | 15140-122 | 1X |
| Progesterone | Sigma Aldrich | P8783 | 16 nM |
| Putrescine | Sigma Aldrich | P5780 | 4.8 µM |
| Basic FGF (FGF2), Human | GoldBio | 1140-02-50 | 10 ng/ml |
| EGF, Human | GoldBio | 1150-04-100 | 20 ng/ml |
| Bottle-Top Filter, 150ml, 33mm, 0.22um, Pes, S, Ind | Corning | 431160 | Use to filter sterlize media |
References
- Maher, E. A., et al. Malignant glioma: genetics and biology of a grave matter. Genes Dev. 15 (11), 1311-1333 (2001).
- Bonavia, R., Inda, M. M., Cavenee, W. K., Furnari, F. B. Heterogeneity maintenance in glioblastoma: a social network. Cancer Res. 71 (12), 4055-4060 (2011).
- Bao, S., et al. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response. Nature. 444 (7120), 756-760 (2006).
- Sul, J., Fine, H. A. Malignant gliomas: new translational therapies. Mt Sinai J Med. 77 (6), 655-666 (2010).
- Bar, E. E., Chaudhry, A., Farah, M. H., Eberhart, C. G. Hedgehog signaling promotes medulloblastoma survival via Bc/II. Am J Pathol. 170 (1), 347-355 (2007).
- Chu, Q., Orr, B. A., Semenkow, S., Bar, E. E., Eberhart, C. G. Prolonged inhibition of glioblastoma xenograft initiation and clonogenic growth following in vivo Notch blockade. Clin Cancer Res. 19 (12), 3224-3233 (2013).
- Schreck, K. C., et al. The Notch target Hes1 directly modulates Gli1 expression and Hedgehog signaling: a potential mechanism of therapeutic resistance. Clin Cancer Res. 16 (24), 6060-6070 (2010).
- Warrell, R. P. Jr, et al. Differentiation therapy of acute promyelocytic leukemia with tretinoin (all-trans-retinoic acid). N Engl J Med. 324 (20), 1385-1393 (1991).
- Piccirillo, S. G., et al. Bone morphogenetic proteins inhibit the tumorigenic potential of human brain tumour-initiating cells. Nature. 444 (7120), 761-765 (2006).
- Bar, E. E., et al. Cyclopamine-mediated hedgehog pathway inhibition depletes stem-like cancer cells in glioblastoma. Stem Cells. 25 (10), 2524-2533 (2007).
- Bar, E. E., Lin, A., Mahairaki, V., Matsui, W., Eberhart, C. G. Hypoxia increases the expression of stem-cell markers and promotes clonogenicity in glioblastoma neurospheres. Am J Pathol. 177 (3), 1491-1502 (2010).
- Kahlert, U. D., et al. CD133/CD15 defines distinct cell subpopulations with differential in vitro clonogenic activity and stem cell-related gene expression profile in in vitro propagated glioblastoma multiforme-derived cell line with a PNET-like component. Folia Neuropathol. 50 (4), 357-368 (2012).
- Lim, K. S., et al. Inhibition of monocarboxylate transporter-4 depletes stem-like glioblastoma cells and inhibits HIF transcriptional response in a lactate-independent manner. Oncogene. 33 (35), 4433-4441 (2014).
- Kahlert, U. D., et al. ZEB1 Promotes Invasion in Human Fetal Neural Stem Cells and Hypoxic Glioma Neurospheres. Brain Pathol. 25 (6), 724-732 (2014).
- Hu, Y., Smyth, G. K. ELDA: extreme limiting dilution analysis for comparing depleted and enriched populations in stem cell and other assays. J Immunol Methods. 347 (1-2), 70-78 (2009).
- Meyer, M., et al. Single cell-derived clonal analysis of human glioblastoma links functional and genomic heterogeneity. Proc Natl Acad Sci U S A. 112 (3), 851-856 (2015).
- Galli, R., et al. Isolation and characterization of tumorigenic, stem-like neural precursors from human glioblastoma. Cancer Res. 64 (19), 7011-7021 (2004).
- Spina, R., Voss, D. M., Asnaghi, L., Sloan, A., Bar, E. E. Atracurium Besylate and other neuromuscular blocking agents promote astroglial differentiation and deplete glioblastoma stem cells. Oncotarget. 7 (1), 459-472 (2016).



