Summary
Un protocollo di screening efficiente è presentato per l'identificazione di piccole molecole che promuovono astroglial differenziazione in cellule staminali di glioblastoma (artigiano). Il dosaggio è basato su un reporter di differenziazione di cellule staminali per cui l'espressione della GFP avanzata (eGFP) è guidato da promotore umano di GFAP.
Abstract
Glioblastoma (GBM) è il tumore cerebrale primario più comune e più letali negli adulti, provocando circa 14.000 morti ogni anno nei soli Stati Uniti. La sopravvivenza mediana dopo la diagnosi è meno di 15 mesi con massima chemioterapia chirurgico di resezione, radioterapia e temozolomide. Le sfide inerenti lo sviluppo di trattamenti più efficaci di GBM sono diventati sempre più chiare e includono la sua invasività inflessibile, la resistenza ai trattamenti standard, sua complessità genetica e molecolare adattabilità e sottopopolazioni di GBM cellule con somiglianze fenotipiche delle cellule staminali normali, riferito come le cellule staminali di glioblastoma (artigiano). Perché artigiano è necessari per la progressione e la crescita del tumore, terapia a base di differenziazione rappresenta una modalità di trattamento vitale per questi neoplasma incurabile.
Il seguente protocollo descrive un insieme di procedure per stabilire un throughput elevato piattaforma, finalizzato all'identificazione di piccole molecole che promuovono la differenziazione di GSC astroglial di screening. Il nucleo del sistema è un reporter-costrutto di differenziazione di proteina silicea fibrillare glial (GFAP). Il protocollo contiene le procedure generali seguenti: (1) stabilire GSC differenziazione reporter linee; (2) test/convalida la rilevanza del reporter alla capacità di auto-rinnovamento/clonogenic GSC; e lo screening di stupefacenti basato di citometria a flusso ad alta capacità (3).
La piattaforma di screening fornisce un approccio semplice e poco costoso per identificare piccole molecole che promuovono la differenziazione di artigiano. Inoltre, l'utilizzo di librerie di farmaci approvati dalla FDA possiede il potenziale per l'identificazione degli agenti che possono essere riutilizzati più rapidamente. Inoltre, terapie che promuovono la differenziazione delle cellule staminali del cancro devono lavorare in sinergia con le terapie "standard di cura" che sono state indicate per mirare ed eliminare soprattutto più cellule di cancro differenziato.
Introduction
Recenti studi hanno dimostrato che i tumori contengono una piccola popolazione di cellule, chiamate cellule staminali tumorali (CSC) o cellule d'inizio del tumore, che sono responsabili della progressione del tumore, metastasi e resistenza alla chemio - e radio-terapie 1, 2. la presenza di cellule staminali tumorali e loro progenie differenziate all'interno dei tumori è considerata un fattore importante promuovere eterogeneità intratumorale e rappresenta quindi una transenna importante nel trattamento di tumori3. Gerarchia delle cellule di tumore, fornita dalla teoria di cellule staminali del cancro, ha ispirato lo sviluppo di nuove strategie per trattare tumori 4. Un approccio per mirare alle cellule staminali tumorali è di identificare e inibire le vie di segnalazione che sono noti per essere richiesto durante lo sviluppo embrionale dell'organo colpito. Infatti, noi ed altri abbiamo precedentemente pubblicato più documenti che descrivono il requisito in corso di cellule staminali-pertinenti segnalazione percorsi neurali Sonic Hedgehog e Notch in glioblastoma5,6,7. Questo lavoro ha aiutato a solidificarsi la spiegazione razionale per parecchi test clinici di GBM. Un secondo approccio per mirare alle cellule staminali tumorali è quello di promuovere la loro differenziazione. Questo approccio ha ricevuto un sacco di supporto dovuto i risultati favorevoli da studi preclinici e clinici nel trattamento della leucemia promyelocytic acuta con l'acido retinoico (ATRA, un analogo della vitamina A). Qui ATRA è stato trovato per rimuovere il blocco di maturazione e promuovere il cancro cellula differenziazione8. Più recentemente, Piccirillo e colleghi hanno elegantemente dimostrato che BMP-4 promuove la differenziazione di GSC in astrocytes con anti-GBM significativi effetti in vitro e in vivo9.
Il razionale per lo studio corrente si basa su un approccio di "ingegneria inversa" per il targeting artigiano. Data l'eterogeneità di vasto presente nel GBM e con scarsa differenziazione essendo uno dei tratti distintivi del cancro, abbiamo chiesto se ci potrebbe promuovere un fenotipo più favorevole - differenziazione in uno stato simil-astrociti. Qui, non abbiamo conoscenza preventiva delle vie di segnalazione che mantenere artigiano in un esemplare del tumore determinato ma piuttosto mirare a raggiungere un fenotipo desiderato (ad es. positività GFAP).
Questo rapporto descrive le procedure utilizzate per stabilire GSC differenziazione reporter-linee dalla trasduzione delle culture GSC-arricchita per selezione clonale GSC. Le linee di glioblastoma neurosphere utilizzate sono state stabilite al laboratorio del Professor Angelo Vescovi da pazienti con una diagnosi di glioblastoma primario presso l'ospedale San Raffaele - Milano, Italia. Queste linee sono state studiate estesamente in diverse pubblicazioni 6,10,11,12,13,14. È altamente raccomandato che gli individui che sono interessati a implementare queste tecniche nel loro laboratorio di determinano la rilevanza del reporter per capacità di auto-rinnovamento delle cellule staminali del cancro nelle cellule hanno in programma di studiare (questo è vero per qualsiasi giornalista). Un protocollo dettagliato per uno dell'analisi in vitro clonogenic accettate nel campo è fornito per compire questo15,16. Infine, un protocollo dettagliato che descrive l'utilizzo delle differenziazione reporter-linee in uno schermo di droga di citometria a flusso basato è fornito alla fine. Di nota, allo stesso modo per il sistema di differenziazione astroglial descritto qui, abbiamo con successo stabilito e convalidato linee reporter GSC l'integrazione di un reporter di MAP2:GFP (differenziamento neuronale). Pertanto, le metodologie di descrivere in questa carta può essere applicata per studiare la differenziazione cellulare in varie linee cellulari.
Alcune delle figure in questo rapporto può essere trovato in una recente pubblicazione: "Atracurium Besylate e altri agenti di blocco neuromuscolare promuovere il differenziamento astrogliale e impoveriscono glioblastoma cellule staminali18.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Nota: Astroglial e sistemi reporter lentivirus neuronale sono stati acquistati come preparazioni lentivirali pre-confezionati, concentrati. Conoscenza di base della tecnica di citometria a flusso è necessaria. Inoltre, per un utilizzo completo del presente protocollo, l'utente dovrà raggiungere un citometro a flusso con capacità di throughput elevato (accetta piastre da 96 pozzetti come origine di esempio).
1. sistema lentivirali trascrizionale Reporter
Nota: In tutte le analisi cytometric di flusso, utilizzare cellule parentali, trasdotte, o trasdotte vettoriale (non fluorescente) per stabilire la fluorescenza della linea di base. Inoltre, si noti che in tutte le fasi cui triturazione meccanica viene chiamato per, essere gentile. Triturazione duro può uccidere un numero significativo dell'artigiano fragile e influenzare i risultati di citometria a flusso.
- 1 x 106 cellule in 2 mL di mezzo di sviluppo completo delle cellule staminali neurali in un piatto 6-pozzetti della piastra.
- Trasducono cellule aggiungendo reporter lentivirus ad una molteplicità di infezione (moi) pari a 5.
- Aggiungere 2 µ l di polybrene per una concentrazione finale di 8 µ g/mL.
- Incubare le cellule a 37 ° C e 5% CO2 per una notte.
- Il giorno successivo, sostituire crescita medio per rimuovere virus non associato. Rimettere la piastra nell'incubatore a 37 ° C e 5% CO2 e incubare per 24 h.
- Vendemmia 0,5 mL di volume totale; rotazione verso il basso le cellule a 360 x g per 5 min a temperatura ambiente in una provetta conica da 15 mL ed eliminare il surnatante tramite aspirazione. Aggiungere 0,5 mL di terreno di coltura fresco delle cellule staminali neurali per le celle rimanenti e restituire la piastra nell'incubatore per l'espansione continua.
- Aggiungere 200 µ l di reagente di dissociazione e incubare per 5 min a 37 ° C.
- Dissociare le cellule pipettando delicatamente su e giù.
Nota: Triturazione duro può provocare significative uccisione di artigiano, dissociazione completa è realizzata solitamente dopo 20 - 30 volte. - Per minimizzare il collegamento delle cellule o aggregazione, aggiungere 800 µ l di Hank bilanciato sale soluzione (HBSS) per un volume finale di 1 mL.
- Trasferire 200 µ l di ogni sospensione cellulare in un pozzetto di una piastra a 96 pozzetti.
- Per questa procedura, è necessario utilizzare un citometro a flusso da banco con piastra a 96 pozzetti capacità equipaggiato con un laser blu per l'eccitazione e con la capacità di rilevare la proteina fluorescente verde. Eseguire analisi cytometric di flusso con almeno 10.000 cellule vitali per ogni acquisizione.
- Determinare la percentuale di cellule GFP-positive tramite flusso cytometry.
2. subclone selezione, espansione e convalida
- Cellule di piastra in 100 µ l di terreno di cellule staminali neurali ad una densità di 0,7 cellule per pozzetto di una piastra a 96 pozzetti.
- Cultura cloni per 11 giorni a 37 ° C e 5% CO2. Questo passaggio è altamente dipendente dal tipo di cellula e richiederà probabilmente una regolazione basata sulla linea cellulare utilizzata. Come regola generale, una sfera di diametro ≥ 100 µm è una buona indicazione della presenza di clonogenic artigiano nel neurosfere.
- Utilizzando un microscopio a fluorescenza dotato di filtro FITC, contrassegnare i pozzetti che contengono un singolo neurosphere dove ~ 1-5% delle cellule sono GFP-positivi.
Nota: Nel determinare che la percentuale esatta delle cellule GFP-positive non è troppo critica a questo punto. Ciascuno dei subcloni sarà successivamente valutata tramite flusso cytometry. Questa operazione viene eseguita per ridurre il totale numero di cloni da analizzare con l'accento sulla neurosfere che provengono da indifferenziato, GFAP-negativo, GSC. - Espandere reporter selezionati cloni fino a quando ci sono un numero sufficiente di cellule per l'analisi di citometria a flusso. Un sub-confluente pozzetto di una piastra 6-pozzetti contenenti ≤ 1, 5x105 cellule/mL dovrebbe fornire un numero sufficiente di cellule.
Nota: Una procedura dettagliata per l'isolamento e l'espansione di artigiano è disponibili 17.
3. determinazione dell'espressione di GFAP:GFP tramite flusso Cytometry
- Raccogliere un'aliquota di cellule (0,5 mL) da ogni reporter clone e non trasdotte controlli per determinare l'esatta percentuale di cellule GFP-positive. Considerando cloni di reporter che contengono cellule GFP-positive ~ 1-5%.
- Spin di cellule a 360 x g per 5 min a temperatura ambiente ed eliminare il surnatante tramite aspirazione.
- Per ogni pallina, aggiungere 200 µ l di reagente di dissociazione delle cellule e incubare le provette in un bagnetto ad acqua settato a 37 ° C.
- Triturare le cellule delicatamente per ottenere una sospensione di singola cellula (di solito tra 20-30 volte).
- Per minimizzare il collegamento delle cellule o aggregazione, è possibile aggiungere 800 µ l HBSS ad un volume finale di 1 mL.
- Trasferire 200 µ l per pozzetto di una piastra a 96 pozzetti da ogni sospensione cellulare.
- Per questa procedura, è necessario utilizzare un citometro a flusso da banco con piastra a 96 pozzetti capacità. Eseguire analisi cytometric di flusso con almeno 10.000 cellule vitali per ogni acquisizione.
4. ELDA Self-Renewal test per valutare la capacità clonogenica
Nota: Per i controlli, sia dei genitori, non trasdotte, nonché che esprimono GFP cellule trasdotte lentivirus, deve essere utilizzato per determinare il potenziale relativo clonogenic delle linee GSC differenziazione reporter alle culture GSC originale da cui sono stati derivati.
- Dissociare subcloni differenziazione-reporter in sospensioni unicellulari, come descritto in precedenza.
- Cellule di piastra a 96 pozzetti piastre in 100 µ l di media di sviluppo completo delle cellule staminali neurali alle densità delle cellule comprese tra 5 e 500 cellule per pozzetto.
- Incubare le cellule per 9 a 11 giorni a 37 ° C e 5% CO2.
- Punteggio ottenuto pozzetti positivi di visualizzazione diretta di neurosfere sotto un microscopio chiaro. Un pozzo dovrebbe essere considerato "positivo" se contiene almeno un singolo grande neurosphere.
- Inserire i dati: totale pozzi analizzati e il numero di pozzetti positivi usando l'interfaccia di ELDA online disponibile a http://bioinf.wehi.edu.au/software/elda/index.html.
5. droga biblioteca diluizione preparazione
- Rimuovere le piastre libreria da conservazione a-80 ° C, coprire con carta stagnola (proteggere composti sensibili alla luce). Scongelare per circa 30 minuti a un'ora a temperatura ambiente.
- Utilizzare una pipetta multicanale a 12 canali per diluire i composti di libreria da 0,2 mM in mezzo completa delle cellule staminali neurali. DMSO diluita al 10% in crescita medio
Nota: La concentrazione finale di DMSO dovrebbe essere 0,1% quando aggiunto alle cellule. Una maggiore concentrazione di DMSO nella cultura può provocare la tossicità. Per questo motivo, si consiglia di testare la sensibilità a DMSO nella linea cellulare utilizzata, prima del trattamento. - Utilizzare DMSO come controllo del veicolo per il trattamento di cellule che si trovano nelle colonne sinistra e destra di ciascuna piastra (colonne 1 e 12; Pozzi A attraverso H).
- Coprire le piastre libreria diluito con carta stagnola e restituire le tavole originali di biblioteca nel congelatore a-80 ° C per la conservazione a lungo termine.
6. drug Screen
Nota: Le cellule trattate DMSO dovrebbero essere utilizzate per impostare la fluorescenza della linea di base e regolare gating.
- Piastra 5x103 celle in una piastra a 96 pozzetti in 99 µ l di terreno di coltura delle cellule staminali neurali completa.
- Utilizzando una pipetta multicanale a 12 canali, trattare le cellule con composti di libreria diluito ad una concentrazione finale di 2 µM (1 µ l di droga di 0,2 mM in 99 µ l di sospensione cellulare) o con DMSO (controllo). Incubare le piastre per 72 h a 37 ° C e 5% CO2.
- Utilizzando una pipetta multicanale a 12 canali aggiungere 150 µ l di reagente di dissociazione delle cellule in ogni pozzetto e incubare per 20 min a 37 ° C.
- Dissociare le cellule mediante triturazione delicatamente con una pipetta multicanale a 12 canali fino a sospensione unicellulare è raggiunto (solitamente fra 20-30 volte). La quantità di tempo che è necessario dissociare completamente neurosfere varierà tra linee di GSC. Mentre il reagente di dissociazione di cella consigliati (Vedi materiali) è sicuro e incubazione fino a 45 minuti non ha avuto effetto sulla vitalità in più righe di GSC testati, verificare per ogni linea di GSC per essere impiegato per lo screening.
Nota: Il volume finale in ogni bene dovrebbe essere all'incirca 250 µ l (100 µ l di sospensione cellulare + 150 µ l di reagente di dissociazione delle cellule). - Determinare la percentuale di cellule che esprimono il reporter GFAP:GFP tramite flusso cytometry. Utilizzare la strategia di gating standard. In primo luogo, tracciare gli spargimenti in avanti e laterali per ottenere un senso generale della dimensione delle cellule e della fattibilità. Poi posto un cancello sulla popolazione di singole cellule vitale. Questa è la popolazione per i quali sarà determinata fluorescenza verde (eGFP). Ogni composto che determini un aumento della percentuale di GFP-positive cellule da oltre tre deviazioni standard sopra controllo (DMSO-trattati) è considerato come un segnale positivo "hit". Questa soglia deve essere regolata secondo l'applicazione specifica e al rigore desiderato.
Nota: Per il throughput elevato schermo è consigliabile utilizzando un singolo subclone reporter GSC. A seguito di identificazione di colpo, ogni colpo deve essere convalidato contro ulteriori reporter subcloni della stessa linea di GSC. Per aumentare la fiducia per veri successi è anche consiglia di test composti contro reporter subcloni isolato da neurosfere GSC diverse linee.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Tre linee indipendenti neurosfere paziente-derivati sono state trasdotte con il reporter di astroglial lentivirus codifica per una proteina fluorescente verde (GFP) fusa in-frame con una cassetta di resistenza zeocina e guidati dall'elemento promotore umano GFAP ( Figura 1). Prossimi singoli cloni sono stati isolati da placcatura 0,7 cellule per pozzetto in un piatto ben 96 (Figura 2), seguita dalla determinazione di cytometric di flusso della percentuale di cellule che esprimono GFP (Figura 3). Cloni di neurosphere, derivati da cellule singole, contenenti cellule GFP-positive di ≤ 5% sono indicati come GL (GFAP bassa) mentre cloni contenenti cellule positive ≥ 75% GFP sono indicati come GH (GFAP alta) e sono considerati essere più differenziato rispetto alla contabilità generale subcloni (Figura 4).
Per identificare gli agenti e le vie che possono controllare differenziazione astroglial in artigiano, uno schermo di droga della piccolo-molecola utilizzando due librerie di raccolta clinica NIH è stato effettuato. Le cellule sono state trattate per 72 ore con 727 agenti libreria della collezione clinica NIH I e II, impostato ad una concentrazione di 2 µM o un volume uguale di DMSO come controllo. L'effetto di questi agenti è stato testato su attuabilità delle cellule in tutte le nostre paziente-derivato GBM neurosphere linee alle concentrazioni che variano da 0,2 µM a 20 µM, prima della proiezione di droga. La concentrazione utilizzata nel presente protocollo ci ha permesso di identificare i composti che sono stati in grado di indurre differenziazione astroglial e allo stesso tempo, ridotto al minimo gli effetti tossici potenzialmente fuori bersaglio a causa di più alte concentrazioni di farmaco.
A seguito di incubazione, abbiamo determinato la percentuale di cellule che esprimono il reporter di GFAP-GFP mediante citometria a flusso. Linee di base per la vitalità e la percentuale di cellule GFP-positive sono state determinate in almeno tre pozzi per ogni piatto di biblioteca, e un successo positivo è stato determinato come un aumento della percentuale di cellule GFP-positive di tre deviazioni standard rispetto al basale (DMSO) e una soglia minima di 25% cellule positive di GFP. Abbiamo identificato 12 farmaci che ha indotto un aumento sufficiente della popolazione di GFP-positive (tabella 1).
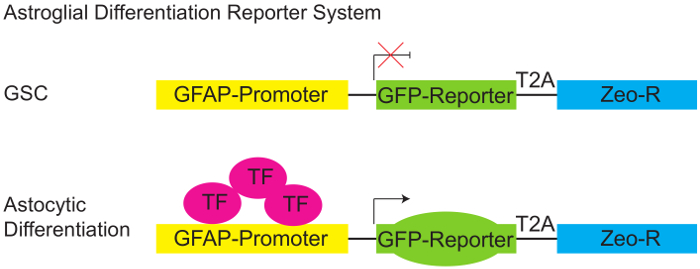
Figura 1: Sistema di Reporter differenziazione Astroglial.
Diagramma schematico di pGreenZeo GFAP:GFP reporter. Artigiano non esprimono la combinazione appropriata di fattori di trascrizione necessari per attivare il promotore di proteina silicea fibrillare glial (GFAP) e pertanto non esprimerà il GFP (pannello superiore). Tuttavia, quando sono presenti i fattori di trascrizione appropriata (ad esempio quando le cellule acquisiscono un destino astroglial - differenziare) il promotore GFAP diventa attivo e le celle esprimerà il reporter GFP (pannello inferiore). (GSC - Glioma stem cell, linker di T2A-proteina, Zeo-R - gene di resistenza zeocina, TF - fattore di trascrizione). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Differenziazione Astroglial - selezione Subclone.
Immagini rappresentative di HSR-GBM1 GSC subcloni che esprimono bassi livelli (GL) o livelli elevati (GH) del reporter GFAP:GFP utilizzando la microscopia a fluorescenza (ingrandimento 40x è indicata). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Citometria a flusso per la determinazione della fluorescenza verde.
HSR-GBM1 paziente-derivati neurosphere linea era trasdotte con lentivirus reporter GFAP:GFP e subcloni multipli sono stati selezionati basato sull'espressione di GFP nella neurosphere avvio-cella e confermata tramite flusso cytometry. Questi cloni sono stati nominati o GL (GFAP basso) o GH (GFAP alta). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Caratterizzazione funzionale di HSR-GBM1 GFAP:GFP subclones.
GL subclones sono più clonogenici in vitro come indicato dall'incremento delle frequenze di GSC che vengono misurate di estrema limitazione diluizione analisi (ELDA). Clicca qui per visualizzare una versione più grande di questa figura.
| Nome | Aumento di volte GFP + cellule | Descrizione | Barriera emato-encefalica | Probabilità di droga banca |
| Vinorelbina | 8,97 | Chemioterapia anti-mitotica | - | 0.88 |
| Difenossilato | 13,89 | Antidiarroico | + | 0,96 |
| Lomerizine | 10.89 | Calcio-antagonista / cerebrale vasodilatatore | NA | NA |
| Phenprobamate | 10,73 | Ansiolitico / Muscle relaxant, ad azione centrale | NA | NA |
| 6-Azauridine | 15.07 | Antimetabolita / antivirale | NA | NA |
| Irinotecan | 14,14 | Topisomerase ho inibitore | + | 0,63 |
| Atracurio besilato | 8.16 | Scheletrici non depolarizzanti miorilassanti | + | 0.93 |
| Glimepiride | 8.75 | Antidiabetici | + | 0,73 |
| Esaclorofene | 9,83 | Antisettico | + | 0.92 |
| Digossina | 8,23 | Cardiotonico glicoside | - | 0,72 |
| Flecainide | 10 | Agente dell'anti-aritmia | + | 0.86 |
| Nisoldipina | 5.05 | Calcio-antagonista | - | 0.95 |
Tabella 1: Piccole molecole che inducono espressione di GFAP-GFP reporter in HSR-GBM1 GL-1
Dodici composti sono stati trovati per aumentare significativamente la percentuale di cellule che esprimono GFP (aumento volte è mostrato) e ha incontrato i rigorosi criteri della ≥ 3 deviazioni standard sopra la linea di base, cellule trattate con DMSO e con non meno di 25% GFP-positive di cellule. La possibilità e la probabilità che un determinato agente di attraversare la barriera ematoencefalica (droga banca (−). Abbreviazione: NA (informazioni non disponibili).
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Mentre la maggior parte degli studi precedenti di artigiano focalizzata principalmente sui marcatori che li definiscono, in questo studio abbiamo deciso di adottare l'approccio inverso. Ci concentriamo principalmente sulla progenie differenziate generate da artigiano (per esempio, le cellule che esprimono astroglial e marcatori neuronali). Qui dimostriamo l'utilizzazione di un sistema, che è basato sulla espressione umana del promotore-dipendente GFAP di GFP di screening di stupefacenti basati su celle a resa elevata. Tutti gli esperimenti sono stati eseguiti utilizzando linee cellulari di glioblastoma neurosphere paziente-derivato. Un protocollo dettagliato che descrive l'isolamento e l'espansione di queste linee è descritto in Galli et al.17.
Il sistema non solo ci ha aiutato nell'identificazione di piccole molecole che sono in grado di indurre differenziazione cellulare di artigiano, ma anche aiutato a determinare in modo inequivocabile che l'espressione del marcatore di differenziamento astrogliale GFAP determina la capacità clonogenica di singole cellule di GBM confrontando le frequenze GSC. L'analisi di ELDA è stata sviluppata da Yifang Hu e Gordon K. Smyth. I lettori sono invitati a leggere il manoscritto per una comprensione approfondita dell'analisi punti di forza e limitazioni15. La formazione della Colonia segnando il passo è altamente dipendente dal tipo di cellula e richiederà probabilmente una regolazione basata sulla linea cellulare utilizzata. Inoltre, come regola generale, utilizziamo sfera diametro ≥ 100 µm come una buona indicazione che il neurosphere è stato originato da un clonogenic GSC.
Inoltre, il sistema che descriviamo qui di screening di stupefacenti permette l'identificazione di nuove vie (in particolare trasporto acetilcolina e calcio) che sono tenuti a mantenere artigiano nello stato indifferenziato (Vedi tabella 1). La concentrazione di farmaco di partenza può variare in base sulla libreria e cella linea utilizzata. Inoltre, il tempo necessario per la differenziazione cellulare potrebbe essere necessario aggiustamento. Inoltre, tumorigenica convalida dei successi di droga richiede un'iniziazione del tumore in vivo analisi 18.
Potenzialmente un limite minore di questa tecnica è che differenziazione spontanea si verifica inevitabilmente in qualsiasi cultura arricchita della gambo-cellula, e questo fenomeno tende ad aumentare con il numero di passaggi in coltura e differisce tra singoli subcloni. Infatti, abbiamo osservato differenziamento spontaneo nel nostro subcloni generalmente dopo passaggio 15. Di conseguenza, abbiamo limitato le nostre analisi di differenziazione alle culture ai numeri di passaggio non superiore a cinque.
Pertanto, forse il punto più critico in questa metodologia è quello di mantenere in vitro di passaggio di questi artigiano al minimo e quando si lavora in vitro, a mantenere la cultura densità inferiore a 1, 5x105 cellule/mL. Inoltre, è consigliabile che ogni droga "hit" viene convalidato contro ulteriori reporter subcloni della stessa linea di GSC, così come, contro reporter subcloni isolati da diversi paziente-derivato GSC neurosfere linee. Ciò aumenterà la fiducia che un vero e proprio "colpo" è a portata di mano.
La versatilità della metodologia descritta in questo protocollo robusto rafforza il valore terapeutico di una differenziazione di cellule staminali di cancro farmaco-indotta e dovrebbe aiutare nell'identificazione di nuovi farmaci come potenziali strategie terapeutiche per GBM e altri tumori. Infine, il dosaggio può essere ottimizzato per essere utilizzato con cellule staminali neurali non-neoplastico, altri tipi di cancro e con i giornalisti diversi differenziazione.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Gli autori non hanno nulla a rivelare.
Acknowledgments
Quest'opera è stata parzialmente sostenuta da NIH R01CA187780.
Materials
| Name | Company | Catalog Number | Comments |
| ESGRO Complete Accutase | EMD Millipore | SF006 | |
| Dimethyl Sulfoxide (DMSO) | Sigma Aldrich | D2650 | |
| HBSS (Hank's Balanced Salt Solution) | Sigma Aldrich | H6648 | |
| Human GFAP Differentiation Reporter (pGreenZeo, Virus) | SBI (System Biosciences) | SR10015VA-1 | |
| 50 ml sterile disposable reagent reservoirs | Corning | 4870 | |
| 6 well plate | Thermo Fisher Scientific | 130184 | |
| 96 well plate | Falcon | 353072 | |
| Biolite T25 cm² Flask Vented | Thermo Fisher Scientific | 130189 | |
| Biolite T75 cm² Flask Vented | Thermo Fisher Scientific | 130190 | |
| 15 ml Centrifuge tubes | Celltreat | 229411 | |
| 1.5ml Microcentrifuge tubes | Fisher Scientific | 05-408-129 | |
| Ovation Multi Channel Pipette, 12 Channel, 0.5 - 20uL | VistaLab Technologies | 1060-0020 | |
| Ovation Multi Channel Pipette, 12 Channel, 5-250uL | VistaLab Technologies | 1060-0250 | |
| Multi 12-channel pipette tips 25 μl | VistaLab Technologies | 4060-1002 | |
| Multi 12-channel pipette tips 250 μl | VistaLab Technologies | 4060-9025 | |
| Guava easyCyte 5HT Benchtop Flow Cytometer | EMD Millipore | 0500-4005 | |
| NIH Clinical Collections 1 and 2 small molecule libraries | Evotec | ||
| Name | Company | Catalog Number | Comments |
| For the preparation of neural stem cell media (500 mL) | Final concentration | ||
| BSA | GoldBio.com | A-421-250 | 0.20% |
| DMEM/F12 10X | Corning | 90-091-PB | 1X |
| Heparin sodium salt | Sigma Aldrich | H3149 | 0.0002% |
| HEPES 1M | Sigma Aldrich | H4036 | 5.4 mM |
| Insulin-Transferrin- Selenium (ITS -G) (100X) | Life Technologies | 41400-045 | 1X |
| NaHCO3 | Sigma Aldrich | S-5761 | 14.5 mM |
| Penicillin-Streptomycin (10,000 U/mL) 100X | Gibco | 15140-122 | 1X |
| Progesterone | Sigma Aldrich | P8783 | 16 nM |
| Putrescine | Sigma Aldrich | P5780 | 4.8 µM |
| Basic FGF (FGF2), Human | GoldBio | 1140-02-50 | 10 ng/ml |
| EGF, Human | GoldBio | 1150-04-100 | 20 ng/ml |
| Bottle-Top Filter, 150ml, 33mm, 0.22um, Pes, S, Ind | Corning | 431160 | Use to filter sterlize media |
References
- Maher, E. A., et al. Malignant glioma: genetics and biology of a grave matter. Genes Dev. 15 (11), 1311-1333 (2001).
- Bonavia, R., Inda, M. M., Cavenee, W. K., Furnari, F. B. Heterogeneity maintenance in glioblastoma: a social network. Cancer Res. 71 (12), 4055-4060 (2011).
- Bao, S., et al. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response. Nature. 444 (7120), 756-760 (2006).
- Sul, J., Fine, H. A. Malignant gliomas: new translational therapies. Mt Sinai J Med. 77 (6), 655-666 (2010).
- Bar, E. E., Chaudhry, A., Farah, M. H., Eberhart, C. G. Hedgehog signaling promotes medulloblastoma survival via Bc/II. Am J Pathol. 170 (1), 347-355 (2007).
- Chu, Q., Orr, B. A., Semenkow, S., Bar, E. E., Eberhart, C. G. Prolonged inhibition of glioblastoma xenograft initiation and clonogenic growth following in vivo Notch blockade. Clin Cancer Res. 19 (12), 3224-3233 (2013).
- Schreck, K. C., et al. The Notch target Hes1 directly modulates Gli1 expression and Hedgehog signaling: a potential mechanism of therapeutic resistance. Clin Cancer Res. 16 (24), 6060-6070 (2010).
- Warrell, R. P. Jr, et al. Differentiation therapy of acute promyelocytic leukemia with tretinoin (all-trans-retinoic acid). N Engl J Med. 324 (20), 1385-1393 (1991).
- Piccirillo, S. G., et al. Bone morphogenetic proteins inhibit the tumorigenic potential of human brain tumour-initiating cells. Nature. 444 (7120), 761-765 (2006).
- Bar, E. E., et al. Cyclopamine-mediated hedgehog pathway inhibition depletes stem-like cancer cells in glioblastoma. Stem Cells. 25 (10), 2524-2533 (2007).
- Bar, E. E., Lin, A., Mahairaki, V., Matsui, W., Eberhart, C. G. Hypoxia increases the expression of stem-cell markers and promotes clonogenicity in glioblastoma neurospheres. Am J Pathol. 177 (3), 1491-1502 (2010).
- Kahlert, U. D., et al. CD133/CD15 defines distinct cell subpopulations with differential in vitro clonogenic activity and stem cell-related gene expression profile in in vitro propagated glioblastoma multiforme-derived cell line with a PNET-like component. Folia Neuropathol. 50 (4), 357-368 (2012).
- Lim, K. S., et al. Inhibition of monocarboxylate transporter-4 depletes stem-like glioblastoma cells and inhibits HIF transcriptional response in a lactate-independent manner. Oncogene. 33 (35), 4433-4441 (2014).
- Kahlert, U. D., et al. ZEB1 Promotes Invasion in Human Fetal Neural Stem Cells and Hypoxic Glioma Neurospheres. Brain Pathol. 25 (6), 724-732 (2014).
- Hu, Y., Smyth, G. K. ELDA: extreme limiting dilution analysis for comparing depleted and enriched populations in stem cell and other assays. J Immunol Methods. 347 (1-2), 70-78 (2009).
- Meyer, M., et al. Single cell-derived clonal analysis of human glioblastoma links functional and genomic heterogeneity. Proc Natl Acad Sci U S A. 112 (3), 851-856 (2015).
- Galli, R., et al. Isolation and characterization of tumorigenic, stem-like neural precursors from human glioblastoma. Cancer Res. 64 (19), 7011-7021 (2004).
- Spina, R., Voss, D. M., Asnaghi, L., Sloan, A., Bar, E. E. Atracurium Besylate and other neuromuscular blocking agents promote astroglial differentiation and deplete glioblastoma stem cells. Oncotarget. 7 (1), 459-472 (2016).



