Summary
En effektiv screening protokoll er presentert for identifikasjon av små molekyler som fremmer astroglial differensiering i glioblastom stilk celler (GSCs). Analysen er basert på en stilk cellen differensiering reporter der uttrykket av den forbedrede GFP (eGFP) er drevet av menneskelig GFAP selskapet.
Abstract
Glioblastom (GBM) er den vanligste og mest dødelige primære hjernesvulst hos voksne, forårsaker omtrent 14 000 dødsfall hvert år i USA alene. Median overlevelse etter diagnose er mindre enn 15 måneder med maksimal kirurgisk resection, stråling og temozolomide kjemoterapi. Utfordringene som er iboende i å utvikle mer effektive GBM behandlinger har blitt stadig klarere, og inkluderer sin urokkelige invasiveness, sin motstand mot standard behandlinger, genetiske kompleksitet og molekylære tilpasningsevne og subpopulasjoner av GBM celler med fenotypiske likheter vanlig stamceller, heretter referert til som glioblastom stamceller (GSCs). Fordi GSCs er nødvendig for tumor vekst og progresjon, representerer differensiering-basert terapi en levedyktig behandling modalitet for disse uhelbredelig neoplasms.
Følgende protokollen beskriver en samling prosedyrer å etablere en høy gjennomstrømning screening plattform rettet mot identifikasjon av små molekyler som fremmer GSC astroglial differensiering. Kjernen i systemet er en glial fibrillary Sure protein (GFAP) differensiering reporter-konstruksjon. Protokollen inneholder følgende generelle prosedyrer: (1) å etablere GSC differensiering reporter linjer; (2) testing/validere relevans av reporteren GSC self-fornyelse/clonogenic kapasitet; og (3) høykapasitets flowcytometri basert narkotikarelaterte screening.
Screening plattformen gir en enkel og rimelig tilnærming for å identifisere små molekyler som fremmer GSCs differensiering. Videre har utnyttelse av biblioteker av FDA-godkjent narkotika potensialet for identifikasjon av agenter som kan gjenproduseres raskere. Også forventes terapi som fremmer kreft stamcelleforskningen differensiering å jobber gjeldende "standard omsorg" behandling som har vist seg å målrette og eliminere primært mer differensiert kreftceller.
Introduction
Nyere studier har vist at svulster inneholder en liten populasjon av celler, kalt stilk celler (CSCs) eller svulst-starte celler, som er ansvarlig for svulst progresjon og metastasering motstand mot kjemoterapi - og radio-behandling 1, 2. kreft stamceller og deres mer differensiert progenies innen svulster er ansett som en viktig faktor å fremme intratumoral heterogenitet og dermed representerer et stort hinder i behandling av kreft3. Svulst celle hierarki, levert av kreft stamcelleforskningen teorien, har inspirert til utviklingen av nye strategier for å behandle kreft 4. En tilnærming for målretting stilk celler er å identifisere og hemme signalveier som kan være nødvendig under embryonale utviklingen av berørte organ. Faktisk har vi og andre tidligere publisert flere artikler som beskriver pågående kravet for de nevrale stamceller relevante signalveier soniske pinnsvin og hakk i glioblastom5,6,7. Dette arbeidet har bidratt i solidifying begrunnelsen for flere GBM kliniske studier. En annen tilnærming for å målrette stilk celler er å fremme deres differensiering. Denne tilnærmingen har fått mye støtte på grunn av gode resultater fra prekliniske og kliniske studier i behandling av akutt promyelocytic leukemi med retinoic syre (ATRA, en vitamin-A analog). Her fant ATRA fjerne modning blokken og fremme kreft cellen differensiering8. Flere nylig, Piccirillo og kolleger har elegant vist at BMP-4 fremmer GSC differensiering inn astrocyttene med betydelig anti-GBM effekter i vitro og vivo9.
Begrunnelsen for denne studien er basert på en "omvendt engineering" tilnærming for målretting GSCs. Gitt den enorme heterogenitet i GBM og med dårlig differensiering er ett av kjennetegnene av kreft, spurte vi om vi kunne fremme en gunstigere fenotypen - differensiering inn en astrocytter-lignende tilstand. Her har vi ikke forkunnskaper i signalveier som opprettholde GSCs i en gitt svulst prøven, men heller sikte på å oppnå en ønsket fenotypen (f.eks GFAP positivitet).
Denne rapporten beskriver fremgangsmåtene brukes til å opprette GSC differensiering reporter-linjer fra signaltransduksjon GSC-beriket kulturer GSC klonal utvalg. Glioblastom neurosphere linjene brukes ble etablert ved Professor Angelo Vescovi fra pasienter med diagnosen primære glioblastom ved sykehuset San Raffaele - Milano, Italia. Disse linjene har vært grundig studert i flere publikasjoner 6,10,11,12,13,14. Det anbefales sterkt at personer som er interessert i å implementere disse teknikkene i sitt laboratorium bestemmer relevansen av reporteren kreft stamcelleforskningen selvtillit fornyelse kapasitet i cellene de planlegger å studere (Dette gjelder for alle reporter). En detaljert protokoll for en av de i vitro clonogenic analyser i feltet tilbys for å oppnå denne15,16. Endelig gis en detaljert protokoll som beskriver bruken av differensiering reporter-linjene i en flowcytometri-basert narkotika skjerm på slutten. Av notatet, har tilsvarende astroglial differensiering systemet beskrevet her, vi opprettet og validert GSC reporter linjer integrere en MAP2:GFP (neuronal differensiering) reporter. Derfor metodikkene beskriver i dette papir brukes til å studere differensiering i forskjellige celle linjene.
Noen av tallene i denne rapporten finnes i en fersk publikasjon: "Atracurium Besylate og andre nevromuskulære blokkere agenter fremme astroglial differensiering og tømme glioblastom stamceller18.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Merk: Astroglial og neuronal lentivirus reporter systemer ble kjøpt som pre-pakket, konsentrert lentiviral forberedelser. Grunnleggende kunnskap om flyt cytometri teknikk er nødvendig. Også for en full bruk av denne protokollen trenger brukeren tilgang til en flyt cytometer med høy gjennomstrømning kapasitet (godtar 96-brønns plater som prøvekilden).
1. lentiviral Transcriptional Reporter System
Merk: I alle flyt cytometric analyser, bruke foreldrekontroll, ikke-transduced, celler eller vektor-transduced (ikke-fluorescerende) celler for å opprette planlagte fluorescens. Også Merk at i alle trinn der mekaniske føden kalles for, vær forsiktig. Harde føden kan drepe et betydelig antall av de skjøre GSCs og påvirke flyt cytometri resultater.
- Plate 1 x 106 celler i 2 mL komplett nevrale stamceller vekstmediet i en 6-multiwell plate.
- Transduce celler ved å legge lentivirus reporter på et mangfold av infeksjon (moi) lik 5.
- Legg 2 µL av polybrene for en siste konsentrasjon av 8 µg/mL.
- Inkuber cellene på 37 ° C og 5% CO2 over natten.
- Neste dag, erstatte oppblomstringen medium for å fjerne ubundet virus. Plasser platen tilbake i inkubator på 37 ° C og 5% CO2 og ruge 24 h.
- Høste 0,5 mL av det totale volumet; Nedspinning cellene på 360 x g i 5 minutter ved romtemperatur i et 15-mL konisk rør og fjerne nedbryting av aspirasjon. Legge til 0,5 mL frisk nevrale stamceller vekstmediet i de gjenværende cellene og returnere platen til inkubator av fortsatt ekspansjon.
- Legge til 200 µL av dissosiasjon reagensen og ruge i 5 min på 37 ° C.
- Distansere celler av pipettering forsiktig opp og ned.
Merk: Harde føden kan medføre betydelig drapet på GSCs, komplett dissosiasjon er vanligvis oppnås etter 20 - 30 ganger. - For å minimere celle vedlegg eller aggregering, legger du til 800 µL av Hanks balansert Salt løsning (HBSS) for et siste volum 1 ml.
- Overføre 200 µL av hver celle suspensjon til et godt av en 96-multiwell plate.
- Til dette bruk en Borstemmaskin flyt cytometer med 96-brønns plate evnen utstyrt med en blå laser for eksitasjon og evnen til å oppdage grønne fluorescerende protein. Utføre flyt cytometric analyse med minst 10.000 levedyktige cellers for hver anskaffelse.
- Finne ut prosentandelen av GFP-positive celler av flowcytometri.
2. subclone utvalg, utvidelse og validering
- Plate cellene i 100 µL av nevrale stamceller medium på en tetthet av 0,7 celler per brønn av en 96-multiwell plate.
- Kultur kloner i 11 dager på 37 ° C og 5% CO2. Dette trinnet er svært celle type avhengige og vil trolig kreve en justering basert på celle linjen brukes. Som regel er en kule diameter ≥ 100 µm en god indikasjon på tilstedeværelsen av clonogenic GSCs i neurospheres.
- Bruke lysstoffrør mikroskop utstyrt med et FITC-filter, Merk brønnene som inneholder en enkelt neurosphere hvor ~ 1-5% av cellene er GFP-positive.
Merk: Avgjøre en nøyaktig prosentdel av GFP-positive celler ikke er for kritisk på dette punktet. Hver av subclones vil senere bli evaluert av flowcytometri. Dette trinnet utføres for å redusere totalen antall kloner som skal analyseres, med vekt på neurospheres som kommer av udifferensierte, GFAP-negativ, GSC. - Utvid valgte reporter kloner til finnes et tilstrekkelig antall celler for analyse av flowcytometri. En sub confluent godt av en 6-multiwell plate som inneholder ≤ 1.5x105 celler/mL skal gi et tilstrekkelig antall celler.
Merk: En detaljert prosedyre for isolasjon og utvidelse av GSCs er tilgjengelig 17.
3. fastsettelse av GFAP:GFP uttrykk av flowcytometri
- Høste en aliquot celler (0,5 mL) fra hver reporter klone og ikke-transduced kontroller for å fastslå en nøyaktig prosentdel av GFP-positive celler. Vurderer reporter kloner som inneholder ~ 1-5% GFP-positive celler.
- Spinn cellene på 360 x g i 5 minutter ved romtemperatur og fjerne nedbryting av aspirasjon.
- Til hver pellets, legge 200 µL av cellen dissosiasjon reagensen og ruge rør i et vannbad satt til 37 ° C.
- Triturate celler forsiktig for å oppnå en enkeltcelle suspensjon (vanligvis mellom 20 til 30 ganger).
- For å minimere celle vedlegg eller samling, legge til 800 µL HBSS et endelig antall 1 mL.
- Overføre 200 µL per brønn av en 96-multiwell plate fra hver celle suspensjon.
- Bruk en Borstemmaskin flyt cytometer med 96-brønns plate mulighet til dette. Utføre flyt cytometric analyse med minst 10.000 levedyktige cellers for hver anskaffelse.
4. ELDA selvtillit fornyelse analysen å vurdere kapasitet i Clonogenic
Merk: For kontroller-både foreldre, ikke-transduced, samt GFP-uttrykke lentivirus-transduced celler, burde bli brukt til relativ clonogenic potensialet i GSC differensiering reporter linjene til de opprinnelige GSC kulturene som de var avledet.
- Distansere differensiering-reporter subclones i én celle suspensjoner som beskrevet ovenfor.
- Plate cellene i 96-multiwell plater i 100 µL av komplett nevrale stamceller vekst medier på cellen tettheter varierer mellom 5 og 500 celler per brønn.
- Inkuber celler for 9-11 dager på 37 ° C og 5% CO2.
- Score positiv brønner ved direkte visualisering av neurospheres under mikroskop lys. En godt anses "positiv" Hvis det inneholder minst én stor neurosphere.
- Koble data: totalt brønner analysert og antall positive brønner med ELDA webgrensesnitt tilgjengelig på http://bioinf.wehi.edu.au/software/elda/index.html.
5. narkotika biblioteket fortynning forberedelse
- Fjerne biblioteket plater fra lagring ved-80 ° C, dekk med aluminiumsfolie (beskytte lysfølsom forbindelser). Tine i ca 30 minutter til en time ved romtemperatur.
- Bruke 12-kanals analyser for å fortynne biblioteket forbindelser til 0.2 mM i fullstendig nevrale stamceller medium. Fortynne DMSO 10% vekst medium
Merk: Den siste konsentrasjonen av DMSO skal 0,1% når lagt til cellene. En høyere konsentrasjon av DMSO i kultur kan føre til toksisitet. Derfor anbefales det å teste følsomhet for DMSO i cellen linjen brukes, før behandling. - Bruke DMSO som kjøretøy kontroll for å behandle cellene i venstre og høyre kolonnene i hver plate (kolonner 1 og 12; Wells A til H).
- Dekke utvannet biblioteket platene med aluminiumsfolie og tilbake den opprinnelige bibliotek platene til-80 ° C fryseren for langtidslagring.
6. stoff skjermen
Merk: DMSO-behandlet celler skal brukes til å angi den opprinnelige fluorescensen og justere gating.
- Plate 5 x 103 celler i en 96-multiwell plate i 99 µL av komplett nevrale stamceller vekst medium.
- Bruker 12-kanals analyser, behandle celler med fortynnet biblioteket forbindelser i en siste konsentrasjon av 2 µM (1 µL av 0.2 mM stoffet i 99 µL av cellen suspensjon) eller med DMSO (kontroll). Inkuber platene 72 h 37 ° C og 5% CO2.
- Med 12-kanals analyser legge 150 µL av cellen dissosiasjon reagens til hver brønn og ruge etter 20 min på 37 ° C.
- Distansere celler av forsiktig triturating med 12-kanals analyser til enkeltcelle suspensjon er oppnådd (vanligvis mellom 20 til 30 ganger). Tiden det tar å distansere neurospheres helt vil variere mellom GSC linjer. Mens anbefalt celle dissosiasjon reagensen (se materialer) er trygt og inkubasjon i opp til 45 minutter hadde ingen effekt på levedyktighet i flere GSC linjer testet, kontroller for hver GSC linje i screening.
Merk: Det siste bindet i hver vel bør være omtrent 250 µL (100 µL av cellen suspensjon + 150 µL av cellen dissosiasjon reagensen). - Angi prosenten av celler som uttrykker GFAP:GFP reporteren av flowcytometri. Bruk standard gating strategi. Først tegne fremover og side Scattere for å få en generell følelse av Cellestørrelse og levedyktighet. Plass en gate levedyktig encellede befolkningen. Dette er befolkningen som grønne fluorescens (eGFP) vil bli bestemt. Alle sammensatte som resulterer i en økning i andelen GFP-positive cellene ved tre standardavvik kontroll (DMSO-behandlet) regnes som en positiv "hit." Denne terskelen bør justeres i henhold til det bestemte programmet og den ønskede stringens.
Merk: For høy gjennomstrømming skjermen anbefales ved hjelp av en enkelt GSC reporter subclone. Etter hit identifikasjon, hvert treff skal valideres mot ekstra reporter subclones fra samme GSC linje. For å øke tilliten for ekte treff er også anbefaler testing forbindelser mot reporter subclones isolert fra forskjellige GSC neurospheres linjer.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Tre uavhengige pasient-avledede neurospheres linjer ble transduced med lentivirus astroglial reporter koding for en grønn-fluorescerende protein (GFP) smeltet i-ramme med en Zeocin motstand kassett og drevet av det menneskelige GFAP promoter elementet ( Figur 1). Neste personlige kloner var isolert av plating 0,7 celler per brønn i en 96 godt plate (figur 2), dette ble etterfulgt av flyt cytometric fastsettelse av andelen celler uttrykke GFP (Figur 3). Neurosphere kloner, avledet fra enkeltceller, som inneholder ≤5% GFP-positive celler kalles GL (GFAP lav) mens clones med ≥75% GFP positive celler kalles GH (GFAP høy) og anses å være mer forskjelligartet sammenlignet med GL subclones (Figur 4).
For å identifisere agenter og trasé som kan styre astroglial differensiering i GSCs, ble en liten-molekyl narkotika skjerm bruker to NIH klinisk samling bibliotekene utført. Cellene ble behandlet for 72 timer med 727 biblioteket agenter fra NIH klinisk samlingen I og II, satt på en konsentrasjon av 2 µM eller en lik mengde DMSO som en kontroll. Effekten av disse agentene ble testet på cellen levedyktighet på alle våre pasient-avledede GBM neurosphere linjer i konsentrasjoner mellom 0,2 µM 20 µM, før den narkotikarelaterte Screeningen. Konsentrasjonen i denne protokollen tillatt oss å identifisere forbindelser som klarte å indusere astroglial differensiering og samtidig, den minimert potensielt off-målet toksiske effekter på grunn av høyere narkotika konsentrasjoner.
Etter inkubasjon bestemt vi prosentandelen av celler som uttrykker reporteren GFAP-GFP av flowcytometri. Opprinnelige planer for levedyktighet og andelen GFP-positive celler var bestemt i minst tre brønner for hver biblioteket plate, og en positiv hit var bestemt som en økning i andelen GFP-positive cellene i tre standardavvik over planlagte (DMSO) og et minimum av 25% GFP positive celler. Vi identifisert 12 stoffer som indusert tilstrekkelig økning i befolkningen GFP-positive (tabell 1).
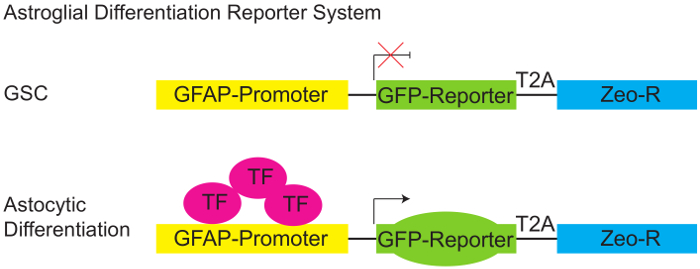
Figur 1: Astroglial differensiering Reporter System.
Skjematisk diagram av pGreenZeo GFAP:GFP reporter. GSCs uttrykke ikke passende kombinasjon av transkripsjonsfaktorer som er nødvendig for å aktivere glial fibrillary Sure protein (GFAP) arrangøren og derfor finner ikke GFP (topp panel). Men når de aktuelle transkripsjonsfaktorer er tilstede (f.eks når cellene erverver en astroglial skjebne - skille) GFAP arrangøren blir aktivt, og cellene vil uttrykke GFP reporter (nedre panelet). (GSC - Glioma stem cell, T2A-protein linker, Zeo-R - Zeocin motstand genet, TF - transkripsjon faktor). Klikk her for å se en større versjon av dette tallet.

Figur 2: Astroglial differensiering - Subclone utvalg.
Representant bilder av HSR-GBM1 GSC subclones uttrykke lave nivåer (GL) eller høye nivåer (GH) med GFAP:GFP reporteren bruker fluorescens mikroskopi (40 X forstørrelse vises). Klikk her for å se en større versjon av dette tallet.

Figur 3: Flowcytometri for fastsetting av grønne fluorescens.
HSR-GBM1 pasient-avledede neurosphere linjen ble transduced med GFAP:GFP reporter lentivirus og flere subclones ble valgt basert på GFP uttrykk i neurosphere starte-cellen og bekreftet av flowcytometri. Disse Klonene ble navngitt GL (GFAP lav) eller GH (GFAP høy). Klikk her for å se en større versjon av dette tallet.

Figur 4: Funksjonell karakteristikk av HSR-GBM1 GFAP:GFP subclones.
GL subclones er mer clonogenic i vitro som indikert av økt GSC frekvenser som måles av den ekstreme begrense fortynning analyse (ELDA). Klikk her for å se en større versjon av dette tallet.
| navn | Fold økning i GFP + celler | Beskrivelse | Blod-hjernebarrieren | Stoffet Bank sannsynlighet |
| Vinorelbine | 8.97 | Anti-mitotisk kjemoterapi | - | 0,88 |
| Diphenoxylate | 13.89 | Antidiarrheal | + | 0,96 |
| Lomerizine | 10.89 | Kalsium kanal blokker / Cerebral vasodilator | NA | NA |
| Phenprobamate | 10,73 | Angstdempende / muskel relaxant, sentralt skuespill | NA | NA |
| 6-Azauridine | 15.07 | Antimetabolite / antivirale | NA | NA |
| Irinotecan | 14.14 | Topisomerase jeg hemmer | + | 0,63 |
| Atracurium Besylate | 8,16 | Nondepolarizing skjelettlidelser muskel relaxant | + | 0.93 |
| Glimepiride | 8,75 | Antidiabetic | + | 0.73 |
| Hexachlorophene | 9.83 | Antiseptisk | + | 0,92 |
| Digoksin | 8,23 | Cardiotonic glycoside | - | 0.72 |
| Flecainide | 10 | Anti-arytmi agent | + | 0,86 |
| Nisoldipine | 5.05 | Kalsium kanal blokker | - | 0,95 |
Tabell 1: Små molekyler inducing GFAP-GFP reporter uttrykk i HSR-GBM1 GL-1
Tolv forbindelser ble funnet for å øke andelen GFP-uttrykke celler betydelig (fold økning vises) og oppfylt de strenge kriteriene i ≥3 standard avvik over grunnlinjen, DMSO-behandlet celler, og med mindre enn 25% GFP-positive celler. Evne og sannsynligheten for en gitt agent å krysse blod-hjernebarrieren (narkotika Bank (−). Forkortelse: NA (informasjon ikke tilgjengelig).
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Mens de fleste av de tidligere studiene av GSCs fokusert primært på indikatorene som definerer dem, i denne studien besluttet vi å ta motsatt tilnærming. Vi fokuserer primært på de differensiert progenies generert av GSCs (f.eks celler uttrykke astroglial og neuronal markører). Her viser vi utnyttelsen av et cellebasert høy gjennomstrømning narkotikarelaterte screening system, som er basert på menneskelige GFAP promoter-avhengige uttrykk for GFP. Alle forsøkene ble utført utnytte pasient-avledede neurosphere glioblastom linjer. En detaljert protokoll som beskriver isolasjon og utvidelse av disse linjene er beskrevet i Galli et al17.
Systemet ikke bare hjulpet oss i identifikasjon av små molekyler som kan indusere cellulære differensiering av GSCs men også hjulpet oss å bestemme utvetydig at uttrykk for astroglial differensiering markøren GFAP bestemmer den clonogenic kapasitet individuelle GBM celler ved å sammenligne GSC frekvenser. ELDA analysen ble utviklet av Yifang Hu og Gordon K. Smyth. Leserne oppfordres til å lese manuskriptet etter en grundig forståelse av analysen styrker og svakheter15. Kolonien dannelsen scoring trinn er svært celle type avhengige og vil trolig kreve en justering basert på celle linjen brukes. Videre, som regel bruker vi kule diameter ≥100 µm som en god indikasjon på at neurosphere ble startet av en clonogenic GSC.
Videre narkotikarelaterte screening systemet vi beskriver her gir identifikasjon av romanen veier (spesielt acetylkolin og kalsium transport) som forpliktet til GSCs i udifferensierte tilstand (se tabell 1). Start narkotika konsentrasjonen kan variere basert på biblioteket og celle linjen brukes. Tiden som kreves for differensiering kan også trenger justering. Videre krever tumorigenic validering av narkotika treff en i vivo svulst innvielse analysen 18.
Potensielt er en mindre begrensninger av denne teknikken at spontan differensiering forekommer uunngåelig noen stem cell beriket kultur, og dette fenomenet tendens til å øke med antall passasjer i kultur og skiller mellom individuelle subclones. Faktisk observerte vi spontan differensiering i vår subclones generelt etter passasje 15. Derfor begrenset vi vår differensiering analyser kulturer på passering tallene ikke overstiger fem.
Derfor kanskje det mest kritiske tidspunkt i denne metoden er å holde i vitro passaging av disse GSCs til et minimum og når du arbeider i vitro, til opprettholde kultur tetthet under 1.5x105 celler/mL. Videre er det sterkt anbefalt at rusmiddel "hit" valideres mot ekstra reporter subclones fra samme GSC linje, samt mot reporter subclones isolert fra forskjellige pasient-avledede GSC neurospheres linjer. Dette vil øke tilliten som en ekte "hit" er for hånden.
Allsidigheten til metodikk beskrevet i denne robuste protokollen styrker terapeutisk verdi av en narkotikainduserte kreft stem celledifferensiering og bør bidra til å identifisere nye stoffer som potensielle romanen strategier for GBM og andre svulster. Til slutt, analysen kan optimaliseres for bruk med ikke-neoplastic nevrale stamceller, andre typer kreft, og med forskjellige differensiering journalister.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne ikke avsløre.
Acknowledgments
Dette arbeidet har vært delvis støttet av NIH R01CA187780.
Materials
| Name | Company | Catalog Number | Comments |
| ESGRO Complete Accutase | EMD Millipore | SF006 | |
| Dimethyl Sulfoxide (DMSO) | Sigma Aldrich | D2650 | |
| HBSS (Hank's Balanced Salt Solution) | Sigma Aldrich | H6648 | |
| Human GFAP Differentiation Reporter (pGreenZeo, Virus) | SBI (System Biosciences) | SR10015VA-1 | |
| 50 ml sterile disposable reagent reservoirs | Corning | 4870 | |
| 6 well plate | Thermo Fisher Scientific | 130184 | |
| 96 well plate | Falcon | 353072 | |
| Biolite T25 cm² Flask Vented | Thermo Fisher Scientific | 130189 | |
| Biolite T75 cm² Flask Vented | Thermo Fisher Scientific | 130190 | |
| 15 ml Centrifuge tubes | Celltreat | 229411 | |
| 1.5ml Microcentrifuge tubes | Fisher Scientific | 05-408-129 | |
| Ovation Multi Channel Pipette, 12 Channel, 0.5 - 20uL | VistaLab Technologies | 1060-0020 | |
| Ovation Multi Channel Pipette, 12 Channel, 5-250uL | VistaLab Technologies | 1060-0250 | |
| Multi 12-channel pipette tips 25 μl | VistaLab Technologies | 4060-1002 | |
| Multi 12-channel pipette tips 250 μl | VistaLab Technologies | 4060-9025 | |
| Guava easyCyte 5HT Benchtop Flow Cytometer | EMD Millipore | 0500-4005 | |
| NIH Clinical Collections 1 and 2 small molecule libraries | Evotec | ||
| Name | Company | Catalog Number | Comments |
| For the preparation of neural stem cell media (500 mL) | Final concentration | ||
| BSA | GoldBio.com | A-421-250 | 0.20% |
| DMEM/F12 10X | Corning | 90-091-PB | 1X |
| Heparin sodium salt | Sigma Aldrich | H3149 | 0.0002% |
| HEPES 1M | Sigma Aldrich | H4036 | 5.4 mM |
| Insulin-Transferrin- Selenium (ITS -G) (100X) | Life Technologies | 41400-045 | 1X |
| NaHCO3 | Sigma Aldrich | S-5761 | 14.5 mM |
| Penicillin-Streptomycin (10,000 U/mL) 100X | Gibco | 15140-122 | 1X |
| Progesterone | Sigma Aldrich | P8783 | 16 nM |
| Putrescine | Sigma Aldrich | P5780 | 4.8 µM |
| Basic FGF (FGF2), Human | GoldBio | 1140-02-50 | 10 ng/ml |
| EGF, Human | GoldBio | 1150-04-100 | 20 ng/ml |
| Bottle-Top Filter, 150ml, 33mm, 0.22um, Pes, S, Ind | Corning | 431160 | Use to filter sterlize media |
References
- Maher, E. A., et al. Malignant glioma: genetics and biology of a grave matter. Genes Dev. 15 (11), 1311-1333 (2001).
- Bonavia, R., Inda, M. M., Cavenee, W. K., Furnari, F. B. Heterogeneity maintenance in glioblastoma: a social network. Cancer Res. 71 (12), 4055-4060 (2011).
- Bao, S., et al. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response. Nature. 444 (7120), 756-760 (2006).
- Sul, J., Fine, H. A. Malignant gliomas: new translational therapies. Mt Sinai J Med. 77 (6), 655-666 (2010).
- Bar, E. E., Chaudhry, A., Farah, M. H., Eberhart, C. G. Hedgehog signaling promotes medulloblastoma survival via Bc/II. Am J Pathol. 170 (1), 347-355 (2007).
- Chu, Q., Orr, B. A., Semenkow, S., Bar, E. E., Eberhart, C. G. Prolonged inhibition of glioblastoma xenograft initiation and clonogenic growth following in vivo Notch blockade. Clin Cancer Res. 19 (12), 3224-3233 (2013).
- Schreck, K. C., et al. The Notch target Hes1 directly modulates Gli1 expression and Hedgehog signaling: a potential mechanism of therapeutic resistance. Clin Cancer Res. 16 (24), 6060-6070 (2010).
- Warrell, R. P. Jr, et al. Differentiation therapy of acute promyelocytic leukemia with tretinoin (all-trans-retinoic acid). N Engl J Med. 324 (20), 1385-1393 (1991).
- Piccirillo, S. G., et al. Bone morphogenetic proteins inhibit the tumorigenic potential of human brain tumour-initiating cells. Nature. 444 (7120), 761-765 (2006).
- Bar, E. E., et al. Cyclopamine-mediated hedgehog pathway inhibition depletes stem-like cancer cells in glioblastoma. Stem Cells. 25 (10), 2524-2533 (2007).
- Bar, E. E., Lin, A., Mahairaki, V., Matsui, W., Eberhart, C. G. Hypoxia increases the expression of stem-cell markers and promotes clonogenicity in glioblastoma neurospheres. Am J Pathol. 177 (3), 1491-1502 (2010).
- Kahlert, U. D., et al. CD133/CD15 defines distinct cell subpopulations with differential in vitro clonogenic activity and stem cell-related gene expression profile in in vitro propagated glioblastoma multiforme-derived cell line with a PNET-like component. Folia Neuropathol. 50 (4), 357-368 (2012).
- Lim, K. S., et al. Inhibition of monocarboxylate transporter-4 depletes stem-like glioblastoma cells and inhibits HIF transcriptional response in a lactate-independent manner. Oncogene. 33 (35), 4433-4441 (2014).
- Kahlert, U. D., et al. ZEB1 Promotes Invasion in Human Fetal Neural Stem Cells and Hypoxic Glioma Neurospheres. Brain Pathol. 25 (6), 724-732 (2014).
- Hu, Y., Smyth, G. K. ELDA: extreme limiting dilution analysis for comparing depleted and enriched populations in stem cell and other assays. J Immunol Methods. 347 (1-2), 70-78 (2009).
- Meyer, M., et al. Single cell-derived clonal analysis of human glioblastoma links functional and genomic heterogeneity. Proc Natl Acad Sci U S A. 112 (3), 851-856 (2015).
- Galli, R., et al. Isolation and characterization of tumorigenic, stem-like neural precursors from human glioblastoma. Cancer Res. 64 (19), 7011-7021 (2004).
- Spina, R., Voss, D. M., Asnaghi, L., Sloan, A., Bar, E. E. Atracurium Besylate and other neuromuscular blocking agents promote astroglial differentiation and deplete glioblastoma stem cells. Oncotarget. 7 (1), 459-472 (2016).



