Summary
En effektiv screening protokoll presenteras för identifiering av små molekyler som främjar astroglial differentiering i glioblastoma stamceller (GSCs). Analysen är baserad på stamcells differentiering reporter varvid uttrycket av den förbättrade GFP (andra) drivs av mänskliga Fredsgenomförande arrangören.
Abstract
Glioblastom (GBM) är den vanligaste och mest dödliga primär hjärntumör hos vuxna, orsakar ungefär 14 000 dödsfall varje år enbart i USA. Medianöverlevnad efter diagnos är mindre än 15 månader med maximal kirurgisk resektion, strålning och temozolomide kemoterapi. Utmaningarna som utveckla effektivare GBM behandlingar har blivit allt tydligare, och dess orubbliga invasivitet, dess motstånd mot standardbehandlingar, dess genetiska komplexiteten och molekylär anpassningsförmåga och subpopulationer av GBM celler med fenotypiska likheterna med normala stamceller, hädanefter kallas glioblastom stamceller (GSCs). Eftersom GSCs krävs för tumörtillväxt och progression, representerar differentiering-baserad terapi en livskraftig behandling modaliteten för dessa obotlig neoplasmer.
Följande protokoll beskriver en samling av förfaranden för att en hög genomströmning screening plattform syftar till identifiering av små molekyler som främjar GSC astroglial differentiering. Kärnan i systemet är en glial fibrillary sura protein (Fredsgenomförande) differentiering reporter-konstruktion. Protokollet innehåller följande allmänna procedurer: (1) om inrättande av GSC differentiering reporter linjer; (2) testning/validera relevansen av reportern till GSC self-förnyelse/clonogenic kapacitet; och (3) hög kapacitet-flödescytometri baserat drogkontroll.
Screening plattformen ger en enkel och billig metod för att identifiera små molekyler som främjar GSCs differentiering. Dessutom innehar utnyttjande av bibliotek av FDA-godkända läkemedel risken för identifiering av ämnen som kan vara repurposed snabbare. Också, terapier som främjar cancer stamcellers differentiering förväntas arbeta synergistiskt med nuvarande ”standard of care” behandlingar som har visat att identifiera och eliminera primärt mer differentierad cancerceller.
Introduction
Nyligen genomförda studier har visat att tumörer innehåller en liten population av celler, kallas cancerstamceller (CSCs) eller tumör-inleda celler, som är ansvariga för tumör progression, metastaser och motstånd till chemo - och radio-terapier 1, 2. förekomsten av cancerstamceller och deras mer differentierade avkommor inom tumörer anses vara en viktig faktor att främja intratumoral heterogenitet och utgör därmed ett stort hinder i behandling av cancer3. Tumör cell hierarki, som tillhandahålls av cancer stamceller teorin, har inspirerat utvecklingen av nya strategier för att behandla cancer 4. En metod för inriktning cancerstamceller är att identifiera och hämma signalvägar som är kända att krävas under fosterutvecklingen av det drabbade organet. Faktiskt har vi och andra tidigare publicerat flera artiklar som beskriver pågående kravet för de neurala stamceller-relevanta signalvägar Sonic Hedgehog och skåran i glioblastoma5,6,7. Detta arbete har hjälpt stelnar den logiska grunden för flera GBM kliniska prövningar. En andra strategi för inriktning cancerstamceller är att främja deras differentiering. Detta synsätt har fått mycket stöd på grund av de gynnsamma resultat från prekliniska och kliniska studier vid behandling av akut promyeloisk leukemi med retinoinsyra syror (ATRA, en vitamin A-analog). Här hittades ATRA ta bort blocket mognad och främja cancer cell differentiering8. Mer nyligen, Piccirillo och kollegor har elegant visat att BMP-4 främjar GSC differentiering in astrocyter med betydande anti-GBM effekter in vitro- och in-vivo9.
Den logiska grunden för den aktuella studien är baserad på en ”reversed engineering” strategi för att rikta GSCs. Med tanke på den stora heterogeniteten som är närvarande i GBM och med dålig differentiering är ett av kännetecknen för cancer, frågade vi om vi kunde främja en mer gynnsam fenotyp - differentiering in ett Astrocyten-liknande tillstånd. Här, har vi inte tidigare kunskap om de signalvägar som underhåller GSCs i given tumör prov men snarare syftar till att uppnå en önskad fenotyp (e.g. Fredsgenomförande positivitet).
Rapporten beskriver de förfaranden som används för att fastställa GSC differentiering reporter-linjer från transduktion av GSC-berikad kulturer till GSC klonförädling. De glioblastoma neurosphere linjerna används fastställdes vid Professor Angelo Vescovi laboratorium från patienter med diagnosen primär glioblastoma på sjukhuset San Raffaele - Milano, Italien. Dessa linjer har studerats i flera publikationer 6,10,11,12,13,14. Det rekommenderas att individer som är intresserade av att genomföra dessa tekniker i deras laboratorium avgöra relevansen av reportern till cancer stamceller självförnyelse kapacitet i de celler som de planerar att studera (detta är sant för någon reporter). Ett detaljerat protokoll för en av in vitro- clonogenic analyserna accepteras i fältet finns för att åstadkomma detta15,16. Slutligen finns ett detaljerat protokoll som beskriver användningen av differentiering reporter-raderna i en flödescytometri-baserat drog skärm i slutet. Notera, har likaså till astroglial differentiering systemet beskrivs här, vi framgångsrikt etablerat och validerade GSC reporter linjer att integrera en MAP2:GFP (neuronal differentiering) reporter. Därför, metoderna som Beskriv i detta papper kan användas för att studera celldifferentiering i olika cell härstamningar.
Några av siffrorna i denna rapport kan hittas i en ny publikation: ”Atracurium Besylate och andra neuromuskulärt blockerande medel främja astroglial differentiering och bryter ned glioblastoma stamceller18.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Obs: Astroglial och neuronala lentivirus reporter system inköptes som färdigförpackade, koncentrerad lentiviral preparat. Grundläggande kunskap om flödet flödescytometri teknik krävs. Även, för ett fullt utnyttjande av detta protokoll måste användaren tillgång till en flödescytometer med hög genomströmning kapacitet (accepterar 96 brunnar som provkällan).
1. lentiviral transkriptionell Reporter systemet
Obs: I alla flödesanalyser flödescytometrisk, använda föräldrakontroll, icke-sensorik, celler eller vector-sensorik (icke-fluorescerande) celler för fastställande av baslinjen fluorescens. Också, Observera att i alla steg där mekanisk sönderdelning kallas för, vara varsam. Hårda trituration kan döda ett betydande antal av de sköra GSCs och påverka flödet flödescytometri resultat.
- Tallrik 1 x 106 celler i 2 mL odlingsmedium komplett neurala stamceller i en 6-multiwell plate.
- Transduce celler genom att lägga till lentivirus reporter på en multiplicity av infektion (moi) lika med 5.
- Tillsätt 2 µL av polybrene för en slutlig koncentration på 8 µg/mL.
- Inkubera cellerna vid 37 ° C och 5% CO2 över natten.
- Nästa dag, ersätta odlingsmedium för att avlägsna obunden virus. Placera plattan tillbaka i inkubatorn vid 37 ° C och 5% CO2 och Inkubera under 24 h.
- Skörda 0,5 mL av den totala volymen; snurra ner cellerna på 360 x g för 5 min i rumstemperatur i en 15 mL koniska rör och ta bort supernatanten genom aspiration. Tillsätt 0,5 mL färsk neurala stamceller odlingsmedium till återstående cellerna och tillbaka plattan till inkubatorn för fortsatt expansion.
- Tillsätt 200 µL av dissociation reagens och inkubera i 5 minuter vid 37 ° C.
- Separera celler genom pipettering försiktigt upp och ner.
Obs: Hårda trituration kan resultera i betydande dödandet av GSCs, fullständig dissociation sker oftast efter 20 - 30 gånger. - För att minimera cell fastsättning eller aggregering, tillsätt 800 µL av Hank's Balanced Salt lösning (HBSS) för en slutlig volym av 1 mL.
- Överföra 200 µL av varje cellsuspension till en brunn av en 96-multiwell plate.
- För detta förfarande, Använd en bänkmonterade flödescytometer med plattan med 96 brunnar kapacitet utrustad med en blå laser för magnetisering och med förmåga att upptäcka grönt fluorescerande protein. Utföra flöde flödescytometrisk analys med minst 10.000 viabla celler för varje förvärv.
- Bestämma procentandelen av GFP-positiva celler av flödescytometri.
2. subclone urval, Expansion och validering
- Platta celler i 100 µL av neurala stamceller medium med en täthet av 0.7 celler per väl av en 96-multiwell plate.
- Kultur kloner i 11 dagar vid 37 ° C och 5% CO2. Detta steg är mycket celltyp beroende och sannolikt kommer att kräva en justering utifrån den cellinje som används. Som en allmän regel är en sfär diameter ≥ 100 µm en bra indikation på förekomst av clonogenic GSCs i neurospheres.
- Med fluorescerande Mikroskop utrustat med en FITC-filter Markera brunnarna som innehåller en enda neurosphere där ~ 1-5% av cellerna är GFP-positiva.
Obs: Att bestämma den exakta procentandelen av GFP-positiva celler är inte alltför kritisk på denna punkt. Var och en av subkloner kommer senare att utvärderas av flödescytometri. Detta steg utförs för att minska totalen antal kloner analyseras med betoning på neurospheres som kommer av odifferentierade, Fredsgenomförande-negativ, GSC. - Expandera valda reporter kloner tills det finns ett tillräckligt antal celler för analys av flödescytometri. En sub konfluenta väl 6-multiwell platta innehållande ≤ 1.5x105 celler/mL bör tillhandahålla ett tillräckligt antal celler.
Obs: Ett detaljerat förfarande för isolering och utbyggnad av GSCs är tillgängliga 17.
3. bestämning av GFAP:GFP uttryck av flödescytometri
- Skörda en alikvot av celler (0,5 mL) från varje reporter klon och icke-sensorik kontroller för att fastställa den exakta procentandelen av GFP-positiva celler. Med tanke på reporter kloner som innehåller ~ 1-5% GFP-positiva celler.
- Snurra celler vid 360 x g i 5 min i rumstemperatur och ta bort supernatanten genom aspiration.
- Till varje pellet, tillsätt 200 µL av cell dissociation reagens och inkubera rören i vattenbad inställt på 37 ° C.
- Pulverisera celler försiktigt för att uppnå en enda cellsuspension (vanligtvis mellan 20 till 30 gånger).
- För att minimera cell fastsättning eller aggregering, tillsätt 800 µL HBSS till en slutlig volym av 1 mL.
- Överföra 200 µL per brunn av en 96-multiwell plate från varje cellsuspension.
- För detta förfarande, Använd en bänkmonterade flödescytometer med plattan med 96 brunnar anlagen. Utföra flöde flödescytometrisk analys med minst 10.000 viabla celler för varje förvärv.
4. ELDA självförnyelse Assay att bedöma Clonogenic kapacitet
Obs: För kontroller, föräldraledighet, icke-sensorik, såväl som GFP-uttryckande lentivirus-sensorik celler, bör användas att bestämma den relativa clonogenic potentialen av GSC differentiering reporter raderna till ursprungliga GSC kulturer som de var härrör.
- Separera differentiering-reporter subkloner i encelliga suspensioner som beskrivs ovan.
- Platta celler i 96-multiwell tallrikar i 100 µL av komplett neurala stamceller tillväxt medier på cell densiteter mellan 5 och 500 celler per brunn.
- Inkubera cellerna i 9 – 11 dagar vid 37 ° C och 5% CO2.
- Poäng positiva brunnar av direkt visualisering av neurospheres under ett ljusmikroskop. En brunn bör övervägas ”positiva” om det innehåller minst en enda stor neurosphere.
- Anslut data: Summa brunnar analyseras och antalet positiva brunnar i gränssnittet ELDA online tillgänglig på http://bioinf.wehi.edu.au/software/elda/index.html.
5. läkemedel bibliotek utspädning förberedelse
- Ta bort bibliotek plattor från lagring vid-80 ° C, täcka med aluminiumfolie (skydda ljuskänsliga föreningar). Tina i ca 30 min till en timme i rumstemperatur.
- Använd en 12-kanals multikanalpipett att späda ut de bibliotek föreningarna till 0,2 mM i komplett neurala stamceller medium. Utspädd DMSO till 10% i odlingsmedium
Obs: Den slutliga koncentrationen av DMSO bör vara 0,1% när läggas till celler. En högre koncentration av DMSO i kulturen kan resultera i toxicitet. Därför är det rekommenderat att testa känslighet för DMSO i den cellinje som används, före behandling. - Använda DMSO som medlet kontrollerar för att behandla celler som finns i vänster och höger kolumner i varje platta (kolumn 1 och 12; Brunnarna A genom H).
- Täcka de utspädda bibliotek plattorna med aluminiumfolie och återgå ursprungliga bibliotek plattorna till-80 ° C frysen för långsiktig lagring.
6. drog skärm
Obs: DMSO-behandlade celler bör användas för att ange originalplan fluorescensen och justera gating.
- Tallrik 5 x 103 celler i en 96-multiwell plate i 99 µL komplett neurala stamceller odlingsmedium.
- Med hjälp av en 12-kanals multikanalpipett, behandla celler med utspädda bibliotek föreningar med en slutlig koncentration på 2 µM (1 µL av 0,2 mM drog in 99 µL cellsuspension) eller med DMSO (kontroll). Inkubera plattorna under 72 timmar vid 37 ° C och 5% CO2.
- Med hjälp av en 12-kanals multikanalpipett Tillsätt 150 µL cell dissociation reagens i varje brunn och Inkubera under 20 minuter vid 37 ° C.
- Separera celler av triturating försiktigt med en 12-kanals multikanalpipett tills enda cellsuspension uppnås (vanligtvis mellan 20 till 30 gånger). Hur lång tid som krävs för att separera neurospheres helt kommer att variera mellan GSC linjer. Medan den rekommenderade cell dissociation reagensen (se material) är säkert och inkubering upp till 45 minuter hade ingen effekt på lönsamheten i flera GSC rader testad, verifiera för varje GSC linje som ska användas i screening.
Obs: Den slutliga volymen i varje väl bör vara ungefär 250 µL (100 µL cellsuspension + 150 µL cell dissociation reagens). - Bestämma procentandelen av celler som uttrycker GFAP:GFP reporter av flödescytometri. Använd vanliga Usenets strategi. Först Rita fram och sida scatters för att få en allmän känsla av Cellstorlek och livskraft. Placera sedan en grind på livskraftiga encelliga befolkningen. Det är befolkningen som grön fluorescens (andra) kommer att fastställas. Varje förening att resulterar i en ökning av andelen GFP-positiva celler med över tre standardavvikelser över kontrollen (DMSO-behandlade) är ansett som en positiv ”hit”. Detta tröskelvärde bör anpassas efter ansökan och den önskad hårdhet.
Obs: För hög genomströmning skärmen rekommenderas använda en enda GSC reporter subclone. Efter träffen identifiering, varje träff ska valideras mot ytterligare reporter subkloner från samma GSC linje. För att öka förtroendet för sann träffar är också rekommenderar testning föreningar mot reporter subkloner isolerats från olika GSC neurospheres linjer.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Tre oberoende patientderiverade neurospheres linjer var sensorik med lentivirus astroglial reporter kodning för ett grönt fluorescerande protein (GFP) smält i-ram med en Zeocin motstånd kassett och drivs av den mänskliga Fredsgenomförande arrangör faktorn ( Figur 1). Nästa enskilda kloner isolerades av plätering 0.7 celler per brunn i en 96 väl platta (figur 2), Detta följdes av flöde flödescytometrisk bestämning av andelen celler som uttrycker GFP (figur 3). Neurosphere kloner, härrör från enstaka celler, som innehåller ≤5% GFP-positiva celler kallas GL (Fredsgenomförande låg) medan kloner som innehåller ≥75% GFP positiva celler kallas GH (Fredsgenomförande hög) och anses vara mer differentierad jämfört med GL subkloner (figur 4).
För att identifiera agenter och vägar som kan styra astroglial differentiering i GSCs, utfördes en småmolekylär drog skärm använder två NIH kliniska samling bibliotek. Celler behandlades för 72 timmar med 727 bibliotek agenter från NIH kliniska samlingen I och II, inställda på en koncentration av 2 µM eller en lika stor volym av DMSO som kontroll. Effekten av dessa medel testades på cellernas viabilitet i alla våra patientderiverade GBM neurosphere linjer vid koncentrationer från 0,2 µM 20 µm, innan drogkontroll. Den koncentration som används i detta protokoll som tillät oss att identifiera substanser som skulle kunna framkalla astroglial differentiering och på samma gång, den minimerad potentiellt off-target toxiska effekter på grund av högre läkemedelskoncentrationen.
Efter inkubering bestäms vi andelen celler som uttrycker de Fredsgenomförande-GFP reportern av flödescytometri. Baslinjer för livskraft och procentandel av GFP-positiva celler bestämdes i minst tre brunnar för varje bibliotek plattan, och en positiv hit bestämdes som en ökning av andelen GFP-positiva celler av tre standardavvikelser över baslinjen (DMSO) och en minsta 25% GFP positiva celler. Vi identifierat 12 droger som inducerad tillräcklig ökning av GFP-positiv befolkningen (tabell 1).
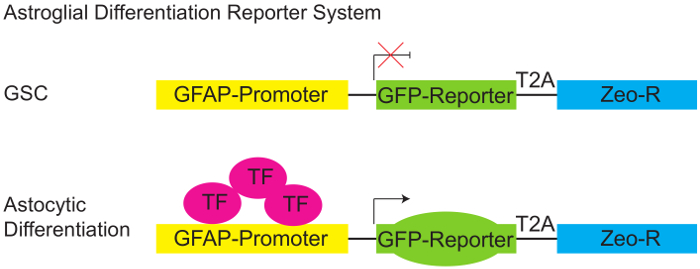
Figur 1: Astroglial differentiering Reporter systemet.
Schematisk bild av pGreenZeo GFAP:GFP reporter. GSCs uttrycker inte den lämpliga kombinationen av transkriptionsfaktorer nödvändigt att aktivera promotorn glial fibrillary sura protein (Fredsgenomförande) och därför uttrycker inte GFP (övre panelen). Dock när de lämpliga transkriptionsfaktorerna är närvarande (t.ex. När celler förvärva en astroglial öde - skilja) Fredsgenomförande arrangören blir aktiv, och cellerna uttrycker GFP reportern (nedre panelen). (GSC - gliom stamceller, T2A-protein länkare, Zeo-R - Zeocin motstånd gen, TF - transkriptionsfaktor). Klicka här för att se en större version av denna siffra.

Figur 2: Astroglial differentiering - Subclone urval.
Representativa bilder av HSR-GBM1 GSC subkloner uttrycker låga nivåer (GL) eller hög (GH) av GFAP:GFP reporter använder fluorescensmikroskopi (40 X förstoring är visas). Klicka här för att se en större version av denna siffra.

Figur 3: Flödescytometri för bestämning av grön fluorescens.
HSR-GBM1 patientderiverade neurosphere linje var sensorik med GFAP:GFP reporter lentivirus och flera subkloner valdes ut baserat på god Jordbrukarsed uttryck i cellen för neurosphere inleda- och bekräftats av flödescytometri. Dessa kloner namngavs antingen GL (Fredsgenomförande låg) eller GH (Fredsgenomförande hög). Klicka här för att se en större version av denna siffra.

Figur 4: Funktionell karakterisering av HSR-GBM1 GFAP:GFP subclones.
GL subkloner är mer clonogenic i vitro indikerat av ökade GSC frekvenser som mäts av extrema att begränsa utspädning analys (ELDA). Klicka här för att se en större version av denna siffra.
| Namn | Faldig ökning av GFP + celler | Beskrivning | Blod-hjärnbarriären | Drogen Bank sannolikheten |
| Vinorelbin | 8,97 | Anti mitotiska kemoterapi | - | 0,88 |
| Diphenoxylate | 13,89 | Antidiarrheal | + | 0,96 |
| Lomerizine | 10,89 | Kalciumantagonist / Cerebral vasodilaterande | NA | NA |
| Phenprobamate | 10,73 | Ångestdämpande / Muscle relaxant, centralt verkande | NA | NA |
| 6-Azauridine | 15.07 | Antimetabolit / antivirala | NA | NA |
| Irinotekan | 14.14 | Topisomerase jag hämmare | + | 0,63 |
| Atrakurium Besylate | 8.16 | Icke-depolariserande muskelavslappnande medel skelett | + | 0,93 |
| Glimepirid | 8,75 | Antidiabetika | + | 0,73 |
| Hexaklorofen | 9,83 | Antiseptiska | + | 0,92 |
| Digoxin | 8,23 | Hjärtstimulerande glykosid | - | 0,72 |
| Flekainid | 10 | Anti arytmi agent | + | 0,86 |
| Nisoldipin | 5,05 | Kalciumantagonist | - | 0,95 |
Tabell 1: Små molekyler inducerande Fredsgenomförande-GFP reporter uttryck i HSR-GBM1 GL-1
Tolv föreningar konstaterades att avsevärt öka andelen GFP-uttryckande celler (faldig ökning är visas) och träffade de stränga kriterierna i ≥ 3 standardavvikelser över baslinjen, DMSO-behandlade celler, och med inte mindre än 25% GFP-positiva celler. Förmåga och sannolikheten för en viss agent att passera blod-hjärnbarriären (Drug Bank (−). Förkortning: NA (information saknas).
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Medan de flesta av de tidigare studierna av GSCs inriktades främst på de markörer som definierar dem, i denna studie beslutade vi att ta den omvända strategin. Vi fokuserar främst på de differentierade avkommor som genereras av GSCs (t.ex. celler som uttrycker astroglial och neuronala markörer). Här visar vi ett utnyttjande av en cell-baserad hög genomströmning drug screening system, som bygger på mänskliga Fredsgenomförande arrangören-beroende uttryck för god Jordbrukarsed. Alla experiment utfördes utnyttja patientderiverade neurosphere glioblastoma cell linjer. Ett detaljerat protokoll som beskriver isolering och expansion av dessa linjer är beskrivs i Galli et al17.
Systemet inte bara hjälpt oss i identifiering av små molekyler som kan framkalla cellulär differentiering av GSCs men också hjälpt oss att entydigt bestämma att uttrycket av astroglial differentiering markören Fredsgenomförande avgör den clonogenic kapacitet av enskilda GBM celler genom att jämföra GSC frekvenser. ELDA analysen utvecklades av Yifang Hu och Gordon K. Smyth. Läsare uppmuntras att läsa manuskriptet för en fördjupad förståelse av assay styrkor och begränsningar15. Kolonin bildandet scoring steg är mycket celltyp beroende och sannolikt kommer att kräva en justering utifrån den cellinje som används. Dessutom som en allmän regel, använder vi sfär diameter ≥100 µm som ett tecken på att neurosphere har sitt ursprung av en clonogenic GSC.
Dessutom drogen screening system som vi beskriver här möjliggör identifiering av nya vägar (speciellt acetylkolin och kalcium transport) som krävs för att upprätthålla GSCs i odifferentierade tillståndet (se tabell 1). Start drog koncentrationen kan variera beroende på raden bibliotek och cell utnyttjas. Också, den tid som krävs för celldifferentiering kan behöva justeras. Dessutom kräver tumörframkallande validering av drogen träffar en i vivo tumör initiation assay 18.
Potentiellt är en mindre begränsning av denna teknik att spontan differentiering oundvikligen uppstår i någon stamceller berikad kultur, och detta fenomen tenderar att öka med antalet passager i kultur och skiljer sig mellan enskilda subkloner. Faktiskt observerade vi spontana differentiering i vår subkloner generellt efter passagen 15. Därför begränsade vi vår differentiering analyser till kulturer vid passage-nummer som inte överstiger fem.
Därför kanske den mest kritiska punkten i denna metod är att hålla in vitro-passaging av dessa GSCs till ett minimum och när du arbetar i vitro, till upprätthålla kultur densitet under 1.5x105 celler/mL. Dessutom rekommenderas att varje drog ”hit” valideras mot ytterligare reporter subkloner från samma GSC linje samt, reporter subkloner isolerade från olika patientderiverade GSC neurospheres linjer. Detta kommer att öka förtroendet som en riktig ”hit” är till hands.
Mångsidigheten hos den metod som beskrivs i detta robust protokoll stärker det terapeutiska värdet av en drog-inducerad cancer stamcellers differentiering och bör bidra till att identifiera nya droger som potentiella nya terapeutiska strategier för GBM och andra tumörer. Slutligen, analysen kan optimeras för att användas med icke-neoplastiska neurala stamceller, andra typer av cancer, och med olika differentiering reportrar.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Författarna har något att avslöja.
Acknowledgments
Detta arbete har varit delvis stöd av NIH R01CA187780.
Materials
| Name | Company | Catalog Number | Comments |
| ESGRO Complete Accutase | EMD Millipore | SF006 | |
| Dimethyl Sulfoxide (DMSO) | Sigma Aldrich | D2650 | |
| HBSS (Hank's Balanced Salt Solution) | Sigma Aldrich | H6648 | |
| Human GFAP Differentiation Reporter (pGreenZeo, Virus) | SBI (System Biosciences) | SR10015VA-1 | |
| 50 ml sterile disposable reagent reservoirs | Corning | 4870 | |
| 6 well plate | Thermo Fisher Scientific | 130184 | |
| 96 well plate | Falcon | 353072 | |
| Biolite T25 cm² Flask Vented | Thermo Fisher Scientific | 130189 | |
| Biolite T75 cm² Flask Vented | Thermo Fisher Scientific | 130190 | |
| 15 ml Centrifuge tubes | Celltreat | 229411 | |
| 1.5ml Microcentrifuge tubes | Fisher Scientific | 05-408-129 | |
| Ovation Multi Channel Pipette, 12 Channel, 0.5 - 20uL | VistaLab Technologies | 1060-0020 | |
| Ovation Multi Channel Pipette, 12 Channel, 5-250uL | VistaLab Technologies | 1060-0250 | |
| Multi 12-channel pipette tips 25 μl | VistaLab Technologies | 4060-1002 | |
| Multi 12-channel pipette tips 250 μl | VistaLab Technologies | 4060-9025 | |
| Guava easyCyte 5HT Benchtop Flow Cytometer | EMD Millipore | 0500-4005 | |
| NIH Clinical Collections 1 and 2 small molecule libraries | Evotec | ||
| Name | Company | Catalog Number | Comments |
| For the preparation of neural stem cell media (500 mL) | Final concentration | ||
| BSA | GoldBio.com | A-421-250 | 0.20% |
| DMEM/F12 10X | Corning | 90-091-PB | 1X |
| Heparin sodium salt | Sigma Aldrich | H3149 | 0.0002% |
| HEPES 1M | Sigma Aldrich | H4036 | 5.4 mM |
| Insulin-Transferrin- Selenium (ITS -G) (100X) | Life Technologies | 41400-045 | 1X |
| NaHCO3 | Sigma Aldrich | S-5761 | 14.5 mM |
| Penicillin-Streptomycin (10,000 U/mL) 100X | Gibco | 15140-122 | 1X |
| Progesterone | Sigma Aldrich | P8783 | 16 nM |
| Putrescine | Sigma Aldrich | P5780 | 4.8 µM |
| Basic FGF (FGF2), Human | GoldBio | 1140-02-50 | 10 ng/ml |
| EGF, Human | GoldBio | 1150-04-100 | 20 ng/ml |
| Bottle-Top Filter, 150ml, 33mm, 0.22um, Pes, S, Ind | Corning | 431160 | Use to filter sterlize media |
References
- Maher, E. A., et al. Malignant glioma: genetics and biology of a grave matter. Genes Dev. 15 (11), 1311-1333 (2001).
- Bonavia, R., Inda, M. M., Cavenee, W. K., Furnari, F. B. Heterogeneity maintenance in glioblastoma: a social network. Cancer Res. 71 (12), 4055-4060 (2011).
- Bao, S., et al. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response. Nature. 444 (7120), 756-760 (2006).
- Sul, J., Fine, H. A. Malignant gliomas: new translational therapies. Mt Sinai J Med. 77 (6), 655-666 (2010).
- Bar, E. E., Chaudhry, A., Farah, M. H., Eberhart, C. G. Hedgehog signaling promotes medulloblastoma survival via Bc/II. Am J Pathol. 170 (1), 347-355 (2007).
- Chu, Q., Orr, B. A., Semenkow, S., Bar, E. E., Eberhart, C. G. Prolonged inhibition of glioblastoma xenograft initiation and clonogenic growth following in vivo Notch blockade. Clin Cancer Res. 19 (12), 3224-3233 (2013).
- Schreck, K. C., et al. The Notch target Hes1 directly modulates Gli1 expression and Hedgehog signaling: a potential mechanism of therapeutic resistance. Clin Cancer Res. 16 (24), 6060-6070 (2010).
- Warrell, R. P. Jr, et al. Differentiation therapy of acute promyelocytic leukemia with tretinoin (all-trans-retinoic acid). N Engl J Med. 324 (20), 1385-1393 (1991).
- Piccirillo, S. G., et al. Bone morphogenetic proteins inhibit the tumorigenic potential of human brain tumour-initiating cells. Nature. 444 (7120), 761-765 (2006).
- Bar, E. E., et al. Cyclopamine-mediated hedgehog pathway inhibition depletes stem-like cancer cells in glioblastoma. Stem Cells. 25 (10), 2524-2533 (2007).
- Bar, E. E., Lin, A., Mahairaki, V., Matsui, W., Eberhart, C. G. Hypoxia increases the expression of stem-cell markers and promotes clonogenicity in glioblastoma neurospheres. Am J Pathol. 177 (3), 1491-1502 (2010).
- Kahlert, U. D., et al. CD133/CD15 defines distinct cell subpopulations with differential in vitro clonogenic activity and stem cell-related gene expression profile in in vitro propagated glioblastoma multiforme-derived cell line with a PNET-like component. Folia Neuropathol. 50 (4), 357-368 (2012).
- Lim, K. S., et al. Inhibition of monocarboxylate transporter-4 depletes stem-like glioblastoma cells and inhibits HIF transcriptional response in a lactate-independent manner. Oncogene. 33 (35), 4433-4441 (2014).
- Kahlert, U. D., et al. ZEB1 Promotes Invasion in Human Fetal Neural Stem Cells and Hypoxic Glioma Neurospheres. Brain Pathol. 25 (6), 724-732 (2014).
- Hu, Y., Smyth, G. K. ELDA: extreme limiting dilution analysis for comparing depleted and enriched populations in stem cell and other assays. J Immunol Methods. 347 (1-2), 70-78 (2009).
- Meyer, M., et al. Single cell-derived clonal analysis of human glioblastoma links functional and genomic heterogeneity. Proc Natl Acad Sci U S A. 112 (3), 851-856 (2015).
- Galli, R., et al. Isolation and characterization of tumorigenic, stem-like neural precursors from human glioblastoma. Cancer Res. 64 (19), 7011-7021 (2004).
- Spina, R., Voss, D. M., Asnaghi, L., Sloan, A., Bar, E. E. Atracurium Besylate and other neuromuscular blocking agents promote astroglial differentiation and deplete glioblastoma stem cells. Oncotarget. 7 (1), 459-472 (2016).



