Summary
Vi viser tre forskellige væv forberedelse teknikker til immunhistokemiske visualisering af rotte retinal mikrovaskulære pericytes, dvs., cryo-sektioner, hele-mounts og hypotonic isolation af det vaskulære netværk.
Abstract
Retinal pericytes spille en vigtig rolle i mange sygdomme i øjet. Immunhistokemisk farvning teknikker af retinale fartøjer og mikrovaskulære er pericytes centrale for oftalmologisk forskning. Det er vigtigt at vælge en passende metode til at visualisere den mikrovaskulære pericytes. Vi beskriver retinal mikrovaskulære pericyte immunhistokemisk farvning i cryo-sektioner, hele-mounts og hypotonic isoleret Vaskulaturen ved hjælp af antistoffer for Trombocyt-afledt vækst faktor receptor β (PDGFRβ) og nerve/glial antigen 2 (NG2). Dette gør det muligt for os at fremhæve fordele og ulemper ved hver af de tre væv forberedelser for visualisering af den retinale mikrovaskulære pericytes. Cryo-sektioner giver transsectional visualisering af alle retinal lag men indeholder kun et par lejlighedsvis tværgående nedskæringer af microvasculature. Hele-mount giver et overblik over hele retinal Vaskulaturen, men visualisering af microvasculature kan være generende. Hypotonic isolation er en metode til at visualisere hele retinal Vaskulaturen ved fjernelse af neuronale celler, men dette gør vævet meget skrøbelige.
Introduction
Retinal pericytes er i fokus i mange forskningslaboratorier, som disse celler spiller en stor rolle i integriteten af Vaskulaturen. Patologiske tilstande såsom diabetisk retinopati1, iskæmi2og grøn stær3 har vaskulære karakteristika, der vedrører funktionen af pericytes. Pericytes findes i de indre nethinde kapillær plexus. Den centrale retinal arterie, der leverer den indre nethinde filialer i to lag af kapillar plexus. Den indre vaskulære seng ligger mellem ganglion celler og indre nukleare lag. De dybere lag er mere tætte og komplekse og er lokaliseret mellem indre og ydre nukleare lag4,5. Nogle dele af nethinden indeholder derudover også et tredje net betegnes radial parapapillary kapillærer. Disse er lange, lige kapillærerne, der ligger blandt nervefibre og sjældent anastomose med hinanden eller de andre to plexus6. Inden for kapillar væggen, pericytes er indlejret i basalmembranen og line abluminal siden af vascular endothelial celler.
Denne dato er der ingen entydige biologisk markør af disse pericytes, der kan skelne dem fra andre vaskulære celler. Trombocyt-afledt vækst faktor receptor β (PDGFRβ) og nerve/glial antigen 2 (NG2) er almindeligt anvendte markører, som begge findes på pericytes men også andre vaskulære celler. Identifikation af pericytes kompliceres yderligere af eksistensen af pericyte delmængder, der varierer i morfologi og protein udtryk7. I øjeblikket bygger den bedste identifikation på en kombination af protein markører og den karakteristiske placering af pericyte i det vaskulære væg. Vi viser her tre forskellige væv forberedelse teknikker til immunhistokemiske PDGFRβ/NG2 farvning af rotte retinal mikrovaskulære pericytes, dvs., cryo-sektioner, hele-mounts og hypotonic isolation af det vaskulære netværk.
Med cryo-sektioner, er nethinden og sclera skåret gennem synsnerven. Dette giver mulighed for visualisering af alle lagdelt strukturer af neuroner. De forskellige ti lag af nethinden er tilsyneladende som udveksling af nukleare og cytoskeletale/dendritiske strukturer, som kan visualiseres med pletter såsom hæmatoxylin/eosin eller fluorescerende nukleare 4', 6-diamidino-2-phenylindole (DAPI)8. De metaboliske krav varierer mellem lag9 , og det giver en metode til at bestemme tykkelsen eller total mangel af en bestemt lag (f.eks.tab af retinal ganglion celler er et af kendetegnene ved retinal iskæmi10, 11). Vaskulaturen fremgår som tværgående skærer igennem nethinden, hvilket gør det muligt at separat studere de kapillære plexus inden for de respektive retinal lag12,13.
Mere traditionelt udføres undersøgelser af retinale Vaskulaturen netværk i retinal hele-mounts. Med dette væv forberedelse, er nethinden skåret og flad som en blomst-formet struktur. Metoden er en forholdsvis hurtig væv forberedelse teknik, der kan fremhæve den overordnede arkitektur retinale kar og det er derfor ofte anvendes i forbindelse med undersøgelsen af neovascularization i murine nethinden. Vellykket visualisering af microvasculature i hele monterede nethinder er også rapporteret i udviklingslandene neonatal mus og rotter nethinden14,15,16,17,18, 19. disse undersøgelser viser en mere defineret pericytic aktivitet med større kapillær-fri områder i den voksne i forhold til neonatal nethinden14.
En anden måde at visualisere er den retinale microvasculature efter hypotonic isolation. Dette væv forberedelse teknik resulterer i retinale blodkar og kapillærer bliver befriet af neuronale celler. Denne type af to-dimensionelle billeddannelse af den isolerede retinale vaskulære netværk er normalt udføres efter retinal trypsin fordøjelsen20 og bruges til at vurdere de vaskulære abnormaliteter af diabetisk retinopati herunder pericyte tab og kapillær degeneration20,21,22. Metoden hypotonic isolation tilbyder undersøgelser af retinal vaskulær gen og protein lovgivningsmæssige svar, som de har gjort med RT-PCR og western blotting23,24,25. Vi giver her en protokol for free-float immunhistokemisk farvning af hypotonic isoleret retinal Vaskulaturen som et alternativ til trypsin fordøjelsen at undersøge den mikrovaskulære pericytes.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Protokollen blev optimeret og demonstreret på adult mandlig albino rotter. I alle eksperimentelle procedurer, var dyr behandles i henhold til bestemmelser i sætningen ARVO for brug af dyr i Ophthalmic og Vision forskning. Dyrene blev aflivet af kuldioxid og efterfølgende cervikal dislokation.
1. rotte retinale væv præparater
-
Cryo-afsnit
- Gøre posterior og anterior ~0.5 cm slidser af i den rotte øjenlåg med en skalpel.
- Valgfri: Bruger en Diatermi brænderen, markere øje på den indre vinkel at orientere øje på en ensartet måde under indlejring og lodret kryostaten skæring gennem synsnerven.
- Grab øjet med pincet og vippe omhyggeligt til side til at udsætte det omgivende væv. Enucleate øjet ved at foretage nedskæringer med dissektion saks i bindevæv og muskuløs væv.
Forsigtig: Ikke trække øjet for hårdt som uforholdsmæssigt stort pres på den optiske nerve kan forårsage nethindeløsning. - Sætte øjet kort i 4% formaldehyd i fosfatbufferet saltopløsning (PBS) at stabilisere før de foretager en første hul på den hornhinde limbus ved at anvende let tryk med spidsen af en skalpel.
- Under et mikroskop, skær langs den hornhinde limbus med dissektion saks til at fjerne hornhinden og fjern linsen med pincet før nedsænkning i 4% formaldehyd i PBS for 2-4 h.
- Skyl sekventielt i Sörensens fosfat buffer med 10% saccharose og 25% saccharose.
- Integrere i Yazulla medium tilberedt med 3% gelatine fra svin hud og 30% albumin fra kylling æggehvide.
Bemærk: Protokollen kan blive standset her med væv opbevaring ved-20 ° C.
- Gøre posterior og anterior ~0.5 cm slidser af i den rotte øjenlåg med en skalpel.
-
Hele-mount
- Gøre posterior og anterior ~0.5 cm slidser i rotte øjenlåg med en skalpel.
- Grab øjet med pincet og vippe omhyggeligt til side til at udsætte det omgivende væv. Enucleate øjet ved at foretage nedskæringer med dissektion saks i bindevæv og muskuløs væv.
Forsigtig: Ikke trække øjet for hårdt som uforholdsmæssigt stort pres på den optiske nerve kan forårsage nethindeløsning. - Sætte øjet kort i 4% formaldehyd i PBS til at stabilisere før de foretager en første hul på den hornhinde limbus ved at anvende let tryk med spidsen af en skalpel.
- Under et mikroskop, skær langs den hornhinde limbus med dissektion saks til at fjerne hornhinden og fjern linsen med pincet.
- Adskille nethinden fra den retinale pigment epitel mod synsnerven med pincet med lille åbning bevægelser til at undgå store rive.
- Gratis nethinden på synsnerven med dissektion saks og gøre fire spalter af et par millimeter længde fra retinal periferien mod synsnerven hoved.
- Sprede nethinden på et glas dias og tillade tørring i 5-10 min.
- Rette i 4% formaldehyd i 20-30 min. ved dryp formaldehyd på nethinden.
Forsigtig: Må ikke anvendes direkte på nethinden, som det kan løsne sig fra glasset. - Skyl med PBS. For optimale resultater, immuno-pletten direkte efter skylning.
-
Hypotonic isolering
- Gøre posterior og anterior ~0.5 cm slidser i rotte øjenlåg med en skalpel.
- Grab øjet med pincet og vippe omhyggeligt til side til at udsætte det omgivende væv. Enucleate øjet ved at foretage nedskæringer med dissektion saks i bindevæv og muskuløs væv.
Forsigtig: Ikke trække øjet for hårdt som uforholdsmæssigt stort pres på den optiske nerve kan forårsage nethindeløsning. - Gøre en indledende hul på den hornhinde limbus ved at anvende let tryk med spidsen af en skalpel.
- Under et mikroskop, skær langs den hornhinde limbus med dissektion saks til at fjerne hornhinden og fjern linsen med pincet.
- Adskille nethinden fra den retinale pigment epitel mod synsnerven hoved med pincet med lille åbning bevægelser til at undgå store rive.
- Gratis nethinden på synsnerven med dissektion saks, placere nethinden i 1 mL deioniseret vand i en 24-godt plade og ryste på 200 rpm med en 1,5 mm vibrationer kredsløb i 1 time ved stuetemperatur.
Bemærk: Herefter nethinden vises mindre defineret i kanterne. - Tilføje 200 U DNAse 1 for at adskille mængden celle debris fra retinal Vaskulaturen og omrystes i en anden 30 min ved stuetemperatur.
Bemærk: Snavs kan begynde at form i brøndene. - Skyl minimum 3 gange i ionbyttet vand i 5 min. med rysten på 150-300 rpm fjerne neuronal celle debris. Nethinden burde blive mere gennemsigtig med hvert skyl vejledende af fjernelse af neuronal celleaffald.
- Brug en mørk baggrund til at undersøge den 24-godt plade at se klart diaphanous isolerede retinal Vaskulaturen.
- (Valgfri): Hvis Vaskulaturen ikke synes fri af neuronal lag (semi-gennemsigtige) på dette tidspunkt enten tilføje flere trin, skyl, øge den ryster hastighed eller bruge en pipette til Aspirér væske på Vaskulaturen.
Forsigtig: Enten af de valgfrie trin kan beskadige Vaskulaturen.
- Fix 10 min i 1 mL af 4% PARAFORMALDEHYD i PBS ved stuetemperatur og skyl 3 gange i PBS.
Bemærk: Protokollen kan blive standset her med væv opbevaring ved 4 ° C.
2. Immunohistokemi
-
Farvning af cryo-sektioner
- Skær 10 µm cryo-sektioner af gelatine-embedded nethinden som lodret skæring gennem synsnerven og placerer cryo-sektioner på glas dias og lad tørre (minimum 1 h).
- Dykke glas dias i PBS med 0,25% Triton X-100 (PBS-T) i 15 min.
- Dryppe 1: 100 PDGFRβ og 1: 500 NG2 primære antistoffer fortyndes i PBS-T + 1% BSA på afsnittet cryo og Inkuber i inkubation kamre ved 4 ° C natten over.
- Dykke glas dias 2 gange i PBS-T i 15 min og drop 1: 100 anti-Alexa Fluor 594-linked og 1: 100 anti-kanin FITC-linked sekundære museantistoffer fortyndes i PBS-T med 3% BSA på cryo-sektioner.
- Inkuber glas dias 1 time ved stuetemperatur i mørke.
- Skyl glas dias i PBS-T 2 x 15 min.
Bemærk: Valgfri: For dobbelt og tredobbelt immunfluorescent farvning, sekventiel farvning kan udføres ved at gentage proceduren fra 2.1.3 2.1.6 to og tre gange, henholdsvis. - Montere de farvede cryo-sektioner med anti-fading montering medium indeholdende DAPI og en coverslip.
-
Farvning af hele-mount
- Dryppe PBS-T på hele-mount og inkuberes ved stuetemperatur i 15 min.
- Hæld og dryppe 1: 100 PDGFRβ og 1: 500 NG2 primære antistoffer fortyndes i PBS-T + 1% BSA og Inkuber i fugtige kamre ved 4 ° C natten over.
- Hæld og drypper på PBS-T til at skylle glas dias i 2 x 15 min.
- Hæld og drypper på 1: 100 anti-kanin Cy2- og 1: 100 anti-mus Cy3-linked sekundær antistof fortyndes i PBS-T med 3% BSA at udruge 1 h i et fugtigt kammer ved rumtemperatur i mørke.
- Hæld og drypper på PBS-T at skylle i 2 x 15 min i mørke.
Bemærk: Valgfri: For dobbelt og tredobbelt immunfluorescent farvning, sekventiel farvning kan udføres ved at gentage proceduren fra 2.2.2 til 2.2.5 to og tre gange, henholdsvis. - Montere de farvede hele-mount med anti-fading montering medium indeholdende DAPI og en coverslip.
-
Farvning af hypotonic isoleret Vaskulaturen
- Blokere hypotonic isoleret Vaskulaturen 1 h med rysten på 100 rpm og stuetemperatur med 500 µL/brønd af 10% æsel serum fortyndet i PBS.
- Der inkuberes natten over ved stuetemperatur og ryste på 100 rpm med 600 µL/brønd af 1: 100 PDGFRβ og 1: 500 NG2 primære antistoffer fortyndet i 10% æsel serum i PBS.
- Skyl retinal netværk 3 x i PBS i 5 min og Inkuber i 1: 100 anti-Alexa Fluor 594-linked og 1: 100 anti-kanin FITC-linked sekundære museantistoffer fortyndet i 10% æsel serum i PBS ryster på 100 rpm og stuetemperatur i 1 time i mørke.
- Skyl i PBS-T i 5 min, og der inkuberes i 0,2 ng/mL DAPI i PBS-T i 15 min. efterfulgt af 3 x 5 min. skylninger i PBS-T i mørke.
- Skær spidsen af en plast Pasteur pipette, fugte det med PBS-T og bruge det til at overføre den retinale netværk til en 4-godt glas kammer dias.
Bemærk: Den befugtning trin er vigtigt at undgå retinal Vaskulaturen stikning til indersiden af Pasteur pipette. - Udfolde den retinale Vaskulaturen. Undgå at berøre den retinale kar med pincet, da dette kan forårsage Vaskulaturen til virvaret.
Bemærk: Udfolder sig kan gøres ved at vippe kammer dias frem og tilbage eller sugning dråber af flydende på retinal Vaskulaturen. - Fjern mediet fra brøndene. Overfladespænding af væsken vil samkopiere Vaskulaturen på bunden af diaset.
- Sikre korrekt udspiller sig under et mikroskop før at fjerne plastik brønde fra salen dias.
- Montere de farvede Vaskulaturen med anti-fading montering medium og en coverslip.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
De succesfulde protokoller giver tre forskellige retinal præparater til at visualisere mikrovaskulære pericytes. Hver af disse metoder benytter PDGFRβ og NG2 immunoreactivity Co lokaliseringen og den enestående placering i den pericytes, der ombrydes omkring den kapillære endothelium foridentification.
Med cryo-sektioner, neuronal lag kan identificeres af de fluorescerende tæthed af DAPI-mærket kerner og inderste og dybt kapillær plexus indeholder pericytes, der viser PDGFRβ og NG2 immunoreactivity (figur 1). Pericytes unikke position i det vaskulære væg kan ses som cirkulære eller hestesko-formede immunoreactivity i periferien af fartøjer (figur 1, pile) eller lejlighedsvis på langs skæres fartøjer (figur 1, pilespids).
Vellykket visualisering af de mikrovaskulære pericytes i hele-mount forberedelse af voksen rotte kan være udfordrende14,20. PDGFRβ immunoreactivity i hele monterede voksen nethinden resulterede kun i et meget svagt signal (ikke vist). NG2 farvning skitseret den indre vaskulære netværk med intens farvning i abluminal pericytes (figur 2).
For at få overblik over de vaskulære netværk af voksen rotte nethinden, giver Immunhistokemi af hypotonic isoleret rotte retinale vaskulære netværk en alternativ metode til hele-mount. Når korrekt udført, giver dette væv forberedelse teknik et overblik over den hele retinale microvasculature herunder indre og dybt kapillær plexus. Immunhistokemisk farvning med pericytic markører resulterer i den hele mikrovaskulære netværk viser NG2 immunoreactivity med en intens reaktion i bestemt vaskulære celler (figur 3). Nogle af disse celler også vise PDGFRβ immunoreactivity (figur 3).
En omhyggelig udfoldelsen af væv, der er vigtigt at få et godt overblik over den retinale Vaskulaturen. Utilstrækkelig udfoldning kan resultere i Vaskulaturen arrangeres i flere fokus lag, hvilket gør fluorescerende imaging vanskeligt (figur 4). Udfolder sig kan lettes ved blid ryster, vippe kammer dias frem og tilbage eller sugning dråber af flydende på retinal Vaskulaturen. Det skal bemærkes, at anatomi af retinale kapillær plexus vil resultere i nogle overlejring af vaskulære senge. Derfor er det problematisk at adskille indre fra de dybere kapillær plexus når fladtrykt diaset glas.
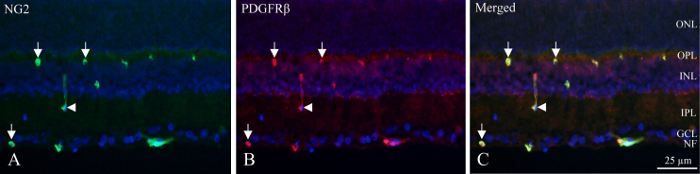
Figur 1: dobbelt immunhistokemiske pericyte farvning af cryo-sektion af indre rotte nethinden. (A) NG2 (grøn) Immunhistokemi afslører positive fartøjer inden for den indre del af nethinden. Pilene angiver cirkulære og hestesko-formede immunoreactivity på fartøjerne. Pilespidsen peger på en på langs skæres fartøj. (B) PDGFRβ (rød) Immunhistokemi Vis reaktivitet svarende til NG2 immunoreactivity. Pile og pilespidsen peger på de samme strukturer som for NG2 farvning. (C) billedet viser en fletning af NG2, PDGFRβ og DAPI (blå) ved at sammenføje de tre forskellige filtre. Det afsløres, at de to antistoffer er co lokaliseret (grøn + rød = gul). NF: nerve fiber lag, GCL: ganglion cellelag, IPL: inderste plexiform lag, INL: nukleare inderst, OPL: ydre plexiform lag, ger.: ydre nukleare lag. Venligst klik her for at se en større version af dette tal.

Figur 2: immunhistokemisk pericyte farvning af hele monterede rotte nethinden. NG2 (rød) immunoreactivity er synlige langs den overfladiske vaskulær networkwith intense farvning i abluminal pericytes. Billederne viser flettede NG2 og DAPI (blå). De neuronale celler er synlig som DAPI-blå kerner mellem den NG2-farvede microvasculature. PDGFRβ immunoreactivity i hele monterede voksen nethinden resulterede kun i et meget svagt signal og er derfor ikke medtaget i dette tal. Venligst klik her for at se en større version af dette tal.

Figur 3: dobbelt immunhistokemiske pericyte farvning af hypotonic isoleret rotte retinal Vaskulaturen. (A). billedet viser hypotonic isoleret rotte retinale vaskulære netværk immunhistokemiske farves med NG2 (grøn) og PDGFRβ (rød). Den komplette netværk viste NG2 immunoreactivity. Dog blev PDGFRβ immunoreactivity fundet i celle svovldepositioner. Indsæt a er en oversigt over retinal Vaskulaturen netværk farves med DAPI (blå). (B) billedet viser den samme model som (A) på en anden placering og højere forstørrelse. Det er klart, at PDGFRβ farvning vises kun i celle svovldepositioner i det vaskulære netværk med angivelse af pericyte immunoreactivity. Indsæt b er det billede, der viser høj forstørrelse af Vaskulaturen farves med NG2 (grøn), PDGFRβ (rød) og fusioneret med DAPI. Herunder DAPI farvning med NG2 og PDGFRβ afslører tre pericytes (PDGFRβ-positive) og to uidentificerede fartøj væg celler. Venligst klik her for at se en større version af dette tal.

Figur 4: eksempel på en utilstrækkelig udfoldet hypotonic isoleret retinal Vaskulaturen. Omhyggelig udfoldelsen af et hypotonic isoleret Vaskulaturen er vigtigt som utilstrækkelig udfoldning kan resultere i Vaskulaturen er stablet. Billederne viser DAPI-farvede retinal Vaskulaturen på det samme websted, men taget i forskellige fokus lag. (A) den DAPI-farvede celler i én fokus lag viser en ca. 25 µm tykt blodkar i retinal Vaskulaturen. (B) den DAPI-farvede celler i et andet fokus lag belyse tynde forgrenede kapillærer på det samme websted, der har været stablet på de større blodkar vises i (A). Venligst klik her for at se en større version af dette tal.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Vi præsenterer tre retinal forberedelse teknikker, der kan anvendes i studiet af mikrovaskulære retinale pericytes. Nedenfor, vi leverer en sammenligning mellem hver af metoderne og fremhæve kritiske trin i protokollerne.
Med cryo-skæring, nethinden er skåret i sagittal sektioner og derfor er det muligt at opnå mange prøver fra de samme nethinden. De talord sektioner som følge af denne metode gør det et ideelt valg for antistof specificitet og titrering test som det forhindrer unødvendige animalske offer. Det forberedende arbejde er afgørende for gode resultater. Det er afgørende, mens dissekere øjet ikke at trække øjet, men at skære alle musklerne omkring øjet. Der er en risiko for nethindeløsning, hvis kraft er brugt. Fordi øjet kop er tynde, bør man ikke fastsætte for lang. Fordybelse med 4% PARAFORMALDEHYD i PBS for 2-4 h vil ordne væv. Hvis fast længere, er der en risiko for at ødelægge antigen af interesse. For at skabe de bedst mulige immunostainings, er det afgørende for hver sektion skal være så fladt som muligt mod glasset. Fordi sektionerne indeholder kun et par lejlighedsvis tværgående nedskæringer af microvasculature, tilbyder dette væv præparater teknik kun intermitterende visualisering af microvasculature. Denne metode er derfor ikke velegnet til studier af den samlede vaskulære arkitektur og kvantificerede foranstaltninger af pericytes.
Den samlede Vaskulaturen kan farves efter hele-montering til at give et overblik over Vaskulaturen. Når mestrer denne teknik, kan det være en hurtig væv forberedelse procedure, der kræver relativt lille arbejdsbyrde. Der er imidlertid et par punkter at være særligt opmærksom på. Nethinden er skrøbelig, og det er altafgørende at håndtere dem med forsigtighed og undgå RIP'er og nedskæringer. Endvidere, mens omhyggeligt håndtering af nethinden, er det af afgørende betydning at undgå folder og andre sprækker under montering, kan påvirke immunhistokemiske imaging senere. Den monterede nethinden har en tykkelse på 250-300 µm og antistof penetration af neuronal lag kan være problematisk. Med hensyn til pericyte visualisering, NG2 farvning i hele-mount-protokollen kunne kun opnås med en Cy3 i forbindelse med sekundær antistof, og PDGFRβ immunoreactivity i hele monterede voksen nethinden resulterede i sådan et meget svagt signal om, at det ikke blev vist i figur. Dermed, nytten af det hele-mount farvning teknik er stærkt hæmmet af den succesfulde farvning afhængigt primært på de specifikke primære og sekundære antistoffer bruges. Yderligere forslag til at optimere protokol for visualiseret mikrovaskulære plexus af en voksen rotte nethinden er ved inkubation i primære antistof i en længere periode af tid og/eller ændre inkubation temperatur26.
På grund af tykkelsen af det hele-monteret er det vigtigt at være opmærksom på nethinden retning efter at de fire snit fra retinal periferien mod synsnerven hovedet for at undgå utilsigtet montering med indre nethinden som indeholder kapillærer vender ned. Stadig, detaljerede visualisering af de dybere mikrovaskulære plexus og pericytes kan være generende med denne metode14,20. Som helhed-mount farvning af voksen nethinden er vanskeligt i den dybere kapillære plexus, kan dette medføre nethinden optræder avascular i nogle dele. Den immunhistokemiske farvning af hele monterede voksen nethinden indeholder kun en fragmenteret oversigt over Vaskulaturen med pericytes foring fartøjer i den overfladiske kapillære plexus og derfor denne metode kan føre til falsk negative resultater i den visualisering af rotte retinal Vaskulaturen.
Trypsin fordøjelsen har længe været betragtet som guld standard teknikken til isolation og visualisering af retinale Vaskulaturen20. Hypotonic isolation giver en alternativ metode til visualisering af den hele komplekse tre-dimensionel vaskulære netværk og står over for mange af de samme udfordringer arbejder med meget skrøbelige væv, som er vanskelige at håndtere. På grund af ligheden i de retinale vaskulære produkt mellem de to metoder, den hypotonic isolation står over for mange af de samme udfordringer som trypsin fordøjelsen20 herunder omhyggelig dissektion at forhindre store tårer og forsigtig håndtering ved at undgå pipettering og rørende med pincet. En vigtig forskel mellem metoderne er fiksering. Trypsin fordøjelsen er typisk udført efter fiksering og kan anvendes med succes på bevarede nethinder, der har været i fiksativ for flere år20. Hypotonic isolering udføres før fiksering og dermed giver mulighed for gennemførelsen i forskellige andre assays som tidligere beskrevet i litteraturen23,24,25. Trypsin fordøjelsen er udført over to dage20, mens den hypotonic isolation kan være færdiggjort inden for timer. Derudover hypotonic isolation protokol omfatter ikke risikoen for overdreven fordøjelse og enzymatiske spaltning af membran markører kræves for pericyte anerkendelse, fx PDGFRβ og NG2, hvilket gør denne metode foretrækkes til efterfølgende immunhistokemiske mikrovaskulære farvning.
Endelig, selv om ikke umiddelbart omfattet af dette manuskript, der er en mindre kendt, men meget nyttig teknik til isolering af store, intakte mikrovaskulære plexi fra gnaver ud af nethinden27. Nethinden er placeret i en særlig glas kammer og coverslip. Ved fjernelse af coverslip, microvasculature forbliver knyttet til coverslip at oprette en fuldt i live (≈ 98% af celler) væv print. Den største fordel ved denne metode er, at det giver for fysiologiske studier af fartøjer og efterfølgende fiksering for immunfarvning. En indlysende begrænsning af metoden er at det giver ikke visualisering/isolering af den hele mikrovaskulære netværk som nethinden flad mount og hypotonic præparater gøre. Stadig, pericytes kan visualiseres ved anvendelse af denne metode27.
De tre væv forberedelse teknikker beskrevet her er komplementære i den forstand, at hver metode består af fordele og ulemper for visualisering af mikrovaskulære pericytes. Vurdering af hver metoder potentialer og svagheder er vigtigt at vælge den optimale metode for at undersøge den mikrovaskulære pericytes særlige patologiske betingelser. De påviste metoder kan udvides til farvning ikke kun for pericyte markører, men også for visualisering af mikrovaskulære strukturer generelt. Til sidst, er det for den enkelte forsker til at vælge den passende Visualisering metode baseret på den pågældende forskning hypotese.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne har ikke noget at oplyse.
Acknowledgments
Forskningen blev finansieret af The Lundbeckfonden, Danmark.
Materials
| Name | Company | Catalog Number | Comments |
| Geletin from porcine skin | Sigma-Aldrich | G2625-500G | |
| Albumin from chicken egg white | Sigma-Aldrich | A5253-500G | |
| Deoxyribonuclease (DNAse) I from bovine pancreas | Sigma-Aldrich | D5025-15KU | Dissolved in 0.15 M NaCl |
| Bovine serum albumin (BSA) | VWR | 0332-100G | |
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121, lot 129348 | |
| Rabbit anti-PDGFRβ | Santa Cruz | sc-432 | 1:100 |
| Mouse anti-NG2 | Abcam | ab50009 | 1:500 |
| Alexa Fluor 594 AffiniPure Donkey Anti-Rabbit IgG | Jackson ImmunoResearch | 711-585-152 | 1:100 |
| Fluorescein (FITC) AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-095-151 | 1:100 |
| Cy2 AffiniPure Donkey Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-225-152 | 1:100 |
| Cy3 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-165-150 | 1:100 |
| 4',6-diamidino-2-phenylindole (DAPI) | Sigma-Aldrich | D9542-1MG | Dissolved in DMSO |
| Anti-fading mounting medium | Vector Laboratories | H-1000 | |
| Anti-fading mounting medium with DAPI | Vector Laboratories | H-1200 | |
| Nunc Lab-Tek II 4-well chamber slide | Thermo Fisher Scientific | 154526 |
References
- Eshaq, R. S., Aldalati, A. M. Z., Alexander, J. S., Harris, N. R. Diabetic retinopathy: Breaking the barrier. Pathophysiology. , (2017).
- Cai, W., et al. Pericytes in Brain Injury and Repair After Ischemic Stroke. Translational Stroke Research. , (2016).
- Trost, A., et al. Brain and Retinal Pericytes: Origin, Function and Role. Frontiers in Cellular Neuroscience. 10, 20 (2016).
- Ramos, D., et al. The Use of Confocal Laser Microscopy to Analyze Mouse Retinal Blood Vessels. Confocal Laser Microscopy - Principles and Applications in Medicine, Biology, and the Food Sciences. Lagali, N. , InTech. (2013).
- Moran, E. P., et al. Neurovascular cross talk in diabetic retinopathy: Pathophysiological roles and therapeutic implications. American Journal of Physiology. Heart and Circulatory Physiolog. 311, H738-H749 (2016).
- Henkind, P. Microcirculation of the peripapillary retina. Transactions - American Academy of Ophthalmology and Otolaryngology. 73, 890-897 (1969).
- Attwell, D., Mishra, A., Hall, C. N., O'Farrell, F. M., Dalkara, T. What is a pericyte? Journal of Cerebral Blood Flow & Metabolism. 36, 451-455 (2016).
- Fernandez-Bueno, I., et al. Histologic Characterization of Retina Neuroglia Modifications in Diabetic Zucker Diabetic Fatty Rats. Investigative Ophthalmology & Visual Science. 58, 4925-4933 (2017).
- Yu, D. -Y., Yu, P. K., Cringle, S. J., Kang, M. H., Su, E. -N. Functional and morphological characteristics of the retinal and choroidal vasculature. Progress in Retinal and Eye Research. 40, 53-93 (2014).
- Allen, R. S., et al. Severity of middle cerebral artery occlusion determines retinal deficits in rats. Experimental Neurology. 254, 206-215 (2014).
- Kyhn, M. V., et al. Acute retinal ischemia caused by controlled low ocular perfusion pressure in a porcine model. Electrophysiological and histological characterisation. Experimental Eye Research. 88, 1100-1106 (2009).
- Blixt, F. W., Radziwon-Balicka, A., Edvinsson, L., Warfvinge, K. Distribution of CGRP and its receptor components CLR and RAMP1 in the rat retina. Experimental Eye Research. 161, 124-131 (2017).
- Sarlos, S., Wilkinson-Berka, J. L. The renin-angiotensin system and the developing retinal vasculature. Investigative Ophthalmology & Visual Science. 46, 1069-1077 (2005).
- Wittig, D., Jaszai, J., Corbeil, D., Funk, R. H. W. Immunohistochemical localization and characterization of putative mesenchymal stem cell markers in the retinal capillary network of rodents. Cells Tissues Organs. 197, 344-359 (2013).
- Tual-Chalot, S., Allinson, K. R., Fruttiger, M., Arthur, H. M. Whole mount immunofluorescent staining of the neonatal mouse retina to investigate angiogenesis in vivo. Journal of Visualized Experiments. , e50546 (2013).
- Park, D. Y., et al. Plastic roles of pericytes in the blood-retinal barrier. Nature Communications. 8, 15296 (2017).
- Hughes, S., Chan-Ling, T. Characterization of smooth muscle cell and pericyte differentiation in the rat retina in vivo. Investigative Ophthalmology & Visual Science. 45, 2795-2806 (2004).
- Lange, C., et al. Intravitreal injection of the heparin analog 5-amino-2-naphthalenesulfonate reduces retinal neovascularization in mice. Experimental Eye Research. 85, 323-327 (2007).
- Higgins, R. D., et al. Diltiazem reduces retinal neovascularization in a mouse model of oxygen induced retinopathy. Current Eye Research. 18, 20-27 (1999).
- Chou, J. C., Rollins, S. D., Fawzi, A. A. Trypsin digest protocol to analyze the retinal vasculature of a mouse model. Journal of Visualized Experiments. , e50489 (2013).
- Hazra, S., et al. Liver X receptor modulates diabetic retinopathy outcome in a mouse model of streptozotocin-induced diabetes. Diabetes. 61, 3270-3279 (2012).
- Zhang, L., Xia, H., Han, Q., Chen, B. Effects of antioxidant gene therapy on the development of diabetic retinopathy and the metabolic memory phenomenon. Graefe's Archive for Clinical and Experimental Ophthalmology. 253, 249-259 (2015).
- Dagher, Z., et al. Studies of rat and human retinas predict a role for the polyol pathway in human diabetic retinopathy. Diabetes. 53, 2404-2411 (2004).
- Navaratna, D., McGuire, P. G., Menicucci, G., Das, A. Proteolytic degradation of VE-cadherin alters the blood-retinal barrier in diabetes. Diabetes. 56, 2380-2387 (2007).
- Gustavsson, C., et al. Vascular cellular adhesion molecule-1 (VCAM-1) expression in mice retinal vessels is affected by both hyperglycemia and hyperlipidemia. PLoS One. 5, e12699 (2010).
- Kornfield, T. E., Newman, E. A. Regulation of blood flow in the retinal trilaminar vascular network. Journal of Neuroscience. 34, 11504-11513 (2014).
- Puro, D. G. Retinovascular physiology and pathophysiology: new experimental approach/new insights. Progress in Retinal and Eye Research. 31, 258-270 (2012).



