Summary
Nous montrons trois techniques de préparation de tissus différents pour la visualisation d’immunohistochemical des péricytes microvasculaire rétine de rat, c'est-à-dire, cryo-sections, ensemble-montages et hypotonique isolement du réseau vasculaire.
Abstract
Les péricytes rétiniennes jouent un rôle important dans de nombreuses maladies de le œil. IMMUNOHISTOCHEMICAL souillant techniques des vaisseaux rétiniens et microvasculaire péricytes sont au cœur de la recherche ophtalmologique. Il est essentiel de choisir la méthode appropriée de visualiser les péricytes microvasculaires. Nous décrivons rétinienne pericyte microvasculaire immunohistochemical souillant en cryo-sections, ensemble-montages et hypotonique vascularisation isolée en utilisant des anticorps pour β de récepteur de facteur de croissance dérivé des plaquettes (PDGFRβ) et nerf/glial antigène 2 (NG2). Cela nous permet de mettre en évidence les avantages et les inconvénients de chacune de la préparation de trois tissus de la visualisation de la rétine péricytes microvasculaire. Cryo-sections fournissent transsectional visualisation de toutes les couches rétiniennes mais contiennent seulement quelques coupes transversales occasionnels de la microcirculation. Entier-Montez donne un aperçu de la vascularisation rétinienne ensemble, mais visualisation de la microcirculation peut être gênante. Hypotonique isolement fournit une méthode pour visualiser la vascularisation rétinienne toute en enlevant les cellules neuronales, mais ce qui rend le tissu très fragile.
Introduction
Les péricytes rétiniennes font l’objet de nombreux laboratoires de recherche que ces cellules jouent un rôle majeur dans l’intégrité du système vasculaire. Certaines pathologies telles que la rétinopathie diabétique1, ischémie2et glaucome3 ont des caractéristiques vasculaires qui impliquent la fonction des péricytes. Péricytes sont trouvent dans les plexus capillaires rétiniens intérieures. L’artère rétinienne centrale qui alimente la rétine interne se ramifie en deux couches de plexus capillaires. Le lit vasculaire interne est situé entre les cellules de ganglion et les couches nucléaires internes. La couche plus profonde est plus dense et complexe et est localisée entre les couches nucléaires intérieure et extérieure4,5. En outre, certaines parties de la rétine contiennent également un troisième réseau appelé capillaires parapapillary radial. Celles-ci sont longues, droites capillaires qui se trouvent parmi les fibres nerveuses et rarement s’anastomosent avec les uns ou les autres deux plexus6. Intérieur de la paroi capillaire, péricytes sont incorporées dans la membrane basale et le côté abluminal des cellules endothéliales vasculaires.
À ce jour, il n’y a aucun marqueur biologique unique de ces péricytes qui peut les différencier des autres cellules vasculaires. Β de récepteur de facteur de croissance dérivé des plaquettes (PDGFRβ) et nerf/glial antigène 2 (NG2) sont des marqueurs couramment utilisés qui sont tous deux présent sur les péricytes mais aussi d’autres cellules vasculaires. Identification des péricytes est encore compliquée par l’existence de sous-ensembles pericyte qui varient dans la morphologie et la protéine expression7. Actuellement, la meilleure identification s’appuie sur une combinaison de marqueurs protéiques et le positionnement caractéristique de la pericyte dans la paroi vasculaire. Nous démontrons ici trois techniques de préparation de tissus différents pour le marquage de PDGFRβ/NG2 immunohistochimique des péricytes microvasculaire rétine de rat, c'est-à-dire, cryo-sections, ensemble-montages et hypotonique isolement du réseau vasculaire.
Cryo-sections, la rétine et la sclérotique sont coupés par l’intermédiaire du nerf optique. Cela permet la visualisation de toutes les structures en couches de neurones. Les dix couches distinctes de la rétine sont apparentes en interchangeant les structures nucléaires et axonale/dendritiques qui peuvent être visualisées avec des taches comme l’hématoxyline/éosine ou fluorescence nucléaire 4', 6-diamidino-2-phénylindole (DAPI)8. Les besoins métaboliques diffèrent entre les couches9 et il fournit une méthode pour déterminer l’absence de total ou de l’épaisseur d’une couche spécifique (par exemple, la perte de cellules ganglionnaires rétiniennes est l’une des caractéristiques de l’ischémie rétinienne10, 11). La vascularisation est évidente puisque transverse traverse la rétine, ce qui permet d’étudier séparément les plexus capillaires dans les couches rétiniennes respectifs12,13.
Plus traditionnellement, les enquêtes du réseau vasculaire rétinienne sont effectuées dans son ensemble-montures rétiniennes. Avec cette préparation du tissu, la rétine est coupée et aplatie comme une structure en forme de fleur. La méthode est une technique de préparation de tissus relativement rapide qui peut mettre en évidence la vascularisation rétinienne d’architecture globale et il est donc souvent appliqué lors de l’enquête de la néovascularisation dans la rétine murine. Visualisation réussie de la microcirculation dans les rétines montés ensemble est également signalée dans le développement néonatale souris et rat rétine14,15,16,17,18, 19. ces études révèlent une activité pericytic plus définie avec les plus grandes zones exemptes de capillaire chez l’adulte par rapport à la rétine néonatale14.
Une autre façon de visualiser est la microcirculation rétinienne après isolement hypotonique. Cette technique de préparation de tissus se traduit par des vaisseaux sanguins rétiniens et capillaires libérées des cellules neuronales. Ce type d’imagerie bidimensionnelle du réseau vasculaire rétiniens isolé est généralement effectué après digestion de trypsine rétinienne20 et utilisé pour évaluer les anomalies vasculaires de la rétinopathie diabétique, y compris perte de pericyte et des capillaires dégénérescence20,21,22. La méthode d’isolement hypotonique propose des enquêtes du gène vasculaire rétinienne et réponses réglementaires de protéine comme il a été fait avec la RT-PCR et western blot23,24,25. Ici, nous fournissons un protocole pour la coloration immunohistochimique flottant de la vascularisation rétinienne isolée hypotonique comme alternative à la digestion trypsique d’examiner les péricytes microvasculaires.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Le protocole a été optimisé et démontré chez le rat albinos mâles adultes. Dans toutes les procédures expérimentales, des animaux ont été traités conformément à la réglementation dans l’instruction d’ARVO sur l’utilisation des animaux dans ophtalmique et Vision Research. Animaux ont été euthanasiés par le dioxyde de carbone et de dislocation cervicale ultérieure.
1. préparations de tissu rétinien de rat
-
Cryo-section
- Faire des fentes cm de ~0.5 postérieure et antérieure dans la paupière de rat avec un scalpel.
- Facultatif : Un brûleur de diathermie, tracez le œil à l’angle interne à orienter le œil d’une manière uniforme au cours de l’incorporation et permettant un cryostat vertical découpe par l’intermédiaire du nerf optique.
- Prenez l’oeil avec une pince et pencher attentivement sur le côté pour exposer les tissus environnants. Enucleate le œil en faisant des coupes avec des ciseaux de dissection dans les tissus conjonctifs et musculaires.
ATTENTION : Ne pas tirer le œil trop dur car une pression excessive sur le nerf optique peut provoquer le décollement de la rétine. - Mettre le œil brièvement en formaldéhyde à 4 % dans une solution saline tamponnée au phosphate (PBS), afin de se stabiliser avant de faire un trou initial à la limbe cornéen en appuyant légèrement avec la pointe d’un scalpel.
- Sous un microscope, couper le long du limbe cornéen avec des ciseaux de dissection pour enlever la cornée et retirez la lentille avec une pince avant submergeant dans 4 % de formaldéhyde dans du PBS pendant 2 à 4 h.
- Rincer successivement dans un tampon phosphate de Sörensen avec 10 % de sucrose et 25 % de sucrose.
- Intégrer dans le milieu de Yazulla préparé avec 3 % de gélatine de porc peau et 30 % de l’albumine du blanc d’oeuf de poulet.
Remarque : Le protocole peut être suspendu ici avec stockage de tissus à-20 ° C.
- Faire des fentes cm de ~0.5 postérieure et antérieure dans la paupière de rat avec un scalpel.
-
Entier-Montez
- Faites des fentes cm ~0.5 postérieure et antérieure à la paupière de rat avec un scalpel.
- Prenez l’oeil avec une pince et pencher attentivement sur le côté pour exposer les tissus environnants. Enucleate le œil en faisant des coupes avec des ciseaux de dissection dans les tissus conjonctifs et musculaires.
ATTENTION : Ne pas tirer le œil trop dur car une pression excessive sur le nerf optique peut provoquer le décollement de la rétine. - Mettre le œil brièvement dans 4 % de formaldéhyde dans du PBS pour stabiliser avant d’effectuer un trou initial à la limbe cornéen en appuyant légèrement avec la pointe d’un scalpel.
- Sous un microscope, couper le long du limbe cornéen avec des ciseaux de dissection pour enlever la cornée et retirez la lentille avec une pince.
- Séparer la rétine de l’épithélium pigmentaire rétinien vers le nerf optique avec une pince à l’aide de mouvements de petite ouverture pour éviter le déchirement majeur.
- Libre de la rétine au nerf optique avec des ciseaux de dissection et faire quatre fentes de quelques millimètres longueur de la périphérie rétinienne vers la tête du nerf optique.
- Répandre la rétine sur une lame de verre et laissez sécher pendant 5 à 10 min.
- Difficulté à 4 % de formaldéhyde pendant 20 à 30 min par dégoulinant de formaldéhyde dans la rétine.
ATTENTION : Ne pas appliquer directement sur la rétine comme il peut se détacher de la vitre. - Rincer avec du PBS. Pour des résultats optimaux, immuno-coloration directement après le rinçage.
-
Isolement hypotonique
- Faites des fentes cm ~0.5 postérieure et antérieure à la paupière de rat avec un scalpel.
- Prenez l’oeil avec une pince et pencher attentivement sur le côté pour exposer les tissus environnants. Enucleate le œil en faisant des coupes avec des ciseaux de dissection dans les tissus conjonctifs et musculaires.
ATTENTION : Ne pas tirer le œil trop dur car une pression excessive sur le nerf optique peut provoquer le décollement de la rétine. - Faire un trou initial à la limbe cornéen en appuyant légèrement avec la pointe d’un scalpel.
- Sous un microscope, couper le long du limbe cornéen avec des ciseaux de dissection pour enlever la cornée et retirez la lentille avec une pince.
- Séparer la rétine de l’épithélium pigmentaire rétinien vers la tête du nerf optique avec une pince à l’aide de mouvements de petite ouverture pour éviter le déchirement majeur.
- Libérer la rétine au nerf optique avec des ciseaux de dissection, placez la rétine dans 1 mL d’eau désionisée dans une plaque 24 puits et agiter à 200 tr/min avec une orbite de vibration de 1,5 mm pendant 1 h à température ambiante.
Remarque : Ci-après, la rétine apparaît que moins définies sur les bords. - Ajouter 200 U DNAse 1 pour dissocier les débris de cellules lysées de la vascularisation rétinienne et agiter pendant 30 min à température ambiante.
Remarque : Des débris pourraient commencent à se former dans les puits. - Rincez minimum 3 fois dans l’eau désionisée pendant 5 min avec la secousse à 150-300 tr/min pour enlever les débris de cellules neuronales. La rétine doit devenir plus transparente avec chaque rinçage indicative de l’élimination des débris cellulaires neuronales.
- Utiliser un fond sombre se pour pencher sur la plaque 24 puits de voir clairement la vascularisation rétinienne isolée diaphane.
- (Facultatif) : si le système vasculaire n’apparaît pas gratuit de couches neuronales (semi-transparente) à ce stade soit ajouter des étapes de rinçage plus, augmenter la vitesse d’agitation ou utilisez une pipette pour aspirer le liquide sur le système vasculaire.
ATTENTION : Une des étapes facultatives peuvent endommager le système vasculaire.
- Difficulté 10 min dans 1 mL de paraformaldéhyde à 4 % dans du PBS à température ambiante et rincer 3 fois dans du PBS.
Remarque : Le protocole peut être suspendu ici avec stockage de tissus à 4 ° C.
2. immunohistochimie
-
Coloration de cryo-coupes
- Coupez 10 µm cryo-section de la rétine de gélatine-encastrés comme profilés verticaux à travers le nerf optique et placer les cryo-sections sur une lame de verre et laisser sécher (1 h minimum).
- Plonger la lame dans du PBS à 0,25 % Triton X-100 (PBS-T) pendant 15 min.
- Goutte à goutte au 1/100 PDGFRβ et 1/500 NG2 anticorps primaires dilués dans du PBS-T + 1 % de BSA sur la cryo-section et incuber dans des chambres d’incubation à 4 ° C jusqu’au lendemain.
- Plonger la lame de verre 2 fois au PBS-T pendant 15 min et goutte à goutte au 1/100 Alexa Fluor 594-lié et au 1/100 anti-lapin FITC-linked secondaires anticorps anti-souris dilués dans du PBS-T avec 3 % de BSA sur les sections de cryo.
- Incuber la lame de verre 1 h à température ambiante dans l’obscurité.
- Rincer la lame de verre dans PBS-T 2 x 15 min.
Remarque : En option : pour double et triple immunofluorescence, coloration séquentiel peut être effectuée en répétant la procédure de 2.1.3 à 2.1.6 deux à trois fois, respectivement. - Montez les cryo-sections colorées avec anti-décoloration moyens contenant DAPI et une lamelle de montage.
-
La coloration des entiers
- Couler de PBS-T sur l’ensemble-Mont et incuber à température ambiante pendant 15 minutes.
- Décanter et goutte à goutte au 1/100 PDGFRβ et 1/500 NG2 anticorps primaires dilués dans du PBS-T + BSA 1 % et incuber durant une nuit en chambre humide à 4 ° C.
- Décanter et goutte à goutte sur PBS-T pour rincer la lame de verre en 2 x 15 min.
- Décanter et goutte à goutte à 1/100 anti-lapin Cy2 - 1/100 anti-souris Cy3-linked secondaires anticorps et dilué dans du PBS-T avec 3 % de BSA à incuber pendant 1 h dans une chambre humide à température de la pièce dans l’obscurité.
- Décanter et goutte à goutte sur PBS-T se rincer en 2 x 15 min dans le noir.
Remarque : En option : pour double et triple immunofluorescence, coloration séquentiel peut être effectuée en répétant la procédure de 2.2.2 à 2.2.5 deux à trois fois, respectivement. - Montez la monture tout teintée avec anti-décoloration moyens contenant DAPI et une lamelle de montage.
-
La coloration des vaisseaux isolé hypotonique
- Bloquer la vascularisation hypotonique isolée 1 h avec agitation à 100 tr/min et la température de la pièce avec 500 µL/puits de 10 % de sérum d’âne dilué dans du PBS.
- Incuber une nuit à température ambiante et l’agiter à 100 tr/min avec 600 µL/puits de 1/100 PDGFRβ et 1/500 NG2 anticorps primaires dilués dans du sérum d’âne de 10 % dans du PBS.
- Rincer la rétine réseau 3 x dans du PBS pendant 5 min et incuber au 1/100 Alexa Fluor 594-lié et au 1/100 anti-lapin FITC-linked secondaires anticorps anti-souris dilués à 10 % de sérum d’âne dans l’agitation de PBS à 100 tr/min et la température de la pièce dans l’obscurité pendant 1 heure.
- Rincez dans PBS-T pendant 5 min, puis incuber à 0,2 ng/mL DAPI dans PBS-T pendant 15 min, suivie de rinçages 3 x 5 min dans PBS-T dans l’obscurité.
- Couper l’extrémité d’une pipette Pasteur en plastique, Humidifiez-le avec PBS-T et l’utiliser pour transférer le réseau rétinien sur une lame de 4 puits verre chambre.
Remarque : L’étape humidification est importante pour éviter la vascularisation rétinienne s’en tenir à l’intérieur de la pipette Pasteur. - Déplier la vascularisation rétinienne. Évitez de toucher la vascularisation rétinienne avec une pince car cela peut causer la vascularisation à s’emmêler.
Remarque : Dépliage peut s’effectuer en inclinant la lame de la chambre en arrière ou aspirant gouttes de liquide sur la vascularisation rétinienne. - Retirer le support des puits. La tension superficielle du liquide va s’aplatir la vascularisation sur le fond de la diapositive.
- Assurer un déroulement correct sous un microscope avant d’enlever le plastique des puits de la lame de la chambre.
- Montez la vascularisation tachée avec milieu de montage anti-décoloration et un lamelle couvre-objet.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Les protocoles réussies offrent trois différentes préparations rétiniennes pour visualiser les péricytes microvasculaires. Chacune de ces méthodes utilise le PDGFRβ et NG2 immunoréactivité co-localisation et la position unique de la péricytes qui enveloppent autour de la foridentification de l’endothélium capillaire.
Cryo-sections, les couches neuronales peuvent être identifiés par la densité fluorescente de noyaux marquées au DAPI et le cercle intérieur et plexus capillaires profond contiennent des péricytes qui affichent l’immunoréactivité PDGFRβ et NG2 (Figure 1). La position unique des péricytes dans la paroi vasculaire peut être vu comme l’immunoréactivité circulaire ou en forme de fer à cheval dans la périphérie des vaisseaux (Figure 1, flèches) ou occasionnels couper longitudinalement bateaux (Figure 1, flèche).
Visualisation avec succès des péricytes microvasculaires en entier-Montez préparation du rat adulte peut être difficile de14,20. L’immunoréactivité de PDGFRβ dans la rétine adulte montés ensemble entraîné seulement un signal très faible (non illustré). NG2 coloration décrit le réseau vasculaire interne avec une coloration intense en abluminal péricytes (Figure 2).
Pour obtenir une vue d’ensemble du réseau vasculaire de la rétine de rat adulte, immunohistochimie du réseau vasculaire rétinienne hypotonique rat isolé fournit une méthode alternative pour monter ensemble. Quand a effectué avec succès, cette technique de préparation des tissus donne un aperçu de la microcirculation rétinienne entière y compris intérieures et profonde capillaires des plexus. IMMUNOHISTOCHEMICAL souillant avec des marqueurs de pericytic résultats dans l’ensemble du réseau microvasculaire montrant NG2 immunoréactivité avec une réponse intense dans les cellules vasculaires spécifiques (Figure 3). Certaines de ces cellules présentent également l’immunoréactivité PDGFRβ (Figure 3).
Une attention qui se déroulent du tissu est important pour obtenir un bon aperçu de la vascularisation rétinienne. Déroulement insuffisant peut entraîner la vascularisation étant disposée en couches multiples de mise au point qui rend fluorescente imagerie difficile (Figure 4). Déroulement peut être facilitée en secouant douce, en inclinant la lame de la chambre en arrière ou en aspirant gouttes de liquide sur la vascularisation rétinienne. Il est à noter que l’anatomie des rétiniens plexus capillaires se traduira par une superposition des lits vasculaires. Il est donc difficile de distinguer l’intérieur les plexus capillaires plus profondes lorsque dépliée sur la lame de verre.
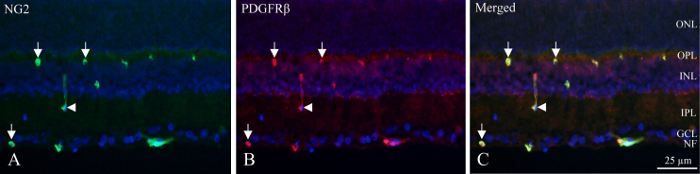
Figure 1 : Double marquage de pericyte immunohistochimique de cryo-section de la rétine de rat intérieure. (A) NG2 immunohistochimie (vert) révèle des navires positives au sein de la partie interne de la rétine. Les flèches indiquent l’immunoréactivité circulaire et en forme de fer à cheval dans les vaisseaux. La flèche indique un navire coupé longitudinalement. Immunohistochimie (B), PDGFRβ (rouge) montrent la réactivité similaire à immunoréactivité NG2. Flèches et pointe de flèche point sur les mêmes structures en ce qui concerne la coloration du NG2. (C), l’image montre une fusion du NG2, PDGFRβ et DAPI (bleu) en superposant les trois filtres différents. Il est révélé que les deux anticorps sont conjointement localisées (vert + rouge = jaune). NF : couche de fibres nerveuses, GCL : couche de cellules ganglionnaires, IPL : couche plexiforme interne, INL : couche nucléaire interne, BPO : couche plexiforme externe, ONL : couche nucléaire externe. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : marquage de pericyte immunohistochimique de la rétine de rat montés ensemble. L’immunoréactivité NG2 (rouge) est visible le long de la networkwith vasculaire superficiel intense coloration chez abluminal péricytes. Les images montrent la fusion NG2 et DAPI (bleu). Les cellules neuronales sont visibles comme des noyaux de DAPI-bleu entre la microcirculation NG2 colorés. PDGFRβ dans la rétine adulte monté ensemble a donné lieu seulement à un signal très faible et n’est donc pas inclus dans ce chiffre. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : Double coloration de pericyte immunohistochimique de la vascularisation rétinienne hypotonique isolé du rat. (A). l’image montre rat isolé hypotonique réseau vasculaire rétinienne immunohistochemical coloré au NG2 (vert) et PDGFRβ (rouge). Le réseau complet a montré l’immunoréactivité NG2. Toutefois, l’immunoréactivité de PDGFRβ a été trouvée dans somas de cellule. L’insertion de A est un aperçu du système vasculaire rétinien réseau colorée au DAPI (bleu). (B), l’image montre le même spécimen comme (A) à un emplacement différent et un grossissement supérieur. Il est clair que PDGFRβ coloration apparaît seulement dans somas de cellule dans le réseau vasculaire indiquant l’immunoréactivité de pericyte. L’insert de B est l’image qui montre le rapport optique élevé du système vasculaire colorées au NG2 (vert), PDGFRβ (rouge) et a fusionné avec DAPI. Y compris la coloration DAPI ainsi que NG2 et PDGFRβ révèlent trois péricytes (PDGFRβ-positif) et deux cellules de mur de navire non identifié. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : exemple d’une insuffisante déplié hypotonique isolé système vasculaire rétinien. Le déroulement minutieuse d’une vascularisation isolée hypotonique est important car déroulement insuffisant peut entraîner la vascularisation étant empilée. Les photos montrent le système vasculaire rétinien colorés au DAPI sur le même site mais pris dans les couches d’orientation différente. (A) colorés au DAPI les cellules en couche un foyer montrent un vaisseau sanguin épais d’environ 25 µm dans les vaisseaux rétinien. (B) colorés au DAPI les cellules dans une seconde couche de focus élucider fines ramifications capillaires sur le même site qui a été empilés sur les vaisseaux sanguins plus grande affichée en (A). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Nous présentons trois techniques de préparation rétinienne qui peuvent être appliquées dans l’étude des péricytes rétinienne microvasculaires. Ci-dessous, nous permettre une comparaison entre chacune des méthodes et les mettre en évidence des étapes cruciales dans les protocoles.
Avec cryo-sectionnement, la rétine est découpée en coupes sagittales et donc, il est possible d’obtenir de nombreux spécimens de la rétine même. Les sections chiffres résultant de cette méthode en font un choix idéal pour spécificité de l’anticorps et le titrage test car elle empêche inutile sacrifice animal. Le travail préparatoire est décisif pour de bons résultats. C’est crucial en disséquant l’oeil ne pas de tirer de l’oeil, mais pour couper tous les muscles autour des yeux. Il y a un risque de décollement de la rétine si la force est utilisée. Les bonnettes étant très mince, on devrait résoudre pas trop long. Immersion avec 4 % de paraformaldéhyde dans du PBS pour 2 – 4 h va fixer le tissu. Si le fixe est plus, il existe un risque de détruire l’antigène d’intérêt. Afin de générer le meilleur immunostainings possible, il est essentiel pour chaque section à être aussi plate que possible contre la vitre. Parce que les sections contiennent seulement quelques coupes transversales occasionnels de la microcirculation, cette technique de préparation de tissus offre seulement intermittente visualisation de la microcirculation. Par conséquent, cette méthode ne consiste pas pour les études de l’architecture vasculaire global et des mesures quantifiables des péricytes.
Le système vasculaire global peut être coloré après montage ensemble pour donner un aperçu du système vasculaire. Lorsque la maîtrise de cette technique, il peut être une procédure de préparation tissulaire rapide qui nécessite relativement peu de charge de travail. Cependant, il y a quelques points en particulier connaître. La rétine est fragile et il est primordial de manipulez-les avec soin et éviter les déchirures et les coupes. En outre, lors de la manipulation avec soin la rétine, c’est d’une importance capitale pour éviter les plis et autres crevasses lors du montage qui peuvent affecter l’imagerie immunohistochimique par la suite. La rétine montée a une épaisseur de 250-300 µm et la pénétration des couches neuronales anticorps pourrait être problématique. En ce qui concerne la visualisation de la pericyte, la coloration NG2 dans le protocole entier-montent ne peut se faire avec un anticorps secondaire lié à Cy3 et immunoréactivité PDGFRβ dans la rétine adulte monté ensemble a donné lieu à ces un très faible signal qu’il ne figurait pas dans la figure. Par conséquent, l’utilité de la technique de coloration ensemble monture est fortement entravée par la coloration réussie en fonction principalement sur les anticorps primaires et secondaires spécifiques utilisés. Autres suggestions pour optimiser le protocole pour visualisé microvasculaires plexus d’une rétine de rat adulte est de l’incubation à l’anticorps primaire pour une plus longue période de temps ou changer la température de l’incubation26.
En raison de l’épaisseur de l’ensemble monté, il est important d’être conscient de la direction de la rétine après avoir fait les quatre incisions de la périphérie rétinienne vers la tête du nerf optique pour éviter le montage accidentel avec la rétine interne contenant les capillaires orienté vers le bas. Pourtant, visualisation détaillée des plexus microvasculaires plus profondes et les péricytes peut être gênante avec cette méthode14,20. Entier-Montez la souillure de la rétine adulte étant difficile dans le plexus capillaire plus profond, cela pourrait entraîner la rétine apparaissant avasculaire dans certaines régions. La coloration immunohistochimique de rétine adulte monté ensemble fournit uniquement une vue d’ensemble fragmenté de la vascularisation avec péricytes tapissant les vaisseaux dans le plexus capillaire superficiel et par conséquent, cette méthode peut conduire à des résultats faussement négatifs dans la visualisation de la vascularisation rétinienne de rat.
La digestion trypsique a longtemps été considérée comme la technique de l’étalon-or pour l’isolement et la visualisation du système vasculaire rétinien20. Isolement hypotonique fournit une méthode alternative pour la visualisation de l’ensemble complexe réseau vasculaire en trois dimensions et fait face à beaucoup de mêmes défis travaillant avec des tissus très fragiles qui sont difficile à gérer. En raison de la ressemblance du produit vasculaire rétinienne, entre les deux méthodes, l’isolement hypotonique face à bon nombre des mêmes défis que la trypsine digestion20 y compris dissection minutieuse afin d’éviter de grandes déchirures et manipulation prudente en évitant pipetage et toucher avec une pince. Une différence importante entre les méthodes est la fixation. La digestion trypsique est généralement effectuée après fixation et peut être appliquée avec succès sur des rétines préservés qui ont été dans le fixateur pour plusieurs années20. Isolement hypotonique est effectuée avant la fixation et permet ainsi la mise en oeuvre dans divers autres tests, comme décrit précédemment dans la littérature23,24,25. La digestion trypsique est effectuée plus de deux jours20, tandis que l’isolement hypotonique peut être complété en quelques heures. En outre, le protocole d’isolement hypotonique ne comprend pas le risque de dépassement de la digestion et clivage enzymatique de marqueurs membranaires requis pour la reconnaissance de le pericyte, par exemple PDGFRβ et NG2, rendant cette méthode préférée pour les suivantes marquage immunohistochimique microvasculaires.
Enfin, bien que hors de la portée immédiate de ce manuscrit, il y a une technique moins connue mais très utile pour isoler les intact, grand plexi microvasculaire de rongeurs sur la rétine27. La rétine est placée dans une chambre de verre spécial et la lamelle couvre-objet. Lors de la suppression de la lamelle, les restes de la microcirculation attachés à la lamelle couvre-objet pour créer une vie pleinement (≈ 98 % des cellules) tissu imprimé. Le plus grand avantage de cette méthode est qu’elle permet l’étude physiologique des vaisseaux et la fixation ultérieure pour immunostaining. Une limitation évidente de la méthode est qu’elle ne fournit pas la visualisation/isolation de l’ensemble du réseau microvasculaire comme support plat dans la rétine et préparations hypotoniques ne. Pourtant, les péricytes peuvent être visualisées par application de cette méthode27.
Les techniques de préparation de trois tissus décrites ici sont complémentaires en ce sens que chaque méthode comprend les avantages et les lacunes pour la visualisation de la péricytes microvasculaires. L’évaluation de chaque potentiels de méthodes et de ses faiblesses est importante de sélectionner la meilleure méthode pour étudier les péricytes microvasculaires dans des conditions pathologiques spécifiques. Les méthodes démontrées peuvent être étendus aux taches non seulement pour les marqueurs de pericyte, mais aussi pour la visualisation des structures microvasculaires en général. Finalement, c’est pour le chercheur individuel sélectionner la méthode de visualisation approprié basée sur l’hypothèse de recherche en question.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Les auteurs n’ont rien à divulguer.
Acknowledgments
La recherche a été financée par la Fondation de Lundbeck, Danemark.
Materials
| Name | Company | Catalog Number | Comments |
| Geletin from porcine skin | Sigma-Aldrich | G2625-500G | |
| Albumin from chicken egg white | Sigma-Aldrich | A5253-500G | |
| Deoxyribonuclease (DNAse) I from bovine pancreas | Sigma-Aldrich | D5025-15KU | Dissolved in 0.15 M NaCl |
| Bovine serum albumin (BSA) | VWR | 0332-100G | |
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121, lot 129348 | |
| Rabbit anti-PDGFRβ | Santa Cruz | sc-432 | 1:100 |
| Mouse anti-NG2 | Abcam | ab50009 | 1:500 |
| Alexa Fluor 594 AffiniPure Donkey Anti-Rabbit IgG | Jackson ImmunoResearch | 711-585-152 | 1:100 |
| Fluorescein (FITC) AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-095-151 | 1:100 |
| Cy2 AffiniPure Donkey Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-225-152 | 1:100 |
| Cy3 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-165-150 | 1:100 |
| 4',6-diamidino-2-phenylindole (DAPI) | Sigma-Aldrich | D9542-1MG | Dissolved in DMSO |
| Anti-fading mounting medium | Vector Laboratories | H-1000 | |
| Anti-fading mounting medium with DAPI | Vector Laboratories | H-1200 | |
| Nunc Lab-Tek II 4-well chamber slide | Thermo Fisher Scientific | 154526 |
References
- Eshaq, R. S., Aldalati, A. M. Z., Alexander, J. S., Harris, N. R. Diabetic retinopathy: Breaking the barrier. Pathophysiology. , (2017).
- Cai, W., et al. Pericytes in Brain Injury and Repair After Ischemic Stroke. Translational Stroke Research. , (2016).
- Trost, A., et al. Brain and Retinal Pericytes: Origin, Function and Role. Frontiers in Cellular Neuroscience. 10, 20 (2016).
- Ramos, D., et al. The Use of Confocal Laser Microscopy to Analyze Mouse Retinal Blood Vessels. Confocal Laser Microscopy - Principles and Applications in Medicine, Biology, and the Food Sciences. Lagali, N. , InTech. (2013).
- Moran, E. P., et al. Neurovascular cross talk in diabetic retinopathy: Pathophysiological roles and therapeutic implications. American Journal of Physiology. Heart and Circulatory Physiolog. 311, H738-H749 (2016).
- Henkind, P. Microcirculation of the peripapillary retina. Transactions - American Academy of Ophthalmology and Otolaryngology. 73, 890-897 (1969).
- Attwell, D., Mishra, A., Hall, C. N., O'Farrell, F. M., Dalkara, T. What is a pericyte? Journal of Cerebral Blood Flow & Metabolism. 36, 451-455 (2016).
- Fernandez-Bueno, I., et al. Histologic Characterization of Retina Neuroglia Modifications in Diabetic Zucker Diabetic Fatty Rats. Investigative Ophthalmology & Visual Science. 58, 4925-4933 (2017).
- Yu, D. -Y., Yu, P. K., Cringle, S. J., Kang, M. H., Su, E. -N. Functional and morphological characteristics of the retinal and choroidal vasculature. Progress in Retinal and Eye Research. 40, 53-93 (2014).
- Allen, R. S., et al. Severity of middle cerebral artery occlusion determines retinal deficits in rats. Experimental Neurology. 254, 206-215 (2014).
- Kyhn, M. V., et al. Acute retinal ischemia caused by controlled low ocular perfusion pressure in a porcine model. Electrophysiological and histological characterisation. Experimental Eye Research. 88, 1100-1106 (2009).
- Blixt, F. W., Radziwon-Balicka, A., Edvinsson, L., Warfvinge, K. Distribution of CGRP and its receptor components CLR and RAMP1 in the rat retina. Experimental Eye Research. 161, 124-131 (2017).
- Sarlos, S., Wilkinson-Berka, J. L. The renin-angiotensin system and the developing retinal vasculature. Investigative Ophthalmology & Visual Science. 46, 1069-1077 (2005).
- Wittig, D., Jaszai, J., Corbeil, D., Funk, R. H. W. Immunohistochemical localization and characterization of putative mesenchymal stem cell markers in the retinal capillary network of rodents. Cells Tissues Organs. 197, 344-359 (2013).
- Tual-Chalot, S., Allinson, K. R., Fruttiger, M., Arthur, H. M. Whole mount immunofluorescent staining of the neonatal mouse retina to investigate angiogenesis in vivo. Journal of Visualized Experiments. , e50546 (2013).
- Park, D. Y., et al. Plastic roles of pericytes in the blood-retinal barrier. Nature Communications. 8, 15296 (2017).
- Hughes, S., Chan-Ling, T. Characterization of smooth muscle cell and pericyte differentiation in the rat retina in vivo. Investigative Ophthalmology & Visual Science. 45, 2795-2806 (2004).
- Lange, C., et al. Intravitreal injection of the heparin analog 5-amino-2-naphthalenesulfonate reduces retinal neovascularization in mice. Experimental Eye Research. 85, 323-327 (2007).
- Higgins, R. D., et al. Diltiazem reduces retinal neovascularization in a mouse model of oxygen induced retinopathy. Current Eye Research. 18, 20-27 (1999).
- Chou, J. C., Rollins, S. D., Fawzi, A. A. Trypsin digest protocol to analyze the retinal vasculature of a mouse model. Journal of Visualized Experiments. , e50489 (2013).
- Hazra, S., et al. Liver X receptor modulates diabetic retinopathy outcome in a mouse model of streptozotocin-induced diabetes. Diabetes. 61, 3270-3279 (2012).
- Zhang, L., Xia, H., Han, Q., Chen, B. Effects of antioxidant gene therapy on the development of diabetic retinopathy and the metabolic memory phenomenon. Graefe's Archive for Clinical and Experimental Ophthalmology. 253, 249-259 (2015).
- Dagher, Z., et al. Studies of rat and human retinas predict a role for the polyol pathway in human diabetic retinopathy. Diabetes. 53, 2404-2411 (2004).
- Navaratna, D., McGuire, P. G., Menicucci, G., Das, A. Proteolytic degradation of VE-cadherin alters the blood-retinal barrier in diabetes. Diabetes. 56, 2380-2387 (2007).
- Gustavsson, C., et al. Vascular cellular adhesion molecule-1 (VCAM-1) expression in mice retinal vessels is affected by both hyperglycemia and hyperlipidemia. PLoS One. 5, e12699 (2010).
- Kornfield, T. E., Newman, E. A. Regulation of blood flow in the retinal trilaminar vascular network. Journal of Neuroscience. 34, 11504-11513 (2014).
- Puro, D. G. Retinovascular physiology and pathophysiology: new experimental approach/new insights. Progress in Retinal and Eye Research. 31, 258-270 (2012).



