ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Nous présentons un protocole pour le conditionnement classique de fourmis harnachées qui permet aux chercheurs d’étudier la formation apprentissage et la mémoire visuelle à un niveau d’analyse n’est pas possible avec se déplaçant librement les individus.
Abstract
Plusieurs espèces d’insectes sont devenus des systèmes modèles pour étudier la formation de l’apprentissage et la mémoire. Bien que de nombreuses études axées sur le libre déplacement des animaux, études de mise en œuvre des paradigmes du conditionnement classique avec des insectes harnachés ont été importantes pour étudier les indices exacts que les individus apprennent et les mécanismes neuronaux sous-tendant l’apprentissage et formation de la mémoire. Nous présentons ici un protocole des éloges pour visual apprentissage associatif dans les fourmis des bois par conditionnement classique. Dans ce paradigme, les fourmis sont exploités et présentés avec un repère visuel (carton bleu), le stimulus conditionnel (SC), couplé avec une récompense de sucre d’appétence, le stimulus inconditionnel (US). Les fourmis exécutent un réflexe d’Extension du maxillaire-Labium (MaLER), la réponse inconditionnelle (UR), qui peut être utilisée comme un indicateur pour l’apprentissage. Formation se compose de 10 essais, séparés par un intervalle de 5 minutes épreuves (ITI). Les fourmis sont également testés pour la rétention de la mémoire 10 minutes ou 1 heure après l’entraînement. Ce protocole a le potentiel pour permettre aux chercheurs d’analyser, de manière précise et contrôlée, les détails de la formation de la mémoire visuelle et les bases neurales de formation de l’apprentissage et la mémoire dans les fourmis des bois.
Introduction
Insectes ont été largement utilisés comme modèles pour l’étude de formation d’apprentissage et de mémoire1. Une veine particulièrement réussie de la recherche implique l’utilisation de conditionnement classique d’animaux restreints, qui permet un contrôle précis sur les repères se réaffiche et permet aux chercheurs d’étudier les mécanismes neurones qui sous-tendent l’apprentissage et la mémoire. La majorité des études ont porté sur le conditionnement classique appétence des travailleurs de l’abeille domestique, Apis mellifera. Les travailleurs de l’abeille sont formés pour associer un CS à un américain qui évoque le cycle d’Uruguay. Dans ce paradigme, développé à l’origine par Takeda2 et Bitterman et al. 3, le cycle d’Uruguay est le réflexe d’Extension Proboscis (PER), les États-Unis sont le sucre et le CS est une odeur. Abeilles Découvrez l’association entre le CS et les États-Unis et peuvent former une mémoire à long terme de cette association.
Le paradigme original utilisant le rap comme le cycle d’Uruguay a été utilisé pour démêler les voies neuronales qui sous-tendent l’apprentissage olfactif en abeilles4. Il a été modifié dans plusieurs façons de tester l’apprentissage de différents stimuli sensoriels, y compris les stimuli visuels5,6,7, d’incorporer aversifs d’apprentissage à l’aide de la suppression de la p.8 ou l’Extension de Sting Réflexe (SER)9 comme le cycle d’Uruguay et de tester l’apprentissage chez d’autres espèces, telles que les bourdons10 et drosophiles11. Bien que la formation de la mémoire avec plusieurs modalités a été étudiée par le biais de conditionnement classique, visuel d’apprentissage est toujours difficile à observer à l’aide de cette approche, même chez les espèces qui montrent un degré élevé de capacité d’apprentissage visuel au cours de la recherche de nourriture, tels que abeilles.
Des études récentes ont appliqué une approche similaire aux insectes qui n’ont pas une trompe, comme les criquets, qui effectuent le Palp ouverture réponse (POR)12et les fourmis, qui effectuent le maxillaire-Labium Extension réflexe (MaLER)13. Cela a déjà révélé des capacités propres à la phase d’apprentissage qui correspondent à des stratégies d’alimentation phase spécifique les deux phénotypes différents de Criquet pèlerin, les grégaires et les formes solitaires, ré-appliquer l’idée que la formation de la mémoire doit correspondre à 14de besoins écologiques. En outre, des études sur l’apprentissage olfactif à fourmis a montré similitudes entre les fourmis et les abeilles dans la formation de la mémoire et de conservation, avec rétention de la mémoire à long terme, 72 heures après sa formation, dépend de la synthèse de protéine15.
Ces adaptations du paradigme original ont permis la formation de l’apprentissage et la mémoire à étudier avec plusieurs modalités et chez plusieurs espèces de modèle. Ceci est essentiel pour l’identification des mécanismes de mémoire commun de formation pour les insectes, mais aussi pour identifier les différences qui reflètent l’écologie particulière de l’apprentissage et la mémoire chez les différentes espèces. L’objectif principal du protocole que nous décrivons ici est de fournir un moyen de réaliser des expériences de conditionnement classique à l’aide d’un stimulus conditionnel visuel avec une espèce de fourmi largement étudié, Formica rufa. Il est issu de notre étude de l’apprentissage visuel dans les fourmis des bois16, qui est aussi une adaptation des paradigmes visuels conditionnement classique.
Protocol
1. maintien des Colonies de Formica rufa
Remarque : Les colonies de fourmi (Formica rufa, L.) utilisés pour cette étude ont été récoltées dans la forêt d’Ashdown, Sussex, UK (N 51 4.680, E 0 1.800). Au sein du Royaume-Uni, F. rufa colonies doivent être collectées entre juillet et août. Une bonne proportion du nid doit être retirée, comprenant plusieurs centaines de travailleurs et de couvain, pour s’assurer de la colonie est soutenue et active pour longues périodes de temps (jusqu'à un an). Doit demander l’autorisation des autorités compétentes avant l’enlèvement du nid.
- Abritent des colonies de fourmi dans une grande boîte (environ 135 x 70 cm x 35 cm) avec des murs recouverts de résine de polytétrafluoroéthylène (PTFE) (p. ex., Fluon) pour empêcher les fourmis de s’échapper, à 21 ° C, sous une lumière de 12 h : 12-cycle foncé h.
- Fournir l’eau et le saccharose (333 g/L) pour les fourmis, à l’aide de distributeurs d’eau. Afin d’assurer que l’alimentation des fourmis est riche en protéines, nourrir la colonie avec des grillons surgelés 2 x par semaine. Pulvériser le nid avec de l’eau tous les jours pour le garder humide.
- Afin d’améliorer les conditions sanitaires de la colonie, ajouter la résine de pin, lorsque cela est nécessaire ; résine de pin réduit le parasitisme en fourmi colonies17. Placez un petit récipient (environ 15 cm de diamètre et 5 cm de profondeur) à l’intérieur du nid afin que les fourmis peuvent déposer des membres de la colonie morts dedans.
- Garder des fourmis dans les conditions précitées pendant au moins 2 semaines après avoir recueilli avant de tenter toutes les expériences. Retirez le saccharose du nid d’affamer les fourmis 2 d avant les expériences, améliorant ainsi leur motivation.
2. sélection et exploiter des fourmis
Remarque : Pour l’exploitation de fourmis, un porte sur mesure est nécessaire. Cela peut être construit à l’aide de glaise à modeler et un carton avec une coupe d’ouverture fixé horizontalement. La surface supérieure du carton doit être partiellement enduite avec de la cire, permettant des insectes épingles pour être attaché au cours de la fixation. Manipulation soigneuse est nécessaire pour chaque étape de ce protocole (y compris l’entretien, le transport et expérience), mais surtout lorsque exploitant des fourmis, pour éviter en les soumettant à des niveaux élevés de stress avant la formation.
- Pour sélectionner les fourmis qui sont motivés pour manger, placez une lame avec une goutte de saccharose (200 g/L) à l’intérieur d’une petite boîte (environ 14 cm x 8 cm x 5 cm) avec des murs recouverts de résine PTF pour empêcher la fuite. Ne sélectionnez pas les fourmis qui transportent les fourmis bois ou morts du nid. Au lieu de cela, prendre des fourmis qui sont ramper sur les murs du nid, car ceux-ci sont plus susceptibles d’être des butineuses tentait de quitter le nid à la recherche de nourriture.
- Placer chaque fourmi dans la zone et attendre de voir si il se nourrit de la chute de saccharose. Dans l’affirmative, le transférer immédiatement à une autre boîte vide pour empêcher la satiété.
- Transférer chaque fourmi dans une éprouvette. Placez chaque tube dans le congélateur pendant 1 à 2 min, ou dans la glace pilée jusqu'à 5 min, pour immobiliser la fourmi.
- Placez la fourmi immobilisée dans le support, par le biais de la coupe sur le carton, grâce à l’articulation entre sa tête et son thorax. S’assurer que les antennes restent sur le côté de la tête, à l’aide de goupilles insectes incorporés dans la couche de cire sur le dessus du carton.
- Utilisez un élément de chauffage sur mesure à la pour cire de la pointe d’une insecte broche à la tête de la fourmi, parallèle à la partie cartonnée. Au cours de cette procédure, ne toucher les antennes avec l’élément chauffant de fil pour éviter de payer des dommages pour eux.
- Après que la cire sèche, retirez les goupilles insectes détenant les antennes et retirez délicatement la fourmi le titulaire.
- Difficulté de l’axe insecte supportant la fourmi dans une argile de modélisation cylindre et fix, un support en plastique sur mesure située en dessous, assurant la fourmi maintient une posture typique debout et que l’ensemble du corps est libre de se déplacer, sauf la tête.
- Gardez les fourmis harnachés dans l’obscurité pendant au moins 2 h avant la formation.
3. formation et tests
-
Set-up, stimulus conditionné et stimulus inconditionnel
- Mener des expériences dans une boîte acrylique blanche (50 x 50 x 50 cm), ouverte à l’avant pour permettre l’accès pour l’expérimentateur. Enregistrer le comportement de la fourmi avec un appareil photo.
- Placez la caméra avec une lentille macro directement au-dessus de la fourmi, à travers un trou dans la surface supérieure de la boîte.
- Pour réduire tout repères visuels extérieurs, garder la chambre dans l’obscurité, à l’exception d’une source lumineuse pointant directement vers le haut de la boîte acrylique (deux feux de 26-W).
- Utiliser comme un repère visuel (CS) un rectangle de carton bleu vif (spectre en Figure S1) (60 x 45 mm) fixé en son centre à une aiguille, reliée à une seringue (2 mL) avec lequel les Etats-Unis (saccharose 200 g/L) est livré manuellement à la fourmi (Figure 1 a et 1 b ).
Remarque : La solution de saccharose peut être faite avec n’importe quel sucre blanc, pourvu qu’il n’a pas de couleur et l’odeur lorsque dissout dans l’eau. - Effectuer deux types de formation en parallèle, appariés et non appariés (Voir l’explication ci-dessous), dans un ordre aléatoire.
Remarque : Dans cette étude, nous n’a pas prêté attention à la nature de la repère visuel. Seulement l’association entre la queue et la récompense ont été prise en compte. Couleur et la forme ont été testés pas, et il est probable qu’une CS avec d’autres fonctionnalités produirait des résultats similaires. Néanmoins, la couleur bleue a été choisie parce que les fourmis du même genre auraient dû être divulgués est sensible aux longueurs d’onde qui couvrent la couleur bleue18.
- Mener des expériences dans une boîte acrylique blanche (50 x 50 x 50 cm), ouverte à l’avant pour permettre l’accès pour l’expérimentateur. Enregistrer le comportement de la fourmi avec un appareil photo.
-
Formation de paire
Note : Dans la formation de paire, le CS et les États-Unis sont présentées dans chaque procès, sont associées entre elles (Figure 1).- Commencez à enregistrer les fourmis 10 s avant de présenter le CS pour faire en sorte que les fourmis sont acquittent pas spontanément MaLER avant la présentation. Si les fourmis exécutent MaLER durant cette période, reporter le procès pendant quelques secondes. Si une fourmi montre ce comportement en permanence, l’exclut de l’analyse.
- Déplacez la seringue + CS devant la fourmi pour ~ 10 s, avec la pointe de l’aiguille maintenue entre le visage de la fourmi et un maximum de 5 mm au-dessus et de chaque côté. Pendant ce temps, passer la pointe de l’aiguille aussi près que possible à la tête de la fourmi, mais sans toucher à l’antenne (Figure 1 b).
Note : Motion était incluse lors de la présentation du CS parce qu’il a été démontré à jouer un rôle dans l’apprentissage associatif visuel en abeilles6. - Appliquer une pression à exsuder une seule goutte de saccharose de l’embout de la seringue et déposer la goutte de saccharose à côté des antennes et des pièces buccales pour permettre la fourmi détecter le saccharose. Permettre la fourmi nourrir pendant environ 5 s.
Remarque : La quantité de fourmis de saccharose consommée dans chaque procès n’était pas contrôlée dans ces expériences. La chute de saccharose sur les fourmis l’aliment doit être assez grand pour leur permettre de nourrir librement pendant environ 5 s. - Répétez cette procédure 10 x, avec un ITI de 5 min.
Remarque : Dans ces expériences, les fourmis ont toujours tournés vers la droite, avec leur œil droit près du côté ouvert de la boîte acrylique. Par conséquent, le CS a toujours abordé les fourmis de leur côté droit. Bien que cela n’invalide pas l’apprentissage, ces expériences peuvent être menées en tournant la moitié des fourmis vers la gauche et l’autre moitié à droite, pour éviter tout effet possible de latéralisation.
-
Formation non appariée
Remarque : Cette formation consiste à présenter les CS ou les Etats-Unis séparément, ces deux stimuli étant, les fourmis ainsi, dissocié de l’autre au fil du temps (Figure 1).- Démarrer l’enregistrement fourmis 10 s avant chaque essai.
- Présente la CS de la même manière qu’en formation de paire, mais ne livrent pas le saccharose de la fourmi.
- Après 2,5 min, livrer aux États-Unis directement sur les pièces buccales (également toucher les antennes) à l’aide d’une seringue sans le CS attaché.
- Commencer par un essai de CS et répétez l’opération 10 x pour chaque type d’essai, en intercalant les avec un ITI de 2,5 min.
-
Test
Remarque : Un test doit être effectué seulement 1 x, soit 10 min ou 1 h après le dernier procès de formation ; un essai dans lequel la fourmi est présentée avec le CS, mais pas avec les Etats-Unis pourrait provoquer l’extinction de la mémoire associative créée précédemment.- Démarrer l’enregistrement le s de fourmis 10 avant le test.
- Présenter le CS à la fourmi pour environ 10 s.
- Veiller à ce que la fourmi est toujours motivée pour se nourrir en livrant le saccharose après l’essai.
4. collecte des données et l’analyse
- Enregistrer le comportement de la fourmi, par dessus, en 10 s avant chaque essai et au cours des présentations CS et aux États-Unis. S’assurer que tous les essais et analyses sont enregistrées pour l’analyse postérieure.
- En utilisant les enregistrements réalisés au cours de la formation et les tests, marquer les réponses de la fourmis pendant les 10 s de présentation de CS.
- Séparer les réponses de la fourmis lors de la présentation du CS en trois types de comportement, en fonction de l’extension et la circulation des pièces buccales : Extension complète avec le mouvement (MEF) comme si l’alimentation, l’Extension complète sans mouvement (FE) ou Extension partielle (PE) de la palpes maxillaires-labium ou maxillaire (Figure 2 a - 2D). Pour l’analyse, le groupe tous les types de MaLER comme une réponse unique (Figure 2E).
- Exclure toute fourmi qui a fait que ne se nourrissent ne pas dans tous les procès et test.
Remarque : Pour l’analyse, un test statistique qui tient compte des fourmis individuels est recommandé, représentant ainsi la variabilité chez les individus. Lors du classement des réponses de fourmis pendant l’entraînement de façon binaire (1 pour les réponses positives et 0 pour aucune réponse), la régression logistique à effets mixtes est conseillé16,19. Pour comparer la proportion des fourmis dans chaque procès de formation ou de test, un G-test ou test exact de Fisher est recommandé, selon le nombre de fourmis analysé16,20.
Representative Results
Au cours d’expériences de conditionnement classique, le CS ne doit pas induisent une réponse spontanée chez les animaux. Dans les expériences que nous avons réalisé, seulement 3 % à 4 % des fourmis effectué MaLER en réponse à la communication visuelle lors du premier procès, avant la formation. Les fourmis qui subissaient un entraînement apparié effectué MaLER de plus en plus en réponse à la CS (Figure 3 a; de la régression logistique, N = 51, degrés de liberté (df) = 507, z = 5.949, p < 0,01). Le pourcentage des fourmis appariés qui répondent à la CS plafonné à environ 50 %, passant de la troisième procès a partir. Au contraire, fourmis non appariés a montré non significatives augmentent de MaLER au cours de la formation (Figure 3 b, régression logistique, N = 29, df = 287, z = 0,758, p = 0,45). La présence de MaLER en réponse à la communication visuelle était significativement plus élevée au cours jumelé que non appariés formation (régression logistique, N = 80, df = 796, z =-5.306, p < 0,01), qui a été vrai pour toutes les épreuves sauf le premier (tableau 1).
Pour l’examen de leur court et une mémoire à mi-parcours15, les fourmis ont été testées 10 min ou 1 h après le dernier essai de formation. Pour les deux essais, la proportion des fourmis effectuant MaLER en réponse à la CS était significativement plus élevée lorsqu’ils avaient suivi une formation appariée et non appariée (Figure 3 et 3D; Le tableau 1).
Au cours de la formation, les fourmis ont montré une variation importante dans le nombre et le type de MaLER qu’ils affichent (Figure 4 a et 4 b). Seulement 14 % des fourmis appariés a répondu à toutes les épreuves de la deuxième ou troisième procès, alors que la plupart des fourmis alternaient entre des essais dans lesquels ils ont répondu et dans lequel ils n’ont pas. Ces essais de formation où les fourmis ont répondu, la mesure dans laquelle ils élargi et déplacé leurs pièces buccales varié. Par conséquent, nous avons divisé MaLER en trois types différents : MEF, FE ou PE. Généralement, les fourmis exécutées MEF ou PE plus souvent que FE. Cependant, seulement quelques fourmis effectué systématiquement le même type de réponse ; dans la plupart des cas, fourmis ont montré peu de cohérence sur le type de MaLER qu'ils ont joué (Figure 4).

Figure 1 : Montage expérimental et plan de formation. (A) fixer la fourmi avec de la cire sur une insecte broche attachée à une modélisation cylindre d’argile (orange) et place une porte sur mesure-sous elle afin de permettre une attitude naturaliste. Placez-la à l’intérieur d’une boîte acrylique blanche éclairée par deux sources lumineuses, directement sous une caméra. Utiliser comme stimulus conditionné (CS) carton (carré bleu) attaché à la seringue qui délivre le stimulus inconditionnel (US), une récompense de sucre. L' encart montre une vue rapprochée d’une fourmi dans le support. (B), la pointe de la seringue aiguille est placé aussi près que possible à la tête de la fourmi, mais sans toucher les antennes, comme le montre ce schéma. Jumelé de fourmis train via soit un (C) ou (D) non appariées de formation. Ce chiffre a été modifié par Fernandes et al. 16. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : La réponse d’Extension de maxillaire-Labium de fourmis des bois. Des images individuelles, des enregistrements vidéo montrent partie mouvements de la bouche des fourmis pendant l’entraînement. (A), ce panneau n’affiche aucune réponse. (B) ce panneau présente une extension complète (FE) de la maxillaire-labium qui se termine dans la glossa. (C), ce panneau représente une extension partielle (PE) avec seulement le maxillaire palpus visibles. (D), ce panneau indique une extension partielle (PE) des structures maxillaire-labium. Les fourmis (E) en formation appariée (N = 51) effectuer une extension complète avec mouvement (MEF, brun foncé), un FE (brun moyen) soit une PE (brun clair). Ce chiffre a été modifié par Fernandes et al. 16. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : Forme de fourmis mémoires associatives d’un repère visuel jumelés avec une récompense de sucre de bois. (A), le pourcentage de fourmis appariés (N = 51) effectuant MaLER en réponse à la présentation de CS significativement augmenté tout au long de la formation. (B) le pourcentage de fourmis effectuant MaLER n’augmente pas sensiblement tout au long de la formation non appariée (N = 29). Les fourmis ont été testé (C) 10 minutes (appariés : N = 15 ; non appariés : N = 15) ou (D), 1 heure (appariés : N = 15 ; non appariés : N = 14) après le dernier procès de formation. Le pourcentage des fourmis en réponse à la CS pendant et après l’entraînement de même couleur ou non apparié sont représentés en brun ou en gris, respectivement. Les trois types de MaLER sont représentés dans l’obscurité (MEF), moyen (FE) et des tons de lumière (PE). Ce chiffre a été modifié par Fernandes et al. 16. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : Performance individuelle des fourmis pendant l’entraînement. Ces panneaux montrent les performances individuelles de (A) fourmis appariés et (B) non appariés des fourmis. Les trois types de MaLER sont représentés en noir (MEF), moyen (FE) et brun clair (PE) ou en gris. Ce chiffre a été modifié par Fernandes et al. 16. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Trial | N | DF | G (ajusté) | P |
| 1 | 80 | na | na | > 0,1 |
| 2 | 80 | 1 | 3.86 | < 0,05 |
| 3 | 80 | 1 | 8.41 | < 0,01 |
| 4 | 80 | 1 | 6.63 | < 0,01 |
| 5 | 80 | 1 | 8.41 | < 0,01 |
| 6 | 80 | 1 | 7.5 | < 0,01 |
| 7 | 80 | 1 | 10.69 | < 0,01 |
| 8 | 80 | 1 | 11.76 | < 0,01 |
| 9 | 80 | 1 | 17.13 | < 0,01 |
| 10 | 80 | 1 | 17.13 | < 0,01 |
| 10 min | 59 | 1 | 5.5 | < 0,05 |
| 1 h | 59 | 1 | 4.42 | < 0,05 |
Tableau 1 : comparaison des réponses MaLER au CS entre les fourmis qui avaient subi appariés et non appariés de formation, pour chaque essai et test. Le nombre de fourmis (N), degrés de liberté (df), G-test d’indépendance (G) et de la p-valeur sont affichés. Le premier essai a été analysé avec test exact de Fisher. Ce tableau a été modifié par Fernandes et al. 16.
Discussion
Conditionnement classique est l’un des paradigmes plus bien établies afin d’étudier l’apprentissage et la mémoire. Le protocole que nous avons présenté ici est une adaptation du paradigme conçues pour miel abeille travailleurs2,3 et par la suite utilisé avec plusieurs autres espèces, comme les bourdons, mouches des fruits, qui utilisent également pour comme une lecture pour apprendre10 ,11et les criquets et les fourmis, qui utilisent les POR et MaLER, respectivement12,13. Utilisant ce protocole, il est possible de former les fourmis des bois attelés à apprendre l’association entre un repère visuel et une récompense de sucre et d’analyser le maintien de cette courte (10 min) et à moyen terme (1 heure) mémoire16.
Dans toute expérience comportementale, il est nécessaire de tenir compte des étapes cruciales qui peuvent réduire la variabilité des réponses de l’animal. Dans le protocole présenté ici, plusieurs mesures sont prises pour réduire au minimum la variabilité avant et Pendant la formation. Avant le début des expériences, la colonie doit être affamé depuis au moins deux jours et fourmis doivent être sélectionnés, basé sur leur volonté de manger d’une goutte de sucre dans la zone d’exploitation. Sélection des fourmis de cette façon est destiné à maximiser les chances de fourmis de formation qui sont motivés pour se nourrir. Attention manipulation est également un facteur important car il peut aider à réduire les niveaux de stress, qui perturbe d’apprentissage s’il est trop intense21. À cette fin, fourmis devraient être anesthésiés par le froid à rester immobile tout en étant exploitée, car tout mouvement (pour échapper) au cours de cette procédure pourrait être une source de stress. En outre, le contact entre la fourmi et la cire devrait être minime, en évitant tout contact entre les antennes et la cire chaude ou le fil, ce qui pourrait causer des dommages. Bien que ces observations n’ont pas officiellement été analysées, les antennes semblaient se déplacer avec un modèle spécifique lors de l’apprentissage.
Au cours d’expériences, attention livraison du sucre est également important d’entretenir la motivation des fourmis. Encore une fois, alors que cela n’a pas officiellement été analysée, livraison de nourriture brusque semblait causer un stress supplémentaire à la fourmi, qui a conduit à un manque de motivation et l’apprentissage. En outre, le saccharose, prononcé lors de la formation doit être d’une diminution de la concentration (200 g/L) pour éviter de satiété avant la fin de la formation et les tests. Cela permet de MaLER comme une réponse inconditionnelle de bon candidat car, ainsi que d’une faible performance spontanée de cette réponse à la communication visuelle, elle aussi ne pas saturer au cours des essais. Enfin, contrairement à la plupart de conditionnement classique étudie2,3,5,6,7,8,9,10, 11 , 12 , 13, nous avons formé une fourmi dans le temps jusqu'à la fin de l’expérience, laissant en place entre les essais plutôt que de le retirer pour tester une autre fourmi. Formation plusieurs fourmis ensemble semble produire des résultats plus variables, qui peuvent être due à une augmentation de stress ou de conflit entre les informations visuelles causées par le changement complet du paysage. Afin de réduire la durée de chaque expérience, nous avons utilisé un ITI 5 minutes au lieu de l’ITI 10 minutes utilisée dans la plupart d’études conditionnement classique16. Bien que toutes ces considérations devraient aider à faire en sorte que les fourmis sont motivés pour se nourrir et d’apprendre au cours de la formation, certaine variabilité ne peut être évitée. Nous recommandons à l’aide de fourmis qui semblent avoir un comportement social, appétence et locomotion normal et à l’exclusion des fourmis de l’analyse au moment où qu'ils ne parviennent pas à se nourrir sur un essai de formation ou d’un test.
La nature de la CS n’a pas été évaluée dans cette étude. Bien que nous avons utilisé un stimulus visuel bleu parce que les fourmis du même genre sont sensibles à ces longueurs d’onde18, autres couleurs peuvent également être tiré des enseignements en liaison avec une récompense. Il faudrait d’autres expériences pour caractériser complètement les couleurs étant vu et appris dans ce set-up. Cela vaut également pour les différentes formes et tailles du repère visuel. Nous n’avons pas testé si la résolution spatiale des fourmis serait suffisante pour distinguer le stimulus visuel présenté ici à la distance entre les yeux les fourmis à qu'a été présenté. Bien que les yeux composés des fourmis des bois ont été décrits en termes de taille et le nombre de facettes22, à notre connaissance, leur résolution spatiale n'a pas été entièrement décrit encore. Cependant, ceci a été calculé pour Manana Melophorus23. Une caractérisation similaire des fourmis bois, ou les yeux des autres insectes testés contribuerait à une enquête claire des caractéristiques de la repère visuel étant observé et appris par les animaux. En outre, nous avons inclus motion lors de la présentation du stimulus visuel à la fourmi, car il a été démontré à jouer un rôle dans l’apprentissage associatif abeilles durant le conditionnement classique6. Cependant, cela n’était également pas testé dans cette étude et, en raison de la nature des différents mouvements d’insectes par rapport à la marche des insectes volants, différences entre les abeilles et les fourmis visuel conditionnement classique pourraient être observés.
Sur une note finale, nous n’avons pu examiner la rétention à long terme de mémoire parce que les fourmis n’ont pas survécu étant exploitées pour ces longues périodes après la formation. Toutefois, dans les séries ultérieures d’expériences, nous avons gardé des fourmis vivantes et motivé pour manger et apprendre quand attelés et quitté durant la nuit dans un environnement sombre et humide (en plaçant une boîte au-dessus d’eux). Par conséquent, ce paradigme pourrait servir à élucider la rétention à long terme de mémoire des fourmis des bois, en plus de la mémoire de court et moyen terme.
Avec cette procédure très simple, adaptée de paradigmes généraux conditionnement classique, il est possible d’étudier l’acquisition et la rétention des souvenirs visuels dans harnachées fourmis des bois, qui ont été étudiés largement dans les paradigmes à l’aide de mouvement libre des animaux. Ce paradigme a le potentiel d’être utilisé pour analyser les bases neurales de l’apprentissage visuel dans un modèle très bien établi pour la navigation de l’insecte.
Disclosures
Les auteurs n’ont rien à divulguer.
Acknowledgments
Les auteurs remercient Tom Collett et Cornelia Buehlmann pour le partage des renseignements précieux au sujet de la collecte et la maintenance des colonies de fourmi. Les auteurs remercient également Justine Crevel de commenter les versions précédentes du présent article.
Materials
| Name | Company | Catalog Number | Comments |
| Fluon | Blades Biological Ltd, Edenbridge, UK | ACS 109; ACS 112; ACS 114 | For preventing insects from scaping |
| Crickets | Blades Biological Ltd, Edenbridge, UK | LZJ 217 | Given to the ant colonies as protein source |
| Natural Pine Rosin/Resin | Minerals-water Ltd, Rainham, UK | 500g | Given to the ant colonies for sanitation |
| Austerlitz Insect Pin | Fine Science Tools GmbH, Heidelberg, Germany | 26000-40 | For harnessing ants |
| High speed camera | Edmund Optics Inc., Barrington, USA | eo-13122M | MaLER recordings during training and testing |
| Macrolens | Cannon, Surrey, UK | EF 100 mm f/2.8 L Macro IS USM | MaLER recordings during training and testing |
| Software | IDS Imaging Development Systems GmbH | uEye64 | MaLER recordings during training and testing |
| Blue Cardboard | john smith's at Union Store, University of Sussex | JACK-PJM41358 | Constitutes de conditional stimulus |
| Syringe | Fisher Scientific LTD, Loughborough, UK | BD Plastipak 300185case; Product Code.12369289 | US and CS (attached) presentation |
| Needle (0.5 x 16 mm) | Fisher Scientific LTD, Loughborough, UK | BD Microlance 300600; Product Code:10442204 | US and CS (attached) presentation |
References
- Chittka, L., Niven, J. Are bigger brains better? Current Biology. 19 (21), R995-R1008 (2009).
- Takeda, K. Classical conditioned response in the honey bee. Journal of Insect Physiology. 6, 168-179 (1961).
- Bitterman, M. E., Menzel, R., Fietz, A., Schäfer, S. Classical conditioning of proboscis extension in honeybees (Apis mellifera). Journal of Comparative Psychology. 97 (2), 107-119 (1983).
- Menzel, R., Muller, U. Learning and memory in honeybees: from behavior to neural substrates. Annual Review of Neuroscience. 19 (1), 379-404 (1996).
- Hori, S., Takeuchi, H., Kubo, T. Associative learning and discrimination of motion cues in the harnessed honeybee Apis mellifera L. Journal of Comparative Physiology A. 193 (8), 825-833 (2007).
- Balamurali, G. S., Somanathan, H., De Ibarra, N. H. Motion cues improve the performance of harnessed bees in a colour learning task. Journal of Comparative Physiology A. 201 (5), 505-511 (2015).
- Mujagić, S., Würth, S. M., Hellbach, S., Dürr, V. Tactile conditioning and movement analysis of antennal sampling strategies in honey bees (Apis mellifera L). Journal of Visualized Experiments. (70), e50179 (2012).
- Wright, G., et al. Parallel reinforcement pathways for conditioned food aversions in the honeybee. Current Biology. 20 (24), 2234-2240 (2010).
- Vergoz, V., Roussel, E., Sandoz, J. C., Giurfa, M. Aversive learning in honeybees revealed by the olfactory conditioning of the sting extension reflex. PloS One. 2 (3), e288 (2007).
- Laloi, D., et al. Olfactory conditioning of the proboscis extension in bumble bees. Entomologia Experimentalis et Applicata. 90 (2), 123-129 (1999).
- Chabaud, M. A., Devaud, J. M., Pham-Delègue, M. H., Preat, T., Kaiser, L. Olfactory conditioning of proboscis activity in Drosophila melanogaster. Journal of Comparative Physiology A. 192 (12), 1335-1348 (2006).
- Simões, P., Ott, S. R., Niven, J. E. Associative olfactory learning in the desert locust, Schistocerca gregaria. Journal of Experimental Biology. 214 (15), 2495-2503 (2011).
- Guerrieri, F. J., d'Ettorre, P. Associative learning in ants: conditioning of the maxilla-labium extension response in Camponotus aethiops. Journal of Insect Physiology. 56 (1), 88-92 (2010).
- Simões, P. M., Niven, J. E., Ott, S. R. Phenotypic transformation affects associative learning in the desert locust. Current Biology. 23 (23), 2407-2412 (2013).
- Guerrieri, F. J., d'Ettorre, P., Devaud, J. M., Giurfa, M. Long-term olfactory memories are stabilised via protein synthesis in Camponotus fellah ants. Journal of Experimental Biology. 214 (19), 3300-3304 (2011).
- Fernandes, A. S. D., Buckley, C. L., Niven, J. E. Visual associative learning in wood ants. Journal of Experimental Biology. 221 (3), 173260 (2018).
- Christe, P., Oppliger, A., Bancala, F., Castella, G., Chapuisat, M. Evidence for collective medication in ants. Ecology Letters. 6 (1), 19-22 (2003).
- Aksoy, V., Camlitepe, Y. Behavioural analysis of chromatic and achromatic vision in the ant Formica cunicularia (Hymenoptera: Formicidae). Vision research. 67, 28-36 (2012).
- Bates, D. M. lme4: Mixed-Effects Modeling with R. , Springer. New York, NY. (2010).
- Sokal, R. R., Rohlf, F. J. Biometry (3rd edn). , W.H. Freman and Company. New York, NY. (1995).
- Bateson, M., Desire, S., Gartside, S. E., Wright, G. A. Agitated honeybees exhibit pessimistic cognitive biases. Current Biology. 21 (12), 1070-1073 (2011).
- Perl, C. D., Niven, J. E. Differential scaling within an insect compound eye. Biology letters. 12 (3), 20160042 (2016).
- Schwarz, S., Narendra, A., Zeil, J. The properties of the visual system in the Australian desert ant Melophorus bagoti. Arthropod Structure & Development. 40 (2), 128-134 (2011).
Tags
Comportement numéro 140 aides visuelles conditionnement d’appétence apprentissage mémoire MaLER Formica rufaErratum
Formal Correction: Erratum: Visual Classical Conditioning in Wood Ants
Posted by JoVE Editors on 12/31/1969.
Citeable Link.
An erratum was issued for: Visual Classical Conditioning in Wood Ants. The Acknowledgments section was updated, and a supplemental figure was added.
The Acknowledgments sections was updated from:
The authors thank Tom Collett and Cornelia Buehlmann for sharing valuable information regarding collection and maintenance of wood ant colonies. The authors also thank Justine Crevel for commenting on previous versions of this article.
to:
The authors thank Tom Collett and Cornelia Buehlmann for sharing information regarding collection and maintenance of wood ant colonies. The authors also thank Justine Crevel for commenting on previous versions of this article, and Nora Nevala for measuring the spectrum intensity of the visual stimulus. This work was supported by a BBSRC grant to JEN (grant number BB/R005036/1). All the data pertaining to this manuscript are published in the University of Sussex Research Data Repository online database (10.25377/sussex.5794386).
The following supplemental figure was added to the end of the Representative Results section:
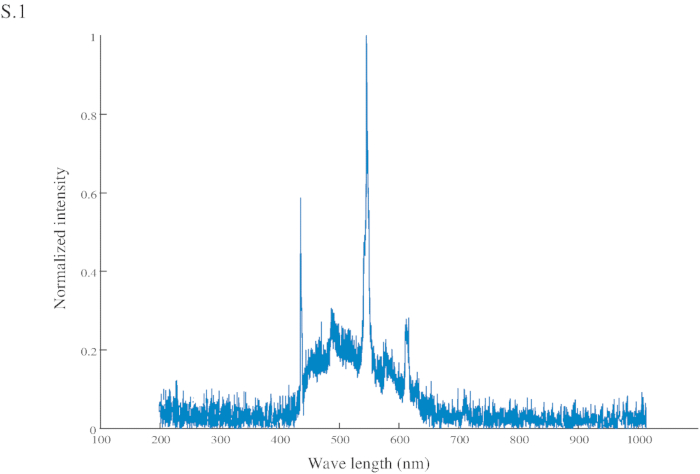
Figure S1: Normalized intensity of the conditional stimuli (CS). The CS has a peak intensity at 545 nm (in the green range) and another at 435 nm (in the blue range).



