Summary
电子顺磁共振 (epr) 光谱是一种明确的方法来测量自由基。使用选择性自旋探针可以检测不同细胞隔间中的自由基。我们提出了一个实用、有效的方法来收集生物样本, 方便处理、储存和转移用于 epr 测量的样品。
Abstract
准确、特异地检测不同细胞和组织间的活性氧 (ros) 是研究生物环境中氧化还原调节信号的关键。电子顺磁共振波谱 (epr) 是唯一明确评估自由基的直接方法。它的优点是, 它检测特定物种的生理水平具有较高的特异性, 但它确实需要专门的技术, 仔细的样品制备, 并适当的控制, 以确保准确的解释数据。循环羟胺自旋探针与超氧化物或其他自由基选择性地反应, 产生可通过 epr 光谱学量化的亚氧化物信号。细胞渗透性自旋探针和自旋探针设计在线粒体中快速积累允许测定不同细胞隔间中的超氧化物浓度。
在培养的细胞中, 使用细胞渗透性 1-羟基-3-甲氧基碳酸-2, 2, 5, 5-四甲基吡咯烷酮 (cmh) 以及和不具有细胞不透水超氧化物歧化酶 (sod) 预处理, 或使用细胞渗透性 peg-sod, 允许细胞外与细胞质超氧化物的分化。线粒体 1-羟基-4-[2-三苯基磷酰磷)-乙酰胺多]-2, 2, 6, 6-四甲基-哌啶, 1-羟基 2, 2, 6, 6-四甲基-4-[2-(三苯基磷磷) 乙酰胺]线粒体 ros (主要是超氧化物)。
自旋探针和 epr 光谱也可应用于体内模型。超氧化物可以检测到细胞外液体, 如血液和肺泡液, 以及组织, 如肺组织。提出了几种处理和储存组织进行 epr 测量的方法, 并在体内提供静脉注射 1-羟基-3-羧基 2, 2, 5, 5-四甲基吡咯烷酮 (cph) 自旋探针。虽然测量可以在室温下进行, 但从体外和体内模型中获得的样品也可以储存在-80°c, 并由 epr 在 77 k 进行分析。样品可以存储在稳定在-80°c 的专用管材中, 并在 77 k 下运行, 以实现实用、高效和可重复的方法, 从而便于存储和转移样品。
Introduction
虽然氧化应激和活性氧物种的测量对所有器官系统的各种疾病的研究都很重要, 但由于半衰期短、反应性高, 活性氧物种的检测具有挑战性。电子顺磁共振 (epr) 技术是检测自由基最明确的方法。与较常用的荧光探针相比, 旋转探针具有优势。虽然荧光探针相对便宜, 易于使用, 并提供快速, 灵敏的检测 ros, 他们确实有严重的局限性, 由于人工信号, 无法计算 ros 浓度, 以及普遍缺乏特异性 1.
为了便于 epr 用于生物研究, 合成了各种自旋探针, 可以测量一系列与生物相关的自由基物种以及po2、ph 值和氧化还原状态2,3, 4,5,6,7。自旋陷阱也被开发来捕获短命基和形成长寿的加合物, 这有利于检测 epr8。这两类 (自旋探针和自旋陷阱) 都有优点和局限性。一类常用的自旋探针是环状羟基胺, 它们是 epr 静音的, 与短命基反应, 形成稳定的亚硝基氧化物。环羟基胺与超氧化物的反应速度是自旋陷阱的 100倍, 使它们能够与细胞抗氧化剂竞争, 但它们缺乏特异性, 需要使用适当的控制和抑制剂来识别自由基的种类或来源负责亚硝基氧化物信号。虽然自旋陷阱表现出特异性, 根据被困物种的不同, 它们具有明显的光谱模式, 但它们具有超氧化物自旋诱捕的缓慢动力学, 并且容易对自由基加合物进行生物降解。自旋诱捕的应用在生物医学研究中有据可查,9、10、11、12、13.
该项目的目的是演示设计实验和准备样品的实用 epr 方法, 以便在不同的细胞隔间和体内不同的组织隔间中使用自旋探针检测超氧化物。一些手稿公布了与这些目标相关的协议, 使用细胞渗透性、细胞不渗透和线粒体靶向自旋探针, 针对不同的细胞隔间进行体外观察, 并处理组织, 以便在小鼠模型中进行分析14,15. 我们在这一文献的基础上, 验证了一种方法, 利用 1-羟基-3-甲氧基碳基 2, 2, 5, 5-四甲基吡咯烷酮 (cmh) 自旋探针在不同的细胞隔间在体外测量超氧化物, 以确保准确测量, 突出可能会扭曲结果的潜在技术问题。我们还提供了使用 cmh 自旋探针在血液、支气管肺泡灌洗液和肺组织中进行 epr 测量的方法。这些研究比较了处理组织的不同方法, 并提出了一种在收获组织之前将另一个自旋探针 cph 注入小鼠体内的方法。最后, 我们开发了一种实用的方法来储存样品在聚四氟乙烯 (ptfe) 油管, 允许存储和转移样品之前 epr 测量在 77 k。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
所有动物研究都得到了科罗拉多大学丹佛机构动物护理和使用委员会的批准。
1. 试剂的制备
-
二乙基氨基苯乙酸 (dtpa) 库存 (150 mm)
- 在去离子水中加入2.95 克 dtpa (393.35 g/mol)。
- 要溶解 dtpa, 滴注添加 1 m naoh, 并使 ph 值为7.0。
- 将体积带至50毫升, 水最终 dtpa 浓度为 150 mm, 并存放在4°c。
-
磷酸盐缓冲碱 (pbs) (50 mm, ph 7.4)
- 制备 5 m 氯化钠 (氯化钠) (58.44 g/mol; 29.22 g/100 ml)。
- 制备 1 m 磷酸二钾二基 hk 2 po4 (174.18 g/mol; 17.42 g/100 毫升)
- 制备 1 m 磷酸钾单氮 kh 2 po4 (136.1 g/mol; 13.61 g/100 ml).将5m 氯化钠与 1 m 磷酸二钾的 4.24 ml 和 1 m 磷酸钾的 0.760 ml 混合。检查 ph 值。
- 用去离子水将体积提高到100毫升。
- 在室温 (rt) 下短期 (天) 和4°c 下存放, 进行长期 (周) 储存。
-
含有 100μm dtpa 的 krebs-henseleit 缓冲液 (khb)
- 在50毫升锥形离心管中, 加入33.3 微米的 150 mm dtpa 库存溶液。
- 使用克瑞克-亨塞利特缓冲 (khb) 将交易量增加到50毫升。
- 每天用 dtpa 准备新鲜的缓冲液, 并将其保存在 rt。
-
含有蔗糖的 tris-edta 缓冲液
- 制备 0.5 m tris 库存: 在150毫升的去离子水中溶解 15.14 g tris 基座 (121.14 g/mol)。使用 hcl, 将 ph 值调整到 7.8, 并使最终体积达到250毫升。
- 在150毫升去离子水中溶解21.4 克蔗糖 (342.29 g/mol; 最终浓度 = 0.25 mm)。
- 添加5毫升的 tris 股票蔗糖, 以实现 10 mm 的最终 tris 浓度。
- 在酸蔗糖中加入 0.5 medta 股票 0.5 ml, 以达到 1 mm 的最终浓度。
- 检查 ph 值并将其调整为7.4。
- 使用去离子水将最终体积达到250毫升, 并在4°c 下储存。
-
牛红细胞铜锌超氧化物歧化酶 (sod) 库存 (30, 000 u ml)
- 在 pbs 的1毫升中重新构建 30, 000 u 的 sod (约5.7 毫克, 取决于 sod 批次的活性)。
- 混合良好, 脂肪, 并存储在-20°c 短期 (6-12) 和-80°c 长期存储。
-
sod 工作解决方案 (1000 uml)
- 将 30, 000 uml sod 库存的 30μl aliquot 转移到870μl 无菌 pbs 中。
- 将溶液放在冰上, 并使用新鲜。
-
phorbol 12-myristate 13-乙酸 (pma) 库存 (5 mm)
- 在325μl 的 dmso (最终浓度 = 5 mm) 中溶解1毫克 pma (616.83 g/mol)。
- 倾斜一个 5 mm pma 溶液, 并将其存储在-20°c。
-
pma 工作解决方案 (125μm)
- 将 5mm pma 库存的 10μl aliquot 稀释为39μl 无菌 pbs。
- 将溶液放在冰上, 并使用新鲜。
- 对于 pma 的车辆控制, 请在390μl 的 pbs 中使用10μl 的 dmso。
-
二苯二氧基氯化物 (dip) (2.5 mm)
- 在4毫升中溶解3.2 毫克 dip (166.57 g/mol), 以获得 2.5 mm 的库存。
- 准备解决方案, 并使用它新鲜。
-
甲磺酸脱沙胺盐 (dfo) (20 mm)
- 在340μl 中溶解4.5 毫克 dfo (656.79 g/mol), 得到 20 mm 的库存。
- 准备解决方案, 并使用它新鲜。
-
抗霉素 a (aa) 库存的制备 (5 mm)
- 在乙醇2毫升 (最终浓度 = 5 mm) 中溶解5.4 毫克 aa (532 g/mol)。
- 将库存用玻璃瓶中, 存放在-20°c。
-
自旋探针的制备
- 用氮气泡含有 100μm dtpa 的 50 mm 磷酸盐缓冲液 30分钟, 从缓冲液中去除溶解氧。
- 从-20°c 的冰柜中取出旋转探头, 并允许容器进入 rt (10-15)。
- 称重2.4 毫克的 1-羟基-3-甲氧基碳基 2, 2, 5, 5-四甲基吡咯烷酮·hcl (cmh) (237.8 g/mol)
- 将 cmh 溶解到脱氧磷酸盐缓冲液的1毫升中, 最终浓度为 10 mm。
- 称重5毫克的 1-羟基-4-[2-三苯基磷磷)-乙酰胺多]-2, 2, 6, 6-四甲基哌啶, 1-羟基 2, 2, 6, 6-四甲基-4-[2-(三苯基磷磷) 乙酰胺] 二氯吡啶 (mito-tempo-h) (529.1 g/mol)。
- 将线粒体-tempo-h 溶解到脱氧磷酸盐缓冲液的1毫升中, 最终浓度为 9.5 mm。
- 重量4.9 毫克的 1-羟基-3-羧 2, 2, 5, 5-四甲基吡咯烷酮·hcl (cph) (223.7 g/mol)。
- 将 cph 溶解到脱氧磷酸盐缓冲液的1毫升中, 最终浓度为 22 mm。
- 在-80°c 下进行倾斜和储存 (不建议采用冻融)。
2. 超氧化物的体外检测
-
rt pma 刺激的 raw 264.7 细胞中总超氧化物的检测
- 遵循适当的无菌技术, 在二氧化碳孵化器中, 用10% 的 fbs (低内毒素) 和1% 的抗甲肽/安匹西林在37°c 的情况下将其解冻, 并在dmem培养基中通过。
- 在治疗前一天将种子 raw 264.7 细胞在 1 x10 6 细胞/中, 进入6孔板。
- 轻轻去除培养基, 用1毫升的 khb 缓冲液清洗一次细胞。
- 在每口井中加入含有 100μm dtpa 的 khb, 并以下列方法处理总体积为 500μl:
- 对于经 sod 预处理的井, 加入15μl/井的 sod 工作溶液 (1000 uml; 最终浓度的 sod = 30 u/ml), 在37°c 孵育10分钟后加入 cmh 和 pma。
- 加入 12.5μl/井 10 mm cmh 库存 (最终浓度 = 0.25 mm)。
- 加入 40μm pma 工作溶液 (最终浓度 = 10μm) 或40μl 车 (库存 10μl dmso 在390微米 pbs 中)。
- 在37°c 下, 在 co2 孵化器中孵育 50分钟 。
- 从孵化器中取出这些盘子, 并立即将其放置在冰上。
- 收集缓冲从每个井在单独的, 1.5 ml, 标记管。一直在冰上。
- 加入含有 100μm dtpa 的100微米新鲜 khb 缓冲液, 轻轻刮刮细胞, 并通过多次上下移液重新悬浮。在整个细胞再悬浮过程中保持在冰上。
- 按步骤加载收集的样品 2.1.10, 并在每个毛细管中 2.1.11 (50μl)。密封两端并运行 epr。
注: 始终测试在缓冲液中含有探针的管或井 (无细胞) (相同浓度 = 0.25 mm), 在与对照相同的条件下处理 (相同的培养时间和温度), 因为探针的背景强度是温度的。和时间相关。 - 将 epr 采集参数设置为以下内容: 微波频率 = 9.65 ghz;中心场 = 3432 g;调制幅度 = 2.0 g;扫描宽度 = 80 g;微波功率 = 19.9 mw;扫描总数 = 10;扫描时间 = 12.11秒;时间常数 = 20.48 毫秒。
-
原264.7 细胞线粒体超氧化物的检测
- 在实验前一天按照步骤2.1.1 和2.1.2 将 raw 264.7 细胞播种。
- 取出培养基, 用1毫升的 khb 缓冲液清洗细胞一次。
- 在每口井加入含有 100μm dtpa 的 200μl khb。
- 加入5.3μl/井 9.5 mm-tempo-h 库存 (最终浓度 = 0.25 mm)
- 在 rt 孵化10分钟。
- 在乙醇中加入1μl/井, 在乙醇中加入5mm 的库存溶液 (最终浓度 = 25μm)。
- 在37°c 下, 在 co2 孵化器中孵育 50分钟 。
- 从孵化器中取出这些盘子, 并立即将其放置在冰上。
- 轻轻刮细胞, 通过上下移液重新暂停。继续冰上。
- 将样品装入毛细管。密封两端。
- 有关 epr 设置, 请参阅上一节。
-
在 77 k 的 raw 264.7 细胞中检测超氧化物
- 将1.1.10 的步骤中收集的缓冲液放入事先准备好的 ptfe 管材中1-2 英寸长 ("od x" id)。确保 ptfe 管材是直的, 以便它可以很容易地插入和从手指脱手。使用橡胶塞子关闭 ptfe 管的一端, 将缓冲器或电池悬架 (100 至 150μl) 移液器插入 ptfe 管材, 并用第二塞子密封管。
- 闪存将样品冻结在液氮中。样品可以转移到贴有标签的冷冻保存管, 在-80°c 下储存或立即运行。
- 用液氮填充手指, 并将含有样品的 ptfe 管插入手指除战中。确保样品以谐振器的活动空间为中心, 并以 77 k 的速度运行 epr。
注: 在测量前15-30 启动氮气流向光谱仪, 并在整个测量过程中继续这种流动, 以防止谐振器中的水凝结。 - 将 epr 采集参数设置为以下内容: 微波频率 = 9.65 ghz;中心场 = 3438 g;调制幅度 = 4.0 g;扫描宽度 = 150 g;微波功率 = 0.316 mw;扫描总数 = 10;扫描时间 = 60秒;和时间常数 = 1.28 ms。
3. 流体中的 epr 测量
-
全血
- 治疗小鼠 (8-12) 的单剂量气管内白霉素 (bleo; 100μl 在 1 uml) 溶解在 pbs 或 pbs 单独如前面所述的 16,17。
- 通过吸入异氟醚 (1.5-4%) 使小鼠安乐死, 然后进行失血过多和宫颈脱位。将血液通过右心室吸入涂有肝素 (1000 usp/ml) 的注射器, 其中含有 100μm dtpa, 并转移到 1.5 ml 管中。
- 在单独的 1.5 ml 管中, 将含有 100μm dtpa 和 3μl cmh (10 mm) 的 pbs 添加到132μl 血液中, 总体积为 150μl, 最终 cmh 浓度为 0.2 mm。
- 在37°c 的水浴中培养血液10分钟。
- 从水浴中取出管子。
- 在毛细管中加血, 并在 rt 运行 epr, 并具有以下 epr 采集参数: 微波频率 = 9.65 ghz;中心场 = 3432 g;调制幅度 = 1.0 g;扫描宽度 = 80 g;微波功率 = 19.9 mw;扫描总数 = 3;扫描时间 = 12.11秒;或者, 对于 77 k. epr 采集参数的测量, 可以按照步骤2.3 所述的方法对样品进行闪光冻结: 微波频率 = 9.65 ghz;中心场 = 3438 g;调制幅度 = 4.0 g;扫描宽度 = 150 g;微波功率 = 0.316 mw;扫描总数 = 2;扫描时间 = 60秒;和时间常数 = 1.28 ms。
-
支气管肺泡灌洗液 (balf)
- 安乐死后 (见步骤 3.1.2),通过放置在气管中的插管, 在注射器中三次在注射器中缓慢注入和取出含有 100μm dtpa 的1毫升 pbs, 以收集 balf。
- 在 1.5 ml 管中, 用4μl 的 cmh (10 mm) 处理200μl 的 balf, 以获得 0.2 mm 的最终浓度。
- 在37°c 的水浴中培养 balf 50分钟。
- 把管子从水浴中取出, 放在冰上。
- 将 balf 装入毛细管, 并在 rt 运行 epr, 其 epr 设置与步骤1.1.13 中使用的 epr 相同, 或如步骤2.3 中所述的液氮闪存。
-
血液和 balf 中的 epr 测量值为 77 k
- 按照上面的协议收集血液 (步骤 3.1.1 3.1.4) 和 balf (步骤 3.2.1 3.2.4)。
- 将经过治疗的血液或 balf 的150μl 放入 ptfe 导管 (1-2 英寸) 中。在添加样品之前, 使用橡胶塞子关闭 ptfe 管材的一端, 并使用另一个塞子密封管材。
- 闪存将样品冻结在液氮中。
- 有关在滤过聚四氟乙烯管材中使用手指 dewar 在 77-k. run 冷冻 cmh 处理血液样品的情况, 请参见第2.3 节。
4. 肺组织 epr 测量
-
闪光冷冻肺组织
- 在3.2.1 步步收集了 balf 后, 胸部被打开, 肺部通过右心室用10毫升的冷 pbs 冲洗, 以去除血液。闪光冻结液氮中的肺组织。冷冻肺组织可在-80°c 下保存长达 6个月, 直到用于 epr 测量。
- 用推拿器稳定干冰上的肺组织, 用单刃刀片切割多个小块 (5-15 毫克) 的肺组织。
- 在 1.5 ml 管中称量组织, 将管放在刻度上并调整刻度, 然后添加组织块并记录重量。
- 在 1.5 ml 管的组织中, 加入196μl 含有 dtpa 的 khb 和4μl 的 cmh (0.2 mm), 以达到200μl 的总体积。
- 在37°c 的水浴中孵化1小时。
- 在 3, 884 x g 的微型离心机中向下旋转 (几秒钟)。
- 按照第2.3 节所述, 将上清液的顶纳剂放置在冰上和移液器 150μl, 并冻结 77 k 测量。
注: 对于这种方法, 需要考虑损伤的异质性。对于博莱霉素引起的肺损伤, 考虑到这是一种高度异质性的损伤, 建议从每只小鼠身上从肺的不同部位切割几个组织块。或者, 可以在含有 100μm dtpa 的 khb 缓冲液中, 以1:6 的重量与体积比 (mgμμl) 同质化较大的组织, 如下所述。
-
蔗糖缓冲液中保存的新鲜肺组织
- 用冷 pbs 冲洗灌洗的肺部, 以去除3.1.2 步调一致的血液。
- 使用带有玻璃或 ptfe 针的 d脾脏组织磨床, 将含有 0.25 m 蔗糖的 Tris-EDTA 缓冲液中的新鲜肺组织与 1:1 lug/p驻地 (mg/μl) 的比率进行同质化。
- 将50μl 的肺均质添加到含有 100μm dtpa 的 khb 的450μl 中。
- 在 1.5 ml 管 (总体积为 100μl) 中, 在 khb 中加入98μl 的肺均质, 加入10mm 库存的 2μl cmh, 最终浓度为 0.2 mm。
- 在水浴中沐浴 20分钟37°c。
- 将样品放在冰上, 装入毛细管。在 rt 运行 epr (步骤2.1.13 中使用的设置)。
- 为了测试使用不同抑制剂的特定种类和来源的贡献, 预处理88μl 的肺均质 +/抑制剂, 用 khb 进行调整, 以达到98μl 的最终体积。在本实验中, 抑制剂包括10μl 的 sod (100 u/ml)、4μl 的去氧胺 (dfo; 最终浓度 = 800μm) 或4μl 的氯化二苯并溴二苯二酮 (dip; 最终浓度 = 100μm)。在37°c 的水浴中孵化20分钟。
- 加入2μl 的 cmh, 在37°c 下再孵育 20分钟, 然后进行上述 epr 测量。包括一次性匹配的空白样品与 cmh khb 含有蔗糖缓冲液。或者, 将剩余的肺均质 (步骤 3.1.2) 的等价物存储在-80°c, 以便将来测量。
注: 总体积可根据需要缩放。
-
体内注射自旋探针小鼠肺组织的epr 测量 (在 rt 使用组织细胞)
- 在过滤脱氧的 50 mm 磷酸盐缓冲液中溶解4.9 毫克的 cph, 制备 cph 库存溶液。
- 用吸入异氟醚 (1.5-4%) 对小鼠进行20-30 的麻醉, 直到对脚趾夹紧没有反应。用100μl 的 cph 自旋探针通过后轨道路线注入小鼠25克小鼠体重 (最终剂量 = 20mg/2 kg), 并允许探针立即循环 1小时. 在眼眶注射后, 在眼睛区域上加入0.5% 的丙拉卡因 hcl, 以准备不是眼睛疼痛和干燥。监测小鼠 1小时, 并进行组织采集。
- 如上面所述, 采集肺组织, 并使肺部出现闪光冻结。
- 在干冰上切20-30 毫克的冷冻组织, 并记录确切的重量。
- 用清洁湿巾轻轻擦拭纸巾, 以吸收任何地表水。
- 将组织放置在组织细胞的窗口内 (附件允许组织样本的 epr 测量), 并运行 epr 以确定总旋转。这些数据可以表示为每毫克组织的总旋转。
5. 数据分析
- 使用在台式 emxnano epr 光谱仪的 xenon 软件中集成的 spinfit 模块模拟 epr 光谱。通过自旋计数模块确定硝基苯的浓度。或者, 可以制作稳定的亚氮氧化物的校准曲线, 如 4-羟基 tempo 或 tempol, 并通过将信号强度与样品和标准进行比较来获得浓度。
- 对于在 77 k 处收集的数据, 请使用双积分, 然后使用 spincount。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
利用 x/xo 超氧化物生成系统验证了 cmh 的超氧化物检测, 证明 sod 完全抑制了亚氧化物(cm) 信号, 而过氧化氢酶无效应 (图 1a)。然后用细胞渗透 cmh 自旋探针 +/-sod 预处理培养细胞, 在 raw 264.7 细胞中对细胞外超氧化物进行评价。在细胞悬浮液和缓冲液中都测定了硝基氧化物浓度, 这表明由于自旋探针的渗透性和快速平衡性, 这两种样品类型的值相似 (图 1b)。与对照细胞相比, 在 pma 刺激的 raw 264.7 细胞中, 硝基氧化物自由基信号增加。在预处理细胞不渗透 sod 的细胞中, 该信号明显衰减 (图 1c)。每种颜色都代表在不同日期测试的井, 显示了在特定日期收集的数据的一致性和结果在不同时间内的重现性。在无 sod (t) 的情况下, 通过从 pma (t) 后的信号中减去经 sod 预处理的 pma 细胞中的信号来测定细胞外超氧化物的浓度。其余信号归因于细胞内超氧化物 (图 1c)。图 1d显示了总超氧化物和细胞外超氧化物的计算。(e) 在去除培养基后, 通过 peg-sod 对信号的影响, 在 pma 处理的细胞中确认了细胞内信号。在此图中, 与 (c) 不同的是, 没有从测量中减去 cmh 空白, 并显示原始数据。
利用 epr 自旋探针丝裂-tempo-h 在丝裂组织中积累, 检测到原氧化锆细胞中的线粒体超氧化物。(a) 在缓冲液中的基线线粒体-tempo-h 信号的代表性 epr 光谱, 控制细胞中的线粒体-tempo-h 信号增加, 以及线粒体抑制剂抗痛 a (aa) 刺激的细胞中信号的进一步增强。信号的增加归因于线粒体超氧化物的原因, 我们以前的研究表明, sod2 过度表达显著降低了有丝分裂-tempo-h10的测量。在图2b 中, 线粒体亚硝基化氧化物浓度是通过从细胞测量中减去时间匹配缓冲液中的线粒体 tempo-h 信号来确定的。在 sod 存在和不存在的情况下, 用 pma 刺激 raw 264.7 细胞在低温下获得的 cm 信号.(图 3 a)在 sod 存在的情况下, cm 信号被衰减, 这与室温数据一致 (图 1).图 3b显示了聚四氟乙烯管材的照片, 其塞子用于收集细胞和体内样品的 77 k 数据。利用 cmh 自旋探针检测到血液和 balf 中的超氧化物产生。从 pbs 和 b主义处理的小鼠身上采集血液或 balf 样本, 并用 cmh 立即孵育。样品被转移到聚四氟乙烯管和闪光冻结, epr 数据收集在 77 k。在37度的血液中积累的硝基氧化物 (cm.) 浓度为 37度, 时间为 10分钟 (图 4a)。来自 balf 孵育50分钟的硝基氧化物 (cm) 浓度 (图 4b)。硝基氧化物浓度表示实验中使用的血液量或balf 中积累的 (cm.) 浓度。
三种方法已被测试, 以评估几种已公布的技术组织保存和管理的自旋探针与体内。在体内.为了对肺组织进行 epr 测量, 我们首先使用了来自控制小鼠或受伤小鼠的闪光冷冻肺组织。图 5a显示了 pbs治疗小鼠在 37°c cmh 孵育的一小块肺组织的上清液中的总 cm 信号。由于除过血后肺损伤的异质性, 建议从肺的不同区域切割碎片, 并平均进行几次测量, 以提供更具代表性的值。或者, 你可以同质整个肺, 并使用这种同质的一个样本。使用聚四氟乙烯管材和手指 dewar 在 77 k 处收集的数据。图 5b分别显示了 pbs 和 broo 处理小鼠的亚硝基氧化物 (cm) 信号的代表性光谱。
对体内治疗肺组织的一个限制是, 由于对破坏细胞膜的组织进行处理, 无法可靠地区分细胞外超氧化物。如果这些信息对实验问题很重要, 可以使用下面描述的体内cph 注入方法来解决。冷冻组织不能用来评估线粒体超氧化物;不过, 对于这种测量, 该协议可以适应在组织或新鲜分离的线粒体中使用线粒体。
作为肺组织 epr 测量的第二种方法, 在蔗糖缓冲液中进行了新鲜组织的均质。用 cmh 探针在含有 dtpa 的 khb 缓冲液中培养肺均质。在 rt 上进行了 epr 测量,图 6a显示了 cm 的增加.和布莱奥在一起我们提出了一个额外的测试使用不同的抑制剂, 可以用来确定物种, 有助于 cm.信号。为了阐明肺组织产生的 cm 信号的来源, 我们用几种清除剂和酶抑制剂对肺均质进行了预处理。在没有或存在 sod、脱氧胺 (dfo) 和二苯二氧二钠 (dip) 的情况下, 用 cmh 孵育肺均质物, 分别负责含有黄素的超氧化物、铁或超氧化物的贡献酶 (图 6b)。这种方法可以用来评估系统中产生的特定自由基物种, 或阐明其他酶来源 (如nox、enos 或黄素氧化酶) 的贡献。
通过眼眶后路径注射 cph 自旋探针 (20 mg/2 称) , 在体内进行 epr 测量。目前尚不清楚 cmh 是否可以安全地给动物服用, 而 cph 探针已被报道为无毒;因此, 我们选择 cph 进行体内实验。在 cph 探针循环1小时后, 在液氮中采集肺组织并使其冻结。小鼠可以同时用特定的抗氧化剂进行治疗, 以区分负责信号的物种。图 7a显示了较高的 cp.与对照小鼠相比, 在经过自爆处理的小鼠中的信号。图 7b显示了对照和经出血处理的小鼠肺组织的代表性光谱。cp 的混合 epr 光谱.并观察到抗坏血酸自由基。图 7a中报告的值是 cp 的浓度.组件。数据是在 rt 使用组织细胞收集的。
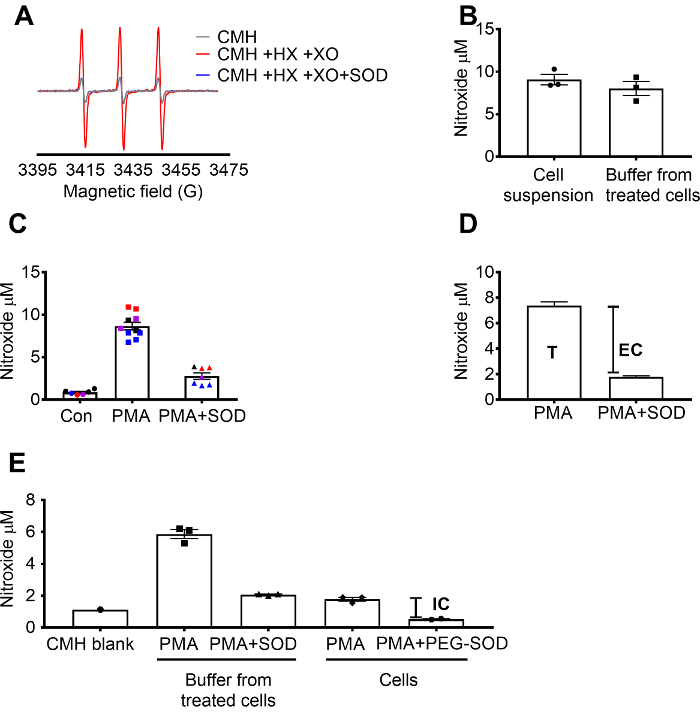
图 1: 检测不同电池隔间中的超氧化物.(a) 在 0.5 mm 下黄嘌呤/黄嘌呤氧化酶 (8 mum/ml) 中生成 0.25 mm cmh 的 epr 谱, 并伴有和不含有 sod (30 u ml)。(b) raw 264.7 细胞 (1 x10 6 cellsms well) 在37°c 时 cmh 存在 50分钟, 在细胞悬浮液 (细胞 + 缓冲液) 和从处理过的细胞中收集的缓冲液中检测到硝基氧化物浓度 (μm), 用 10μm pma 刺激50分钟。(c) raw 264.7 细胞受到 pma与pma 的刺激。车辆控制 (con)。用 30 uml 细胞不透水 sod (pma + sod) 对一组细胞进行了10分钟的预处理。每种颜色表示来自不同实验天的数据, 每一点代表来自单个井的细胞。从每个信号中减去了 khb 中与 cmh 时间匹配的空白中的硝基氧化物信号, 以获得最终值。(d) pma 刺激细胞中总超氧化物和细胞外超氧化物的计算;t = 总超氧化物, ec = 细胞外超氧化物 (sod 抑制信号)。(e) 为了评价细胞内超氧化物信号 (ic), 将 pma + sod 后缓冲液中的信号与去除缓冲液后的 pma 处理单元进行了比较。为证实, 采用 60 umml 细胞渗透聚乙二醇预处理1.5 小时, 测定细胞内 sod 的抑制作用。显示了时间匹配的 cmh 空白, 数据反映了绝对亚硝基氧化物信号。以平均± sem 表示的数据. 请点击这里查看此图的较大版本.

图 2: 抗霉素 a 刺激的 raw 细胞线粒体超氧化物的检测.线粒体特异性 epr 自旋探针的代表性光谱, 在 raw 264.7 细胞中的 0.25 mm 线粒体-tempo-h, 或用25μm 抗霉素 a (aa) 在37°c 下50分钟。(b) 与对照相比, aa 处理的细胞中 cm. 浓度 (μm)。从总信号中减去时间匹配的米托-tempo-h 空白中的亚硝基氧化物信号, 以获得最终值。以平均± sem 表示的数据. 请点击这里查看此图的较大版本.

图 3: 在77k 的 raw 264.7 细胞中检测超氧化物。(a) raw 264.7 细胞受 10μm pma 和 epr 自旋探针刺激, cmh 0.25 mm (37°c 时 50分钟), 带 (黑色) 或不带 30 uml sod 的预处理 (红色)。100μl 的上清液被装入1英寸长的聚四氟乙烯管材中, 然后在液氮中闪烁冻结。塞子被取出, 冷冻聚四氟乙烯管被放置在手指上, 用于数据采集, 时间为 77 k. (b) 聚四氟乙烯管材和塞子的照片。请点击这里查看此图的较大版本.

图 4: 对照和博莱霉素处理小鼠血液和 balf 中 epr 的测量.用单剂量的气管内波莱霉素 (it bleo) (100μl at 1 uml) 或 pbs 载体对小鼠进行治疗。7天时, 老鼠被麻醉并安乐死。通过右心室穿刺将血液收集到一个涂有 USP/mL 肝素的注射器中, 其中含有 100μm dtpa。在 pbs 中, 用 100μm dtpa 的1毫升对肺部进行灌洗, 收集支气管肺泡灌洗液 (balf)。血液和 balf 分别孵育10分钟或 50分钟, 在37°c 时以 0.2 mm cmh 孵育。150μl 的血液或 balf 被装载在聚四氟乙烯管子闪光冻结在液氮和 epr 数据收集在 77 k 使用手指 dewar。数据显示, pbs 和 balof 中的硝基氧化物浓度来自 pbs 和 balf 处理的小鼠 (n = 4-6)。数据以平均±sem (c) 在 pbs 和出血处理小鼠血液中的代表谱表示。请点击这里查看此图的较大版本.

图 5: 闪光冷冻肺组织中的 epr 测量.用单剂量的气管内波莱霉素 (it bleo) (100μl at 1 u/ml) 或 pbs 载体对小鼠进行治疗。7天时, 肺部用冷 pbs 冲洗, 以去除血液和在液氮中冻结的闪光。在 khb 中用 0.2 mm cmm cmh 孵育5-15 毫克的闪冷冻肺组织, 在37°c 下收集并放置在 ptfe 管中, 在手指 dewar 中以 77 k 的速度运行。(a) 硝基苯胺浓度 (亚硝基氧化物的μm 归一化为1毫克的组织)。数据代表每个肺2-3 次测量的平均值。数据以平均±sem (b) 在 pbs 和出血处理小鼠肺组织中的代表谱表示。请点击这里查看此图的较大版本.

图 6: 保存在蔗糖缓冲液中的肺组织 epr 测量.用单剂气管内波莱霉素 (1 uml 时 100μl) 对小鼠进行治疗。治疗后 7天, 用冷 pbs 冲洗肺部以止血, 新鲜肺组织在含有 0.25 mm 蔗糖的 Tris-EDTA 缓冲液中均匀化, 比例为 1: 6 肺重量缓冲液体积 (mg/μl)。在37°c 条件下, 用 khb 预培养 50μl, 并在37°c 下使用或不使用以下抑制剂 20分钟: sod (100 u/ml)、脱氧胺 (dfo; 800μm) 和二苯二氧基氯化铵 (dip; 100μm), 然后在 khb 中用 0.2 mm cmh 孵育, 含有 100μm dtpa在37°c 下使用20分钟。数据是在 rt 中使用 epr 毛细管获得的。(a) pbs 和 b《白鼠》处理的小鼠肺部中的硝基氧化物浓度。(b) 在没有或存在抑制剂 (nact3) 的情况下, 在布里奥肺部中使用硝基氧化物浓度。以平均± sem 表示的数据. 请点击这里查看此图的较大版本.

图7:epr 测量注射 cph 自旋探针的小鼠肺组织.通过眼眶后注射给出100μl 的 cph, 最终浓度为每公斤体重20毫克。循环1小时后, 小鼠被安乐死,肺部经右心室用10毫升的冷 pbs 冲洗, 肺组织被闪光冻结。20至30毫克的肺组织被放置在组织细胞和 epr 测量在 rt. (a) 数据表示为 spins/mg. (b) 在 pbs 和 bleo 肺组织中的亚硝基氧化物信号的代表性光谱 (* 表示与抗坏血酸自由基重叠)。以平均± sem 表示的数据. 请点击这里查看此图的较大版本.
| 抑制剂 | 物种 |
| 超氧化物歧化酶 (sod) | 细胞外超氧化物 |
| 超氧化物歧化酶-聚乙二醇 (peg-sod) | 细胞内超氧化物 |
| 过氧化氢 酶 | 过氧化氢基自由基 |
| 尿酸 | 硝酸过氧化物 |
| 乙醇和 dmso | 羟基自由基 |
| 金属螯合剂 | 金属离子 (铁和铜) |
表1。用于区分负责自旋探针氧化的物种的常见抑制剂。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
对生物环境中自由基产生的评估对于了解氧化还原调节的健康和疾病信号很重要, 但由于自由基物种和技术物种的半衰期很短, 这些物种的测量极具挑战性常用方法的限制。epr 是氧化还原生物学中一个有价值和强大的工具, 因为它是检测自由基的唯一明确的方法。在本项目中, 我们演示了设计实验和准备样品的实际 epr 方法, 以便在不同的细胞隔间和体内不同的组织隔间中使用自旋探针检测 ros.我们还提供了处理生物样品和存储样品的实用方法, 以提高效率。
自旋探针与 ros 有效反应, 并产生稳定的硝基氧化物自由基, 可通过 epr 检测。合成了几种具有不同渗透率特性的自旋探针 (环羟胺) 衍生物, 使其适用于检测不同细胞间的自由基产生 10.该协议利用了细胞渗透自旋探针 cmh;但不透水自旋探针 1-羟基 2, 2, 6, 6-四甲基哌啶-4-烷基三甲基氯化铵 (cat1h) 可用于检测细胞外超氧化物。类似于我们之前对人类淋巴细胞细胞系18的研究, 我们能够验证使用渗透性 cmh 自旋探针与不透水的 sod 和细胞渗透性 peg-sod 在 raw264.7 细胞 (小鼠肺巨噬细胞系) 刺激 pma区分细胞外超氧化物和细胞内超氧化物。
我们还验证了细胞内和细胞外隔间之间 cmh 的快速平衡, 我们还发现, 细胞中的超氧化物信号在用 khb 只清洗细胞一次后明显下降 (数据未显示)。我们证实了线粒体特异性自旋探针线粒体 tempo-h 在 raw 264.7 细胞中的作用, 以测量线粒体电子转运链抑制剂抗霉素 a 刺激刺激刺激后产生的线粒体超氧化物的增加。线粒体超氧化物的产生对线粒体 tempo-h 的具体贡献已经得到了证实, 并可在使用分离的新鲜线粒体或线粒体超氧化物歧化酶 mnsod (sod2) 系统的实验中得到验证过度表达10。
对体内ros 生产的评估特别具有挑战性, 但在询问氧化应激或氧化还原调控信号在生物学中的作用时, 检测特定 ros 产生的能力提供了重要信息设置。在使用自旋探针和 epr 时对组织进行适当的处理对于产生可重现和有意义的结果至关重要。使用带有组织的自旋探针不可能测量组织收获时由于半衰期较短而存在的超氧化物自由基, 而是检测 napdh 氧化酶、未耦合的一氧化氮合酶等酶产生的超氧化物当肺组织或均质体在37°c 与自旋探针孵育时, 或黄氨酸氧化酶。冷冻组织的使用将不包括线粒体产生的超氧化物, 因为冷冻会损害线粒体电子转运链的活性。为了测试线粒体超氧化物, 研究人员需要分离新鲜线粒体或在体内或在新鲜组织中使用线粒体特异性探针。
文献14、15 发表了几种不同的保存组织的方案。我们比较了三种已公布的肺组织 epr 测量方法: 1) 液氮中的闪光冷冻组织, 2) 蔗糖缓冲液中的均质组织, 3) 在组织采集前1小时用自旋探针在体内处理小鼠。我们比较了控制小鼠与博莱霉素引起的严重肺部炎症和氧化应激小鼠, 以测试每种方法在受伤肺部显示氮氧化物信号一致差异的能力。这三种方法都显示, 在博莱霉素治疗的小鼠肺部, 亚硝基氧化物信号也有类似的相对增加。使用闪光冷冻组织可能是收集大多数实验室组织的最简单的方法, 这就不需要在收获时处理蔗糖缓冲液中的组织。注射 cph 在体内捕获自由基是强大的, 但要确认特定的物种, 这需要一个治疗小组, 包括适当的抗氧化剂。
使用自旋探针的一个挑战是, 自旋探针氧化氮氧化物产生类似的三线 epr 谱, 而不考虑导致氧化的物种;因此, 它不区分不同的 ros 种类。另外, 据报道, 有可能反应的羟胺探针与光合电子运输链和细胞色素 c 氧化酶 19,20。在解释结果时应考虑到这些意见。在该协议中, 光合系统不存在, 将 dtpa 与缓冲液结合在一起, 可抑制游离铁和铜离子 10的潜在污染。我们演示了如何在肺组织中使用一系列特定的酶或螯合剂来确定特定 ros 或酶抑制剂对确定 ros 来源的贡献。以前在 epr中使用过这种方法来确定 ros 由于不耦合的 enos 13,15的贡献。我们提供了一个常用抑制剂的列表, 用于区分负责自旋探针氧化的物种 (表 1)。
我们还证明了优化每个实验条件的培养时间的重要性。在比较自旋探针与自旋陷阱时, 自旋陷阱会产生独特的光谱, 这取决于反应物, 从而允许自由基物种的特异性;然而, 它们也表现出超氧化物自旋诱捕的缓慢动力学, 并且容易发生生物降解。在体内使用 epr 探针治疗肺组织也受到限制, 因为在组织 (冷冻或同质化)。在体内使用注入的自旋探针与 sod 或细胞渗透 peg-sod 一起使用可以解决这个问题。
一个目标是建立一个协议, 在 epr 测量之前有效地收集样品并将其存储在-80°c。因此, 我们开发了一种实用的方法来使用聚四氟乙烯管来保存样品。这管子直接地被安置入手指 dewar 为 epr 分析在 77 k, 不用清洁在样品之间的 dewar。这是一个替代最近公布的方法涉及冻结样品在1毫升注射器。在 ptfe 管材中储存的冷冻样品中的测量可以重复几天, 以显示信号的稳定性。这种方法允许对 epr 测量进行批处理, 并便于在实验室之间传输样品, 因此远程 epr 设施可以运行样品。
总体而言, 这些协议提供了一种简单的方法来准备用于生物系统中 epr 测量的细胞和组织。这些协议可以适用于与氧化应激和使用其他自旋探针相关的其他模型。自旋探针的时间和浓度需要根据每个实验条件进行调整。epr 能够明确地确定自由基物种的存在和产生, 这为氧化还原生物学领域的实验方法提供了严谨性。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
作者没有什么可透露的。
Acknowledgments
这项工作得到了科罗拉多大学医学院院长战略研究基础设施奖 r01 hl0866868-09 和1r35hl139726-01 的支持, 颁发给 e. n. g. 和 ucd cfret 奖学金 (he)。作者感谢 sandra eaton 博士和 gareth eaton 博士 (丹佛大学)、gerald rosen 博士和 joseph p. kao 博士 (马里兰州立大学) 和 sujatha venkataraman 博士 (科罗拉多大学丹佛分校) 进行的有益讨论, 以及 joanne maltzahn, ashleytrumpie 和 ivy mcdermott (科罗拉多丹佛大学) 提供技术支持。
Materials
| Name | Company | Catalog Number | Comments |
| DMEM | LifeTech | 10566-016 | cell culture media |
| Diethylenetriaminepentaacetic acid (DTPA) | Sigma Aldrich | D6518-5G | |
| sodium chloride (NaCl) | Fisher Scientific | BP358-212 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| potassium phosphate dibasic (HK2PO4 ) | Fisher Scientific | BP363-500 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| potassium phosphate monobasic (KH2PO4 ) | Sigma Aldrich | P-5379 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| Krebs-Henseleit buffer (KHB) | (Alfa Aesar, Hill) | J67820 | |
| Bovine erythrocyte superoxide dismutase (SOD) | Sigma Aldrich | S7571-30KU | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma Aldrich | P1585-1MG | Dissolve in DMSO |
| Antimycin A (AA) | Sigma Aldrich | A8674-25MG | Dissolve in Ethanol and store in glass vials(MW used is the averaged molecular weights for four lots) |
| 1-Hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine . HCl (CMH) | Enzo Life Sciences | ALX-430-117-M050 | |
| 1-Hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine . HCl (CPH) | Enzo Life Sciences | ALX-430-078-M250 | |
| 1-Hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethylpiperidine, 1-Hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido]piperidinium dichloride ( mito-TEMPO-H) | Enzo Life Sciences | ALX-430-171-M005 | |
| 1-Hydroxy-2,2,6,6-tetramethylpiperidin-4-yl-trimethylammonium chloride . HCl (CAT1H) | Enzo Life Sciences | ALX-430-131-M250 | |
| Heparin | Sagent Pharmaceuticals | NDC 25021-400-10 | |
| Diphenyliodonium chloride | Sigma Aldrich | 43088 | |
| Deferoxamin mesylate salt | Sigma Aldrich | D9533-1G | |
| Critoseal | Leica | 39215003 | |
| BRAND disposable BLAUBRAND micropipettes, intraMark | Sigma Aldrich | 708733 | Capillaries |
| PTFE FRACTIONAL FLUOROPOLYMER TUBING 3/16” OD x 1/8” ID |
NORELL | 1598774A | Teflon tubing |
| SILICONE RUBBER STOPPERS FOR NMR SAMPLE TUBES FOR THIN WALL TUBES HAVING AN OD OF 4mm-5mm (3.2mm TO 4.2mm ID) TS-4-5-SR | NORELL | 94987 | |
| EMXnano Bench-Top EPR spectrometer | Bruker BioSpin GmbH | E7004002 | |
| EMX NANO TISSUE CELL | Bruker BioSpin GmbH | E7004542 |
References
- Kalyanaraman, B., et al. Measuring reactive oxygen and nitrogen species with fluorescent probes: challenges and limitations. Free Radical Biology and Medicine. 52 (1), 1-6 (2012).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magnetic Resonance in Medicine. 67 (6), 1827-1836 (2012).
- Elajaili, H. B., et al. Electron spin relaxation times and rapid scan EPR imaging of pH-sensitive amino-substituted trityl radicals. Magnetic Resonance in Chemistry. 53 (4), 280-284 (2015).
- Elajaili, H., et al. Imaging disulfide dinitroxides at 250 MHz to monitor thiol redox status. Journal of Magnetic Resonance. 260, 77-82 (2015).
- Halpern, H. J., et al. Oxymetry Deep in Tissues with Low-Frequency Electron-Paramagnetic-Resonance. Proceedings of the National Academy of Sciences of the United States of America. 91 (26), 13047-13051 (1994).
- Epel, B., et al. Imaging thiol redox status in murine tumors in vivo with rapid-scan electron paramagnetic resonanc. Journal of Magnetic Resonance. 276, 31-36 (2017).
- Legenzov, E. A., Sims, S. J., Dirda, N. D. A., Rosen, G. M., Kao, J. P. Y. Disulfide-Linked Dinitroxides for Monitoring Cellular Thiol Redox Status through Electron Paramagnetic Resonance Spectroscopy. Biochemistry. 54 (47), 6973-6982 (2015).
- Abbas, K., et al. Medium-throughput ESR detection of superoxide production in undetached adherent cells using cyclic nitrone spin traps. Free Radical Research. 49 (9), 1122-1128 (2015).
- Dikalov, S. I., et al. Distinct roles of Nox1 and Nox4 in basal and angiotensin II-stimulated superoxide and hydrogen peroxide production. Free Radical Biology and Medicine. 45 (9), 1340-1351 (2008).
- Dikalov, S. I., Kirilyuk, I. A., Voinov, M., Grigor'ev, I. A. EPR detection of cellular and mitochondrial superoxide using cyclic hydroxylamines. Free Radical Research. 45 (4), 417-430 (2011).
- Dikalova, A. E., et al. Therapeutic Targeting of Mitochondrial Superoxide in Hypertension. Circulation Research. 107 (1), 106-116 (2010).
- Dikalov, S. I., Polienko, Y. F., Kirilyuk, I. Electron Paramagnetic Resonance Measurements of Reactive Oxygen Species by Cyclic Hydroxylamine Spin Probes. Antioxidants & Redox Signaling. , (2017).
- Sharma, S., et al. L-Carnitine preserves endothelial function in a lamb model of increased pulmonary blood flow. Pediatric Research. 74 (1), 39-47 (2013).
- Berg, K., Ericsson, M., Lindgren, M., Gustafsson, H. A High Precision Method for Quantitative Measurements of Reactive Oxygen Species in Frozen Biopsies. PloS One. 9 (3), (2014).
- Kozlov, A. V., et al. EPR analysis reveals three tissues responding to endotoxin by increased formation of reactive oxygen and nitrogen species. Free Radical Biology and Medicine. 34 (12), 1555-1562 (2003).
- Van Rheen, Z., et al. Lung Extracellular Superoxide Dismutase Overexpression Lessens Bleomycin-Induced Pulmonary Hypertension and Vascular Remodeling. American Journal of Respiratory Cell and Molecular Biology. 44 (4), 500-508 (2011).
- Mouradian, G. C., et al. Superoxide Dismutase 3 R213G Single-Nucleotide Polymorphism Blocks Murine Bleomycin-Induced Fibrosis and Promotes Resolution of Inflammation. American Journal of Respiratory Cell and Molecular Biology. 56 (3), 362-371 (2017).
- Dikalov, S. I., Li, W., Mehranpour, P., Wang, S. S., Zafari, A. M. Production of extracellular superoxide by human lymphoblast cell lines: comparison of electron spin resonance techniques and cytochrome C reduction assay. Biochem Pharmacol. 73 (7), 972-980 (2007).
- Kozuleva, M., et al. Quantification of superoxide radical production in thylakoid membrane using cyclic hydroxylamines. Free Radical Biology and Medicine. 89, 1014-1023 (2015).
- Chen, K., Swartz, H. M. Oxidation of Hydroxylamines to Nitroxide Spin Labels in Living Cells. Biochimica Et Biophysica Acta. 970 (3), 270-277 (1988).



