Summary
電子常磁性共鳴 (EPR) 分光法は、フリーラジカルを測定する明確な方法です。選択的スピン プローブは、異なる細胞コンパートメント中のフリーラジカルの検出に使用します。治療、保存、および EPR 測定用サンプルを転送を容易にする生物学的サンプルを収集するために、実用的で効率的な手法を提案します。
Abstract
別の細胞およびティッシュ コンパートメントにおける活性酸素種 (ROS) の正確かつ特定の検出は生物学的設定におけるシグナル伝達レドックス調節の研究に不可欠です。電子常磁性共鳴 (EPR) は、フリーラジカルを明確に把握する唯一の直接の方法です。その利点は、高い特異性と特定の種の生理学的レベルを検出したが、データの正確な解釈を確保するため、専門的な技術、注意サンプル準備と適切なコントロールが必要です。繰返しヒドロキシルアミン スピン プローブは、スーパーオキシドまたは EPR 分光法によって定量することができますニトロキシド信号を生成するその他のラジカルと選択的に反応します。細胞膜透過性のスピン プローブおよび急速にミトコンドリアに蓄積するように設計スピン プローブ別の細胞コンパートメントに活性酸素濃度の測定を可能にします。
培養細胞、細胞透過性 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine (CMH) と一緒に、細胞不浸透性のスーパーオキシド ジスムターゼ (SOD) 前処理なしの使用または細胞膜透過性 PEG SOD の使用には、細胞内活性酸素から細胞の分化。ミトコンドリア 1-hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethyl-piperidine,1-hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido] ピペリジ ニウム塩化 (水戸-テンポ-H) の測定が可能になりますミトコンドリア ROS (主に活性酸素)。
スピン プローブと EPR 分光は、体内モデルにも適用できます。活性酸素は、肺などの組織と同様、血液や肺胞液などの細胞外液に検出できます。EPR 測定のための組織を処理して静脈内 1-hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine (CPH) スピン プローブの生体を提供いくつかの方法が掲載されています。In vitroとin vivoモデルから得られた試料測定は室温で実行できますが、-80 ° C で保存および 77 K において EPR によって分析できるはまたサンプルは、特殊なチューブ安定-80 ° c で保存し、77 K、効率的、実用的を有効にして格納と転送のサンプルを容易に再現可能な方法で実行できます。
Introduction
酸化ストレスと活性酸素の対策がすべての器官システムで多様な病気の研究に重要な活性酸素種 (ROS) の検出は、半減期が短いと高い反応性のために挑戦。電子常磁性共鳴 (EPR) 法は、フリーラジカルの検出の最も明白な方法です。スピン プローブより一般的に使用される蛍光プローブ上の利点を持っています。蛍光プローブは、比較的安価で使いやすく、活性酸素の急速な敏感な検出を提供するが、彼らは人工信号、ROS 濃度と特異性1 の一般的な不足を計算することができないことに起因する深刻な制限を持ってください。.
EPR の生物学的研究のための使用を容易にするさまざまな生物学的関連性の高いフリーラジカル種と同様、pO2pH、酸化還元の範囲を測定できるプローブを合成されているスピン状態2,3, 4,5,6,7。スピン トラップは、短寿命ラジカルをキャプチャするため開発されているし、フォーム長期的付加、EPR8によって検出を容易にします。両方のクラス (スピン プローブとスピン トラップ) の利点と制限があります。スピン プローブの 1 つの一般的に使用されるクラスは、EPR サイレントと安定したニトロキシドを形成する短寿命ラジカルと反応して環状の hydroxylamines です。繰返し hydroxylamines 反応スーパーオキシドと 100 回スピン トラップ、細胞酸化防止剤との競争にそれらを有効にするよりも高速が彼らは特異性がないし、適切なコントロールとラジカルまたはソースを識別する阻害剤を使用する必要ニトロキシド信号を担当します。スピン トラップ展示特異性、間と異なるスペクトル スーパーオキシド スピン トラッピングとラジカルの生分解しやすいパターンによって閉じ込められた種、彼らが遅い速度をある付加体します。スピン トラッピングのためのアプリケーションは、生物医学研究9,10、11,12,13で十分に文書化されています。
このプロジェクトの目的は実験を設計するための実用的な EPR 方法を示しますし、異なる細胞コンパートメント体外と異なる組織コンパートメント体内にプローブ スピンを使用して活性酸素を検出するサンプルを準備します。複数の原稿は、マウスモデルの解析の異なる細胞コンパートメントの体外およびプロセスの組織をターゲットに細胞膜透過性、細胞不浸透性、そしてミトコンドリア標的スピン プローブを使用して、これらの目標に関連するプロトコルを公開しています。14,15します正確なことを確認する別の細胞コンパートメントの in vitro 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine (CMH) スピン プローブを用いた活性酸素を測定するためのアプローチを検証することによって文献のこのボディに基づいて構築。測定、結果が偏る可能性があります潜在的な技術的な問題を強調表示します。我々 はまた CMH スピン プローブを用いた肺組織、気管支肺胞洗浄液、血で EPR 測定を実行するメソッドを提供します。これらの研究は、マウス組織を収穫する前に別のスピン プローブ、CPH を注入する手法し同様、組織を処理するさまざまな方法を比較します。最後に、ストレージの 77 K において EPR 測定前にサンプルの転送を許可するポリテトラフルオロ エチレン (PTFE) チューブのサンプルを格納するための実用的な方法を開発します。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
すべての動物の研究は、コロラド州デンバー機関動物ケアおよび使用委員会の大学によって承認されました。
1. 試薬の調製
-
ジエチレントリアミン酸 (DTPA) 株式 (150 mM)
- DTPA の 2.95 g を追加 (393.35 g/mol) 10 mL の脱イオン水に。
- DTPA を解散するには、1 M 水酸化ナトリウムを滴下追加し、7.0 の pH にもたらします。
- 150 mM の最終 DTPA 濃度の水で 50 mL にボリュームをもたらし、4 ° C で保存
-
リン酸バッファー生理食塩水 (PBS) (50 mM、pH 7.4)
- 5 M の塩化ナトリウム (NaCl) (58.44 g/mol; 29.22 g/100 mL) を準備します。
- カリウム リン酸二塩基 HK2PO4 (174.18 g/mol; 17.42 g/100 mL) の 1 M を準備します。
- カリウム リン酸一塩基 KH2PO4 (136.1 g/mol; 13.61 g/100 mL) の 1 M を準備します。りん酸一 1 M カリウム リン酸水素 4.24 mL と 1 M カリウムの 0.760 mL と 5 M の NaCl の 3 mL を混ぜます。PH を確認してください。
- 脱イオン水 100 mL にボリュームをもたらします。
- 短期 (日) 室内温度 (RT) と長期 (数週間) ストレージのための 4 ° C で保存します。
-
100 μ M DTPA を含む促進バッファー (khb 東日本放送)
- 50 mL の円錐形遠心分離機管 150 mM DTPA 原液の 33.3 μ L を追加します。
- 促進バッファー (khb 東日本放送) で 50 mL のボリュームをもたらします。
- 毎日 DTPA と新鮮なバッファーを準備し、室温維持
-
ショ糖を含むトリス EDTA バッファー
- 0.5 M トリス在庫を準備: 150 mL の脱イオン水でトリス基地 (121.14 g/mol) の 15.14 g を溶かします。HCl を使用して、7.8 に pH を調整し、250 mL の最終巻にもたらします。
- ショ糖の 21.4 g を溶解 (342.29 g/mol; 最終濃度 = 0.25 mM) 150 mL の脱イオン水に。
- 10 mM の最終的なトリス濃度を達成するためにショ糖にトリス株式の 5 mL を追加します。
- 1 mM の最終的な集中を達成するためにトリス ショ糖に 0.5 M EDTA ストックの 0.5 mL を追加します。
- PH を確認し、7.4 に調整します。
- 250 mL の脱イオン水での最終巻に持参し、4 ° C で保存
-
牛赤血球銅/亜鉛スーパーオキシド ジスムターゼ (SOD) 株式 (30,000 U/mL)
- 1 mL の PBS (約 5.7 mg、多くの SOD の活性に応じて) で SOD の 30,000 U を再構築します。
- よく、因数を混合し、短期 (6-12 ヶ月) の-20 ° c と長期保存用-80 ° C で保存します。
-
SOD 作業ソリューション (1000 U/mL)
- 870 μ L の滅菌 PBS に 30,000 U/mL SOD 株式の 30 μ 因数を転送します。
- 氷の上のソリューションを保持し、新鮮な使用します。
-
ホルボール 12-ミリスタート 13-アセタート (PMA) 株式 (5 mM)
- PMA の 1 mg を溶解 (616.83 g/mol) DMSO の 325 μ L で (最終濃度 5 mm)。
- 因数 5 mM PMA ソリューションし、-20 ° C で保存
-
PMA 作業ソリューション (125 μ M)
- 390 μ L の滅菌 PBS に 5 mM PMA 株式の 10 μ L の因数を希釈します。
- 氷の上のソリューションを保持し、新鮮な使用します。
- PMA の車両制御、390 μ L の PBS で DMSO の 10 μ L を使用します。
-
塩化ジフェニル (DIP) (2.5 mM)
- 3.2 mg を溶解 4 ml の 2.5 mM の在庫を取得する (316.57 g/mol) をつけます。
- ソリューションを準備し、それを使用して、新鮮です。
-
デフェロキサミン メシル酸塩 (DFO) (20 mM)
- DFO の 4.5 mg を溶解 (656.79 g/mol) 20 の mM の在庫を取得する 340 μ L で。
- ソリューションを準備し、それを使用して、新鮮です。
-
アンチマイシン A (AA) 株式 (5 mM) の準備
- AA の 5.4 mg を溶解 (532 g/mol) エタノール 2 mL 中 (最終濃度 5 mm)。
- ガラスの瓶、-20 ° C で店で在庫の約数
-
スピン プローブの準備
- バブル 50 mM リン酸バッファー バッファーから溶存酸素を取り除くに 30 分間、窒素を含む 100 μ M DTPA。
- -20 ° C のフリーザーからスピン プローブを削除でき、RT (10-15 分) に来てコンテナー。
- 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine· の 2.4 mg を量りHCl (CMH) (237.8 g/mol)
- CMH を最終濃度 10 mM の脱酸素化リン酸バッファーの 1 mL に溶解します。
- 5 mg 1-hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethylpiperidine,1-hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido]piperidinium 二塩化 (水戸-テンポ-H) (529.1 g/mol) の重量を量り。
- 水戸-テンポ-H を最終濃度 9.5 mM の脱酸素化リン酸バッファーの 1 mL に溶解します。
- 1-hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine· 4.9 mg を量りHCl (CPH) (223.7 g/mol)。
- CPH を 22 mM の最終的な集中の脱酸素化リン酸バッファーの 1 mL に溶解します。
- 因数とストア-80 ° c (凍結融解は推奨しません)。
2. 活性酸素の生体外の検出
-
RT で PMA 刺激の未加工 264.7 のセルの合計、細胞外と細胞内の活性酸素の検出
- 以下の適切な無菌テクニックは未加工 264.7 のセルの雪解け、DMEM 培地 10 %fbs (低エンドトキシン フリー) と 1% 抗真菌薬/アンピシリン CO2インキュベーターで 37 ° c でそれらを通過します。
- 種子 1 x 106 6 ウェル プレート 1 日治療前に細胞/ウェルで未加工 264.7 のセル。
- 優しくメディアを取り出し、1 mL の khb 東日本放送のバッファーに一度セルを洗浄します。
- Khb 東日本放送の各ウェルに 100 μ M DTPA を含むを追加し、次 500 μ L の容量で治療します。
- SOD、前処理井戸追加 SOD 実用的なソリューションの 15 μ L/ウェル (1000 U/mL; SOD の最終濃度 = 30 U/mL) CMH と PMA の添加前に 37 ° C で 10 分間インキュベートし、。
- 10 mM CMH 株式 12.5 μ L/ウェルを追加 (最終濃度 = 0.25 mM)。
- 125 μ M PMA 実用的なソリューションの 40 μ L/ウェルを追加 (最終濃度 = 10 μ M) や 40 μ L 車 (390 μ L の PBS で DMSO の株式 10 μ)。
- CO2のインキュベーターで 37 ° C で 50 分間インキュベートします。
- インキュベーターからプレートを削除し、氷の上すぐに配置します。
- チューブ ラベル、別の 1.5 mL の各ウェルからバッファーを収集します。全体の氷の上を保ちます。
- 100 μ M DTPA を含む新鮮な khb 東日本放送のバッファーを 100 μ l 添加細胞をこすり、ゆっくりを上下に数回ピペッティングによって再懸濁します。再懸濁細胞の中で氷の上を保ちます。
- 負荷サンプル手順 2.1.10 と 2.1.11 (50 μ L) キャピラリー チューブのそれぞれで採取しました。両端をシールし、EPR を実行します。
注: は常にチューブをテストまたはよく (セル) のないバッファーでプローブを含む (同じ濃度 = 0.25 mM)、プローブのバック グラウンド強度は温度コントロールとして細胞 (同じインキュベーション時間と温度) と同じ条件の下で扱われる時間に依存します。 - 次に EPR 買収パラメーターを設定: マイクロ波周波数 = 9.65 GHz の;センター フィールド = 3432 G;変調振幅 = 2.0 G;掃引幅 = 80 G;マイクロ波電力 = 19.9 mW。スキャンの合計数 = 10;掃引時間 = 12.11 s;時定数 = 20.48 ms。
-
未加工 264.7 のセルのミトコンドリア活性酸素検出
- 2.1.1 2.1.2 に手順種子未加工 264.7 のセル実験の前日。
- メディアを削除し、1 mL の khb 東日本放送のバッファーに一度セルを洗浄します。
- 各ウェルに 100 μ M DTPA を含む khb 東日本放送の 200 μ L を追加します。
- 5.3 μ L/ウェル 9.5 mM 水戸テンポ H 株式を追加 (最終濃度 = 0.25 mM)
- 室温 10 分間インキュベートします。
- アンチマイシン A (AA)、エタノールの原液を 5 mM の 1 μ L/ウェルを追加 (最終濃度 25 μ M を =)。
- CO2のインキュベーターで 37 ° C で 50 分間インキュベートします。
- インキュベーターからプレートを削除し、氷の上すぐに配置します。
- 軽く細胞をこすり、上下にピペッティングによって再懸濁します。氷の上を保ちます。
- キャピラリー チューブのサンプルをロードします。両端をシールします。
- EPR の設定に関する前のセクションを参照してください。
-
77 K で未加工 264.7 のセル中の過酸化物の検出
- 事前に用意された PTFE チューブ長さ (3/16"x 1/8" ID OD) で 1 〜 2 インチの手順 1.1.10 で収集バッファーに配置します。簡単に挿入して、指から削除できるので、PTFE チューブがストレート確認デュワー。PTFE チューブの一方の端を閉じる、PTFE チューブに細胞懸濁液 (100 に 150 μ L) またはバッファーをピペットおよび第 2 ストッパー付きチューブをシールにゴム栓を使用します。
- フラッシュは、液体窒素でサンプルを凍結します。サンプルは-80 ° C で保存用ラベル凍結保存チューブに転送またはすぐに実行できます。
- 指を埋める液体窒素と挿入、指にサンプルを含む PTFE チューブ デュワー デュワー。確認サンプルは共振器の能動的空間の中央に配置し、77 K で EPR を実行
注: 窒素ガスの流れ、装置の開発を開始、測定前に 15-30 分、共振器中の水分の凝縮を防ぐために測定中にこのフローを続行します。 - 次に EPR 買収パラメーターを設定: マイクロ波周波数 = 9.65 GHz の;センター フィールド = 3438 G;変調振幅 = 4.0 G;掃引幅 = 150 G;マイクロ波電力 = 0.316 mW。スキャンの合計数 = 10;スイープ時間 = 60 s;時定数 = 1.28 ms。
3. EPR 測定流体
-
全血
- PBS または前述の16,17として単独で PBS に溶解した気管内ブレオマイシン (症例; 1 U/mL で 100 μ L) の単回投与でマウス (8-12 週齢) を扱います。
- 続いて急激と頚部転位吸入イソフルラン (1.5-4%) を投与することによってマウスを安楽死させます。注射器でヘパリン (1000 USP/mL) 100 μ M DTPA と 1.5 mL チューブへの転送を含むコーティングに右心室に血液を吸引します。
- 別 1.5 mL チューブでは 15 μ L の PBS 100 μ M DTPA を含むを追加、150 μ L の容量と最終 CMH 濃度 0.2 mM の血 132 μ に CMH (10 mM) の 3 μ L。
- 37 の ° C の水浴中で 10 分の血液を孵化させなさい。
- 水浴からチューブを取り外します。
- キャピラリー チューブの血液を読み込むことによって、因数を取るし、EPR アクイジション ・ パラメーターは次の RT で EPR を実行: マイクロ波周波数 = 9.65 GHz の;センター フィールド = 3432 G;変調振幅 = 1.0 G;掃引幅 = 80 G;マイクロ波電力 = 19.9 mW。スキャンの合計数 = 3;掃引時間 = 12.11 s;時定数 = 20.48 さんまたは、サンプルで説明されているステップ 2.3 として冷凍フラッシュすることができます 77 k. EPR 集録パラメーターの測定は、次の: マイクロ波周波数 = 9.65 GHz の;センター フィールド = 3438 G;変調振幅 = 4.0 G;掃引幅 = 150 G;マイクロ波電力 = 0.316 mW。スキャンの合計数 = 2;スイープ時間 = 60 s;時定数 = 1.28 ms。
-
気管支肺胞洗浄液 (BALF)
- 安楽死した後 (手順 3.1.2 を参照)、ゆっくり浸透させると 1 mL の PBS 100 μ M DTPA 3 回、注射器を介してカニューレは、気管を含むの撤退による BALF を収集します。
- 1.5 mL チューブに BALF CMH (10 mM)、最終濃度が 0.2 mm の 4 μ L で 200 μ L を扱います。
- BALF 37 ° c 水のお風呂で 50 分間インキュベートします。
- 風呂の水のチューブを取り出して、氷の上に置きます。
- キャピラリー チューブと RT で実行 EPR と同じ EPR 設定、BALF 負荷においてステップ 1.1.13、または 2.3 の手順で説明されているようにフラッシュが液体窒素で凍結します。
-
77 K で血および BALF の EPR 測定
- 血を収集するために上記のプロトコルに従う (ステップ 3.1.1。 3.1.4 に) および BALF (3.2.4 に 3.2.1 のステップ)。
- 処理された血液または ptfe チューブ (1-2 の) BALF の場所 150 μ L。ゴム栓を使用して、サンプルとチューブをシールする別のストッパーを追加する前に PTFE チューブの一方の端を閉じます。
- フラッシュは、液体窒素でサンプルを凍結します。
- 77 k. 実行冷凍 CMH でデュワーと血液サンプルを扱われる一週間で指を使って PTFE チューブの凍結試料で EPR を実行する詳細については、セクション 2.3 を参照してください。
4. EPR 測定肺組織
-
冷凍肺組織をフラッシュします。
- 3.2.1 の手順で BALF を収集した後、胸が開き、肺は血液を削除する右心室を介して冷 PBS の 10 mL でフラッシュします。フラッシュは、液体窒素で肺の組織を凍結します。冷凍の肺組織は、EPR 測定に使用されるまで最大 6 ヶ月間-80 ° C で保存できます。
- ピンセットでドライアイスに肺組織を安定させるし、シングル エッジ刃を使用して肺組織の複数の小さい部分 (5-15 mg) をカットします。
- 1.5 mL チューブに組織の重量を量るスケールのチューブを場所しスケールを風袋、組織部分を追加し、重量を記録します。
- 1.5 mL チューブに組織、DTPA し CMH (0.2 mM) の 4 μ L、200 μ L の総ボリュームを達成するためを含む khb 東日本放送の 196 μ L を追加します。
- 37 の ° C の水浴中で 1 時間インキュベートします。
- (数秒) の 3,884 × g で遠心機でスピンダウンします。
- 氷の場所し、PTFE チューブに上清の 150 μ L をピペット 77 K 測定の凍結するセクション 2.3 で説明されているようです。
注: このメソッドの傷害の不均一性の考慮する必要があります。ブレオマイシンによる肺傷害のため非常に異種の損傷であることを考えればお勧め各マウスから肺のさまざまな部分からいくつかの組織の部分をカットします。または、組織のより大きい部分は、khb 東日本放送のバッファー 1:6 の重量・体積比 (mg/μ L) で 100 μ M DTPA を含む下記のように均質化することができます。
-
新鮮な肺組織のショ糖バッファーに保存
- 3.1.2 のステップで行う血液を削除する冷 PBS の lavaged の肺をフラッシュします。
- ガラスやテフロン乳棒と Dounce 組織グラインダーを用いた 1:6 肺/バッファー (mg/μ L) 比 0.25 M ショ糖を含むトリス EDTA バッファーの新鮮な肺組織をホモジナイズしてください。
- 肺の 50 μ L を含む 100 μ M DTPA khb 東日本放送の 450 μ L に追加します。
- Khb 東日本放送で肺を磨砕液の 98 μ L に 1.5 mL チューブ (100 μ L の総ボリューム) で、最終濃度が 0.2 mm 10 mM 在庫の CMH の 2 μ L を追加します。
- 37 ° C 水のお風呂で 20 分間インキュベートします。
- 氷のサンプルを置き、キャピラリー チューブでそれらをロードします。RT (2.1.13 のステップで使用される設定) で EPR を実行します。
- 特定の種と異なる阻害剤を使用してソースの貢献度をテストするため事前 98 μ L の最終巻を達成するために khb 東日本放送で調整阻害剤 + 肺ホモジネートの 88 μ L を扱います。この実験阻害剤には SOD の 10 μ L が含まれている (100 U/mL)、デフェロキサミンの 4 μ L (DFO; 最終濃度 = 800 μ M)、または塩化ジフェニルの 4 μ L (DIP; 最終濃度 100 μ M を =)。37 の ° C の水浴中で 20 分間インキュベートします。
- CMH の 2 μ L を追加し、37 ° C、EPR 測定に続いて上記のように別の 20 分間インキュベートします。ショ糖バッファーを含む CMH khb 東日本放送で 1 回一致する空白のサンプルが含まれます。また、今後測定-80 ° C で残りの肺乳剤 (ステップ 3.1.2) の因数を格納します。
注: 必要に応じて、合計ボリュームを拡張できます。
-
スピン プローブは体内(常温組織細胞を使用して) 投与マウスから肺組織の EPR 測定
- CPH 原液を準備するには、フィルター処理および脱酸素化の 50 mM リン酸バッファーの 1 mL の CPH の 4.9 mg を溶解します。
- 20-30 秒までピンチをつま先に無理解の吸入イソフルラン (1.5-4%) を持つマウスを麻酔します。25 g マウス体重 CPH スピン プローブの 100 μ L 注入マウス経由でretroorbital ルート (最終投与量 = 20 mg/kg)、preve へ目の領域にプロパラカイン 0.5 %hcl の一滴を追加、retroorbital 注射後すぐに 1 のため循環させてプローブとnt の目の痛みと乾燥。1 h のマウスを監視し、組織採取に進みます。
- 前述のように肺組織を収穫し、フラッシュ凍結肺。
- ドライアイスで凍結するティッシュの 20-30 mg をカットし、正確な重量を記録します。
- クリーニング ワイプ、表面の水を吸収すると組織を軽く拭きます。
- (アクセサリー組織サンプルの EPR 測定が可能) 組織細胞のウィンドウ内で組織を置き、合計スピンを決定する EPR を実行します。データは、組織の mg 当たり合計スピンとして表現できます。
5. データの解析
- ベンチ上 EMXnano EPR 分光器のキセノン ソフトウェアに組み込まれている SpinFit モジュールを使用して EPR スペクトルをシミュレートします。SpinCount モジュールによるニトロキシド濃度を決定します。また、4-ヒドロキシ テンポや TEMPOL など安定したニトロキシドの検量線を作ることができるとサンプルと標準信号の強さを比較することにより濃度を得ることができます。
- 77 K で収集したデータ、SpinCount に続いて二重積分を使用します。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
CMH を用いた活性酸素検出は、X を使用して検証された/XO 活性酸素生成カタラーゼの影響 (図 1 a) をしていた SOD、によって完全に、ニトロキシド (CM.) 信号抑制されたを示すためのシステム。合計、細胞の過酸化物は、SOD 前処理 +/-細胞膜透過性の CMH スピン プローブでインキュベーターの細胞によって未加工 264.7 のセルで評価されました。細胞懸濁液とバッファーは、2 つのサンプル型で値透水性自然とスピン プローブ (図 1 b) の急速な平衡のために類似していたことを示したニトロキシド濃度を測定しました。ニトロキシド根本的な信号制御の細胞と比較して PMA 刺激未加工 264.7 のセルで増加。この信号はだった細胞細胞不浸透性 SOD (図 1) で前処理の大幅減衰します。各色は、時間の経過と共に特定の日に収集されたデータの一貫性と結果の再現性を示す別の日にテスト井戸を表します。SOD (T) の不在で PMA 後信号から SOD で前処理した PMA 細胞信号を減算することによって細胞活性酸素の濃度を測定しました。残りのシグナルは、細胞内活性酸素 (図 1) に起因しました。図 1は、合計と細胞のスーパーオキシドの計算を示しています。(E) の細胞内シグナルは、メディアと信号に及ぼす PEG SOD によって除去した後 PMA 処理細胞で確認されました。このグラフは、(C) と対照をなして CMH 空白だった、測定値から減算されず、生データが表示されます。
未加工 264.7 のセルのミトコンドリアの活性酸素は、EPR スピン プローブ水戸-テンポ-H、mitochondia の蓄積を使用して検出されました。(A) 代表の EPR スペクトルのベースライン水戸テンポ H 信号バッファー、制御の細胞 (Con) で増加水戸テンポ H 信号および細胞ミトコンドリア阻害剤アンチマイシン A (AA) でさらに高度な信号。信号の大幅減衰測定水戸テンポ H10SOD2 過剰発現を示す私たちの以前の研究に基づくミトコンドリアの活性酸素を増加しました。図 2 b、ミトコンドリア ニトロキシド濃度は細胞計測から時間整合バッファーで水戸テンポ H 信号を減算することによって決定されました。SOD の有無で PMA 刺激後に未加工 264.7 のセルの低温で得られる CM.信号。(図 3 a)CM.信号は、SOD、部屋の温度データ (図 1) と一致の存在下で減衰しました。図 3 bは、ストッパーの 77 K における細胞の生体内でのサンプル データの収集に使用した PTFE チューブの写真を示しています。スーパーオキ サイド産生が血と CMH スピン プローブによる BALF で検出されました。血液や BALF のサンプルは、PBS と症例投与マウスから採取した、CMH ですぐに孵化します。サンプルは PTFE チューブと固定、フラッシュに転送された、77 K で収集された EPR データニトロキシド (CM.) の濃度は、CMH (0.2 mM) で 10 分 (図 4 a) 37 度で培養した血液に蓄積します。BALF からニトロキシド (.CM) 濃度は 50 分 (図 4 b) にインキュベートします。ニトロキシド濃度は血液の容積の蓄積 (CM.) の濃度を表してまたは BALF は実験で使用されます。
ティッシュの保存のためのいくつかの公開された技術を評価する 3 つの方法をテストされているし、 ex vivo 対プローブのスピンの管理。生体内で。肺組織に、EPR 測定を実行するには、は、コントロールからフラッシュ凍結肺組織を使用またはマウスを負傷しました。図 5 aは、それぞれ PBS と症例処理マウスで CMH を 37 ° C で培養した肺組織の小片の上清の全 CM.信号を示しています。症例治療後肺傷害の不均一性、原因は、肺の異なった地域からの部分をカットしより代表的な値を提供するために複数の測定値を平均することをお勧めします。また、全肺野を均質化、この磨砕液の 1 つのサンプルを使用できます。PTFE チューブを使用して 77 K で収集されたデータとデュワーを指します。図 5 bは、それぞれ PBS と症例処理マウスからニトロキシド (CM.) 信号の代表的なスペクトルを示しています。
肺組織体外治療に 1 つの制限は、それが細胞膜を破壊するティッシュの処理により細胞内活性酸素から細胞を確実に区別することが可能ではないです。この情報の実験の質問に重要な場合は、生体内でCPH 注入法による下記対処できます。ミトコンドリア活性を評価するために凍結するティッシュを使用できませんしかし、この測定のプロトコルは、組織または新鮮単離ミトコンドリアの水戸-テンポ-H を使用する合わせることができます。
肺組織の EPR 測定のための 2 番目のメソッドとして新鮮な組織されたショ糖バッファーで均質化されました。肺は CMH プローブ DTPA を含む khb 東日本放送バッファー内で孵化します。EPR 測定行った右図 6Aで CM.の増加を示します症例。CM.に貢献する種を決定するため使用することができます別の阻害剤を使って追加テストを紹介信号。肺組織から生成された CM.信号の起源を明らかにするには、いくつかのスカベン ジャーと酵素阻害剤肺乳剤を前処理します。肺乳剤 SOD、デフェロキサミン (DFO) とジフェニル塩化物 (それぞれ) 活性酸素、鉄、または生成される活性酸素からの貢献を考慮する (DIP) の有無でフラビン含有から CMH と培養酵素 (図 6 b)。このアプローチはシステムで生成した特定のラジカル種を評価したり、他の酵素源の寄与を明らかに合わせることができる (例えば.、NOX、eNOS、またはキサンチン酸化酵素)。
マウスは、EPR 測定で体内を実行する retroorbital ルート CPH スピン プローブ (20 mg/kg)を経由を注入しました。かどうか CMH 安全に管理できる動物、CPH プローブ; 非毒性であることが報告されている間は知られてしたがって、我々 は生体内で実験のため CPH を選択しました。肺組織された収穫およびフラッシュ CPH プローブの循環後 1 h の液体窒素冷凍します。マウスは、信号に関与の種を区別するために特定の抗酸化物質と同時に扱うことができます。図 7Aは高い CP.を示しています。コントロール マウスと比較して症例投与マウスの信号を送る。図 7 bにコントロール症例投与マウスからの肺組織の代表的なスペクトルを示します。CP.の混合の EPR スペクトルアスコルビン酸ラジカルが観察されました。図 7Aの報告値が CP.の濃度コンポーネント。データは、組織細胞を用いた RT で収集されました。
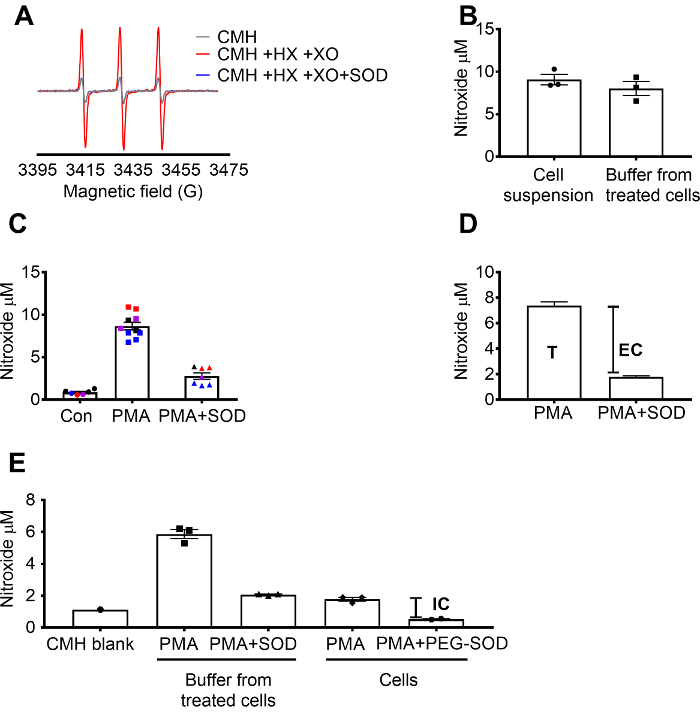
図 1: 異なる細胞区画中の過酸化物の検出。(0.25 mM CMH 0.5 mM ヒポキサンチン ・ キサンチンオキシダーゼ (8 mU/mL) SOD とによって生成された A) EPR スペクトル (30 U/mL)。(B) RAW 264.7 のセル (1 x 106細胞/ウェル) は、細胞懸濁液 (細胞 + バッファー) で検出された 37 ° C、ニトロキシド濃度 (μ M) で 50 分、扱われた細胞から収集バッファー 10 μ m CMH の存在下で PMA 刺激しました。(C) RAW 264.7 のセルは、PMA対と刺激しました。車両制御 (Con)。30 U/mL 細胞不浸透性 SOD (PMA + SOD) と 10 分のため前処理は、セルの 1 つのセット。各色が異なる実験日からデータを表し、各ポイントも個人からセルを表します。最終的な値を取得する各信号時間マッチ空白の khb 東日本放送の CMH のニトロキシド信号を求めた。(D) PMA の合計と細胞のスーパーオキシドの計算刺激細胞;T = 総スーパーオキシド、EC 細胞のスーパーオキシド (SOD inhibitable 信号) を =。(細胞内活性酸素シグナル (IC) を評価するには E) PMA + SOD 後バッファーの信号は PMA 処理細胞バッファー除去後に比べていた。確認するには、井戸前処理 60 U/mL 細胞膜透過性 PEG-SOD 1.5 時間の inhibitable の細胞内の SOD を決定します。時間整合 CMH 空白が表示され、データは絶対ニトロキシド信号を反映します。平均 ± SEM. として表されるデータこの図の拡大版を表示するのにはここをクリックしてください。

図 2: アンチマイシン a. と生細胞中のミトコンドリア過酸化物の検出(A) 代表的なスペクトルのミトコンドリア固有の EPR スピン プローブ、0.25 mM 水戸-テンポ-H (Con) なしの未加工 264.7 のセルで、37 ° C で 50 分間 25 μ M アンチマイシン A (AA)(CM B).濃度 (μ M) のセルは、コントロールと比較する AA と扱われます。総信号の最終的な値を取得する時間一致水戸テンポ H ブランク ニトロキシド信号を求めた。平均 ± SEM. として表されるデータこの図の拡大版を表示するのにはここをクリックしてください。

図 3: 未加工 264.7 の活性酸素検出細胞の 77 K における。(A) 未加工 264.7 のセル 10 μ M PMA と EPR スピン プローブ、CMH 0.25 mM (37 ° C で 50 分) (ブラック) 刺激 30 U/ml の SOD (赤) の前処理の有無。上清の 100 μ L は、PTFE チューブ、液体窒素で凍結フラッシュの長さ部分で 1 インチで読み込まれました。ストッパーが削除されたと冷凍の PTFE チューブは指に置かれた PTFE チューブとストッパーの 77 k. (B) A の写真でデータ集録用デュワー。この図の拡大版を表示するのにはここをクリックしてください。

図 4: 制御およびブレオマイシン投与マウスの血液および BALF 中 EPR 測定。マウスの気管内ブレオマイシン (IT 症例) の単回投与で治療された (1 U/mL で 100 μ L) または PBS 車両。7 日間でマウス麻酔、安楽死させた。血が 1000 でコーティングされた注射器に右室穿刺を介して収集した USP/mL のヘパリン 100 μ M DTPA を含みます。気管支肺胞洗浄液 (BALF) の lavaging によって収集された 1 ml の PBS で DTPA 100 μ M の肺。血および BALF 培養し, 10 または 50 分それぞれ、37 ° C で 0.2 mm CMH150 μ L の血液や BALF は PTFE チューブ フラッシュ凍結液体窒素で指を使って 77 K で収集された EPR データ読み込まれたデュワー。データは、PBS と症例投与マウスから血 (A) と (B) BALF ニトロキシド濃度を表示 (n = 4-6)。± の PBS と症例投与マウスの血中ニトロキシド SEM. (C) 代表的スペクトルを意味表現データ。この図の拡大版を表示するのにはここをクリックしてください。

図 5: フラッシュ凍結肺組織における EPR 測定。マウスの気管内ブレオマイシン (IT 症例) の単回投与で治療された (1 U/mL で 100 μ L) または PBS 車両。7 日で肺が血液や液体窒素で凍結のフラッシュを削除する冷 PBS でフラッシュされます。フラッシュ凍結肺組織の 5-15 mg が 0.2 mM の 37 ° c. 上清を収集し、PTFE チューブの配置で 1 h の総体積 200 μ L で 100 μ M を含む khb 東日本放送の CMH の培養し、指の 77 K における実行デュワー。(A) ニトロキシド濃度 (μ M の組織の 1 mg に正規化ニトロキシド)。データは、各肺の 2-3 測定値の平均を表します。± PBS と症例投与マウス肺組織におけるニトロキシド SEM. (B) 代表的なスペクトルを意味表現データ。この図の拡大版を表示するのにはここをクリックしてください。

図 6: ショ糖バッファーに保存肺組織における EPR 測定。マウスは、気管内ブレオマイシン (1 U/mL で 100 μ L) の単回投与で治療されました。7 日間治療後、肺、血液を削除する冷 PBS でフラッシュされて、新鮮な肺組織は肺重量/バッファー (mg/μ L) を容積比で 1:6 で 0.25 mM ショ糖を含むトリス EDTA バッファーで均質化されました。肺の磨砕液を 50 μ l 添加 khb 東日本放送された虫 37 で 20 分間次の阻害の有無 ° c: SOD (100 U/mL)、デフェロキサミン (DFO; 800 μ M) と塩化ジフェニル (DIP; 100 μ M) に続いて 0.2 mM 100 μ M DTPA を含む khb 東日本放送の CMH の孵化37 ° C で 20 分データは、EPR 毛細管を使用して RT で得られました。(A) ニトロキシド PBS と症例投与マウスから肺の濃度。(阻害剤の有無で症例の肺 B) ニトロキシド濃度 (n = 3)。平均 ± SEM. として表されるデータこの図の拡大版を表示するのにはここをクリックしてください。

図 7: CPH スピン プローブを注入したマウスから肺組織における EPR 測定。CPH の 100 μ L は、投与によるretroorbital 注入 20 mg の最終的な集中の CPH の体重 kg 当りだった。循環の 1 h 後マウスを安楽死させ、10 ml の冷 PBSを介して右心室は肺、フラッシュされて、肺組織が凍結されたフラッシュします。肺組織の 20 〜 30 mg は組織細胞に置かれた、EPR 測定実行室温スピンとして表される (、) のデータ/mg (B) 代表的なスペクトル ニトロキシド PBS と症例の肺組織の信号 (* アスコルビン酸ラジカルとの重複部分を示します)。平均 ± SEM. として表されるデータこの図の拡大版を表示するのにはここをクリックしてください。
| 阻害剤 | 種 |
| スーパーオキシドディスムターゼ (SOD) | 細胞のスーパーオキシド |
| スーパーオキシド ジスムターゼ-ポリエチレング リコール (PEG SOD) | 細胞内活性酸素 |
| カタラーゼ | 中の過酸化水素のラジカル |
| 尿酸 | 大気 |
| エタノールと DMSO | ヒドロキシルラジカル |
| 金属キレート剤 | 金属イオン (鉄および銅) |
表 1。スピン プローブの酸化に関与する種を区別するために使用される一般的な阻害剤。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
生物学的設定でフリーラジカル産生の評価は理解の酸化還元規制で、健康と病気、シグナル伝達で重要ですがこれらの種の測定が高いフリーラジカル種の半減期が短いために挑戦と技術一般的に使用されるメソッドの制限。フリーラジカルの検出のためだけに明確な方法である、EPR は酸化還元の生物学で貴重な強力なツールです。このプロジェクトは、実験計画と異なる細胞コンパートメントの in vitroと異なる組織コンパートメントで ROS スピンを使用して、プローブを検出するためのサンプルの準備の実践的 EPR 方法を示す体内。我々 はまた生体試料を処理し、効率を改善するためにサンプルを格納する実用的な方法を提供します。
スピン プローブと ROS 効率的に反応する EPR で検出できる安定ニトロキシドラジカルを生成します。スピン プローブ (繰返しヒドロキシルアミン) のいくつかの誘導体は、異なる細胞コンパートメント10のフリーラジカルの検出に最適です性別透水特性と合成されています。このプロトコルは細胞膜透過性のスピン プローブ、CMH; を利用しかし、細胞のスーパーオキシドを検出する不浸透性スピン プローブ 1-hydroxy-2,2,6,6-tetramethylpiperidin-4-yl-trimethylammonium 塩化物塩酸 (CAT1H) を使用できます。ヒトリンパ細胞ライン18私たちの事前調査と同様に、我々 ができた不浸透性 SOD と透水性 CMH スピン プローブの使用を検証し、細胞透過性 PEG SOD に pma 刺激 RAW264.7 細胞 (マウス肺マクロファージ細胞株) の細胞外および細胞内活性酸素を区別します。
我々 はまた内極細胞コンパートメント間 CMH の急速な平衡を検証し、活性酸素シグナルの細胞滴大幅 khb 東日本放送 (データは示されていない) で一度だけセルを洗浄後のこともわかった。ミトコンドリアの特定のスピン プローブ水戸-テンポ-H 刺激によるミトコンドリアの電子伝達鎖阻害剤アンチマイシン a. の生成増加ミトコンドリアの活性酸素を測定する未加工 264.7 のセルでの有用性を確認しました。ミトコンドリアの活性酸素産生水戸テンポ H への特定の貢献は以前に実証されているし、ミトコンドリア スーパーオキシドジスムターゼ MnSOD (SOD2) と新鮮なミトコンドリアの分離またはシステムを用いた実験で検証することができます。過剰発現10。
ROS 生産生体内の評価が特に挑戦的な生体信号調整される酸化ストレス ・ レドックスの役割を尋問するときに特定活性酸素の生産を検出する能力が重要な情報を提供します設定。プローブのスピンを使用してティッシュの適切な処理、EPR は再現性のある、意味のある結果を生成する不可欠です。組織のスピン プローブの使用がない可能性が高いメジャー スーパーオキシドラジカル組織は、半減期が短いため収穫の時が NAPDH 酸化酵素、共役内皮一酸化窒素合成酵素などの酵素によって生成される活性酸素を検出する代わりに、キサンチン酸化酵素肺組織または乳剤は 37 ° C でスピン プローブと孵化させるとき凍結するティッシュの使用では、凍結損傷ミトコンドリアの電子伝達鎖活動以来ミトコンドリアによって生成された活性酸素は含まれません。ミトコンドリア活性酸素をテスト、調査官は、新鮮なミトコンドリアの分離または使用ミトコンドリア特定プローブ体内または新鮮な組織を必要があります。
組織を維持するためにいくつかの異なるプロトコルは文献14,15に掲載されています。肺組織の EPR 測定 3 つの公開されたメソッドを比較した: 1) フラッシュ組織を液体窒素で凍結、2) ショ糖バッファー内の組織を均質化、3) マウス体内スピン治療プローブ組織採取の前に 1 時間。重度の肺の炎症と負傷肺でニトロキシド信号の一貫した相違を表示する各メソッドの機能をテストするのにはブレオマイシンにより誘導される酸化ストレス制御マウスを比較しました。すべての 3 つの方法は、ブレオマイシン投与マウスの肺におけるニトロキシド信号で似たような相対的な増加を示した。フラッシュ凍結するティッシュの使用ほとんどのラボ、収穫の時にショ糖バッファー内の組織を処理する必要性を否定することのための組織を収集する最も簡単な方法ででしょう。体内のフリーラジカルをキャプチャする CPH の注入は強力ですが、特定の種を確認するためこれは適切な抗酸化物質を含む治療グループが必要です。
スピン プローブを使用しての 1 つの課題は、ニトロキシド スピン プローブの酸化が; 酸化に関与する種に関係なく同じような 3 行の EPR スペクトルを生成することです。したがって、活性酸素種と区別しません。また、光合成の電子輸送鎖とチトクローム c オキシダーゼ19,20ヒドロキシルアミン プローブの潜在的な反応があることが報告されています。結果を解釈するとき、これらの観測を見なす必要があります。このプロトコルでは光合成システムが存在しないとバッファーと DTPA を含める無料鉄及び銅イオン10の潜在的な汚染を抑制します。肺組織で特定の ROS の貢献または ROS のソースを決定する酵素の阻害剤を確立する一連の特定の酵素やキレート剤を使用する方法を示しました。このアプローチは、共役 eNOS13,15 のため ROS の寄与を決定する EPR で以前使用されています。スピン プローブ酸化 (表 1) に関与する種を区別するために使用される一般的な阻害剤のリストを提供します。
また、実験条件ごとにインキュベーション時間を最適化することの重要性を示した。スピン トラップがフリーラジカル種の特異性を可能にする反応によってユニークなスペクトルを生成するトラップをスピン プローブ スピンを比較するときしかし、彼らはまたスーパーオキシド スピン トラッピングの遅い動力学の展示、生分解しやすい。肺組織、EPR プローブ前のヴィヴォの治療も十分に組織の処理中に細胞膜の破綻による細胞内活性酸素から細胞を区別できないによって制限されます (凍結または均質化)。注入されたスピン プローブは、生体内でSOD や細胞膜透過性 PEG SOD と組み合わせての使用は、この問題を解決することができます。
1 つの目標は、効率的にサンプルを収集して EPR 測定前に-80 ° C で保存するプロトコルを確立することだった。我々 したがって、PTFE チューブを使用して、サンプルを保持するために実用的な方法を開発しました。このチューブは指に直接置かれるサンプル間デュワーをきれいに必要とせず 77 K において EPR 分析用デュワー。これは、1 mL 注射器で試料の凍結を含む最近公開されたメソッドに代わるものです。PTFE チューブに格納されている凍結試料で測定は、信号の安定性を実証する数日間で繰り返すことができます。このアプローチは、EPR 測定をバッチ処理が可能になります、リモート EPR 施設は、サンプルを実行できるように研究所間でサンプルの転送が容易になります。
全体的にみて、これらのプロトコルは、EPR 測定用生体の細胞や組織を準備するための簡単な方法を提供します。プロトコルは、酸化ストレス、他のスピン プローブの使用と関連付けられている他のモデルに適応することができます。タイミングとスピン プローブの濃度は、実験条件ごとに調整する必要があります。明確に存在し、フリーラジカルの生産を決定する EPR の能力は、酸化還元の生物学の分野で実験的アプローチに厳しさを提供します。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
著者が明らかに何もありません。
Acknowledgments
この作品は、コロラド大学大学院医学研究科長の戦略的研究基盤賞、R01 HL086680-09 ・ 1R35HL139726-01、E.N.G.、UCD CFReT 奨学 (彼) によって支えられました。著者に感謝博士サンドラ イートンと博士ギャレス イートン (デンバーの大学)、博士ジェラルド ローゼンと博士ジョセフ p. 花王 (メリーランド大学)、博士スジャータ ベンカタラマン (コロラド大学デンバー) 役に立つ議論のためジョアン Maltzahn、アシュリーTrumpie とアイビー ・ マクダーモット (コロラド大学デンバー) のテクニカル サポート。
Materials
| Name | Company | Catalog Number | Comments |
| DMEM | LifeTech | 10566-016 | cell culture media |
| Diethylenetriaminepentaacetic acid (DTPA) | Sigma Aldrich | D6518-5G | |
| sodium chloride (NaCl) | Fisher Scientific | BP358-212 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| potassium phosphate dibasic (HK2PO4 ) | Fisher Scientific | BP363-500 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| potassium phosphate monobasic (KH2PO4 ) | Sigma Aldrich | P-5379 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| Krebs-Henseleit buffer (KHB) | (Alfa Aesar, Hill) | J67820 | |
| Bovine erythrocyte superoxide dismutase (SOD) | Sigma Aldrich | S7571-30KU | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma Aldrich | P1585-1MG | Dissolve in DMSO |
| Antimycin A (AA) | Sigma Aldrich | A8674-25MG | Dissolve in Ethanol and store in glass vials(MW used is the averaged molecular weights for four lots) |
| 1-Hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine . HCl (CMH) | Enzo Life Sciences | ALX-430-117-M050 | |
| 1-Hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine . HCl (CPH) | Enzo Life Sciences | ALX-430-078-M250 | |
| 1-Hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethylpiperidine, 1-Hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido]piperidinium dichloride ( mito-TEMPO-H) | Enzo Life Sciences | ALX-430-171-M005 | |
| 1-Hydroxy-2,2,6,6-tetramethylpiperidin-4-yl-trimethylammonium chloride . HCl (CAT1H) | Enzo Life Sciences | ALX-430-131-M250 | |
| Heparin | Sagent Pharmaceuticals | NDC 25021-400-10 | |
| Diphenyliodonium chloride | Sigma Aldrich | 43088 | |
| Deferoxamin mesylate salt | Sigma Aldrich | D9533-1G | |
| Critoseal | Leica | 39215003 | |
| BRAND disposable BLAUBRAND micropipettes, intraMark | Sigma Aldrich | 708733 | Capillaries |
| PTFE FRACTIONAL FLUOROPOLYMER TUBING 3/16” OD x 1/8” ID |
NORELL | 1598774A | Teflon tubing |
| SILICONE RUBBER STOPPERS FOR NMR SAMPLE TUBES FOR THIN WALL TUBES HAVING AN OD OF 4mm-5mm (3.2mm TO 4.2mm ID) TS-4-5-SR | NORELL | 94987 | |
| EMXnano Bench-Top EPR spectrometer | Bruker BioSpin GmbH | E7004002 | |
| EMX NANO TISSUE CELL | Bruker BioSpin GmbH | E7004542 |
References
- Kalyanaraman, B., et al. Measuring reactive oxygen and nitrogen species with fluorescent probes: challenges and limitations. Free Radical Biology and Medicine. 52 (1), 1-6 (2012).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magnetic Resonance in Medicine. 67 (6), 1827-1836 (2012).
- Elajaili, H. B., et al. Electron spin relaxation times and rapid scan EPR imaging of pH-sensitive amino-substituted trityl radicals. Magnetic Resonance in Chemistry. 53 (4), 280-284 (2015).
- Elajaili, H., et al. Imaging disulfide dinitroxides at 250 MHz to monitor thiol redox status. Journal of Magnetic Resonance. 260, 77-82 (2015).
- Halpern, H. J., et al. Oxymetry Deep in Tissues with Low-Frequency Electron-Paramagnetic-Resonance. Proceedings of the National Academy of Sciences of the United States of America. 91 (26), 13047-13051 (1994).
- Epel, B., et al. Imaging thiol redox status in murine tumors in vivo with rapid-scan electron paramagnetic resonanc. Journal of Magnetic Resonance. 276, 31-36 (2017).
- Legenzov, E. A., Sims, S. J., Dirda, N. D. A., Rosen, G. M., Kao, J. P. Y. Disulfide-Linked Dinitroxides for Monitoring Cellular Thiol Redox Status through Electron Paramagnetic Resonance Spectroscopy. Biochemistry. 54 (47), 6973-6982 (2015).
- Abbas, K., et al. Medium-throughput ESR detection of superoxide production in undetached adherent cells using cyclic nitrone spin traps. Free Radical Research. 49 (9), 1122-1128 (2015).
- Dikalov, S. I., et al. Distinct roles of Nox1 and Nox4 in basal and angiotensin II-stimulated superoxide and hydrogen peroxide production. Free Radical Biology and Medicine. 45 (9), 1340-1351 (2008).
- Dikalov, S. I., Kirilyuk, I. A., Voinov, M., Grigor'ev, I. A. EPR detection of cellular and mitochondrial superoxide using cyclic hydroxylamines. Free Radical Research. 45 (4), 417-430 (2011).
- Dikalova, A. E., et al. Therapeutic Targeting of Mitochondrial Superoxide in Hypertension. Circulation Research. 107 (1), 106-116 (2010).
- Dikalov, S. I., Polienko, Y. F., Kirilyuk, I. Electron Paramagnetic Resonance Measurements of Reactive Oxygen Species by Cyclic Hydroxylamine Spin Probes. Antioxidants & Redox Signaling. , (2017).
- Sharma, S., et al. L-Carnitine preserves endothelial function in a lamb model of increased pulmonary blood flow. Pediatric Research. 74 (1), 39-47 (2013).
- Berg, K., Ericsson, M., Lindgren, M., Gustafsson, H. A High Precision Method for Quantitative Measurements of Reactive Oxygen Species in Frozen Biopsies. PloS One. 9 (3), (2014).
- Kozlov, A. V., et al. EPR analysis reveals three tissues responding to endotoxin by increased formation of reactive oxygen and nitrogen species. Free Radical Biology and Medicine. 34 (12), 1555-1562 (2003).
- Van Rheen, Z., et al. Lung Extracellular Superoxide Dismutase Overexpression Lessens Bleomycin-Induced Pulmonary Hypertension and Vascular Remodeling. American Journal of Respiratory Cell and Molecular Biology. 44 (4), 500-508 (2011).
- Mouradian, G. C., et al. Superoxide Dismutase 3 R213G Single-Nucleotide Polymorphism Blocks Murine Bleomycin-Induced Fibrosis and Promotes Resolution of Inflammation. American Journal of Respiratory Cell and Molecular Biology. 56 (3), 362-371 (2017).
- Dikalov, S. I., Li, W., Mehranpour, P., Wang, S. S., Zafari, A. M. Production of extracellular superoxide by human lymphoblast cell lines: comparison of electron spin resonance techniques and cytochrome C reduction assay. Biochem Pharmacol. 73 (7), 972-980 (2007).
- Kozuleva, M., et al. Quantification of superoxide radical production in thylakoid membrane using cyclic hydroxylamines. Free Radical Biology and Medicine. 89, 1014-1023 (2015).
- Chen, K., Swartz, H. M. Oxidation of Hydroxylamines to Nitroxide Spin Labels in Living Cells. Biochimica Et Biophysica Acta. 970 (3), 270-277 (1988).



