Summary
Elektron paramagnetisch resonantie (EPR) spectroscopie is een eenduidige methode voor het meten van vrije radicalen. Het gebruik van selectieve spin sondes zorgt voor detectie van vrije radicalen in andere cellulaire compartimenten. Presenteren we een praktische, efficiënte methode voor het verzamelen van biologische monsters die behandeling, opslaan en overzetten van monsters voor EPR metingen te vergemakkelijken.
Abstract
De nauwkeurige en specifieke detectie van reactieve zuurstof soorten (ROS) in verschillende compartimenten voor cellulaire en weefsel is essentieel voor de studie van redox-gereglementeerde signalering in biologische instellingen. Elektron paramagnetisch resonantie spectroscopie (EPR) is de enige directe methode te beoordelen van vrije radicalen ondubbelzinnig. Het voordeel is dat fysiologische niveaus van specifieke soorten met een hoge specificiteit wordt gedetecteerd, maar het vereist gespecialiseerde technologie, zorgvuldige monstervoorbereiding en passende controles om ervoor te zorgen nauwkeurige interpretatie van de gegevens. Cyclische hydroxylamine spin sondes reageren selectief met superoxide of andere radicalen voor het genereren van een nitroxide-signaal dat kan worden gekwantificeerd door EPR spectroscopie. Cel-permeabele spin sondes en spin sondes ontworpen snel ophopen in de mitochondriën toestaan voor de bepaling van superoxide concentratie in andere cellulaire compartimenten.
In gekweekte cellen, het gebruik van cel permeabele 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine (CMH) samen met en zonder cel-ondoordringbare superoxide dismutase (SOD) voorbehandeling of gebruik van cel-permeabele PEG-SOD, voorziet in de differentiatie van extracellulaire van cytosolische superoxide. De mitochondriale 1-hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethyl-piperidine,1-hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido] piperidinium dichloride (mito-TEMPO-H) zorgt voor de meting van mitochondriale ROS (overwegend superoxide).
Spin sondes en EPR spectroscopie kunnen ook worden toegepast op de in vivo modellen. Superoxide kan worden opgespoord in extracellulaire vloeistoffen zoals bloed en alveolaire vloeistof, evenals weefsels zoals longweefsel. Verschillende methoden worden gepresenteerd voor het verwerken en opslaan van weefsel voor EPR metingen en leveren van intraveneuze 1-hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine (CPH) spin sonde in vivo. Terwijl metingen kunnen worden uitgevoerd bij kamertemperatuur, kunnen monsters verkregen van in vitro en in vivo modellen ook worden opgeslagen bij-80 ° C en geanalyseerd door EPR op 77 K. De monsters kunnen worden opgeslagen in gespecialiseerde buis stal bij-80 ° C en op 77 K om een praktische, efficiënte, en reproduceerbare methode die vergemakkelijkt opslaan en overdragen monsters worden uitgevoerd.
Introduction
Terwijl maatregelen van oxidatieve stress en reactieve zuurstof soorten belangrijk voor de studie van diverse ziekten over alle orgaansystemen zijn, is de detectie van reactieve zuurstof soorten (ROS) uitdagend als gevolg van een korte halfwaardetijd en hoge reactiviteit. Een elektron paramagnetisch resonantie (EPR) techniek is de meest duidelijke methode voor het opsporen van vrije radicalen. Spin sondes hebben voordelen ten opzichte van de meer gangbare TL sondes. Hoewel fluorescerende sondes zijn relatief goedkoop en gemakkelijk te gebruiken en bieden snelle, gevoelige detectie van ROS, hebben ze ernstige beperkingen als gevolg van artefactuele signalen, een onvermogen om ROS concentraties, en een algemeen gebrek aan specificiteit1 te berekenen .
Ter vergemakkelijking van het gebruik van EPR voor biologische studies, een aantal spin sondes hebben al gesynthetiseerd die een aantal biologisch relevante vrije radicalen soorten, alsmede pO2, pH en redox meten kan staat2,3, 4,5,6,7. Spin traps zijn ook ontwikkeld om te vangen kortstondige radicalen en vorm lang-leven adducten, die detectie door EPR8vergemakkelijkt. Beide klassen (spin sondes en spin traps) hebben voordelen en beperkingen. Een veelgebruikte klasse van spin sondes zijn cyclische hydroxylamines, die zijn EPR-stille en reageren met kortstondige radicalen vormen een stabiele nitroxide. Cyclische hydroxylamines reageren met superoxide 100 keer sneller dan spin traps, inschakelen van hen om te concurreren met cellulaire antioxidanten, maar zij gebrek aan specificiteit en vereisen het gebruik van de passende controles en remmers radicale soorten of bron te identificeren verantwoordelijk voor het nitroxide signaal. Terwijl de spin traps tentoonstelling specificiteit, met verschillende spectrale dat patronen is afhankelijk van de gevangen soorten, ze hebben langzame kinetiek superoxide spin overlapping en zijn gevoelig voor biologische afbraak van de radicale adducten. Toepassingen voor overvulling van de spin zijn geweest goed gedocumenteerd in biomedisch onderzoek9,10,11,12,13.
Het doel van dit project is om aan te tonen van praktische EPR methoden voor het ontwerpen van experimenten en voorbereiding van monsters te detecteren superoxide met behulp van spin sondes in andere cellulaire compartimenten in vitro en in verschillende weefsels compartimenten in vivo. Verschillende manuscripten hebt protocollen die relevant zijn voor deze doelstellingen, met behulp van cel-permeabele, cel-ondoordringbaar en mitochondriale gerichte spin sondes naar andere cellulaire compartimenten in vitro en proces doelweefsel p.a. in muismodellen gepubliceerd 14 , 15. we voortbouwen op dit lichaam van literatuur door het valideren van een aanpak voor het meten van superoxide met behulp van een 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine (CMH) spin sonde in het andere cellulaire compartimenten in vitro om ervoor te zorgen nauwkeurige metingen, benadrukken de mogelijke technische problemen kunnen vertekenen resultaten. Wij bieden ook methoden voor het uitvoeren van metingen van de EPR in bloed, bronchoalveolar lavage vloeistof en longweefsel met behulp van de CMH spin sonde. Deze studies vergelijken verschillende methoden voor het verwerken van de weefsels, alsmede het presenteren van een methode om een andere spin sonde, CPH, injecteren muizen vóór de oogst van weefsel. Ten slotte, ontwikkelen wij een praktische methode voor het opslaan van monsters in polytetrafluorethyleen (PTFE) buizen te maken voor de opslag en overslag van monsters vóór EPR metingen op 77 K.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Alle dierlijke studies werden goedgekeurd door de Universiteit van Colorado Denver institutionele Animal Care en gebruik Comité.
1. bereiding van reagentia
-
Diethylenetriaminepentaacetic zuur (DTPA) voorraad (150 mM)
- Voeg 2,95 g DTPA (393.35 g/mol) tot 10 mL gedeïoniseerd water.
- Te ontbinden DTPA, voeg 1 M NaOH ontkleuring en breng aan een pH van 7.0.
- Breng het volume aan 50 mL met water voor een eindconcentratie van DTPA van 150 mM, en bewaren bij 4 ° C.
-
Fosfaat buffer zoutoplossing (PBS) (50 mM, pH 7.4)
- 5 M van natriumchloride (NaCl) (58.44 g/mol; 29.22 g/100 mL) voor te bereiden.
- Bereiden van 1 M van kalium fosfaat dibasische HK2PO4 (174.18 g/mol; 17.42 g/100 mL)
- Bereiden 1 M van kalium fosfaat monobasisch KH2PO4 (136.1 g/mol; 13.61 g/100 mL). Meng 3 mL 5 M NaCl met 4.24 mL 1 M kalium fosfaat dibasische en 0.760 mL 1 M kalium fosfaat monobasisch. Controleer de pH.
- Breng het volume met gedeïoniseerd water tot 100 mL.
- Bewaren bij kamertemperatuur (RT) voor korte termijn (dagen) en bij 4 ° C voor opslag op lange termijn (weken).
-
Krebs-Henseleit buffer (KHB) met 100 µM DTPA
- Voeg 33.3 µL van 150 mM DTPA stockoplossing in 50 mL conische centrifugebuis.
- Een volume van 50 mL met Krebs-Henseleit buffer (KHB) brengen.
- Bereiden van verse buffer met DTPA elke dag en houd het op RT.
-
Tris-EDTA-buffer met sacharose
- 0.5 M Tris voorraad bereiden: Los 15.14 g voor Tris base (121.14 g/mol) in 150 mL gedeïoniseerd water. Met behulp van HCl, breng de pH op 7,8 en breng aan een eindvolume van 250 mL.
- Los 21.4 g van sacharose (342.29 g/mol; eindconcentratie = 0,25 mM) in 150 mL gedeïoniseerd water.
- Voeg 5 mL van Tris voorraad aan sacharose te bereiken van een 10 mM definitieve concentratie van Tris.
- Voeg toe 0,5 mL 0,5 M EDTA voorraad aan Tris-sacharose om een eindconcentratie van 1 mM.
- Controleer de pH en pas het aan 7.4.
- Breng aan een eindvolume van 250 mL met gedeïoniseerd water en bewaren bij 4 ° C.
-
Boviene erytrocyt Cu/Zn superoxide dismutase (SOD) voorraad (30.000 U/mL)
- Reconstrueren 30.000 U van SOD in 1 mL PBS (ongeveer 5,7 mg, afhankelijk van de activiteit van de ZODE veel).
- Meng goed, hoeveelheid, en opgeslagen bij-20 ° C voor korte termijn (6-12 maanden) en bij-80 ° C voor langdurige opslag.
-
SOD werkoplossing (1000 U/mL)
- Pipetteer een aliquoot 30 µL van 30.000 U/mL SOD voorraad in een 870 µL van steriele PBS.
- Bewaar deze oplossing op ijs en vers gebruiken.
-
Phorbol 12-myristaat 13-acetaat (PMA) voorraad (5 mM)
- Los 1 mg PMA (616.83 g/mol) in 325 µL van DMSO (eindconcentratie = 5 mM).
- Aliquot een PMA-oplossing van 5 mM en opslaan bij-20 ° C.
-
PMA werkoplossing (125 µM)
- Verdun een hoeveelheid van 10 µL van 5 mM PMA voorraad in 390 µL van steriele PBS.
- Bewaar deze oplossing op ijs en vers gebruiken.
- Gebruiken voor de controle van een voertuig voor PMA, 10 µL van DMSO in 390 µL van PBS.
-
Diphenyliodonium chloride (DIP) (2,5 mM)
- Los 3,2 mg (316.57 g/mol) duik in 4 mL tot het verkrijgen van een voorraad van 2.5 mM.
- Bereid de oplossing en gebruik het vers.
-
Deferoxamine mesylaat zout (DFO) (20 mM)
- Los 4.5 mg voor DFO (656.79 g / mol) in 340 µL te verkrijgen van een voorraad van 20 mM.
- Bereid de oplossing en gebruik het vers.
-
Voorbereiding van antimycin A (AA) voorraad (5 mM)
- Los 5.4 mg AA (532 g/mol) in 2 mL ethanol (eindconcentratie = 5 mM).
- Aliquot de voorraad in glazen flesjes en winkel bij-20 ° C.
-
Voorbereiding van de spin sondes
- Bubble 50 mM fosfaat buffer met 100 µM DTPA met stikstof gedurende 30 minuten om het gehalte aan opgeloste zuurstof te verwijderen uit de buffer.
- De sonde van de spin verwijderen uit de diepvries van-20 ° C en laat de container om te komen tot RT (10-15 min).
- Weeg 2,4 mg 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine· HCl (CMH) (237.8 g/mol)
- Los CMH in 1 mL van de gedeoxygeneerd fosfaatbuffer voor een eindconcentratie van 10 mM.
- Weeg 5 mg 1-hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethylpiperidine,1-hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido]piperidinium dichloride (mito-TEMPO-H) (529.1 g/mol).
- Los mito-TEMPO-H in 1 mL van de gedeoxygeneerd fosfaatbuffer voor een eindconcentratie van 9,5 mM.
- Weeg 4,9 mg 1-hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine· HCl (CPH) (223,7 g/mol).
- Los CPH in 1 mL van de gedeoxygeneerd fosfaatbuffer voor een eindconcentratie van 22 mM.
- Aliquot en winkel bij-80 ° C (bevriezen-ontdooien is niet aanbevolen).
2. opsporing van Superoxide in vitro
-
Detectie van totale extracellulaire en intracellulaire superoxide in RAW 264.7 PMA-gestimuleerd cellen op RT
- Volgende juiste aseptische techniek, ontdooi RAW 264.7 cellen en hen in DMEM media aangevuld met 10% FBS (laag endotoxine-gratis) en 1% antimycotic/ampicilline bij 37 ° C in CO2 incubator passage.
- Zaad RAW 264.7 cellen op 1 x 106 cellen per putje in 6-Wells-platen een dag voorafgaand aan de behandeling.
- Zachtjes Verwijder media en wassen van de cellen een keer met 1 mL van KHB buffer.
- Voeg KHB met 100 µM DTPA aan elk putje en behandelen in een totaal volume van 500 µL met het volgende:
- Wells voorbehandeld met SOD, voeg 15 µL per putje van SOD werkoplossing (1000 U/mL; eindconcentratie van SOD = 30 U/mL) en incubeer gedurende 10 minuten bij 37 ° C vóór toevoeging van de CMH en PMA.
- Toevoegen van 12,5 µL per putje van 10 mM CMH voorraad (eindconcentratie = 0,25 mM).
- Voeg toe 40 µL per putje van 125 µM PMA werkoplossing (eindconcentratie = 10 µM) of 40 µL voertuig (voorraad 10 µL van DMSO in 390 µL van PBS).
- Incubeer gedurende 50 minuten bij 37 ° C in een broedstoof CO2 .
- Verwijderen van de platen uit de incubator en leg ze direct op ijs.
- Verzamelen buffer van elk putje in aparte, 1,5 mL, het label van buizen. Houd op ijs in de gehele.
- Voeg 100 µL van verse KHB buffer met 100 µM DTPA voorzichtig schrapen van de cellen en resuspendeer door pipetteren op en neer meerdere malen. Houd op ijs in de gehele cel resuspensie.
- Belasting het monster verzameld in stappen 2.1.10 en 2.1.11 (50 µL) in elk van de capillaire buisjes. Zegel van beide uiteinden en voer de EPR.
Opmerking: Altijd testen van een buis of goed (zonder cellen) met de sonde in de buffer (dezelfde concentratie = 0,25 mM), behandelde onder dezelfde voorwaarden als de cellen (dezelfde incubatietijd en temperatuur) als een besturingselement, omdat de achtergrond intensiteit van de sonde is temperatuur - en tijd-afhankelijke. - De EPR overname parameters ingesteld op de volgende: magnetron frequentie = 9.65 GHz; veld = 3432 G; modulatie amplitude = 2,0 G; vegen breedte = 80 G; Magnetron vermogen = 19,9 mW; Totaalaantal scans = 10; vegen tijd = 12.11 s; en tijdconstante = 20.48 ms.
-
Detectie van mitochondriale superoxide in RAW 264.7 cellen
- Stappen 2.1.1 en 2.1.2 naar zaad RAW 264.7 cellen één dag voorafgaand aan het experiment.
- Verwijder media en wassen van de cellen een keer met 1 mL van KHB buffer.
- Voeg 200 µL van KHB met 100 µM DTPA aan elk putje.
- 5.3 µL per putje van 9,5 mM mito-TEMPO-H voorraad toevoegen (eindconcentratie = 0,25 mM)
- Incubeer gedurende 10 min op RT.
- Voeg 1 µL per putje van antimycin A (AA), 5 mM-stockoplossing in ethanol (eindconcentratie = 25 µM).
- Incubeer gedurende 50 minuten bij 37 ° C in een broedstoof CO2 .
- Verwijderen van de platen uit de incubator en leg ze direct op ijs.
- Voorzichtig schrapen van de cellen en resuspendeer door pipetteren omhoog en omlaag. Houd op ijs.
- Het laden van het monster in een capillaire buis. Beide uiteinden te verzegelen.
- Zie de vorige sectie voor EPR instelling.
-
Detectie van superoxide in RAW 264.7 cellen bij 77 K
- Plaats de buffer verzameld in stap 1.1.10 in vooraf bereid PTFE slang van 1-2 duim in lengte (3/16" OD x 1/8"-ID). Zorg ervoor dat de PTFE-buis is eenvoudig, zodat het gemakkelijk kan worden ingevoegd en verwijderd uit de vinger dewar. Gebruik een rubberstop Sluit één uiteinde van de PTFE-buis, de buffer of celsuspensie (100 tot 150 µL) Pipetteer in de PTFE-buis en verzegelen van de buis met een tweede stop.
- Flash bevriezing van het monster in vloeibare stikstof. Het monster kan worden overgebracht naar een gelabelde cryopreservatie buis voor opslag bij-80 ° C of onmiddellijk uitvoeren.
- Vul de vinger dewar met vloeibare stikstof en invoegen de PTFE-buis met het monster in de vinger dewar. Zorg ervoor dat het monster is gecentreerd in een actief tijdsbestek van de resonator en EPR draaien op 77 K.
Opmerking: Start de gasstroming stikstof aan uw spectrometer 15-30 min voordat de metingen, en blijven deze stroming in de metingen om te voorkomen dat de condensatie van het water in de resonator. - EPR overname parameters ingesteld op de volgende: magnetron frequentie = 9.65 GHz; veld = 3438 G; modulatie amplitude = 4,0 G; vegen breedte = 150 G; Magnetron vermogen = 0.316 mW; Totaalaantal scans = 10; vegen tijd = 60 s; en tijdconstante = 1,28 ms.
3. EPR metingen in vloeistoffen
-
Volbloed
- Muizen (8-12 weken oud) met een enkelvoudige dosis van intratracheale bleomycine (Bleo; 100 µL bij 1 U/mL) opgelost in PBS of PBS alleen als eerder beschreven16,17te behandelen.
- Euthanaseren muizen door het toedienen van geïnhaleerde Isofluraan (1.5-4%) gevolgd door exsanguination en cervicale dislocatie. Bloed via de rechterventrikel gecombineerd in een spuit bedekt met heparine (1000 USP/mL) met 100 µM DTPA en transfer naar een 1,5 mL-buis.
- In een aparte 1,5 mL-buis, voeg 15 µL van PBS met 100 µM DTPA en 3 µL van CMH (10 mM) tot 132 µL bloed voor een totaal volume van 150 µL en CMH eindconcentratie van 0,2 mM.
- Incubeer bloed gedurende 10 minuten bij 37 ° C in een waterbad.
- Verwijder de buizen uit het waterbad.
- Een aliquot deel te nemen door het bloed in een capillair laden en draaien EPR op RT met de volgende parameters van de EPR overname: magnetron frequentie = 9.65 GHz; veld = 3432 G; modulatie amplitude = 1,0 G; vegen breedte = 80 G; Magnetron vermogen = 19,9 mW; Totaalaantal scans = 3; vegen tijd = 12.11 s; en tijdconstante = 20.48 ms. ook monsters kan worden bevroren als beschreven in stap 2.3 flash voor metingen op 77 K. EPR overname parameters de volgende zijn: magnetron frequentie = 9.65 GHz; veld = 3438 G; modulatie amplitude = 4,0 G; vegen breedte = 150 G; Magnetron vermogen = 0.316 mW; Totaalaantal scans = 2; vegen tijd = 60 s; en tijdconstante = 1,28 ms.
-
Bronchoalveolar lavage vloeistof (BALF)
- Na euthanasie (zie stap 3.1.2), verzamelen BALF door langzaam wekken of intrekking van de 1 mL PBS met 100 µM DTPA driemaal in een spuit via een canule in de luchtpijp geplaatst.
- Behandelen in een buis 1,5 mL, 200 µL van BALF met 4 µL van CMH (10 mM) te verkrijgen van een eindconcentratie van 0,2 mM.
- BALF Incubeer gedurende 50 minuten bij 37 ° C in een waterbad.
- Neem buizen uit het waterbad en plaats ze op het ijs.
- BALF lading in een capillair en stormloop EPR op RT met dezelfde EPR instellingen zoals gebruikt in stap 1.1.13 of flash bevriezen in vloeibare stikstof, zoals beschreven in stap 2.3.
-
Metingen van de EPR in bloed en BALF op 77 K
- Volg het protocol hierboven om het verzamelen van bloed (stappen 3.1.1. aan 3.1.4) en BALF (stappen 3.2.1 tot en met 3.2.4).
- Plaats 150 µL van het behandelde bloed of BALF in PTFE slang (1-2 in). Gebruik een rubberstop Sluit één uiteinde van de PTFE-buis voorafgaand aan het monster en een andere stop te verzegelen de slang toe te voegen.
- Flash bevriezing van het monster in vloeibare stikstof.
- Zie sectie 2.3 voor meer informatie over het uitvoeren van de EPR in bevroren monsters in de PTFE-buis met de vinger die Dewar op 77 K. Run bevroren CMH bloedmonsters met behandeld in een week.
4. EPR metingen op longweefsel
-
Flash bevroren longweefsel
- Na het verzamelen van de BALF in stap 3.2.1, de borst is geopend en longen gespoeld met 10 mL van koude PBS via de rechterventrikel Schakel bloed. Flash bevriezen de longweefsel in vloeibare stikstof. Bevroren longweefsel kan worden achtergelaten bij-80 ° C voor maximaal 6 maanden tot gebruik voor EPR metingen.
- Stabiliseren van het longweefsel op droog ijs met een pincet en meerdere kleine stukjes (5-15 mg) van het longweefsel met behulp van een single-edge mes gesneden.
- Wegen van het weefsel in een tube van 1,5 mL, plaats de buis op de schaal en tarra van de schaal, dan toevoegen van stukjes weefsel en het gewicht.
- Voeg aan het weefsel in de 1,5 mL-buis, 196 µL van KHB met DTPA en 4 µL van CMH (0.2 mM), zodat het bereiken van een 200 µL totaal volume.
- Incubeer gedurende 1 uur bij 37 ° C in een waterbad.
- Spin down (voor een paar seconden) in een microcentrifuge bij 3,884 x-g.
- Plaats op ijs en Pipetteer 150 µL van de bovendrijvende substantie in de PTFE-buis en bevriezen voor de 77 K metingen zoals beschreven in punt 2.3.
Opmerking: Voor deze methode, de heterogeniteit van de schade moet worden beschouwd. Voor een blessure van bleomycine-geïnduceerde Long, gezien het feit dat het een zeer heterogene blessure, is het aanbevolen om het Knip verschillende weefsel stukken uit verschillende delen van de Long van elke muis. Anderzijds kan een groter stuk weefsel worden gehomogeniseerd in KHB buffer met 100 µM DTPA met een onderlinge verhouding van 1:6, gewicht-naar-volume (mg/µL) zoals hieronder beschreven.
-
Verse longweefsel bewaard in sacharose buffer
- Spoel de lavaged longen met koude PBS bloed verwijderen, zoals gedaan in stap 3.1.2.
- Meng het verse longweefsel in Tris-EDTA-buffer met 0,25 M sacharose met een verhouding van 1:6 Long/buffer (mg/µL) Dounce weefsel grinder met een glas of PTFE stamper.
- 50 µL van de Long homogenaat aan 450 µL van KHB met 100 µM DTPA toevoegen.
- Voeg in een 1,5 mL buis (in een totaal volume van 100 µL), aan 98 µL van longkanker homogenaat in KHB, 2 µL van CMH van 10 mM materieel te verkrijgen van een eindconcentratie van 0,2 mM.
- Incubeer gedurende 20 minuten in een waterbad 37 ° C.
- Leg de monsters op ijs en ze laden in een capillaire buis. EPR op RT (instellingen gebruikt in stap 2.1.13) uitvoeren.
- Om te testen de bijdrage van bepaalde soorten en bronnen met behulp van verschillende remmers, vooraf 88 µL van longkanker homogenaat +/-remmer, aanpassen met KHB tot een eindvolume van 98 µL te behandelen. In dit experiment, inbegrepen de remmers 10 µL van SOD (100 U/mL), 4 µL van deferoxamine (DFO; eindconcentratie = 800 µM), of 4 µL van diphenyliodonium chloride (DIP; eindconcentratie = 100 µM). Incubeer gedurende 20 minuten bij 37 ° C in een waterbad.
- Voeg 2 µL van CMH en incubeer gedurende een ander 20 minuten bij 37 ° C, gevolgd door EPR metingen zoals hierboven beschreven. Omvatten een eenmalige gecompenseerde blancomonster met CMH KHB met sacharose buffer. U kunt ook opslaan aliquots van de overblijvende Long homogenates (stap 3.1.2) bij-80 ° C voor toekomstige metingen.
Opmerking: Het totale volume kan worden aangepast zoals nodig.
-
EPR metingen op longweefsel van muizen ingespoten met spin sondes in vivo (bij RT met weefsel-cel)
- CPH-stockoplossing voorbereiden door ontbinding van 4,9 mg CPH in 1 mL gefilterde en gedeoxygeneerd 50 mM fosfaatbuffer.
- Anesthetize muizen met geïnhaleerde Isofluraan (1.5-4%) voor 20-30 seconden totdat niet-reagerende tot teen snuifje. Injecteren van muizen via de route van de retroorbital met 100 µL van CPH spin sonde voor een lichaamsgewicht van 25 g muis (laatste dosis = 20 mg/kg), en laat de sonde te circuleren voor 1 h. onmiddellijk na retroorbital injectie, een daling van 0,5% proparacaine HCl op de oogcontour aan preve toevoegen NT oog pijn en droogte. Muizen voor 1 h controleren en ga naar het weefsel oogsten.
- Oogst van het longweefsel, zoals hierboven beschreven en flash bevriezen de longen.
- Knippen van 20-30 mg van bevroren weefsel op droog ijs en het exacte gewicht opnemen.
- Veeg voorzichtig het weefsel met schoonmaak doekjes om elk oppervlak water absorberen.
- Plaats het weefsel binnen het venster van de weefsel-cel (een accessoire maakt EPR metingen voor weefselsteekproeven) en EPR en controleer of totaal draaiingen worden uitgevoerd. De gegevens kan worden uitgedrukt als de totale draaiingen per mg van weefsel.
5. de gegevensanalyse
- De EPR spectra met behulp van de SpinFit module opgenomen in de software van de Xenon van de Bank-top EMXnano EPR spectrometer simuleren. Bepaal de concentratie van nitroxide door de SpinCount module. U kunt ook een ijkkromme van een stabiel nitroxide zoals 4-hydroxy-TEMPO of TEMPOL kan worden gemaakt, en de concentratie kan worden verkregen door het vergelijken van de intensiteit van het signaal met het monster en de standaard.
- Gebruiken voor de gegevens verzameld bij 77 K, dubbele integratie gevolgd door SpinCount.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Superoxide detectie met behulp van CMH werd gevalideerd met behulp van de X / XO superoxide genereren systeem om aan te tonen dat de nitroxide (CM.)-signaal was volledig geremd door SOD, terwijl katalase had geen effect (figuur 1A). De totale, extracellulaire superoxide was het vervolgens geëvalueerd in RAW 264.7 cellen door drachtige cellen met de cel-permeabele CMH spin sonde +/-SOD voorbehandeling. De concentratie van de nitroxide werd gemeten in zowel de celsuspensie en buffer, dat aangetoond heeft dat de waarden in de twee types van de steekproef vergelijkbaar als gevolg van de permeabele aard en snelle evenwichtsinstelling van de spin-sonde (figuur 1B waren). De radicale signaal van nitroxide stegen in RAW 264.7 cellen gestimuleerd met PMA in vergelijking met cellen. Dit signaal werd aanzienlijk verzwakt in cellen die zijn voorbehandeld met cel-ondoordringbare SOD (Figuur 1 c). Elke kleur vertegenwoordigt wells getest op verschillende dagen, het aantonen van de consistentie van gegevens die zijn verzameld op specifieke dagen en reproduceerbaarheid van de resultaten over een periode. De concentratie van de extracellulaire superoxide werd bepaald door het aftrekken van het signaal in de cellen van de PMA voorbehandeld met SOD van het signaal na de PMA in het ontbreken van SOD (T). De resterende signaal werd toegeschreven aan intracellulaire superoxide (Figuur 1 c). Figuur 1 d illustreert de berekening van de totale en extracellulaire superoxide. (E) de intracellulaire signaal werd bevestigd in de PMA-behandelde cellen na verwijdering van de media en door het effect van PEG-SOD op het signaal. In deze grafiek, in tegenstelling tot (C), de CMH blanco was niet afgetrokken van de metingen en de ruwe gegevens wordt weergegeven.
Mitochondriale superoxide in RAW 264.7 cellen werd ontdekt met behulp van de EPR spin sonde mito-TEMPO-H, die hoopt zich op in mitochondia. (A) vertegenwoordiger EPR spectra voor het signaal van de mito-TEMPO-H basislijn in de buffer, de verhoogde mito-TEMPO-H-signaal in cellen (Con) en het verder verbeterde signaal in cellen gestimuleerd met de mitochondriale Antimycin A (AA)-remmer. De toename van het signaal werd toegeschreven aan de mitochondriale superoxide gebaseerd op onze vorige onderzoek waaruit blijkt dat die SOD2 overexpressie aanzienlijk verzwakte metingen met mito-TEMPO-H10. In figuur 2B, werd de concentratie van de mitochondriale nitroxide bepaald door het aftrekken van het signaal van de mito-TEMPO-H in tijd-matched buffer van de metingen van de cel. De CM. signaal verkregen bij lage temperaturen in RAW 264.7 cellen na stimulatie met PMA in de aanwezigheid en de afwezigheid van SOD. (Figuur 3A) Het signaal van de CM. was verzwakt bij aanwezigheid van SOD, consistent met de kamertemperatuur gegevens (Figuur 1). Figuur 3B toont de foto van de PTFE-buis met de stoppers gebruikt om gegevens bij 77 K voor cellen en in vivo monsters te verzamelen. Superoxide productie werd ontdekt in bloed en BALF met behulp van de CMH spin sonde. Bloed of BALF monsters werden verzameld uit muizen PBS - en Bleo-testgroep en onmiddellijk geïncubeerd met CMH. De monsters werden overgedragen aan de PTFE-buis en de flitser bevroren en EPR gegevens zijn verzameld op 77 K. De concentratie van nitroxide (CM.) verzameld in bloed geïncubeerd met CMH (0.2 mM) op 37 graden gedurende 10 minuten (figuur 4A). Nitroxide (CM.) concentratie van BALF ge¨ uncubeerd 50 min (figuur 4B). Concentratie van de Nitroxide staat voor de concentratie van (.CM) opgebouwd in hoeveelheid bloed of BALF gebruikt in het experiment.
Drie methoden zijn getest om te evalueren van verschillende gepubliceerde technieken voor weefsel behoud en beheer van spin sondes ex vivo vs. in vivo. Wilt uitvoeren EPR metingen op longweefsel, we eerst gebruikt flash bevroren longweefsel van controle of gewond muizen. Figuur 5A toont de totale CM. signaal in het supernatant van een klein stukje longweefsel geïncubeerd bij 37 ° C met CMH in PBS - en Bleo-testgroep muizen, respectievelijk. Als gevolg van de heterogeniteit van de long letsel na de Bleo behandeling, is het aanbevolen om gesneden stukken uit verschillende regio's van de longen en het gemiddelde van verschillende afmetingen om te zorgen voor een meer representatieve waarde. Anderzijds kan het homogeniseren van de gehele Long en gebruik één monster van deze homogenaat. Gegevens verzameld bij 77 K met behulp van de PTFE-buis en vinger dewar. Figuur 5B toont representatieve spectra van nitroxide (CM.) signalen van PBS - en Bleo-testgroep muizen, respectievelijk.
Een beperking aan de behandeling van longkanker weefsel ex vivo is dat het is niet mogelijk om op een betrouwbare manier onderscheiden extracellulaire van intracellulaire superoxide als gevolg van de verwerking van het weefsel dat celmembranen verstoort. Als deze informatie belangrijk voor de experimentele vraag is, kan het worden aangepakt met behulp van de in vivo CPH instillation onderstaande methode. Bevroren weefsel kan niet worden gebruikt om te beoordelen van mitochondriale superoxide; Niettemin, voor deze meting het protocol kan worden aangepast aan de mito-TEMPO-H in het weefsel of vers geïsoleerde mitochondriën gebruikt worden.
Als een tweede werkwijze voor EPR metingen in longweefsel, was verse weefsel gehomogeniseerd in sacharose buffer. De Long homogenaat was geïncubeerd met CMH sonde in KHB buffer met DTPA. EPR-metingen werden uitgevoerd bij RT. figuur 6A toont de toename van de CM. met Bleo. We presenteerden een extra worden getest met behulp van verschillende remmers die kunnen worden gebruikt om te bepalen van de soorten die aan de CM. bijdragen signaal. Om de oorsprong van CM. signaal gegenereerd op basis van longweefsel te verhelderen, voorbehandeld we de Long homogenates met verschillende aaseters en enzymen remmers. Long homogenates werden geïncubeerd met CMH in de afwezigheid of de aanwezigheid van SOD, deferoxamine (DFO) en diphenyliodonium chloride (DIP) ter verantwoording (respectievelijk) voor de bijdragen van superoxide, ijzer of superoxide gegenereerd van flavin-bevattende enzymen (figuur 6B). Deze aanpak kan worden aangepast aan het beoordelen van het specifieke radicale soorten gegenereerd in een systeem of verhelderen van de bijdrage van andere enzymatische bronnen (bv., NOX, eNOS of xanthine oxidase).
Muizen werden ingespoten met CPH spin sondes (20 mg/kg) via de route van de retroorbital voor het uitvoeren van EPR metingen in vivo. Het is onbekend CMH of veilig kan worden toegediend aan dieren, terwijl de CPH-sonde is gemeld als niet-toxisch; Dus, we geselecteerd CPH voor de in vivo experimenten. Weefsels van de longen werden geoogst en flash ingevroren in vloeibare stikstof 1 h na verspreiding van CPH sondes. Muizen kunnen gelijktijdig behandeld worden met specifieke anti-oxyderend om te onderscheiden van de soorten die verantwoordelijk zijn voor het signaal. Figuur 7A toont de hogere CP. signaal in muizen met Bleo-behandeld in vergelijking met controle muizen. Representatieve spectra van longweefsel van controle- en Bleo-behandelde muizen staan in figuur 7B. Een gemengde EPR spectra van CP. en ascorbinezuur radicaal werd waargenomen. De waarden die zijn gemeld in de figuur 7A zijn de concentraties van CP. onderdelen. Gegevens waren verzameld op RT met de weefsel-cel.
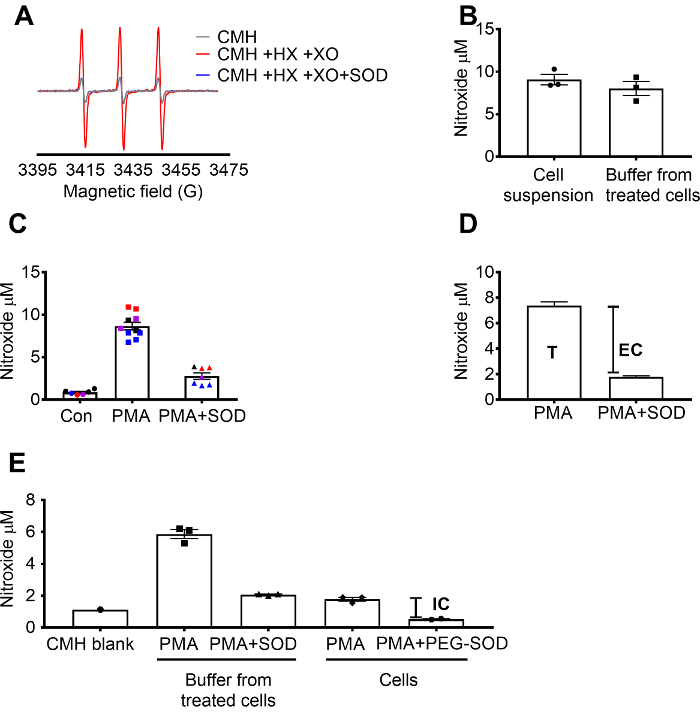
Figuur 1: detectie van superoxide in verschillende cel compartimenten. (A) EPR spectra gegenereerd door 0,25 mM CMH in 0.5 mM hypoxanthine/xanthine oxidase (8 mU/mL) met en zonder SOD (30 U/mL). (B) RAW 264.7 cellen (1 x 106 cellen/well) werden gestimuleerd met 10 µM PMA in aanwezigheid van de CMH voor 50 minuten bij 37 ° C en nitroxide concentratie (µM) gedetecteerd in celsuspensie (cellen + buffer) en buffer verzameld van de behandelde cellen. (C) RAW 264.7 cellen werden gestimuleerd met PMA vs. voertuig controle (Con). Één set cellen werden voorbehandeld gedurende 10 minuten met 30 U/mL cel-ondoordringbare SOD (PMA + SOD). Elke kleur staat voor gegevens van verschillende experimentele dagen en elk punt vertegenwoordigt cellen van een individu goed. Het signaal van de nitroxide in een tijd-matched blanco met CMH in KHB werd afgetrokken van elk signaal om definitieve waarden te verkrijgen. (D) berekening van de totale en extracellulaire superoxide in PMA gestimuleerd cellen; T = totale superoxide, EG = extracellulaire superoxide (SOD inhibitable signaal). (E) om te beoordelen van het intracellulaire superoxide-signaal (IC), werd het signaal in de buffer na de PMA + SOD vergeleken met de PMA-behandelde cellen na de verwijdering van de buffer. Om te bevestigen, werden wells voorbehandeld met 60 U/mL cel-permeabele PEG-SOD voor 1,5 uur om de intracellulaire SOD inhibitable. De tijd-matched CMH leeg wordt weergegeven, en gegevens overeen met absolute nitroxide signaal. Gegevens uitgedrukt als gemiddelde ± SEM. Klik hier voor een grotere versie van dit cijfer.

Figuur 2: detectie van mitochondriale superoxide in ruwe cellen gestimuleerd met antimycin A. (A) representatieve spectra van de mitochondriale-specifieke EPR spin probe, 0,25 mM mito-TEMPO-H in RAW 264.7 cellen zonder (Con) of met 25 µM antimycin A (AA) gedurende 50 minuten bij 37 ° C. (B) CM. concentratie (µM) in cellen die zijn behandeld met AA in vergelijking met controle. Het signaal van de nitroxide van een tijd-matched mito-TEMPO-H leeg was afgetrokken van het totale signaal om definitieve waarden te verkrijgen. Gegevens uitgedrukt als gemiddelde ± SEM. Klik hier voor een grotere versie van dit cijfer.

Figuur 3: detectie van superoxide in RAW 264.7 cellen bij 77K. (A) RAW 264.7 cellen gestimuleerd met 10 µM PMA en EPR spin sonde, CMH 0,25 mM (50 minuten bij 37 ° C) en (zwart) of zonder (rood) voorbehandeling met 30 U/mL SOD. 100 µL van het supernatans dat is geladen in een 1-inch in lengte stuk van PTFE-buis, dan flash ingevroren in vloeibare stikstof. De stoppers werden verwijderd, en bevroren PTFE-buis werd geplaatst in de vinger dewar voor data-acquisitie op 77 K. (B) een foto van de PTFE-buis en stoppen. Klik hier voor een grotere versie van dit cijfer.

Figuur 4: EPR metingen in bloed en BALF van controle en muizen bleomycine-behandeld. Muizen werden behandeld met een enkelvoudige dosis van intratracheale bleomycine (IT Bleo) (100 µL bij 1 U/mL) of PBS voertuig. 7 dagen, waren muizen verdoofd en euthanized. Bloed was verzameld via recht ventriculaire punctie in een spuit bedekt met 1000 USP/mL heparine met 100 µM DTPA. Bronchoalveolar lavage vloeistof (BALF) werd verzameld door lavaging de longen met 1 mL 100 µM DTPA in PBS. Bloed en BALF waren ge¨ uncubeerd 10 of 50 min, respectievelijk met 0,2 mM CMH bij 37 ° C. 150 µL bloed of BALF is geladen in PTFE slang flitser ingevroren in vloeibare stikstof en EPR gegevens verzameld bij 77 K met behulp van een vinger dewar. Gegevens nitroxide concentraties in het bloed (A) en (B) BALF weergeven van PBS - en Bleo-testgroep muizen (n = 4-6). Gegevens uitgedrukt als bedoel ± SEM. (C) Representative spectra van nitroxide in het bloed van de PBS - en Bleo-testgroep muizen. Klik hier voor een grotere versie van dit cijfer.

Figuur 5: EPR metingen in flash bevroren longweefsel. Muizen werden behandeld met een enkelvoudige dosis van intratracheale bleomycine (IT bleo) (100 µL bij 1 U/mL) of PBS voertuig. 7 dagen, werden de longen gespoeld met koud PBS te verwijderen van bloed en flash ingevroren in vloeibare stikstof. 5-15 mg van flash-bevroren longweefsel was geïncubeerd met 0,2 mM CMH in KHB met 100 µM in 200 µL van totale volume gedurende 1 uur bij 37° C. Supernatant was verzameld en geplaatst in de PTFE-buis en draaien op 77 K in de vinger dewar. (A) Nitroxide concentratie (µM van nitroxide genormaliseerd naar 1 mg van weefsel). Gegevens vertegenwoordigen het gemiddelde van 2-3 metingen voor elke Long. Gegevens uitgedrukt als betekenen ± SEM. B representatieve spectra van nitroxide in longweefsel van PBS - en Bleo-testgroep muizen. Klik hier voor een grotere versie van dit cijfer.

Figuur 6: EPR metingen in longweefsel bewaard in sacharose buffer. Muizen werden behandeld met een enkelvoudige dosis van intratracheale bleomycine (100 µL bij 1 U/mL). Bij 7 dagen na de behandeling, de longen werden gespoeld met koud PBS te verwijderen van bloed en verse longweefsel was gehomogeniseerd in Tris-EDTA-buffer met 0,25 mM sacharose met een onderlinge verhouding van 1:6 longkanker gewicht/buffer volume (mg/µL). 50 µL van longkanker homogenaat was gepreïncubeerd met KHB met of zonder de volgende remmers gedurende 20 minuten bij 37 ° C: SOD (100 U/mL), deferoxamine (DFO; 800 µM) en diphenyliodonium chloride (DIP; 100 μM) gevolgd door incubatie met 0,2 mM CMH in KHB met 100 µM DTPA gedurende 20 minuten bij 37 ° C. Gegevens werd verkregen op RT met behulp van EPR capillaire buisjes. (A) Nitroxide concentratie in longen van PBS - en Bleo-testgroep muizen. (B) Nitroxide concentratie in Bleo longen in de afwezigheid of de aanwezigheid van inhibitors (n = 3). Gegevens uitgedrukt als gemiddelde ± SEM. Klik hier voor een grotere versie van dit cijfer.

Figuur 7: EPR metingen in longweefsel van muizen met CPH spin sonde geïnjecteerd. 100 µL van CPH was toegediend via retroorbital injectie voor een eindconcentratie van 20 mg van CPH per kg lichaamsgewicht. Na 1 h voor verkeer, muizen werden euthanized, longen werden gespoeld met 10 mL van koude PBS via de rechterventrikel en longweefsel flash was bevroren. 20 tot 30 mg van longweefsel werd geplaatst in weefsel-cel en EPR metingen verricht op RT. (A) gegevens uitgedrukt als draaiingen / mg. (B) de vertegenwoordiger spectra van nitroxide signaal in PBS en Bleo weefsels van de longen (* geeft aan dat de overlapping met ascorbinezuur radicale). Gegevens uitgedrukt als gemiddelde ± SEM. Klik hier voor een grotere versie van dit cijfer.
| Remmers | Soorten |
| Superoxide dismutase (SOD) | Extracellulaire superoxide |
| Superoxide dismutase-polyethyleenglycol (PEG-SOD) | Intracellulaire superoxide |
| Katalase | Waterstofperoxide gebaseerd radicalen |
| •Uraat | Peroxynitrate |
| Ethanol en DMSO | Hydroxyl radicaal |
| Metalen chelaatvormers | Metaalionen (ijzer en koper) |
Tabel 1. Gemeenschappelijke remmers gebruikt om te onderscheiden soorten verantwoordelijk voor spin sonde oxidatie.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
De beoordeling van de productie van vrije radicalen in biologische instellingen is belangrijk in begrip redox geregeld signalering bij gezondheid en ziekte, maar de maatregel van deze soorten is zeer uitdagend vanwege de korte halfwaardetijd van vrije radicalen soorten en technische beperkingen met veelgebruikte methoden. EPR is een waardevolle en krachtige tool in de redox biologie, want het is de alleen ondubbelzinnig methode voor het opsporen van vrije radicalen. In dit project, tonen we praktische EPR methoden voor het ontwerpen van experimenten en voorbereiding van monsters te detecteren ROS met behulp van spin sondes in andere cellulaire compartimenten in vitro en verschillende weefsel compartimenten in vivo. Wij bieden ook praktische methoden voor hanteren van biologische monsters en opslaan van monsters om efficiëntie te verbeteren.
Spin sondes efficiënt reageren met ROS en produceren een stabiele radicale nitroxide die kan worden opgespoord met EPR. Verscheidene derivaten van de spin-sonde (cyclische hydroxylamine) hebben zijn gesynthetiseerd met verschillende permeabiliteit kenmerken vertonen, waardoor ze geschikt zijn voor het opsporen van de productie van vrije radicalen in andere cellulaire compartimenten10. Dit protocol gebruikt de cel-permeabele spin sonde, CMH; echter kan de ondoordringbare spin sonde 1-hydroxy-2,2,6,6-tetramethylpiperidin-4-yl-trimethylammonium chloride HCl (CAT1H) worden gebruikt om op te sporen van extracellulaire superoxide. Gelijkaardig aan onze voorafgaande studie van menselijke lymfoblast cel lijnen18, konden we gebruik van de permeabele CMH spin sonde met ondoordringbare SOD valideren en cel permeabele PEG-GRASZODE in RAW264.7 cellen (een muis Long macrofaag cellijn) gestimuleerd met PMA te onderscheid maken tussen extracellulaire en intracellulaire superoxide.
We ook de snelle evenwichtsinstelling van CMH tussen de compartimenten voor de intra - en extra - cellular gevalideerd, en we vonden ook dat het superoxide-signaal in cellen druppels aanzienlijk na het wassen van de cellen slechts eenmaal met KHB (gegevens niet worden weergegeven). We bevestigden nut van de mitochondriale specifieke spin sonde mito-TEMPO-H in RAW 264.7 cellen voor het meten van de verhoogde mitochondrial superoxide gegenereerd na stimulatie met mitochondriaal elektronentransport keten remmer antimycin A. De specifieke bijdrage van mitochondriale superoxide productie tot de mito-TEMPO-H eerder is aangetoond en kan worden gevalideerd in experimenten met behulp van geïsoleerde verse mitochondriën of systemen met mitochondriale superoxide dismutase MnSOD (SOD2) overexpressie10.
De beoordeling van ROS productie in vivo vormt een bijzondere uitdaging, maar de mogelijkheid om op te sporen van de productie van specifieke ROS geeft belangrijke informatie bij het ondervragen van de rol van oxidatieve stress of redox geregeld signalering in biologische Instellingen. De juiste behandeling van weefsel bij het gebruik van de spin sondes en EPR is essentieel om reproduceerbare en zinvolle resultaten te genereren. Het gebruik van spin sondes met weefsel zal niet waarschijnlijk maatregel superoxide radicalen presenteren ten tijde van het weefsel oogsten als gevolg van een korte halfwaardetijd, maar in plaats daarvan het detecteert superoxide geproduceerd door enzymen zoals NAPDH oxidase, afgekoppeld endothelial stikstofoxide synthase , of xanthine oxidase wanneer longweefsel of homogenates worden geïncubeerd met de spin-sonde bij 37 ° C. Het gebruik van bevroren weefsel zal niet omvatten superoxide gegenereerd door mitochondriën, sinds de bevriezing schade mitochondriaal elektronentransport keten activiteit. Als u wilt testen van mitochondriale superoxide, moeten onderzoekers isoleren verse mitochondriën of gebruik mitochondriale specifieke sondes in vivo of in verse weefsel.
Verscheidene verschillende protocollen voor het behoud van weefsel zijn gepubliceerd in de literatuur14,15. We vergeleken drie gepubliceerde methoden voor EPR metingen in longweefsel: 1) de flits weefsel ingevroren in vloeibare stikstof, 2) homogenisatie weefsel in sacharose buffer en 3) behandeling van muizen in vivo met een spin sonde 1 uur vóór het oogsten van weefsel. We vergeleken de controle muizen aan muizen met ernstige long ontstekingen en oxidatieve stress veroorzaakt door bleomycine voor het testen van elke methode de mogelijkheid om consistent verschillen in nitroxide signalen vertonen gewonde longen. Alle drie de methoden toonde een soortgelijke relatieve stijging in nitroxide signaal in de longen van bleomycine behandeld muizen. Het gebruik van flash bevroren weefsel zou waarschijnlijk de beste aanpak voor het verzamelen van weefsel voor meeste labs, ontkenning van de noodzaak voor het verwerken van weefsel in de buffer van sucrose op het moment van oogsten. De injectie van CPH te vangen vrije radicalen in vivo is krachtig, maar om te bevestigen de specifieke soorten, dit vereist een behandelde groep met inbegrip van de passende antioxidant.
Een uitdaging van het gebruik van de spin sondes is dat de oxidatie van spin sondes te nitroxide een vergelijkbaar spectrum van drie regels EPR ongeacht de soort die verantwoordelijk is voor de oxidatie genereert; dus maakt het geen onderscheid tussen verschillende soorten van de ROS. Het is ook gemeld dat er potentiële reacties van hydroxylamine sondes met fotosynthetische elektronentransport ketting en cytochroom c oxidase19,20 zijn. Deze opmerkingen moeten worden overwogen bij de interpretatie van de resultaten. In dit protocol, het fotosynthetische systeem niet aanwezig is en de opname van DTPA met de buffer remt potentiële verontreiniging van gratis ijzer(III) en koper-ionen10 . We laten zien hoe met een reeks specifieke enzymen of chelaatvormers in longweefsel om de bijdrage van bepaalde ROS of enzym remmers om de bron van ROS te bepalen. Deze aanpak is eerder met EPR gebruikt om te bepalen van de bijdrage van ROS als gevolg van afgekoppeld eNOS13,15. Wij bieden een lijst van gemeenschappelijke remmers gebruikt om te onderscheiden soorten verantwoordelijk voor spin sonde oxidatie (tabel 1).
We toonden ook het belang van het optimaliseren van de incubatietijd voor elke experimentele voorwaarde. Bij het vergelijken van spin sondes te draaien vallen, spin traps genereren unieke spectra afhankelijk van de reactieve waarmee voor de specificiteit van de vrije radicalen soorten; echter ze ook langzaam kinetiek vertonen voor superoxide spin vangen en zijn gevoelig voor biologische afbraak. De behandeling van longweefsel met de EPR sonde ex vivo wordt ook beperkt door een onvermogen om voldoende onderscheid extracellulaire van intracellulaire superoxide als gevolg van de verstoring van celmembranen tijdens de verwerking van het weefsel (bevriezing of homogenisatie). Gebruik van de geïnjecteerde spin sonde in vivo juncto SOD of cel-permeabele PEG-SOD kan dit probleem worden aangepakt.
Één doel was om een protocol om efficiënt verzamelen van monsters en bewaar ze bij-80 ° C vóór EPR metingen. Daarom ontwikkelden we een praktische methode om met behulp van de PTFE-buis voor het houden van de monsters. Deze buis is geplaatst rechtstreeks in de vinger dewar p.a. EPR bij 77 K zonder de noodzaak om de dewar tussen monsters schoon te maken. Dit is een alternatief voor de onlangs gepubliceerde methode waarbij de bevriezing van de monsters in 1 mL spuiten. De metingen in bevroren monsters opgeslagen in PTFE-buis kunnen worden herhaald gedurende een aantal dagen om aan te tonen van de stabiliteit van het signaal. Deze aanpak zorgt voor de EPR-metingen batching en vergemakkelijkt de overdracht van de monsters tussen laboratoria zodat een externe EPR-faciliteit monsters kunt uitvoeren.
Deze protocollen zorgen over het geheel genomen een eenvoudige benadering aan de voorbereiding van cellen en weefsels voor EPR metingen in biologische systemen. De protocollen kunnen worden aangepast aan andere modellen verband met oxidatieve stress en het gebruik van andere spin-sondes. De timing en de concentratie van de spin-sonde zal moeten worden aangepast voor elke experimentele voorwaarde. Het vermogen van de EPR te bepalen van de aanwezigheid en de productie van vrije radicalen soorten ondubbelzinnig biedt strengheid aan experimentele benaderingen op het gebied van redox biologie.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
De auteurs hebben niets te onthullen.
Acknowledgments
Dit werk werd gesteund door de Universiteit van Colorado-School van geneeskunde Dean's strategische onderzoeksinfrastructuur award, R01 HL086680-09 en 1R35HL139726-01, E.N.G. en UCD CFReT fellowship Award (HE). De auteurs bedanken Dr. Sandra Eaton en Dr. Gareth Eaton (Universiteit van Denver), Dr. Gerald Rosen en Dr. Joseph P. Kao (Universiteit van Maryland), Dr. Sujatha Venkataraman (Universiteit van Colorado Denver) voor nuttige discussies en Joanne Maltzahn, Ashley Trumpie en Ivy McDermott (Universiteit van Colorado Denver) voor technische ondersteuning.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM | LifeTech | 10566-016 | cell culture media |
| Diethylenetriaminepentaacetic acid (DTPA) | Sigma Aldrich | D6518-5G | |
| sodium chloride (NaCl) | Fisher Scientific | BP358-212 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| potassium phosphate dibasic (HK2PO4 ) | Fisher Scientific | BP363-500 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| potassium phosphate monobasic (KH2PO4 ) | Sigma Aldrich | P-5379 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| Krebs-Henseleit buffer (KHB) | (Alfa Aesar, Hill) | J67820 | |
| Bovine erythrocyte superoxide dismutase (SOD) | Sigma Aldrich | S7571-30KU | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma Aldrich | P1585-1MG | Dissolve in DMSO |
| Antimycin A (AA) | Sigma Aldrich | A8674-25MG | Dissolve in Ethanol and store in glass vials(MW used is the averaged molecular weights for four lots) |
| 1-Hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine . HCl (CMH) | Enzo Life Sciences | ALX-430-117-M050 | |
| 1-Hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine . HCl (CPH) | Enzo Life Sciences | ALX-430-078-M250 | |
| 1-Hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethylpiperidine, 1-Hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido]piperidinium dichloride ( mito-TEMPO-H) | Enzo Life Sciences | ALX-430-171-M005 | |
| 1-Hydroxy-2,2,6,6-tetramethylpiperidin-4-yl-trimethylammonium chloride . HCl (CAT1H) | Enzo Life Sciences | ALX-430-131-M250 | |
| Heparin | Sagent Pharmaceuticals | NDC 25021-400-10 | |
| Diphenyliodonium chloride | Sigma Aldrich | 43088 | |
| Deferoxamin mesylate salt | Sigma Aldrich | D9533-1G | |
| Critoseal | Leica | 39215003 | |
| BRAND disposable BLAUBRAND micropipettes, intraMark | Sigma Aldrich | 708733 | Capillaries |
| PTFE FRACTIONAL FLUOROPOLYMER TUBING 3/16” OD x 1/8” ID |
NORELL | 1598774A | Teflon tubing |
| SILICONE RUBBER STOPPERS FOR NMR SAMPLE TUBES FOR THIN WALL TUBES HAVING AN OD OF 4mm-5mm (3.2mm TO 4.2mm ID) TS-4-5-SR | NORELL | 94987 | |
| EMXnano Bench-Top EPR spectrometer | Bruker BioSpin GmbH | E7004002 | |
| EMX NANO TISSUE CELL | Bruker BioSpin GmbH | E7004542 |
References
- Kalyanaraman, B., et al. Measuring reactive oxygen and nitrogen species with fluorescent probes: challenges and limitations. Free Radical Biology and Medicine. 52 (1), 1-6 (2012).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magnetic Resonance in Medicine. 67 (6), 1827-1836 (2012).
- Elajaili, H. B., et al. Electron spin relaxation times and rapid scan EPR imaging of pH-sensitive amino-substituted trityl radicals. Magnetic Resonance in Chemistry. 53 (4), 280-284 (2015).
- Elajaili, H., et al. Imaging disulfide dinitroxides at 250 MHz to monitor thiol redox status. Journal of Magnetic Resonance. 260, 77-82 (2015).
- Halpern, H. J., et al. Oxymetry Deep in Tissues with Low-Frequency Electron-Paramagnetic-Resonance. Proceedings of the National Academy of Sciences of the United States of America. 91 (26), 13047-13051 (1994).
- Epel, B., et al. Imaging thiol redox status in murine tumors in vivo with rapid-scan electron paramagnetic resonanc. Journal of Magnetic Resonance. 276, 31-36 (2017).
- Legenzov, E. A., Sims, S. J., Dirda, N. D. A., Rosen, G. M., Kao, J. P. Y. Disulfide-Linked Dinitroxides for Monitoring Cellular Thiol Redox Status through Electron Paramagnetic Resonance Spectroscopy. Biochemistry. 54 (47), 6973-6982 (2015).
- Abbas, K., et al. Medium-throughput ESR detection of superoxide production in undetached adherent cells using cyclic nitrone spin traps. Free Radical Research. 49 (9), 1122-1128 (2015).
- Dikalov, S. I., et al. Distinct roles of Nox1 and Nox4 in basal and angiotensin II-stimulated superoxide and hydrogen peroxide production. Free Radical Biology and Medicine. 45 (9), 1340-1351 (2008).
- Dikalov, S. I., Kirilyuk, I. A., Voinov, M., Grigor'ev, I. A. EPR detection of cellular and mitochondrial superoxide using cyclic hydroxylamines. Free Radical Research. 45 (4), 417-430 (2011).
- Dikalova, A. E., et al. Therapeutic Targeting of Mitochondrial Superoxide in Hypertension. Circulation Research. 107 (1), 106-116 (2010).
- Dikalov, S. I., Polienko, Y. F., Kirilyuk, I. Electron Paramagnetic Resonance Measurements of Reactive Oxygen Species by Cyclic Hydroxylamine Spin Probes. Antioxidants & Redox Signaling. , (2017).
- Sharma, S., et al. L-Carnitine preserves endothelial function in a lamb model of increased pulmonary blood flow. Pediatric Research. 74 (1), 39-47 (2013).
- Berg, K., Ericsson, M., Lindgren, M., Gustafsson, H. A High Precision Method for Quantitative Measurements of Reactive Oxygen Species in Frozen Biopsies. PloS One. 9 (3), (2014).
- Kozlov, A. V., et al. EPR analysis reveals three tissues responding to endotoxin by increased formation of reactive oxygen and nitrogen species. Free Radical Biology and Medicine. 34 (12), 1555-1562 (2003).
- Van Rheen, Z., et al. Lung Extracellular Superoxide Dismutase Overexpression Lessens Bleomycin-Induced Pulmonary Hypertension and Vascular Remodeling. American Journal of Respiratory Cell and Molecular Biology. 44 (4), 500-508 (2011).
- Mouradian, G. C., et al. Superoxide Dismutase 3 R213G Single-Nucleotide Polymorphism Blocks Murine Bleomycin-Induced Fibrosis and Promotes Resolution of Inflammation. American Journal of Respiratory Cell and Molecular Biology. 56 (3), 362-371 (2017).
- Dikalov, S. I., Li, W., Mehranpour, P., Wang, S. S., Zafari, A. M. Production of extracellular superoxide by human lymphoblast cell lines: comparison of electron spin resonance techniques and cytochrome C reduction assay. Biochem Pharmacol. 73 (7), 972-980 (2007).
- Kozuleva, M., et al. Quantification of superoxide radical production in thylakoid membrane using cyclic hydroxylamines. Free Radical Biology and Medicine. 89, 1014-1023 (2015).
- Chen, K., Swartz, H. M. Oxidation of Hydroxylamines to Nitroxide Spin Labels in Living Cells. Biochimica Et Biophysica Acta. 970 (3), 270-277 (1988).



