Summary
提出了一种评估神经受养性对外部重复性刺激的时间演化的协议。在时域中获取和求平均值的相同实验条件的稳态记录。通过绘制响应振幅作为时间函数来分析稳态动力学。
Abstract
神经适应是指神经活动与感觉刺激的周期性同步。此同步定义稳态唤起响应的生成(即,脑电图相锁到驱动刺激的振荡)。对稳态唤起响应振幅的经典解释假定存在定型时间不变神经响应加上随机背景波动,因此,对刺激的重复表示求平均值可恢复定型的反应。这种方法忽略了稳定状态的动态,例如长期暴露在刺激中引起的适应。分析稳态响应的动态,可以假定响应振幅的时间演化在不同刺激运行中是相同的,通过足够长的断裂来分隔。基于此假设,提出了一种描述稳态响应时间演化的方法。根据相同的实验条件,可以获取足够大量的记录。实验运行(录像)是按列划分的平均值(即,运行是平均的,但记录中的时代不与前段一起求平均值)。按列值求平均值允许分析具有极高信噪比的录音中的稳态响应。因此,平均信号提供了稳态响应的时间演化的准确表示,可以在时间和频率域进行分析。在本研究中,提供了该方法的详细说明,使用稳态视觉唤起的电位作为响应示例。在与旨在分析神经结合的单试验方法进行比较的基础上,评估了优点和注意事项。
Introduction
当从头皮记录,大脑电活动被观察为持续和定期的变化电压随着时间的推移。这种电活动被称为脑电图(EEG),最初由汉斯·伯杰在上个世纪20年代末1月1日描述。随后的开创性研究将脑电图描述为复合时间序列,其中可以观察到不同的节奏或重复模式2,3,4。如今,脑电图通常分为五个成熟的频段,三角洲,塔,阿尔法,β和伽玛,这与不同的感官和认知过程相关。
多年来,使用脑电图的大脑振荡研究仅限于分析正在进行的活动中的频谱或非周期性感觉事件引起的振荡活动的变化。在过去的几十年中,已经实施了不同的方法来调节正在进行的脑电图振荡,并探索这种调制对感知和认知过程的影响,包括表达节奏感刺激诱导神经结合。术语神经结合是指神经活动与感觉刺激的周期性特性的同步。此过程导致产生稳态激发电位(即,EEG 振荡锁定到驱动刺激的周期性属性)。稳态诱发电位通常通过视觉、听觉和颤动刺激引起,使用以恒定速率呈现的瞬态刺激或以兴趣频率调整振幅的连续刺激。而躯体感觉稳态唤起电位 (SSSEPs) 被记录响应重复触觉刺激5,6,稳态视觉唤起电位 (SSVEPs) 通常由周期引起亮度的显示闪烁,图片,和脸7,8。听觉稳态响应(ASSRs)通常由瞬态声学刺激的列车或振幅调制音调的连续呈现9,10产生。
从测得的EEG中提取稳态诱发电位基本上依赖于随后获得的EEG时间锁定到刺激11的平均值。由于响应的周期性,可以在时间和频率域进行分析。频域变换后,在外部刺激的表示速率或调制频率及其相应的谐波下,将感觉响应观测为振幅峰值。这些程序(时域平均和随后的频域转换)对于开发基于检测具有临床目的的 ASSR 方法的听力测试至关重要 ,15,16.
此外,EEG周期的经典时域平均值对于分析生理过程(如SSVEP17、18的生成和灭绝)非常有用。瓦克等人19日观察到,SSVEP的相锁指数在前400毫秒的刺激中迅速增加,之后仍保持较高水平。.他们还报告说,在刺激后,在700-1 100 ms之间建立了强大的视觉结构。刺激列车的偏移后,某种程度的受压仍然有效,这种反应持续了大约三个周期的振荡反应17,19。这些行为被解释为观测到的振荡的吸引/分离效应,这是人类视觉系统中非线性信息处理的结果17。或者,众所周知,在某些实验条件下,闪烁刺激可以在开始时引起反应,在刺激列车结束时引起反应,而不是神经受套18。
平均连续获取的EEG纪元的主要假设是,EEG信号表示感觉响应和背景噪声20的线性组合。此外,振荡响应的振幅、频率和相位被假定为静止的,而背景噪声则被视为随机活动。但是,在未满足此假设的情况下,在几个纪元之后计算的响应振幅不一定对应于被唤起的电位的瞬时振幅。
最近有报道称,大鼠脑干中产生的ASSR适应振幅调制音调的连续呈现(即响应振幅随时间呈指数级下降)21、22。适应被解释为一种神经机制,它反映了单调重复的感官刺激的新颖性丧失,增加了对声学环境相关波动的敏感性23,24。在听觉途径中,适应可以增强嘈杂环境中的言语理解能力。此外,此过程可能是现有机制的一部分,用于监控自己声音的听觉反馈,以控制语音制作。
Van Eeckhoutte等人25分析了40 Hz ASSR在人类中的时间演化,观察到响应振幅随时间而显著但小幅下降(在假设随时间线性下降时,根据组分析约为-0.0002 μV/s)。因此,这些作者得出结论,40赫兹ASSR在人类不能适应刺激。在人类中,在分析SSVEP26的稳定性时观察到非静止行为。这些作者观察到,在被调查者中,基本频率和二次谐波的振幅分别只有30%和66.7%。两个SSVEP频率分量的相位,虽然随着时间的推移相对稳定,但表现出小漂移26。
因此,尽管随后获取的年代的经典时域平均值允许探索神经包带的固定属性,但当固定的长期动力学是研究,或当短期动态的平均值因长期动态的发生而损坏时。为了描述稳态响应的非静止行为,在给定时间窗口计算的调用响应不应受到前面 EEG 段中计算的响应的影响。换句话说,应从背景噪声中提取唤起的电位,而不使用前面的 EEG 段平均时域。
本研究提出了一种评估神经节动动力学的方法。稳定状态响应被重复记录,以响应相同的刺激,其中连续记录交错的休息间隔是实验运行长度的三倍。考虑到如果不同独立实验运行(独立记录)中生理反应的时间演化相同,则记录按列平均值计算。换句话说,对应于不同录制中同一位置的时段是平均的,而不对录制中的平均纪元。因此,在任何刺激间隔下计算的响应振幅将对应于激发电位的瞬时振幅。根据实验的目的,在时域中分析感觉反应或转换为频域。在任何情况下,振幅都可以绘制为时间的函数,以分析稳态响应的时间演化。通过将分析限制在记录的第一个和最后一个纪元,可以评估稳态唤起电位的生成和消光。
神经包络的动力学可以使用其他方法进行分析,例如窄带滤波单试验测量围绕兴趣频率,并使用低通滤波25和希尔伯特变换27。与这些方法相比,按柱值求值的时序允许基于信号噪声比 (SNR) 较高的信号计算稳态参数。最近,卡尔曼滤波已成为一种很有前途的技术,用于估计40赫兹ASSR振幅28,29,30。实施卡尔曼滤波可以提高接近电生理阈值的稳态反应的检测,减少听力测试的时间29。此外,当使用卡尔曼滤波方法估计ASSR振幅30时,不需要假定静止响应。然而,只有一项研究分析了使用卡尔曼过滤25的ASSR的时间演变。研究结论是40-Hz ASSR振幅在刺激间隔内稳定。因此,卡尔曼滤波需要在ASRR不静止的条件下进行测试。
尽管耗时,但按列划分的平均值方法是无模型的,不需要初始化值和/或噪声行为的先验定义。此外,由于它不涉及收敛时间,柱位平均可以提供神经结合开始更可靠的表示。因此,使用柱位平均法获得的结果可视为使用卡尔曼滤波分析神经结合动力学的地面真理。
该协议的此描述基于 SSVEP 的示例。但是,请务必注意,此处介绍的方法与模式无关,因此也可用于分析 SSSEP 和 ASSR 的时间演变。
Protocol
本研究是在智利瓦尔帕莱索大学研究与伦理委员会(评估声明代码CEC170-18)批准下进行的,经国家人类研究准则确认。
1. 准备
- 欢迎欢迎这个话题。
- 解释研究的目的和相关性。提供相关技术细节的说明。彻底回答所有问题。
- 明确提到,如果需要,她/他可以随时中断实验会话。
- 要求志愿者阅读主题知情同意书并签署相应的表格。如果未获得知情同意,则中断实验会话。
2. 主题准备
- 要求受试者坐在实验室椅上,坐在舒适的位置。
- 用乙醇清洁头皮(溶液在95%去掉覆盖它的死皮细胞和皮脂层。此步骤对于减少电极和头皮之间的阻抗非常重要。
- 使用测量带测量头部周长,以定义要使用的电极盖的大小。
- 要求受试者戴上电极盖。提供舒适但正确定位盖的说明。
- 使用测量带测量鼻腔(Nz,鼻腔缝合的中间点,可以通过眼睛和鼻子顶部之间的凹陷来识别)和肌酸(Iz,骨骼的突出)之间的距离。
- 使用测量带测量左右眼前点之间的距离(在耳朵耳膜前被确定为凹陷)。
- 校正电极盖的位置,以便在前面的步骤中定义的虚线之间的交点对应于头部的顶点。确保调整后主体舒适。
- 根据实验考虑的位置,将导电凝胶放入电极支架中。
- 使用国际 10-20 系统31之后的 64 个头皮位置,使用协议的结果执行源本地化分析。如果需要,可以使用头皮上的电极位置(128)数量较多。
- 如果不计划进行源定位分析,则实施临床或流动设置(仅使用几个电极)。使用"四分"位置记录 SSVEP、获取 ASSR 的时间位置和记录 SSSEP 的页状位置。
- 推动电极支架中的电极。确保电极标签与盖中的位置标签匹配。
- 陪同志愿者前往实验室(最好是屏蔽、减音室)。要求受试者坐在房间内的椅子上,处于舒适的位置。
- 如果物理参考(不同于头皮电极)用于重新参考脑电图记录(在步骤 3.8.1 中),则将外部电极放在鼻子和耳垂上。
- 将外部电极放置在透镜位置。
- 将电极放在脸颊和头部正面区域(眉毛上方约 1 厘米)上,以记录闪烁(步骤 2.6.1)。
- 将电极放在眼睛的外侧,大约在中线上方/下方 1 厘米处,以记录眼部运动(步骤 2.6.1)。
注: 电图 (EOG) 将在步骤 3.8.5 中使用,用于去除由闪烁和眼睛运动引起的 EGG 伪影。
- 如果使用低阻抗系统记录 EEG,则打开 EEG 采集系统并检查电极阻抗。根据需要,根据制造商的指示校正阻抗。阻抗应保持在 10 kΩ32以下。
- 要求受试者眨眼,然后朝不同方向移动眼睛,以确保正确记录 EOG。
- 要分析SSVEP的动态,调整屏幕在垂直方向上的位置,以匹配主体的视角。调暗房间的灯光,直到达到舒适的水平。将屏幕的亮度级别调整到参与者舒适度的上限。
- 要分析 ASSR 的动态,请使用正确的泡沫插入插入耳机,使耳机适合耳道。检查声音是以所需的强度(例如,心理物理舒适级别33) 传递的。
3. 脑电图采集和预处理
- 设置实验设计中定义的刺激参数。有关软件的详细信息,请参阅刺激系统制造商提供的用户手册。
注:有关用于生成SSVEP和ASSR的刺激的综合性解释,请参阅Norcia等人8和兰斯34。 - 指导受试者注意刺激,在视觉约束是实验主题的情况下。
- 当听觉训练是实验的主题时,呈现一部带字幕的电影,声音关闭。
注意:演示无声电影允许转移注意力从声学刺激,同时保持唤醒水平25。
- 当听觉训练是实验的主题时,呈现一部带字幕的电影,声音关闭。
- 目前的刺激超过90年代,已经做了研究SSVEPs和ASSR在人类和动物模型21,22,25,26的时间演变。
注:如果进行了试验性研究,则刺激的持续时间较短。 - 如果只测试一个实验条件,则暂停刺激 2 分钟。与受试者互动,检查意识。
注: 暂停的持续时间取决于刺激的持续时间。暂停时间比刺激间隔长 3 倍将确保一次刺激引起的响应不受先前刺激的影响。如果主题请求,则允许更长的暂停时间。- 当测试不同的实验条件时,暂停刺激至少10s,因为已建议交替刺激与暂停10s,以减少额外的适应效果,并缩短实验的长度25。
- 重复演示步骤(步骤 3.3-3.4)至少 30 倍,以确保在平均纪元(步骤 4.4)之后测量值的高 SNR。
- 使用标准程序35记录 EEG。为每个实验运行创建单独的 EEG 文件。
注:有关软件的详细信息,请参阅采集系统的用户手册。 - 监控 EEG 记录,根据 alpha 活动水平和闪烁伪影出现的频率检测睡眠期。当检测到α水平增加并伴有降低的闪烁频率时,暂停实验,这表明嗜睡。当检测到睡眠周期时,拒绝进一步分析的实验运行。
- 根据实验中使用的采集软件的用户手册中提供的说明,计算每次实验运行结束时稳态响应的振幅。
- 通过比较在每个实验运行结束时获得的稳态响应的振幅,监视受试者的注意力水平。将第一次实验运行中获得的稳态振幅设置为参考振幅。
- 设置抑制阈值(响应振幅在参考振幅上降低 5%)。拒绝稳态响应的振幅满足拒绝标准的实验运行。
- 获取实验设计中定义的运行数后完成实验会话。
- 使用标准 EEG 程序35对 EEG 数据进行离线预处理,根据制造商的指示,在接下来的步骤中进行了描述。
- 使用平均参考值(所有记录电极的平均值)或电极子集的平均值重新引用记录。或者,使用物理参考(例如,放置在鼻子和耳垂上的外部电极,步骤 2.4 中描述的)。
- 如果在 EEG 采集期间使用了径向坐标系,则将电极坐标转换为国际 10/20 系统。有关转换的详细信息,请参阅制造商手册。
- 带通滤波器 EEG 信号在 0.5-300 Hz 之间。如有必要,设置一个槽口滤波器(居中为 50 Hz 或 60 Hz)。
- 对 EEG 信号进行向下采样,以减少为移除眼伪影而选择的算法的执行时间(步骤 3.8.5)。
注:采样频率为512赫兹,足以分析频率低于40 Hz35的大脑振荡。 - 取出眼部伪影。
注:为此,可以使用不同的技术(有关工件去除算法的广泛审查,请参阅 Urigen 和 Garcia-Zapirain35)。其中,独立成分分析是应用最扩展的方法之一,在商业和自由分析软件37、38、39中均得到实施。 - 在时间锁定到刺激的年代内分段脑电图数据。根据实验的目的选择纪元长度。
注: 时间应足够长,以便分析频率域中的稳态响应,并具有适当的频谱分辨率。 - 在此阶段不要运行工件抑制算法来检测和删除包含伪影的划时代。
注: 在此阶段删除纪元将引发错误,当数据集被组织以运行跨列的跨数平均值(步骤 4.2 和 4.4)。拒绝算法在后续处理步骤(步骤 4.1.4)中实现。 - 运行 DC 去趋势函数以计算各个 EEG 纪元中的 DC 趋势并更正它们。
- 运行基线校正功能以更正记录的基线。选择超过 200 毫秒的预刺激时间间隔。
注: 基线校正包括以所选时间间隔内的数据求平均值。平均计算每个通道,并从每个纪元中的每个数据点减去。
4. 响应振幅的计算
- 输入计算稳态响应所需的参数 (图 1A)。
注: 用于处理数据的内部代码可在- 输入实验的录制(实验运行)数。
- 输入对各个录制的分段的纪元长度。
- 输入实验的采样频率。
- 选择工件抑制算法来检测和删除包含伪影的纪元。可用的选择标准是 1) 梯度(两个连续样本之间的绝对差),2) 最大值(纪元中最大振幅和最小振幅之间的差值)和 3) 振幅(绝对最大和最小振幅)。
- 运行处理代码。
注: 选择此选项后,将自动执行步骤 4.2-4.7。如果合适,手动运行这些步骤。
注:加权 EEG 纪元通过将每个电压样本除以其所属的振年振幅方差获得,因此方差用作振幅变异性和加权因子40的度量值。
注: 此步骤允许计算具有极高信噪比 (SNR) 的录音中的稳态振幅。
- 使用快速傅立叶变换 (FFT) 计算每个纪元中由列级平均产生的稳态响应的振幅。
注: FFT 长度应对应于一个纪元的长度。实现窗口技术不是强制性的。稳态响应的振幅定义为在感觉刺激的振幅调制频率上获得的光谱振幅。
注:稳态响应的高频率特异性使得响应振幅独立于具有相似频率的背景振荡,而背景振荡又在相对狭窄的频段41中均匀分布,42,43.
Representative Results
SSVEP 由长度为 40 s 的连续视觉刺激引起,其中光强度由 10 Hz 的正弦波(调制深度 90%)调制。Stimuli 由位于 50 厘米 x 50 厘米黑屏中心的四个发光二极管 (LED) 提供,作为 5 厘米 x 5 厘米正方形的顶点。当参与者坐在离屏幕 70 厘米的地方时,LED 方的正方形区域将视角细分为约 4°。LED 屏幕采用基于 USB 的微控制器开发系统和四个直径为 10 mm 的超亮白色 LED 进行设计。脉冲宽度调制 (PWM) 技术用于控制提供给 LED 的电源。该技术以给定频率控制 LED 强度,并生成最终的正弦包络。PWM 频率为 40 kHz,用于避免可感知的闪烁效果。
获得了30个录音,这些录音分4个百分。因此,获取了由 10 列(录制中的 EEG 纪元数)和 30 行(记录数、实验运行数)组成的数据集。
神经振荡时间锁定到刺激变得明显,因为执行柱式平均(图2)。值得注意的是,在与列 1 对应的跟踪中可以观察到生成 SSVEP 的时间间隔。在该列中,除了前 0.8 s 的神经受套之外,还绘制了 0.2 s 的预刺激基线。因此,此处描述的过程允许描述 1) 一旦神经固定已建立的振荡响应动力学和 2) 神经振荡的介入。刺激结束后记录的一个或多个纪元也可以包含在数据矩阵中,以研究刺激偏移后稳态响应的消减。
在列上对年数的平均值中,SSVEP(10 Hz 的光谱振幅,通过应用 FFT 计算)的平均振幅在列的第一个纪元的平均值期间减小,并在之后趋于稳定(图 3A)。这一结果与先前分析ASSR在连续获取纪元21、22、40、43、44平均期间的演变的研究一致。平均期间响应振幅的行为通常由非平均噪声对在第一个纪元中计算的响应振幅的相对高贡献来解释,当平均执行13时衰减。44,45,46,47.值得注意的是,SSVEP振幅变异性随着平均的推进而显著下降。
我们还分析了在跨数的列值平均期间测量的 RNL(图 3B)。RNL 在 SSVEP 频率两侧的窄频带 (3 Hz) 下计算。虽然此过程在分析 SSVEP 时并不常见,但以给定频率箱数为平均值的矢量是 ASSR测量41、42中估计 RNL 的标准。43.正如预期的那样,RNL 随着平均纪元的增多而逐渐减少,并在处理大约 20 个纪元后达到去量水平。与分析 SSVEP 振幅时观察到的情况不同,RNL 的标准偏差随着平均纪数的增加而保持相对恒定,这表明记录条件沿实验会话保持稳定。
上述结果确定了在柱数平均期间测量的峰值信噪比(pSNR)的变化(图3C)。此术语定义为响应 (SSVEP) 的平方振幅 (SSVEP) 和 RNL 的平方振幅之间的比率(以 dB 表示)。随着平均进度的推进,pSNR 会随着平均纪元数增加到 18,大约增加。平均纪元数的进一步增量对信号的质量没有显著影响。随着更多纪元的平均数,pSNR 的可变性减小。
最后,SSVEP振幅和RNL的动态如图4所示。这些时间演化是通过绘制在按列计算的响应参数(按列平均值作为列数的函数(作为时间的函数)来获取的。正如拉贝基等人26所证明的,SSVEP的动态在受试者之间可能有很大差异。由于图 4中显示的结果对应于单个个体,因此无法进行概括。在此主题中,SSVEP 的振幅显示相对复杂的行为 (图 4A)。在刺激开始后的前 12 秒内,响应振幅逐渐增加(时间对应于 3 个纪元的长度)。随着刺激的持续,SSVEP 在接下来的 12 秒内持续下降,之后保持相对稳定。这些结果不能用RNL的行为来解释,因为这个参数在刺激间隔内是相对恒定的(图4B)。刺激开始后 SSVEP 振幅的增加在图 2所示的轨迹中显而易见,可以通过集成过程来解释,从而稳定神经内联。随后的振幅下降表明SSVEP适应持续刺激。然而,这些假设需要在具有适当样本尺寸的受控实验中进行测试。
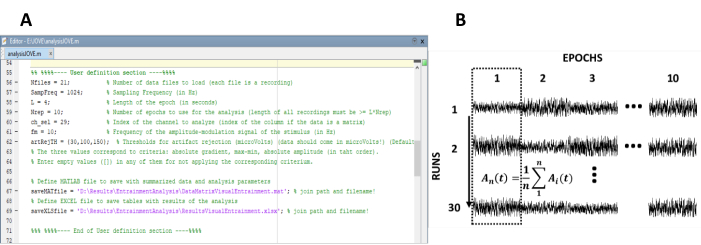
图 1:提取稳态响应振幅的时间演化的关键步骤。(A) 处理代码的屏幕截图,其中定义了分析参数。(B) 说明数据集组织的代表图。表示由 10 个纪元的 30 个记录组成的数据矩阵。在第一列中突出显示按列显示划时代平均值。垂直线表示平均的方向。请点击此处查看此图的较大版本。

图 2:在跨列平均期间,稳态视觉唤起电位 (SSVEP) 的波形变化。通过连续呈现10 Hz振幅的光调制,可以引起响应。行显示在平均所有以前的录制后获得的波形(即,第 1 行是第一次录制,第 5 行是平均前五个录像后获得的波形,最后一行是所有录制的平均值)。随着平均运行次数的增加,每列中观察到更可靠的 SSVEP 波形。为了提供清晰度(使 SSVEP 的振荡可见),仅表示纪元的第一秒。例外情况是数据集第一列中的跟踪,其中显示 0.2 秒的预刺激基线。请点击此处查看此图的较大版本。

图 3:在按列计算分量时响应和记录参数的变化。(A) SSVEP 振幅的演变。(B) RNL 的行为.(C) pSNR 的变化。黑线表示每列 (n = 10) 获得的平均值,灰色阴影表示 * 一个标准偏差覆盖的区域。请点击此处查看此图的较大版本。

图 4:SSVEP的时间演化通过连续视觉刺激的呈现而引起,在10 Hz时以振幅调制。(A) SSVEP 振幅的时间过程.(B) RNL 的时间过程.请点击此处查看此图的较大版本。
Discussion
这项工作描述了一个实验程序,用于分析振荡大脑反应的动态。该方法包括获取足够数量的相同实验条件的独立实验运行,以及不同记录中对应于同一时间窗口的时域平均纪元(按列值平均图 1B.平均数据中计算的振幅表示振荡响应的瞬时振幅。将这些振幅绘制为时间的函数(或数据集中的列数)可以分析振荡响应时间锁定到刺激的时间演变。该方法是Ritter等人23号提出的关于分析瞬态皮质唤起电位适应的建议的修改。该方法已用于分析在人类24和动物模型20,21的听觉诱发电位的动态。
从方法学的角度来看,用于引发稳态响应的参数与从背景噪声中提取神经响应的参数的组合对于分析稳态激发电位的时间演化至关重要22.此处介绍的实验中使用的刺激长度(40 s)是根据试验性研究的结果选择的。这种刺激长度足以分析在大鼠脑干21、22中产生的ASSR的适应。此外,刺激长度应超过达到SSVEPs的去功能瞬时带功率的时间(拉贝基等人图1,第26页)。然而,在某些情况下,SSVEPs的去功能瞬时带功率可以达到60以外的程度(拉贝基等人图2,第26页)。因此,建议进行小样本试验研究,以定义刺激的刺激长度。否则,建议使用长度超过 90 s 的刺激,以实现响应的时间演化的完整表示。在连续记录之间使用足够长的暂停意味着考虑连续的实验运行在统计上是独立的(即同一变量的不同独立度量)。据我们所知,没有执行任何实验来分析运行之间的最佳暂停(使运行彼此独立所需的最小暂停)。使用暂停时间至少比刺激长度长 3 倍的 critey 足够保守,以确保在任何给定运行中记录的稳定状态响应不受先前刺激的影响。
最近,交替刺激(实验条件)被提出作为一种选择,以减少实验运行之间的停顿,避免额外的适应效果25。同样,在此实验协议中实现的实验运行数(30)是保守的,因为阴囊RNL和pSNR通常在平均20次实验运行后达到,大约。当刺激落在响应的动态范围(高感觉水平)的中上层区域时,可能需要较低的运行数来分析唤起反应的动态。然而,在测试不同实验条件的情况下,具有相同数量的实验运行对于在条件之间进行比较(即不同的感觉水平)至关重要。
除了按柱值平均时间外,通过过滤兴趣频率周围的窄频带的单试测量值并计算功率的包络,对振荡唤起电位的动态进行了分析信号使用低通滤波26。同样,已实施单次试验分析,以描述SSVEP48稳定区域之前的过渡期,以及响应49的稳定区域中SSVEP的振幅和相位的变化。虽然单次试验分析允许在响应振幅中区分相对快速的波动,但实验设计分析以给定块间间隔分隔的块的平均响应,仅考虑响应振幅的长期变化。振幅的诱发电位50,51。按列表示纪元平均值介于这两个选项之间。使用 FFT 将平均信号转换为频率域意味着分析分辨率等于纪元长度的响应动力学。在此处介绍的示例中,每 4 s 报告一次 SSVEP。尽管 4 秒的分辨率足以描述在超过几十秒的时间间隔发生的动态,例如 SSVEP26的分辨率,但原始记录中部分重叠的年代允许描述稳态反应以更精细的方式25。
在跨柱平均值之后获得的稳定状态响应动力学主要表示在平均 EEG 段(平均值中存活的)之间同步的振荡活动的演化。因此,关于该方法可行性的一个主要问题是,由于神经振荡阶段从一个独立实验运行到另一个(即记录之间)的变化,响应振幅可能衰减。这个问题需要用实验方式解决。然而,有证据表明,大脑振荡反应的阶段比预期的要少。事实上,几项研究已经报告在人类80赫兹ASSR47,48,49的预期阶段规律性。当根据振荡活动的阶段估计延迟时,观察到了声学刺激的强度和载波频率对听觉反应延迟的可预测影响(即,延迟随着强度和载波频率增加)52,53,54。此外,当从ASSR47、55、56的阶段估计延迟时,还观察到了振幅的典型质感变化和听力水平的从左到右不对称,57,58.拉贝基等人使用单审分析描述SSVEP的时间演变时指出,虽然同一受试者内反应振幅的审中变异性相当高,但阶段明显不太明显。
根据他们的观察结果,Labecki等人26日建议至少进行50次试验,以便可靠地估计反应的平均功率范围。这些结果表明,即使在单个试验中计算响应的振幅,也需要平均(在这种情况下为信封)来报告可信结果。此外,Labecki等人26号报告的SSVEP振幅的审中变化表明,在单次试验中计算这一参数可能受到背景噪声的很大影响。考虑到图 2中所示信噪比的演变,计算平均信号而不是单个试验中的响应,可显著减少需要处理以获得可靠结果的 EEG 段数测量。此外,Labecki等人26获得的相位变异性低支持了这样一种观点,即此处介绍的逐列平均是计算振荡唤起电位动力学的有效过程。
在不同级别对数据求平均值会导致对结果的不同解释。关于振荡诱发的电位,计算独立运行的时域平均之后的响应振幅意味着只分析时间锁定振荡(即那些在平均中存活的振荡)。此过程可能会过滤有关单个试验中响应动态的相关信息。然而,它保证测量的信噪比足够高。当响应接近电生理阈值时,这一方面可能具有重要意义,在这种情况下,由于测量的信号噪比较低,对受套的检测可能会受到影响。
Disclosures
作者没有什么可透露的。
Acknowledgments
作者感谢卢卡·泽佩达、格蕾丝·惠特克和尼古拉斯·尼托对视频制作的贡献。这项工作部分得到了CONICYT项目BASAL FB0008、MEC 80170124和博士奖学金21171741以及国家卫生研究院国家耳聋和其他通信障碍研究所的支持,奖励编号为P50DC015446。内容完全由作者负责,不一定代表国家卫生研究院的官方观点。
Materials
| Name | Company | Catalog Number | Comments |
| Active electrodes | Biosemi | P32-1020-32ACMS (ABC) | for channels 1-32 |
| Active electrodes | Biosemi | P32-1020-32A (ABC) | for channels 33-64 |
| Active electrodes | Biosemi | 8 x TP FLAT | external electrodes |
| Active-Two adquisition system | Biosemi | version 7.0 | EEG adquisition system |
| alcohol | Salcobrand | Code: 3309011 | for cleaning the scalp |
| Electrode cap 64 channels | Biosemi | CAP MS xx yy | cap |
| Electrode cap 64 channels | Biosemi | CAP ML xx yy | cap |
| gel | Biosemi | SIGNA BOX12 | conductive gel |
| Laptop | Asus | Core i7 1TB DD + 128GB SSD 8GB RAM | computer for stimulation |
| Laptop | Asus | Core i7 1TB DD + 128GB SSD 8GB RAM | computer for recording |
| LED screen | in-house production | - | The screen consists of four light-emitting diodes (LEDs) situated on the center of a 50x50 cm black screen, as vertexes of a square of 5x5 cm |
| sterile gauze | Salcobrand | Code: 8730277 | for cleaning the scalp |
References
- Berger, H. Über das elektrenkephalogramm des menschen. European Archives of Psychiatry and Clinical Neuroscience. 87 (1), 527-570 (1929).
- Berger, H. Electroencephalogram of humans. Journal fur Psychologie und Neurologie. 40, 160-179 (1930).
- Walter, W. G. The location of cerebral tumours by electro-encephalography. The Lancet. 228 (5893), 305-308 (1936).
- Jasper, H. H., Andrews, H. L. Electro-encephalography: III. Normal differentiation of occipital and precentral regions in man. Archives of Neurology & Psychiatry. 39 (1), 96-115 (1938).
- Snyder, A. Z. Steady-state vibration evoked potentials: descriptions of technique and characterization of responses. Electroencephalography and Clinical Neurophysiology. 84 (3), 257-268 (1992).
- Giabbiconi, C. M., Trujillo-Barreto, N. J., Gruber, T., Muller, M. M. Sustained spatial attention to vibration is mediated in primary somatosensory cortex. Neuroimage. 35, 255-262 (2007).
- Rossion, B., Boremanse, A. Robust sensitivity to facial identity in the right human occipito-temporal cortex as revealed by steady-state visual-evoked potentials. Journal of Vision. 11 (2), (2011).
- Norcia, A. M., Appelbaum, L. G., Ales, J. M., Cottereau, B. R., Rossion, B. The steady-state visual evoked potential in vision research: a review. Journal of Vision. 15 (6), 4 (2015).
- Galambos, R., Makeig, S., Talmachoff, P. J. A 40-Hz auditory potential recorded from the human scalp. Proceedings of the National Academy of Sciences of the United States of America. 78 (4), 2643-2647 (1981).
- Picton, T. W., Skinner, C. R., Champagne, S. C., Kellett, A. J., Maiste, A. C. Potentials evoked by the sinusoidal modulation of the amplitude or frequency of a tone. The Journal of the Acoustical Society of America. 82 (1), 165-178 (1987).
- Dawson, G. D. A summation technique for the detection of small evoked potentials. Electroencephalography and Clinical Neurophysiology. 6 (1), 65-84 (1954).
- Savio, G., Cardenas, J., Abalo, M. P., Gonzalez, A., Valdes, J. The low and high frequency auditory steady state responses mature at different rates. Audiology and Neurotology. 6 (5), 279-287 (2001).
- Luts, H., Desloovere, C., Kumar, A., Vandermeersch, E., Wouters, J. Objective assessment of frequencyspecific hearing thresholds in babies. International Journal of Pediatric Otorhinolaryngology. 68, 915-926 (2004).
- Valdes, J. L., et al. Comparison of statistical indicators for the automatic detection of 80 Hz auditory steady state responses. Ear and Hearing. 18 (5), 420-429 (1997).
- Wilding, T., McKay, C., Baker, R., Kluk, K. Auditory steady state responses in normal-hearing and hearing-impaired adults: an analysis of between-session amplitude and latency repeatability, test time, and F ratio detection paradigms. Ear and Hearing. 33 (2), 267 (2012).
- de Resende, L. M., et al. Auditory steady-state responses in school-aged children: a pilot study. Journal of NeuroEngineering and Rehabilitation. 12 (1), 13 (2015).
- Halbleib, A., et al. Topographic analysis of engagement and disengagement of neural oscillators in photic driving: a combined electroencephalogram/magnetoencephalogram study. Journal of Clinical Neurophysiology. 29 (1), 33-41 (2012).
- Salchow, C., et al. Rod Driven Frequency Entrainment and Resonance Phenomena. Frontiers in Human Neuroscience. 10, 413 (2016).
- Wacker, M., et al. A time-variant processing approach for the analysis of alpha and gamma MEG oscillations during flicker stimulus generated entrainment. IEEE Transactions on Biomedical Engineering. 58 (11), 3069-3077 (2011).
- Glaser, E. M., Ruchkin, D. S. Principles of Neurobiological Signal Analysis. Journal of Clinical Engineering. 2 (4), 382-383 (1977).
- Prado-Gutierrez, P., et al. Habituation of auditory steady state responses evoked by amplitude-modulated acoustic signals in rats. Audiology Research. 5 (1), (2015).
- Prado-Gutierrez, P., Martínez-Montes, E., Weinstein, A., Zañartu, M. Estimation of auditory steady-state responses based on the averaging of independent EEG epochs. PLoS ONE. 14 (1), (2019).
- Ritter, W., Vaughan, H. G. Jr, Costa, L. D. Orienting and habituation to auditory stimuli: a study of short terms changes in average evoked responses. Electroencephalography and Clinical Neurophysiology. 25 (6), 550-556 (1968).
- Malmierca, M. S., Cristaudo, S., Pérez-González, D., Covey, E. Stimulus-specific adaptation in the inferior colliculus of the anesthetized rat. Journal of Neuroscience. 29 (17), 5483-5493 (2009).
- Van Eeckhoutte, M., Luke, R., Wouters, J., Francart, T. Stability of auditory steady state responses over time. Ear and Hearing. 39 (2), 260-268 (2018).
- Labecki, M., Nowicka, M. M., Suffczynski, P. Temporal Modulation of Steady-State Visual Evoked Potentials. International Journal of Neural Systems. 29 (3), 1850050 (2019).
- Zhang, S., et al. A study on dynamic model of steady-state visual evoked potentials. Journal of Neural Engineering. 15 (4), 046010 (2018).
- Wilson, U. S., Kaf, W. A., Danesh, A. A., Lichtenhan, J. T. Assessment of low-frequency hearing with narrowband chirp evoked 40-Hz sinusoidal auditory steady state response. International Journal of Audiology. 55 (4), 239-247 (2016).
- Kaf, W. A., Mohamed, E. S., Elshafiey, H. 40-Hz Sinusoidal Auditory Steady-State Response and Tone Burst Auditory Brainstem Response Using a Kalman Filter to Determine Thresholds Pre- and Post-Myringotomy with Grommet Tube in Children With Mild, Low-Frequency Conductive Hearing Loss. American Journal of Audiology. 25 (1), 41-53 (2016).
- Luke, R., Wouters, J. Kalman filter based estimation of auditory steady state response parameters. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 25, 196-204 (2017).
- Homan, R. W. The 10-20 Electrode System and Cerebral Location. American Journal of EEG Technology. 28 (4), 269-279 (1988).
- Kappenman, E. S., Steven, J. L. The Effects of Electrode Impedance on Data Quality and Statistical Significance in ERP Recordings. Psychophysiology. 47 (5), 888-904 (2010).
- Moore, R., Gordon-Hickey, S., Jones, A. Most comfortable listening levels, background noise levels, and acceptable noise levels for children and adults with normal hearing. Journal of the American Academy of Audiology. 22 (5), 286-293 (2011).
- Rance, G. The Auditory Steady-state Response: Generation, Recording, and Clinical Application. Plural Publishing. 335, (2008).
- Luck, S. J. An introduction to the event-related potential technique. Second Edition. , MIT Press. 406 (2014).
- Urigüen, J. A., Garcia-Zapirain, B. EEG artifact removal-state-of-the-art and guidelines. Journal of Neural Engineering. 12 (3), (2015).
- Jung, T. P., et al. Removing electroencephalographic artifacts by blind source separation. Psychophysiology. 37 (2), 163-178 (2000).
- Li, Y., Ma, Z., Lu, W., Li, Y. Automatic removal of the eye blink artifact from EEG using an ICA-based template matching approach. Physiological Measurement. 27 (4), 425 (2006).
- Mannan, M. M. N., Jeong, M. Y., Kamran, M. A. Hybrid ICA-Regression: automatic identification and removal of ocular artifacts from electroencephalographic signals. Frontiers in Human Neuroscience. 10, 193 (2016).
- John, M. S., Dimitrijevic, A., Picton, T. W. Weighted averaging of steady-state responses. Clinical Neurophysiology. 112 (3), 555-562 (2001).
- Zurek, P. M. Detectability of transient and sinusoidal otoacoustic emissions. Ear and Hearing. 13 (5), 307-310 (1992).
- Lins, O. G., Picton, P. E., Picton, T. W., Champagne, S. C., Durieux-Smith, A. Auditory steady-state responses to tones amplitude-modulated at 80-110 Hz. Journal of the Acoustical Society of America. 97 (5), 3051-3063 (1995).
- John, M. S., Picton, T. W. Human auditory steady-state responses to amplitude-modulated tones: phase and latency measurements. Hearing Research. 141 (1-2), 57-79 (2000).
- Fortuny, A. T., et al. Criterio de parada de la promediación de la respuesta auditiva de estado estable. Acta Otorrinolaringológica Española. 62 (3), 173-254 (2011).
- John, M. S., Purcell, D. W., Dimitrijevic, A., Picton, T. W. Advantages and caveats when recording steady-state responses to multiple simultaneous stimuli. Journal of the American Academy of Audiology. 13 (5), 246-259 (2002).
- Luts, H., Van Dun, B., Alaerts, J., Wouters, J. The influence of the detection paradigm in recording auditory steady-state responses. Ear and Hearing. 29 (4), 638-650 (2008).
- Choi, J. M., Purcell, D. W., John, M. S. Phase stability of auditory steady state responses in newborn infants. Ear and Hearing. 32 (5), 593-604 (2011).
- Xu, M., et al. Use of a steady-state baseline to address evoked vs. oscillation models of visual evoked potential origin. Neuroimage. 134, 204-212 (2016).
- Peachey, N. S., Demarco, P. J. Jr, Ubilluz, R., Yee, W. Short-term changes in the response characteristics of the human visual evoked potential. Vision Research. 34 (21), 2823-2831 (1994).
- Woods, D. L., Elmasian, R. The habituation of event-related potentials to speech soundsand tones. Electroencephalography and Clinical Neurophysiology. 65, 447-459 (1986).
- Ravden, D., Polich, J. Habituation of P300 from visual stimuli. International Journal of Psychophysiology. 30 (3), 359-365 (1998).
- Picton, T. W., Dimitrijevic, A., John, M. S., Van Roon, P. The use of phase in the detection of auditory steady-state responses. Clinical Neurophysiology. 112 (9), 1698-1711 (2001).
- Alaerts, J., Luts, H., Van Dun, B., Desloovere, C., Wouters, J. Latencies of auditory steady-state responses recorded in early infancy. Audiology and Neurotology. 15 (2), 116-127 (2010).
- John, M. S., Brown, D. K., Muir, P. J., Picton, T. W. Recording auditory steady-state responses in young infants. Ear and Hearing. 25 (6), 539-553 (2004).
- Purcell, D. W., John, S. M., Schneider, B. A., Picton, T. W. Human temporal auditory acuity as assessed by envelope following responses. Journal of the Acoustical Society of America. 116 (6), 3581-3593 (2004).
- Kuwada, S., et al. Sources of the scalp-recorded amplitude-modulation following response. Journal of the American Academy of Audiology. 13 (4), 188-204 (2002).
- Pauli-Magnus, D., et al. Detection and differentiation of sensorineural hearing loss in mice using auditory steady-state responses and transient auditory brainstem responses. Neuroscience. 149 (3), 673-684 (2007).
- Prado-Gutierrez, P., et al. Maturational time course of the Envelope Following Response to amplitude-modulated acoustic signals in rats. International Journal of Audiology. 51 (4), 309-316 (2012).



