Summary
इस लेख का उद्देश्य जिगोट पेरिविटेलिन अंतरिक्ष में वायरस निलंबन के कई इंजेक्शन का उपयोग करके चूहे के भ्रूण में लेंटिवायरल ट्रांसजेनेसिस के लिए कार्यप्रणाली प्रदान करना है। मादा चूहों कि एक अलग प्रमुख फर रंग के साथ एक उपजाऊ पुरुष तनाव के साथ संभोग कर रहे है छद्म गर्भवती पालक माताओं उत्पन्न करने के लिए प्रयोग किया जाता है ।
Abstract
ट्रांसजेनिक पशु मॉडल आधुनिक जैव चिकित्सा अनुसंधान के लिए मौलिक रूप से महत्वपूर्ण हैं। जल्दी माउस या चूहे भ्रूण में विदेशी जीन का समावेश जीवित जीवों में जीन समारोह विश्लेषण के लिए एक अमूल्य उपकरण है । मानक ट्रांसजेनेसिस विधि विदेशी डीएनए टुकड़ों को एक निषेचित ओसाइट के प्रणोदक में माइक्रोइंजेक्ट करने पर आधारित है। इस तकनीक का व्यापक रूप से चूहों में उपयोग किया जाता है लेकिन अन्य जानवरों की प्रजातियों में अपेक्षाकृत अक्षम और तकनीकी रूप से मांग बनी हुई है। ट्रांसजीन को लेंटिवायरल संक्रमण के माध्यम से एक सेल-चरण भ्रूण में भी पेश किया जा सकता है, विशेष रूप से प्रजातियों या उपभेदों में अधिक चुनौतीपूर्ण भ्रूण संरचना के साथ मानक प्रोन्यूक्लियर इंजेक्शन के लिए एक प्रभावी विकल्प प्रदान करता है। इस दृष्टिकोण में, एक निलंबन जिसमें लेंटिवायरल वेक्टर होते हैं, को निषेचित चूहे के भ्रूण के पेरिविटेलिन अंतरिक्ष में इंजेक्ट किया जाता है, जो तकनीकी रूप से कम मांग करता है और इसकी सफलता दर अधिक होती है। लेंटिवायरल वैक्टर को स्थिर ट्रांसजेनिक लाइनों की पीढ़ी निर्धारित करने के लिए ट्रांसजीन को जीनोम में कुशलतापूर्वक शामिल करने के लिए दिखाया गया था। कुछ सीमाओं (जैसे, बायोसेफ्टी लेवल 2 आवश्यकताओं, डीएनए टुकड़ा आकार सीमा), लेंटिवायरल ट्रांसजेनेसिस के बावजूद एक तेजी से और कुशल ट्रांसजेनेसिस विधि है। इसके अतिरिक्त, मादा चूहों का उपयोग करना जो एक अलग प्रमुख फर रंग के साथ एक उपजाऊ पुरुष तनाव के साथ संभोग कर रहे हैं, छद्म गर्भवती पालक माताओं को उत्पन्न करने के विकल्प के रूप में प्रस्तुत किया जाता है।
Introduction
कई वर्षों के लिए, प्रयोगशाला कृंतक, जैसे चूहों और चूहों, मानव शारीरिक और रोग की स्थिति मॉडल के लिए इस्तेमाल किया गया है । पशु अनुसंधान खोजों के लिए नेतृत्व किया है कि किसी भी अंय साधनों से अप्राप्य थे । प्रारंभ में, आनुवंशिक अध्ययन अनायास होने वाले विकारों और फेनोटाइप के विश्लेषण पर केंद्रित थे जिन्हें मानव स्थिति की बारीकी से नकल करने के लिए माना जाता है1। जेनेटिक इंजीनियरिंग विधियों के विकास ने विशिष्ट जीन के परिचय या हटाने को वांछित फेनोटाइप प्राप्त करने की अनुमति दी। इसलिए ट्रांसजेनिक जानवरों की पीढ़ी को आधुनिक शोध में एक मौलिक तकनीक के रूप में पहचाना जाता है जो जीवित जीवों में जीन कार्य के अध्ययन की अनुमति देता है।
ट्रांसजेनिक पशु प्रौद्योगिकी प्रायोगिक भ्रूणविज्ञान और आणविक जीव विज्ञान में उपलब्धियों के संयोजन के माध्यम से संभव हो गया है । 1960 के दशक में, पोलिश भ्रूण विज्ञानी ए के Tarkowski विकास2के प्रारंभिक दौर के दौरान माउस भ्रूण हेरफेर पर पहला काम प्रकाशित किया । इसके अतिरिक्त, आणविक जीव विज्ञानियों ने जानवर के जीनोम में विदेशी डीएनए के अंतर आलिया परिचय के लिए डीएनए वेक्टर (यानी, वाहक) उत्पन्न करने की तकनीक विकसित की। ये वेक्टर चयनित जीन के प्रचार और उनके उचित संशोधन की अनुमति देते हैं, जो अनुसंधान के प्रकार के आधार पर आयोजित किया जाता है । "ट्रांसजेनिक एनिमल" शब्द गॉर्डन और रुडल3द्वारा पेश किया गया था।
न्यूरोबायोलॉजी, फिजियोलॉजी, फार्माकोलॉजी, टॉक्सिकोलॉजी और जैविक और चिकित्सा विज्ञान के कई अन्य क्षेत्रों में उपयोग की जाने वाली पहली व्यापक रूप से स्वीकार्य प्रजातियां नॉर्वे चूहा, रटस नॉर्वेगस4थीं। हालांकि, चूहे के भ्रूण में हेरफेर करने में कठिनाई के कारण, घर माउस मस्स मस्कुलस आनुवंशिक अनुसंधान5में प्रमुख पशु प्रजातियां बन गया है। इस तरह के शोध में माउस की प्रधानता का एक और कारण इस प्रजाति के लिए नॉकआउट जानवरों को उत्पन्न करने के लिए भ्रूणीय स्टेम सेल तकनीक की उपलब्धता थी । ट्रांसजेनेसिस की सबसे अधिक उपयोग की जाने वाली तकनीक (सभी जन्मे जानवरों के सापेक्ष ट्रांसजेनिक संतानों का 2-10%) डीएनए टुकड़ों का माइक्रोइंजेक्शन एक निषेचित ओसाइट के एक प्रोन्यूकलस में है। 1990 में, इस दृष्टिकोण, जो पहली बार चूहों में पेश किया गया था, चूहों6,,7के लिए अनुकूलित किया गया था । प्रोन्यूक्लियर इंजेक्शन द्वारा चूहा ट्रांसजेनेसिस चूहों की तुलना में कम दक्षता8 की विशेषता है, जो लोचदार प्लाज्मा और प्रोन्यूक्लियर झिल्ली9की उपस्थिति से सख्ती से संबंधित है। हालांकि हेरफेर के बाद भ्रूण का अस्तित्व चूहों की तुलना में 40-50% कम है, इस तकनीक को आनुवंशिक रूप से संशोधित चूहों10की पीढ़ी में एक मानक माना जाता है। वैकल्पिक दृष्टिकोण जो कुशल ट्रांसजीन समावेश न कंपोरेशन और इंजेक्शन जाइगोट्स की उच्च जीवित रहने की दरों की गारंटी दे सकते हैं, की जांच की गई है।
स्थिर ट्रांसजीन अभिव्यक्ति और संतान के लिए संचरण के प्रमुख निर्धारक मेजबान सेल जीनोम में इसका एकीकरण है । लेंटिवायरस (एलवी) में विभाजन और गैर-विभाजन कोशिकाओं दोनों को संक्रमित करने में सक्षम होने की विशिष्ट विशेषता है। भ्रूण में विषमलोगोस जीन के समावेश के लिए एक उपकरण के रूप में उनका उपयोग अत्यधिक कुशल11साबित हुआ, और ट्रांसजेनिक व्यक्तियों को शामिल डीएनए टुकड़े की स्थिर अभिव्यक्ति की विशेषता है। चूहों12,13, चूहों12,,14और अन्य प्रजातियों11के आनुवंशिक संशोधन के लिए लेंटिवायरल वेक्टर की प्रभावकारिता की पुष्टि की गई है । इस विधि में, एलवी निलंबन दो प्रोन्यूक्लियी के चरण में भ्रूण के ज़ोना पेल्यूसिडा के तहत इंजेक्ट किया जाता है। यह तकनीक अनिवार्य रूप से भ्रूण के 100% अस्तित्व की गारंटी देती है क्योंकि ओलम्मा अप्रभावित रहती है। उच्च गुणवत्ता वाले और अपेक्षाकृत अत्यधिक केंद्रित एलवी निलंबन का उत्पादन महत्वपूर्ण कारक हैं। हालांकि, एलवी निलंबन की कम सांद्रता को दोहराए गए इंजेक्शन11से दूर किया जा सकता है, जो झिल्ली एकीकरण को प्रभावित नहीं करते हुए अंडे की सतह पर वायरल कणों की मात्रा को बढ़ाता है। भ्रूण जो पेरिविटेलिन अंतरिक्ष में दोहराए गए इंजेक्शन के अधीन होते हैं, आगे विकसित होते हैं, और ट्रांसजेनिक संतान जर्मलाइन के माध्यम से ट्रांसजीन संचारित कर सकते हैं। लेंटिवायरल ट्रांसजेनेसिस द्वारा ट्रांसजेनिक चूहा उत्पादन की दक्षता 80%12तक हो सकती है.
यहां, हम एचआईवी-1-व्युत्पन्न रिकॉम्बिनेंट लेंटिवायरस के उत्पादन का वर्णन करते हैं जिसे वेसिकुलर स्टोमेटाइटिस वायरस (वीवीएसवी) जी लिफाफा प्रोटीन के साथ छद्म टाइप किया गया था। दूसरी पीढ़ी की पैकेजिंग प्रणाली वीएसवी छद्म प्रकार का उपयोग वायरल कणों की व्यापक संक्रामकता को निर्धारित करता है और अत्यधिक स्थिर वैक्टर के उत्पादन की अनुमति देता है जिसे अल्ट्रासेंट्रोफैगेशन और क्रायोपर्जिरेट द्वारा केंद्रित किया जा सकता है। टिटर सत्यापन के बाद, वैक्टर एल्बिनो विस्टार चूहा जाइगोट्स में ट्रांसजीन डिलीवरी के लिए वाहन के रूप में उपयोग करने के लिए तैयार हैं। इंजेक्शन की एक श्रृंखला के बाद, भ्रूण रातोंरात संस्कारी और दो सेल चरण में स्थानांतरित करने के लिए माताओं को बढ़ावा दिया जा सकता है । इस बिंदु पर, दो वैकल्पिक दृष्टिकोणों में से एक पर विचार किया जा सकता है । मानक प्रक्रिया भ्रूण प्राप्तकर्ताओं के रूप में छद्म गर्भवती महिलाओं का उपयोग करती है। हालांकि, जब गर्भपुरुष पुरुषों के साथ संभोग के बाद गर्भावस्था की दर कम होती है, तो भ्रूण को गर्भवती विस्टार/स्प्राग-डाबले (एसडी) महिलाओं में प्रत्यारोपित किया जा सकता है जो गहरे फर रंग (जैसे, ब्राउन नॉर्वे [बीएन] चूहों के साथ उपजाऊ पुरुष चूहों से जुड़े होते हैं। फर का रंग स्थानांतरित हेरफेर भ्रूण से उत्पन्न होने वाली संतानों से प्राकृतिक गर्भावस्था से संतानों के अंतर की अनुमति देता है।
Subscription Required. Please recommend JoVE to your librarian.
Protocol
वायरल वैक्टर का उत्पादन और आवेदन जैव सुरक्षा स्तर 2 दिशानिर्देशों के अनुसार था और इसे पोलिश पर्यावरण मंत्रालय द्वारा अनुमोदित किया गया था । नीचे वर्णित सभी प्रायोगिक पशु प्रक्रियाओं को स्थानीय नैतिक समिति द्वारा अनुमोदित किया गया था । जानवरों को स्थिर तापमान (21-23 डिग्री सेल्सियस) और आर्द्रता (50-60%) पर व्यक्तिगत रूप से हवादार पिंजरों में रखे गए थे विज्ञापन लिमिटम के साथ 12 घंटे/12 एच लाइट/डार्क साइकिल के तहत पानी और भोजन तक पहुंच ।
1. लेंटिवायरल वेक्टर उत्पादन
- एचईसी 293T कोशिकाओं का ट्रांसफेक्शन
नोट: प्रोटोकॉल है कि यहां प्रस्तुत किया जाता है बीस Ø10 सेमी संस्कृति व्यंजन है कि कच्चे वेक्टर supernatant के लगभग २०० मीटर का उत्पादन के ट्रांसफेक्शन के लिए बनाया गया है ।- डीएमईएम माध्यम में संस्कृति एचईसी 293T कोशिकाएं जो 37 डिग्री सेल्सियस पर एक आर्द्र सीओ2 इनक्यूबेटर में भ्रूण गोजातीय सीरम (10%, v/v) के साथ पूरक हैं। ट्रांसफेक्शन के लिए, बीस 10 सेमी व्यास प्लेटें तैयार करें, और बीज 1.5-2 x 106 एचईसी 293T कोशिकाएं प्रति डिश।
- जब संगम ~ 70% तक पहुंचता है, तो पॉलीथीनमाइन (पीई) रिएजेंट, पीएच 7.0 का उपयोग करके कोशिकाओं को डीएनए के प्रति 1 μg प्रति पी के 3 μg के अनुपात में स्थानांतरित कर देता है।
- ट्रांसफेक्शन मिश्रण को पांच प्लेटों के लिए तैयार करें (व्यंजनों की कुल संख्या के अनुसार पुनरावृत्ति की संख्या तैयार करें)। Dulbecco के संशोधित ईगल माध्यम (DMEM; सीरम के बिना) के 1 mL करने के लिए, तीन प्लाज्मिड का मिश्रण जोड़ें ताकि वे VSVg प्लाज्मिड के 25 μg की अंतिम राशि तक पहुंचने, डेल्टा R8.2 के ५० μg, और कोडिंग प्लाज्मिड के ५० μg ।
- ऊपर और नीचे पिपेट, और 3 μg/μL की एकाग्रता पर पी के १२५ μL जोड़ें । 15 टन के लिए कमरे के तापमान पर इनक्यूबेट, इनक्यूबेशन के दौरान ट्यूब तीन बार उलटा । प्रति प्लेट ट्रांसफेक्शन मिश्रण के 200 माइक्रोन जोड़ें। इसके बाद, प्लेटों को 37 डिग्री सेल्सियस पर एक आर्द्र सीओ2 इनक्यूबेटर में इनक्यूबेट करें।
- लेंटिवायरल वेक्टर की एकाग्रता
- ट्रांसफेक्शन के ४८ घंटे बाद, उस माध्यम को फसल करें जिसमें एलवी कण होते हैं । 50 मीटर शंकुट्यूब का प्रयोग करें।
नोट: फ्लोरोसेंट टैग के साथ प्लाज्मिड का उपयोग करते समय, कोशिकाओं को ट्रांसफेक्शन दक्षता सत्यापित करने के लिए इस बिंदु पर कल्पना की जा सकती है। DMEM माध्यम का एक नया हिस्सा जोड़ा जा सकता है, और कोशिकाओं को अतिरिक्त 24 घंटे के लिए इनक्यूबेटेड किया जा सकता है । एलवी यील्ड जब ट्रांसफेक्शन के बाद 48 और 72 घंटे के समय बिंदुओं पर एकत्र की जाती है तो तुलनीय होती है। - अलग कोशिकाओं को हटाने के लिए 5 न्यूनतम और कमरे के तापमान के लिए 3,000 x ग्राम पर मध्यम को केंद्रित करें।
- अधिनेता (0.45 माइक्रोन) को फ़िल्टर करें और इसे नई ट्यूबों में डालें।
नोट: इस कदम को छोड़ा जा सकता है। - DNase I (RNase मुक्त, 1 μg/mL) और MgCl2 (1 mM), और 15 min के लिए ३७ डिग्री सेल्सियस पर एक पानी स्नान में इनक्यूबेट जोड़ें ।
- 115,000 x g पर एक झूलते रोटर में मध्यम को डिस्पोजेबल पॉलीथीन ट्यूबों और अल्ट्रासेंट्रिकफ्यूज और 1.5 घंटे के लिए 4 डिग्री सेल्सियस स्थानांतरित करें।
- अपकेंद्री होने के बाद, धीरे-धीरे ट्यूबों की दीवारों को मध्यम अवशेषों से निकाल ें।
- पैलेट को बाँझ फॉस्फेट-बफर्ड लवइन (पीबीएस; 70-80 माइक्रोन प्रति ट्यूब) से भिगो दें।
- 4-8 डिग्री सेल्सियस पर 2 घंटे के लिए इनक्यूबेट।
- कोमल पाइपिंग द्वारा पीबीएस में वायरल वैक्टर को फिर से निलंबित करें।
सावधानी: फोमिंग से बचें। - 30 एस के लिए 7,000 x ग्राम और 4 डिग्री सेल्सियस पर 1.5 mL अपकेंद्रित्र ट्यूब और अपकेंद्रित्र करने के लिए स्थानांतरण। इस कदम को तब तक दोहराएं जब तक कि कोई सेलुलर मलबे का गोली दिखाई न दे।
- अलीकोट और फ्रीज -80 डिग्री सेल्सियस पर। एलवी अलीकोट को फिर से फ्रीज करने से बचें।
- ट्रांसफेक्शन के ४८ घंटे बाद, उस माध्यम को फसल करें जिसमें एलवी कण होते हैं । 50 मीटर शंकुट्यूब का प्रयोग करें।
- मात्रात्मक बहुलक श्रृंखला प्रतिक्रिया का उपयोग कर वायरस टिटर का निर्धारण
नोट: वायरल वेक्टर का टिटनेस मात्रात्मक पीसीआर (क्यूपीसीआर) का उपयोग करके किया जाता है। यह विधि वायरल जीनोम15के लंबे टर्मिनल दोहराने वाले क्षेत्र के भीतर एक डबल-फंसे 84 बीपी लंबे डीएनए टुकड़े को बढ़ाना पर आधारित है।- एलवी-कोडिंग प्लाज्मिड के सीरियल कमजोराई करके मानक वक्र तैयार करें: 1:500, 1:1,000, 1:5,000, 1:10,000, 1:100,000, और 1:1,000,000। मानक वक्र के लिए उपयोग की जाने वाली प्लाज्मिड की प्रतियों की संख्या निर्धारित करें। निम्नलिखित सूत्र का उपयोग करें: प्रतियों की संख्या/μL = (एकाग्रता [g/μL] x ६.०२ x 1023 [संख्या/मोल])/(६६० [जी/मोल] एक्स प्लाज्मिड आकार [बीपी]), जहां ६.०२ x 1023 नंबर/मोल Avogadro की संख्या है, और ६६० जी/मोल बीपी वजन है ।
नोट: ऑनलाइन कॉपी नंबर कैलकुलेटर का उपयोग किया जा सकता है। - लेंटिवायरल निलंबन के कमजोर: 1:100, 1:500, और 1:1,000 तैयार करें।
- प्रतिक्रिया मिश्रण (प्रति अच्छी तरह से मात्रा): क्यूपीसीआर मास्टरमिक्स के 10 माइक्रोन, 10 माइक्रोन फॉरवर्ड प्राइमर के 1 माइक्रोन, 10 माइक्रोन रिवर्स प्राइमर के 1 माइक्रोन, और एच2ओ पिपेट के 7 माइक्रोन मिश्रण को 96-अच्छी तरह प्लेटों के कुओं में तैयार करें।
नोट: फॉरवर्ड प्राइमर: 5'-AGCTTGCCTTGAGTGCTTCA । रिवर्स प्राइमर: 5'-TGACTAAAGGTCTGAGGA। - ट्रिपलेट में प्रत्येक मानक कमजोर पड़ने और लेंटिवायरल निलंबन के 1 माइक्रोन जोड़ें।
- निम्नलिखित मापदंडों के अनुसार क्यूपीसीआर चलाएं: 2 मिन के लिए 50 डिग्री सेल्सियस, 5 मिन के लिए 96 डिग्री सेल्सियस, और 20 एस के लिए 96 डिग्री सेल्सियस के 35 चक्र, 40 एस के लिए 60 डिग्री सेल्सियस, और 1 मिन के लिए 70 डिग्री सेल्सियस, पिघलकर वक्र चरण: 1 मिन के लिए 95 डिग्री सेल्सियस और 30 एस पर 60 डिग्री सेल्सियस।
- प्रत्येक कमजोर पड़ने के लिए प्राप्त अणुओं की संख्या की तुलना मानक वक्र से करके परिणामों का विश्लेषण करें। प्रत्येक कमजोर पड़ने के लिए तीन प्रतिकृतिके औसत के रूप में वेक्टर अणुओं की एकाग्रता निर्धारित करें।
नोट: प्रस्तुत परिमाण वायरल कणों की भौतिक एकाग्रता देता है। इसे फंक्शनल टिटर नहीं माना जाना चाहिए।
- एलवी-कोडिंग प्लाज्मिड के सीरियल कमजोराई करके मानक वक्र तैयार करें: 1:500, 1:1,000, 1:5,000, 1:10,000, 1:100,000, और 1:1,000,000। मानक वक्र के लिए उपयोग की जाने वाली प्लाज्मिड की प्रतियों की संख्या निर्धारित करें। निम्नलिखित सूत्र का उपयोग करें: प्रतियों की संख्या/μL = (एकाग्रता [g/μL] x ६.०२ x 1023 [संख्या/मोल])/(६६० [जी/मोल] एक्स प्लाज्मिड आकार [बीपी]), जहां ६.०२ x 1023 नंबर/मोल Avogadro की संख्या है, और ६६० जी/मोल बीपी वजन है ।
2. ट्रांसजेनिक चूहों की पीढ़ी
- निषेचित भ्रूण का अधिवष्टीकरण और संग्रह
- गोनाडोट्रोपिन का प्रशासन करें।
नोट: एकत्र भ्रूण (लगभग 30 प्रति महिला) की संख्या बढ़ाने के लिए, हार्मोनल उत्तेजना के लिए अपरिपक्व 5 सप्ताह पुरानी Wistar महिलाओं का उपयोग करें ।- पहले दिन (12 बजे-1 बजे), इंट्रापेरिटोनी गर्भवती घोड़ी के सीरम गोनाडोट्रोपिन (पीएमएसजी; प्रति महिला 25 आईयू) इंजेक्ट करें । 09% नैल में हार्मोन पाउडर को भंग करके 125 आईयू/एमएल की एकाग्रता पर वर्किंग सॉल्यूशन के 1 एमएल एलिकोस तैयार करें। -20 डिग्री सेल्सियस पर 1 महीने तक या -80 डिग्री सेल्सियस तक 6 महीने के लिए स्टोर करें।
- तीसरे दिन (12 बजे-1 बजे), इंट्रापेरिटोनी से ह्यूमन कोरियोनिक गोनाडोट्रोफिन (एचसीजी; 30 आईयू प्रति महिला) इंजेक्ट करें । 09% नैल में हार्मोन पाउडर को भंग करके वर्किंग सॉल्यूशन (150 आईयू/एमएल) के 1 एमएल एलिकोट्स तैयार करें। -20 डिग्री सेल्सियस पर 1 महीने तक या -80 डिग्री सेल्सियस तक 6 महीने के लिए स्टोर करें।
- एचसीजी प्रशासन के बाद, यौन उपजाऊ पुरुषों (3-10 महीने पुराने) के साथ 1:1 दोस्त महिलाओं।
- अगली सुबह (दिन 4 बजे 8-10 बजे), योनि प्लग की उपस्थिति के लिए महिलाओं की जांच करें। एक सफ़ेद संभोग प्लग की उपस्थिति के लिए योनि खोलने की जांच करें, जिसे संभोग रात के बाद सुबह जल्दी जांचा जाना चाहिए। भ्रूण संग्रह के लिए, एक दृश्य प्लग के साथ केवल महिलाओं का उपयोग करें।
- सुबह 10 बजे भ्रूण ले लीजिए। अंडाशय को उत्पादित करने के लिए जानवरों का बलिदान करें, और पूर्व-गरम M2 माध्यम के साथ एक डिश में अंडाशय इकट्ठा करें।
- ओविडक्ट्स को 35 एमएम डिश में स्थानांतरित करें जिसमें 0.5 मिलीग्राम/mL की एकाग्रता पर गोजातीय टेस्ट से हायलुरोनिडेस के साथ पूर्व-गर्म एम 2 माध्यम शामिल है।
- एक स्टीरियोमाइक्रोस्कोप के नीचे ठीक संदंश का उपयोग करओडिड की दीवारों को खोलें और एम्पुला (यानी, ओविडक्ट का सूजन हिस्सा है जिसमें निषेचित भ्रूण शामिल हैं जो क्यूमुलस कोशिकाओं से घिरे हुए हैं) तब तक।
नोट: हायलुरोनिदास एंजाइमेटिक रूप से क्यूमुलस कोशिकाओं को पचाते हैं, भ्रूण को जारी करते हैं।
सावधानी: हायलूरोनिदास के लिए लंबे समय तक जोखिम भ्रूण के लिए हानिकारक है; इसलिए, यह कदम 5 मिन से अधिक नहीं रह जाना चाहिए। - क्यूमुलस कोशिकाओं से भ्रूण की रिहाई की सुविधा के लिए, धीरे-धीरे उन्हें एक ग्लास ट्रांसफर पिपेट का उपयोग करके ऊपर और नीचे पिपेट करें जो मुंह से संचालित एस्पिरेटर ट्यूब से जुड़ा हुआ है।
- स्थानांतरण पिपेट का उत्पादन करने के लिए, एक सीधे ~ 5-10 सेमी टिप का उत्पादन करने के लिए एक लौ पर एक ग्लास पाश्चर पिपेट खींचें। ~ 4 सेमी टिप छोड़ने वाले पिपेट को तोड़ें।
- हायलुरोनिदास और सेलुलर मलबे को हटाने के लिए M2 माध्यम में कई बार भ्रूण धोएं। भ्रूण को 60 मिमी पकवान में स्थानांतरित करें जिसमें 5% सीओ2 वातावरण के साथ आर्द्र 37 डिग्री सेल्सियस इनक्यूबेटर में तरल पैराफिन या खनिज तेल द्वारा कवर पूर्व-समतुल्य M16 मध्यम की (~ 50 माइक्रोन) बूंदें शामिल हैं।
- गोनाडोट्रोपिन का प्रशासन करें।
- ज़ोना पेल्यूसिडा के तहत एक सेल-स्टेज भ्रूण के लिए लेंटिवायरल वेक्टर का माइक्रोइंजेक्शन
नोट: माइक्रोइंजेक्शन(चित्रा 1)के लिए दो दृश्यमान प्रोन्यूक्लिकके साथ एक-कोशिका-चरण भ्रूण का उपयोग करें।- कमरे के तापमान पर एलवी aliquot गल और १०,००० x जी पर अपकेंद्री और 2 मिन के लिए आरटी किसी भी शेष सेलुलर मलबे गोली के लिए ।
- माइक्रोइंजेक्शन सेटअप
- माइक्रोफोर्ज का उपयोग करके ग्लास होल्डिंग पिपेट (बोरोसिलिकेट ग्लास केशिका) तैयार करें। 5-10 सेमी टिप का उत्पादन करने के लिए एक लौ पर ग्लास केशिका खींचें। ~ 4 सेमी टिप छोड़ने वाले पिपेट को तोड़ें। बाहर व्यास ~ 80-120 माइक्रोन होना चाहिए।
नोट: सुनिश्चित करें कि पिपेट टिप पूरी तरह से सीधे और चिकनी है। - हीटिंग फिलामेंट के सामने टिप के साथ एक माइक्रोफोर्ज में खींचे गए पिपेट को इकट्ठा करें। फिलामेंट को पिपेट टिप के बहुत करीब गर्म करें और इसे ~ 15 माइक्रोन (भ्रूण के आकार का लगभग 20%) के व्यास तक सिकुड़ने दें। पिपेट को हीटिंग फिलामेंट, पिपेट टिप से 2-3 मिमी तक लंबवत स्थिति दें, और गर्मी शुरू करें। शीशा नरम होगा। गर्मी जब तक यह एक 15 डिग्री कोण तक पहुंचता है ।
- पिपेट खींचने वाले का उपयोग करके एक फिलामेंट के साथ माइक्रोइंजेक्शन बोरोसिलिकेट ग्लास केशिकाज तैयार करें। पुलिंग कक्ष में केशिका डालें। एक रैंप टेस्ट चलाएं (नए ग्लास के लिए पहली बार और फिलामेंट बदलने के बाद हर बार)। रैंप वैल्यू-10, पुल टू 100, वेग से 150 और टाइम टू 100 पर हीट सेट करें।
नोट: एक इष्टतम इंजेक्शन केशिका प्राप्त करने के लिए मापदंडों को संशोधित करें। - एक बायोसेफ्टी लैमिनार फ्लो हुड के तहत, वायरल समाधान के लगभग 2 माइक्रोओडर टिप के साथ माइक्रोइंजेक्शन पिपेट में लोड करें।
- तरल पैराफिन या खनिज तेल द्वारा कवर किए गए एम 2 मध्यम (बीच में) की 100 माइक्रोन ड्रॉप के साथ एक माइक्रोइंजेक्शन डिश (60 मिमी पेट्री डिश का ढक्कन) तैयार करें।
- एक उल्टे माइक्रोस्कोप के नीचे माइक्रोजोड़क और माइक्रोइंजेक्शन डिश के वायरल समाधान से भरे हुए होल्डिंग पिपेट और माइक्रोइंजेक्शन केशिका को माउंट करें।
- माइक्रोफोर्ज का उपयोग करके ग्लास होल्डिंग पिपेट (बोरोसिलिकेट ग्लास केशिका) तैयार करें। 5-10 सेमी टिप का उत्पादन करने के लिए एक लौ पर ग्लास केशिका खींचें। ~ 4 सेमी टिप छोड़ने वाले पिपेट को तोड़ें। बाहर व्यास ~ 80-120 माइक्रोन होना चाहिए।
- माइक्रोइंजेक्शन करें।
- माइक्रोइंजेक्शन डिश पर M2 ड्रॉप करने के लिए 15-20 एक सेल चरण भ्रूण स्थानांतरण । भ्रूण को पकड़े हुए पिपेट का उपयोग करके पकड़ें।
- 400x आवर्धन का उपयोग करके, एक स्वचालित इंजेक्टर से जुड़े ग्लास केशिका का उपयोग करके ज़ोना पेल्यूसिडा अंतरिक्ष में एलवी समाधान इंजेक्ट करें। एक पल के लिए ज़ोना पेल्यूसिडा के नीचे केशिका पकड़ो।
नोट: कोमल सकारात्मक दबाव का उपयोग करके, वायरल समाधान इंजेक्शन केशिका से लगातार बाहर निकलजाएगा, लेकिन वितरित निलंबन की मात्रा को नियंत्रित नहीं किया जा सकता है। - एक ठीक पिपेट का उपयोग करना, एक 5% सीओ2 वातावरण में 37 डिग्री सेल्सियस पर इनक्यूबेटर में संस्कृति पकवान के लिए भ्रूण वापस। एक जाइगोट के इंजेक्शन की संख्या भिन्न हो सकती है और वायरल वेक्टर एकाग्रता के आधार पर अनुकूलित की जा सकती है।
नोट: इंजेक्शन भ्रूण एक सेल चरण में पालक माताओं को हस्तांतरित किया जा सकता है या M16 माध्यम में इनक्यूबेटेड O/N से पहले दो सेल चरण में स्थानांतरित किया जा रहा है । चूहे के भ्रूण की लंबे समय तक इन विट्रो संस्कृति से बचा जाना चाहिए।
- पालक माताओं के लिए इंजेक्शन भ्रूण का हस्तांतरण
- उपजाऊ बीएन पुरुषों के साथ यौन परिपक्व एसडी महिलाओं संभोग द्वारा पालक माताओं को तैयार करें या पुरुष नसबंदी एसडी पुरुषों के साथ (पुरुष नसबंदी प्रक्रिया नीचे धारा 3 में वर्णित है) 3 दिन (एक कोशिका चरण में भ्रूण स्थानांतरित करने के लिए) या दिन 4 (दो सेल चरण में भ्रूण स्थानांतरित करने के लिए) ।
नोट: ओविडक्ट ट्रांसफर के लिए, 0.5 दिनों के पोस्ट कोइटम (डीपीसी) महिलाओं का उपयोग करें। - अगली सुबह, योनि प्लग के लिए एसडी महिलाओं की जांच करें, और केवल एक दृश्य प्लग वाले लोगों का उपयोग करें।
- भ्रूण हस्तांतरण करते हैं।
नोट: एक स्टीरियोमाइक्रोस्कोप के तहत बाँझ उपकरणों के साथ शल्य प्रक्रिया का संचालन। सर्जरी के दिन से पहले, ऑटोक्लेव कैंची, ठीक संदंश, सुई धारक, और स्केलपेल धारक।- केटामाइन (50 मिलीग्राम/किलो) और मेडिटोमिडीन (0.5 मिलीग्राम/किलो) समाधान के प्रशासन के साथ एक महिला को एनेस्थेटिज़ करें। सर्जिकल प्रक्रिया शुरू करने से पहले संज्ञाहरण की पुष्टि करने के लिए सजगता के लिए परीक्षण करें।
- जानवर को क्रमशः सूजन, दर्द और संक्रमण को रोकने के लिए टॉलेफेनमिक एसिड (2 मिलीग्राम/किलो), बुटॉरटोल टार्ट्रेट (1 मिलीग्राम/किलो), और एनरोलोसेसिन (5-10 मिलीग्राम/किलो) के साथ इंजेक्ट करें।
- कॉर्नियल सुखाने से रोकने के लिए दोनों आंखों पर नेत्र मलम स्नेहन लगाएं। पीठ से फर दाढ़ी, और सर्जिकल स्क्रब के साथ त्वचा बंध्याकरण ७०% शराब बाँझ गैर पालन पैड का उपयोग कर के बाद । त्वचा को सूखने दें।
- चीरा साइट पर 0.25% bupivacaine (स्थानीय संवेदनाकारी) के 100 μL के साथ पशु को नीचे की ओर इंजेक्ट करें। एक शल्य माइक्रोस्कोप के उद्देश्य के तहत एक हीटिंग पैड पर एक साफ सतह के लिए एक प्रवण स्थिति में जानवर हस्तांतरण। पीठ के निचले हिस्से पर एक छोटे से छेद कट के साथ एक बाँझ कपड़े के साथ चूहे को कवर करें।
- काठ कशेरुकी स्तंभ के समानांतर लगभग 2 सेमी त्वचा चीरा करें।
- तेज कैंची का इस्तेमाल करपेट की दीवार में कट बना लें। संदंश का उपयोग करके एक अंडाशय वसा पैड पकड़ो, और अंडाशय और अंडाशय को बाहर निकालें और उन्हें धुंध पर रखें जो 0.9% नैल के साथ गीला है।
- Aspirate M2 मध्यम, हवा के तीन बुलबुले, और स्थानांतरण केशिका में भ्रूण। भ्रूण की कुल संख्या स्थानांतरित करने की सिफारिश की (एकतरफा या द्विपक्षीय): गर्भवती महिला (15-16 भ्रूण), छद्म गर्भवती महिला (30 भ्रूण) ।
- माइक्रो-कैंची का उपयोग करके ओविडक्ट (इनफंडिबुलम और एम्पुला के बीच) में एक छोटा सा चीरा बनाएं, और ओविडक्ट में स्थानांतरण पिपेट डालें।
- पिपेट से ओवक्ट में भ्रूण और हवा के बुलबुले धीरे-धीरे निष्कासित करें। कुंद संदंश के साथ, प्रजनन पथ को पेट की गुहा में वापस रखें।
- पेट की दीवार को पॉलीग्लाइकोलिक एसिड अवशोषक टांके के साथ टांका लगाएं और घाव क्लिप के साथ त्वचा चीरा बंद करें। उपलब्ध भ्रूण की संख्या के आधार पर, अन्य अंडाशय के लिए इस प्रक्रिया को दोहराएं।
- एनेस्थीसिया के प्रभाव को रिवर्स करने के लिए एटिपेमेजोल (0.5 मिलीग्राम/किलो) के साथ पशु इंट्रापेरिटोनी इंजेक्ट करें।
- जानवर को एक साफ पिंजरे में स्थानांतरित करें और संज्ञाहरण से पूरी तरह से उबरने के लिए इसे वार्मिंग प्लेट पर रखें। चूहों में डिलीवरी ~ 21 दिनों के बाद होती है।
नोट: जब पुरुष बीएन चूहों संभोग के लिए उपयोग किया जाता है, केवल सफेद पिल्ले संभावित ट्रांसजेनिक हैं; ब्राउन पिल्ले प्राकृतिक गर्भावस्था से होते हैं। - ऊतक के टुकड़े (अधिमानतः कान से) जीनोटाइप 3 सप्ताह पुराने पिल्ले के लिए ले लीजिए ।
- उपजाऊ बीएन पुरुषों के साथ यौन परिपक्व एसडी महिलाओं संभोग द्वारा पालक माताओं को तैयार करें या पुरुष नसबंदी एसडी पुरुषों के साथ (पुरुष नसबंदी प्रक्रिया नीचे धारा 3 में वर्णित है) 3 दिन (एक कोशिका चरण में भ्रूण स्थानांतरित करने के लिए) या दिन 4 (दो सेल चरण में भ्रूण स्थानांतरित करने के लिए) ।
3. पुरुष नसबंदी
नोट: सर्जरी के दिन से पहले, ऑटोक्लेव कैंची, ठीक संदंश और सुई धारक।
- एनेस्थेटिज़ 5 सप्ताह पुराने पुरुष एसडी चूहे के साथ केटामाइन (50 मिलीग्राम/किलो) और मेडिटोमिडीन (0.5 मिलीग्राम/किलो) समाधान के प्रशासन के साथ। सर्जिकल प्रक्रिया शुरू करने से पहले संज्ञाहरण की पुष्टि करने के लिए सजगता के लिए परीक्षण करें।
- सूजन, दर्द और संक्रमण को रोकने के लिए टॉल्फेनेमिक एसिड (2 मिलीग्राम/किलो), बुटॉरटोल टार्ट्रेट (1 मिलीग्राम/किलो), और सूजन, दर्द और संक्रमण को रोकने के लिए क्रमशः लोफेनेमिक एसिड (2 मिलीग्राम/किलो), और एन्रोलोसेसिन (5-10 मिलीग्राम/किलो) को नीचे ले जाएं।
- कॉर्नियल सुखाने से रोकने के लिए दोनों आंखों पर नेत्र मलम स्नेहन लगाएं। चूहे को एक हीटिंग पैड पर एक साफ सतह पर रखें, और सर्जिकल स्क्रब के साथ टेस्ट पर त्वचा को स्टरलाइज करें और बाँझ गैर-पालन पैड का उपयोग करके 70% अल्कोहल के बाद। त्वचा को सूखने दें। वृषण पर एक छोटे से छेद कट के साथ एक बाँझ कपड़े के साथ चूहे को कवर करें। स्क्रोटल थैली में वृषण का पर्दाफाश करने के लिए धीरे-धीरे पेट को दबाएं।
- सर्जिकल कैंची का उपयोग करके, स्क्रोटल थैली के बीच में ~ 0.5 सेमी चीरा बनाएं। वृषण के बीच मिडलाइन दीवार (सफ़ेद रेखा) का पता लगाएं।
- मिडलाइन दीवार के बाईं ओर के करीब टेस्टिस झिल्ली में 5 मिमी चीरा लगाएं।
- ध्यान से बाईं ओर टेस्टिस पुश और एक रक्त वाहिका के साथ एक सफेद वाहिनी के रूप में (टेस्टिस और मिडलाइन के बीच) वास deferens का पता लगाने ।
- धीरे-धीरे एक घड़ीसाज के संदंश का उपयोग करके स्क्रोटल थैली से वास को बाहर खींचें। संदंश की एक जोड़ी के साथ वास deferens पकड़ो, और यह ठीक कैंची के साथ काट (या संदंश की एक दूसरी जोड़ी के लाल गर्म सुझावों के साथ cauterize) । वाहिनी का ~ 1 सेमी टुकड़ा निकालें।
नोट: यदि कॉटराइजेशन किया जाता है, तो लौ में संदंश की दूसरी जोड़ी की नोक पकड़ें। - अन्य टेस्टिस के लिए उपरोक्त प्रक्रिया दोहराएं। पॉलीग्लाइकोलिक एसिड अवशोषक टांके के साथ त्वचा को टांका और एटिपामेजोल (0.5 मिलीग्राम/किलो) के साथ पशु इंट्रापेरिटोनी इंजेक्ट करें।
- चूहे को एक वार्मिंग प्लेट पर एक साफ पिंजरे में रखें जब तक कि जानवर संज्ञाहरण से ठीक न हो जाए।
नोट: पुरुषों का उपयोग ~ 2 सप्ताह की वसूली अवधि के बाद परीक्षण संभोग में किया जा सकता है। नसबंदी की पुष्टि होने के बाद, उनका उपयोग छद्म गर्भावस्था प्रेरण के लिए किया जा सकता है।
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
यहां वर्णित प्रोटोकॉल का उपयोग करना, सिन-टीडीपी-43-ईजीएफपी निर्माण करने वाले लेंटिवायरल वेक्टर का8उत्पादन किया गया था (भौतिक एलवी टिटर = 3.4 x 10 8/μL) और फिर एक सेल-स्टेज भ्रूण सबजोनल इंजेक्शन के लिए उपयोग किया जा सकता है। केवल दो दिखाई देने वाले प्रोन्यूक्लिसी वाले भ्रूण प्रक्रिया के अधीन थे। वायरल निलंबन के इंजेक्शन की संख्या प्रायोगिक रूप से निर्धारित की गई थी । उच्च प्रत्यारोपण दक्षता और ट्रांसजेनिक संतानों की एक साथ कमी को सफल ट्रांसड्यूक्शन के लिए अपर्याप्त संख्या में वायरल कणों के संकेतक माना जाता था। इस मामले में इंजेक्शन की संख्या बढ़ाई गई थी। एलवी के एकल प्रशासन के परिणामस्वरूप 20 एफ0 पीढ़ी के चूहों का जन्म हुआ, जिनमें से कोई भी ट्रांसजेनिक नहीं था । परिमाण के एक आदेश से इंजेक्शन की संख्या में वृद्धि चूहों के जन्म में परिणाम नहीं था, लेकिन भ्रूण के १००% दो कोशिका चरण के लिए विकसित की है । बाद के प्रयोगों में, इंजेक्शन की संख्या में एक की वृद्धि हुई थी, जिसके लिए संतान प्राप्त किए गए थे। दो इंजेक्शन के संस्करण के लिए, आठ चूहों का जन्म हुआ, जिनमें से तीन ट्रांसजीन (तालिका 1में संक्षेप) ले जाने की पुष्टि की गई । संस्थापकों में से एक ने ट्रांसजीन को वंश में स्थानांतरित नहीं किया। प्रत्येक प्रायोगिक संस्करण में इंजेक्ट और स्थानांतरित किए गए भ्रूणों की संख्या वेरिएंट एलवी x1 और एलवी x2 में ४८ और एलवी x10 में ४५ थी । प्रत्येक प्रायोगिक सेटअप के लिए तीन पालक महिलाओं का उपयोग किया गया था। चुने गए दृष्टिकोण ने स्थिर ट्रांसजेनिक चूहा लाइनों की पीढ़ी को अनुमति दी जिसने पूरे केंद्रीय तंत्रिका तंत्र(चित्रा 2ए, बी)14में न्यूरोनल सिनेप्सिन-1 प्रमोटर के नियंत्रण में टीडीपी-43-ईजीएफपी फ्यूजन प्रोटीन व्यक्त किया। लेंटिवायरस आधारित ट्रांसजेनेसिस के परिणामस्वरूप ट्रांसजीन की एक प्रति प्रविष्टि हुई, जैसा कि क्यूपीसीआर(चित्रा 2 सी)द्वारा प्रदर्शित किया गया है।
ऊपर वर्णित प्रायोगिक सेटअप में, इंजेक्शन भ्रूण की जीवित रहने की दर 95% थी। इसी तरह के परिणाम तब प्राप्त किए गए जब तालिका 2में संक्षेप में अन्य लेंटिवायरल वैक्टर के लिए इसी विधि का उपयोग किया गया था। कृत्रिम परमाणु इंजेक्शन बच भ्रूण का प्रतिशत काफी कम (29-45%) था । तालिका 2 छद्म गर्भवती महिलाओं के हस्तांतरण को ध्यान में रखते हुए हेरफेर किए गए जाइगोट्स की प्रत्यारोपण दक्षता के प्रतिनिधि परिणामों का सारांश देती है। इंजेक्शन भ्रूण के साथ एक साथ गैर हेरफेर भ्रूण के उपयोग पहले16की सूचना दी थी । हमारे समग्र परिणाम ों से पता चलता है कि गर्भवती महिला चूहों को तुलनीय दक्षता के साथ पालक माताओं के रूप में इस्तेमाल किया जा सकता है। हमने गर्भवती और छद्म गर्भवती चूहों में विदेशी भ्रूणों के प्रत्यारोपण का एक समान प्रतिशत प्राप्त किया (कई प्रयोगात्मक सेटअप के लिए कुल औसत: 15% बनाम 16%)। हालांकि, प्रत्यारोपण दर अधिक थी जब भ्रूण अधिक सूक्ष्म हेरफेर से गुजरना पड़ा, जिसका अर्थ है एक सबजोनल इंजेक्शन (10% बनाम 21%)। विशेष रूप से, माइक्रोइंजेक्शन के व्यक्तिगत दौर के लिए विश्लेषण किए गए संख्यात्मक डेटा से संकेत मिलता है कि प्रत्यारोपण की प्रभावशीलता एक भ्रूण(तालिका 1,अंतिम कॉलम) के इंजेक्शन की संख्या पर निर्भर करती है और अप्रत्यक्ष रूप से वायरल लोड पर निर्भर करती है।
| वेक्टर | इंजेक्शन/भ्रूण की संख्या | इंजेक्शन भ्रूण की संख्या | पिल्ले की संख्या | पालक माताओं की संख्या | ट्रांसजेनिक संस्थापकों की संख्या | प्रत्येक संस्करण के लिए प्रत्यारोपण दक्षता |
| सिन-टीडीपी-43डब्ल्यूटीएलवी | 1 | 48 | 20 | 3 | 0 | 42% |
| 10 | 45 | 0 | 3 | 0 | 0% | |
| 2 | 48 | 8 | 3 | 3 | 17% |
तालिका 1: सिन-टीडीपी-43डब्ल्यूटीलेंटिवायरल वैक्टर के साथ जाइगोट्स के सबजोनल इंजेक्शन की संख्या का सारांश।
| विधि | वेक्टर | टिटर/एकाग्रता | इंजेक्शन भ्रूण की संख्या | बच गए भ्रूण | जीवित रहने की दर | पालक माताओं की संख्या | पिल्ले की संख्या | प्रत्यारोपण दक्षता | गर्भावस्था (पी) /छद्म गर्भावस्था (पीपी) |
| पीएनई | TTYH1-Thy1-EGFP | 1 एनजी/μL | 1083 | 424 | 39% | 16 | 54 | 13% | पीपी |
| पीएनई | H3mCherry | 0.5-2 एनजी/μL | 2229 | 647 | 29% | 29 | 67 | 10% | पीपी |
| पीएनई | सिन-टीडीपी-43-A315T | 2 एनजी/μL | 1256 | 562 | 45% | 31 | 42 | 7% | पीपी |
| Lv | सिन-टीडीपी-43-A315T | 8.7 x 108 | 115 | 106 | 92% | 7 | 18 | 17% | पी |
| Lv | सिन-टीडीपी-43 डब्ल्यूटी | 3.4 x 108 | 152 | 141 | 93% | 9 | 28 | 20% | पी |
| Lv | LVH3mcherry | 1.3 x 107 | 504 | 450 | 89% | 13 | 115 | 26% | पीपी |
तालिका 2: भ्रूण जीवित रहने की दर और प्रत्यारोपण दक्षता, इंजेक्शन विधि के आधार पर जिसका उपयोग किया गया था और गर्भावस्था बनाम छद्म गर्भावस्था प्रेरण। पीएनई, प्रोन्यूक्लियर इंजेक्शन; एलवी, लेंटिवायरल वेक्टर सबजोनल इंजेक्शन।

चित्रा 1: एक सेल-स्टेज चूहा भ्रूण की सूक्ष्म तस्वीर जो सबजोनल लेंटिवायरल वेक्टर इंजेक्शन के लिए तैयार की गई थी। भ्रूण को पकड़े हुए पिपेट के साथ स्थिर किया गया था । दो प्रणोदक जिसमें मातृ और पैतृक आनुवंशिक सामग्री थी और ध्रुवीय शरीर दिखाई देता है। स्केल बार = 20 माइक्रोन। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें ।
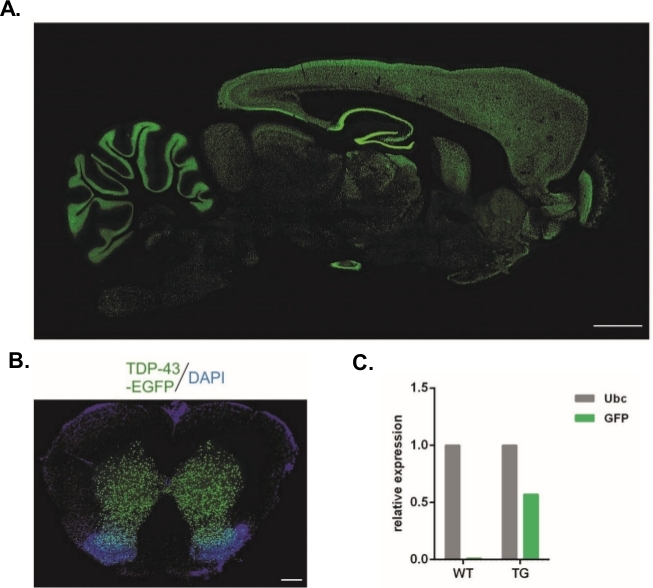
चित्रा 2: स्थिर ट्रांसजेनिक चूहा लाइनों की पीढ़ी है कि पूरे केंद्रीय तंत्रिका तंत्र भर में न्यूरोनल Synapsin-1 प्रमोटर के नियंत्रण में TDP-४३-eGFP संलयन प्रोटीन व्यक्त किया । (A)सिनैपसिन-1 (सिन) -संचालित एचटीडीपी-43-ईजीएफपी अभिव्यक्ति पैटर्न ट्रांसजेनिक चूहा मस्तिष्क के एक सग्तताल खंड में। स्केल बार = 3 मिमी.(बी)ट्रांसजेनिक चूहे की रीढ़ की हड्डी का कोरोनल खंड जहां DAPI के साथ प्रतिदाग ईजीएफपी फ्लोरेसेंस, रीढ़ की हड्डी के ग्रे पदार्थ तक सीमित था। स्केल बार = 250 माइक्रोन। (ग)सर्वव्यापक ताश के संदर्भ प्रतिलिपि की तुलना में जीएफपी ट्रांसजीन ट्रांसक्रिप्ट की सापेक्ष अभिव्यक्ति। n = 2 वाइल्डटाइप। n = 2 ट्रांसजेनिक। इस आंकड़े को14से संशोधित किया गया था । कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें ।
Subscription Required. Please recommend JoVE to your librarian.
Discussion
ट्रांसजेनिक प्रौद्योगिकियों में प्रगति ने कृंतक मॉडलको बायोमेडिकल अनुसंधान में एक अमूल्य उपकरण बना दिया है। वे वीवो में जीनोटाइप-फेनोटाइप संबंधों का अध्ययन करने का अवसर प्रदान करते हैं। यहां, हम प्रोन्यूक्लियर इंजेक्शन द्वारा पारंपरिक ट्रांसजेनेसिस के लिए एक व्यापक रूप से उपलब्ध विकल्प पेश करते हैं। लेंटिवायरल जीन ट्रांसड्यूक्शन का उपयोग माइक्रोइंजेक्शन की मांग की आवश्यकता को दरकिनार करता है क्योंकि वायरल वैक्टर ज़ोना पेलुसिडा के तहत इंजेक्ट किए जा सकते हैं। यह दृष्टिकोण भ्रूण अखंडता को प्रभावित नहीं करता है, जो अनिवार्य रूप से इंजेक्शन zygotes के लिए एक १००% जीवित रहने की दर की गारंटी देता है । लेंटिवायरल वैक्टर के माध्यम से शामिल किए गए ट्रांसजीन को मेजबान जीनोम में स्थिर रूप से एकीकृत किया जाता है, जिससे दीर्घकालिक अभिव्यक्ति और जर्मलाइन संचरण होता है। इसके अतिरिक्त, हम पालक माताओं के लिए संशोधित भ्रूण हस्तांतरण के लिए दो वैकल्पिक तकनीकों को पेश करते हैं । एक तकनीक छद्म गर्भवती महिलाओं को भ्रूण हस्तांतरण का उपयोग करती है जो पहले पुरुषनसबंदी वाले निषेचित पुरुषों के साथ संभोग द्वारा तैयार की जाती हैं। अन्य तकनीक स्वाभाविक रूप से गर्भवती महिलाओं के उपयोग पर आधारित है जो उपजाऊ पुरुषों के साथ मेल खाते हैं लेकिन एक अलग फर रंग (यानी, बीएन चूहों) के साथ। गर्भावस्था का यह अधिक शारीरिक पाठ्यक्रम उन भ्रूणों के समुचित विकास की अनुमति देता है जो चुनौतीपूर्ण आनुवंशिक संशोधनोंसेगुजरते हैं ।
ट्रांसजेनिक चूहों को उत्पन्न करने के पहले सफल प्रयास 19907में सूचित किए गए थे । हालांकि, चूहा ट्रांसजेनेसिस17में कठिनाइयों के कारण, हाल के दशकों 9 में अपेक्षाकृत कम संख्या में ट्रांसजेनिक चूहा लाइनें उत्पन्न हुई हैं। माइक्रोइंजेक्शन का उपयोग करके माउस और चूहा ट्रांसजेनेसिस के बीच कई मुख्य अंतर देखे जाते हैं। चूहों के लिए, मुख्य रूप से आउटब्रीड लाइनों (जैसे, विस्टार और एसडी) का उपयोग ट्रांसजेनेसिस के लिए किया जाता है। चूहों के लिए, शोधकर्ताओं ने मुख्य रूप से अपनी उच्च प्रजनन क्षमता, हार्मोनल सुपरओवुलेशन के लिए बेहतर प्रतिक्रिया, और एक सेल चरण से ब्लास्टोसिस्ट18के लिए विट्रो में भ्रूण के अपेक्षाकृत आसान विकास की वजह से नस्ल उपभेदों के F1 क्रॉसब्रीड का उपयोग करें । चूहों में सुपरोव्यूलेशन का प्रेरण मानक पीएमएसजी/एचसीजी हार्मोन उत्तेजना का उपयोग करचूहों की तुलना में बहुत कम कुशल है । इस कारण से, चूहों में इन हार्मोनों को प्रशासित करने के लिए वैकल्पिक प्रोटोकॉल विकसित करने का प्रयास किया गया है जो एक भी पीएमएसजी प्रशासन19के बजाय निरंतर एफएसएच जलसेक का उपयोग करते हैं। तथापि, पीएमएसजी/एचसीजी या एफएसएच/एचसीजी के कारण होने वाले सुपरओव्यूलेशन में तुलनीय दक्षता20दर्शाई गई है । हमारी राय में, सबसे महत्वपूर्ण कारक है कि superovulation की प्रभावशीलता को प्रभावित करता है चयनित महिलाओं की उम्र है । फिर भी, प्रत्येक चूहे के तनाव, प्रयोगशाला आदि के लिए सटीक मापदंडों का परीक्षण किया जाना चाहिए।
एक एकल कोशिका भ्रूण के प्रणोदक में डीएनए समाधान इंजेक्शन के लिए प्रक्रिया दोनों कृंतक प्रजातियों के लिए समान है । हालांकि, चूहे के जाइगोट्स के प्रोन्यूक्लियी में चूहों की तरह नियमित आकार नहीं होते हैं और कोशिका के साइटोप्लाज्म में परिभाषित करना अधिक कठिन हो जाता है। इसके अतिरिक्त, चूहा जाइगोट कोशिका झिल्ली और प्रोन्यूक्लियर झिल्ली अधिक लोचदार और चिपचिपा होती है, इस प्रकार डीएनए समाधान से भरी हुई ग्लास माइक्रोपाइपेट के सम्मिलन को जटिल बना ती है। इन कारकों माइक्रोइंजेक्शन (चूहों में 31-65% बनाम 80%) के बाद चूहे अंडे के जीवित रहने की दर कम करने के लिए नेतृत्व और चूहों9में कम ट्रांसजेनेसिस दक्षता की व्याख्या । इसके अलावा, भ्रूण के गहन, यांत्रिक हेरफेर भी प्रत्यारोपण दक्षता को प्रभावित कर सकते हैं, जो हमारे सहित कई प्रयोगशालाओं में, अधिकतम 10% तक पहुंचता है । यह अपेक्षाकृत कम उपज21भ्रूणों की उचित संख्या के प्रत्यारोपण के बाद भी देखी जाती है ।
उपरोक्त कठिनाइयों को दूर करने वाली एक विधि रेट्रोवायरस के साथ एकल-कोशिका भ्रूण का संक्रमण है। रेट्रोवायरस में आरएनए के रूप में आनुवंशिक सामग्री होती है, जो संक्रमित कोशिका में प्रवेश पर वायरस के रिवर्स ट्रांसक्रिप्टेज द्वारा डीएनए में लिखा जाता है। इसके बाद डीएनए को न्यूक्लियर छिद्रों के जरिए सेल नाभिक तक पहुंचाया जाता है, जहां यह प्रोवायरस के रूप में कोशिका के जीनोम में एकीकृत होता है । लेंटिवायरल वेक्टर का उपयोग ट्रांसजेनिक चूहों और चूहों को उत्पन्न करने के लिए किया गया है12,14,22. एकल कोशिका भ्रूण है कि एक ज़ोना पेल्यूसिडा की कमी एक मसूर वेक्टर के साथ एक समाधान में इनक्यूबेटेड किया जा सकता है, या वेक्टर perivitelline अंतरिक्ष में ज़ोना पेल्यूसिडा के तहत इंजेक्शन किया जा सकता है । इस विधि का मुख्य लाभ इसकी अत्यंत उच्च दक्षता है, जो ट्रांसजेनिक संतानों के 80% से अधिक तक पहुंच जाती है। लेंटिवायरल वेक्टर के साथ संक्रमण के बाद, विभिन्न साइटों पर कई प्रतियां प्रोन्यूक्लियर माइक्रोइंजेक्शन द्वारा ट्रांसजेनेसिस विधि के विपरीत, जाइगोट जीनोम में एकीकृत हो सकती हैं, जिसमें एक एकीकरण साइट आमतौर पर12देखी जाती है। लेंटिवायरल वैक्टर का उपयोग करके बनाए गए ट्रांसजेनिक संस्थापक की संतानों में, ट्रांसजीन की व्यक्तिगत प्रतियां अलग-अलग की जाती हैं, जो प्रत्येक संतान में ट्रांसजीन की विभिन्न अभिव्यक्ति प्रोफाइल द्वारा प्रकट हो सकती हैं। हालांकि, यह ट्रांसजीन से प्राप्त वांछित अभिव्यक्ति प्रोफ़ाइल के साथ एक विषय प्राप्त करने की संभावना को बढ़ा सकता है। प्रतिबंध मुख्य रूप से ट्रांसजीन के आकार पर लागू होते हैं, जो लगभग 8 केबी23तक सीमित है।
चूहा ट्रांसजेनेसिस में एक और कठिनाई महिलाओं की पीढ़ी है कि आनुवंशिक रूप से संशोधित भ्रूण के लिए किराए की माताओं के रूप में सेवा है । मानक प्रक्रिया में, महिलाओं को छद्म गर्भावस्था को प्रेरित करने के लिए बाँझ पुरुषों के साथ पार किया जाता है। चूहों में, छद्म गर्भावस्था मूल्यांकन तकनीक चूहों की तुलना में बहुत अधिक कठिन है, इसलिए पुरुषों के साथ संभोग से कुछ दिन पहले गोनाडोट्रोपिन रिलीज हार्मोन एगोनिस्ट के साथ उत्तेजना का उपयोग किया जाता है। इन कारणों से, वर्णित प्रोटोकॉल में हम पालक माताओं को प्राप्त करने के लिए दो वैकल्पिक दृष्टिकोण प्रदान करते हैं । गर्भवती या छद्म गर्भवती महिलाओं का उपयोग किए जाने पर छेड़छाड़ किए गए जाइगोट्स की समग्र प्रत्यारोपण दक्षता समान है। हालांकि, प्राकृतिक, गैर हेरफेर भ्रूण की उपस्थिति एक साथ हेरफेर लोगों के साथ गर्भावस्था की दर16में सुधार कर सकते हैं । हालांकि प्रत्यारोपण दर में मुख्य अंतर हेरफेर तकनीक है (यानी, पीएनआई बनाम एलवी, 10% बनाम 20%; टेबल 2देखें), पालक माताओं के रूप में छद्म गर्भवती महिलाओं का उपयोग कुछ प्रयोगों के लिए फायदेमंद हो सकता है ।
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
लेखक (डब्ल्यूके) के पास पेटेंट के अधिकार हैं, "ट्रांसजेनिक जानवर के उत्पादन की विधि," पोलैंड गणराज्य के पेटेंट कार्यालय से (नंबर पी 355353; 21.03.2008)।
Acknowledgments
इस अध्ययन को पोलिश विज्ञान के लिए फाउंडेशन के टीम टेक कोर फैसिलिटी प्लस कार्यक्रम के भीतर ANIMOD परियोजना द्वारा समर्थित किया गया था, जो यूरोपीय क्षेत्रीय विकास कोष के तहत यूरोपीय संघ द्वारा डब्ल्यूके को सह-वित्तपोषित है ।
Materials
| Name | Company | Catalog Number | Comments |
| 7500 Real Time PCR System | Applied Biosystems | ||
| Aerrane (isoflurane) | Baxter | FDG9623 | |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma | A5177-5EA | |
| Atipam 5 mg/ml | Eurovet Animal Health BV | N/A | 0.5 mg/kg |
| Baytril 25 mg/ml (enrofloksacin) | Bayer | N/A | 5-10 mg/kg |
| Borosilicate glass capillaries with filament GC100TF-15 | Harvard Apparatus Limited | 30-0039 | injection capillary |
| Bupivacaine 25 mg/ml | Advanz Pharma | N/A | 0.25% in 0.9% NaCl |
| Butomidor 10 mg/ml (butorphanol tartrate) | Orion Pharma | N/A | 1 mg/kg |
| CELLSTAR Tissue Cell Culture Dish 35-mm | Greiner Bio-One | 627160 | |
| CELLSTAR Tissue Cell Culture Dish 60-mm | Greiner Bio-One | 628160 | |
| CellTram Oil | Eppendorf | 5176 000.025 | |
| Cepetor (Medetomidine) 1 mg/ml | cp-pharma | N/A | 0.5 mg/kg |
| Chorulon, Human Chorionic Gonadotrophin | Intervet | N/A | 150 IU/ ml ml 0.9% NaCl |
| DMEM low glucose | Sigma Aldrich | D6048 | |
| DNase, RNase-free | A&A Biotechnology | 1009-100 | |
| EmbryoMax Filtered Light Mineral Oil | Sigma | ES-005-C | |
| Envelope protein coding plasmid for lentiviral vectors (VSVg plasmid) | ADDGENE | 14888 | |
| FemtoJet | Eppendorf | 4i /5252 000.013 | |
| Fetal Bovine Serum | Sigma Aldrich | F9665-500ML | |
| Folligon, Pregnant Mare’s Serum Gonadotropin | Intervet | N/A | 125 IU/ml in .9% NaCl |
| HEK 293T cells | ATCC | ATCC CRL-3216 | |
| Hyaluronidase from Bovine Testis | Sigma | H4272-30MG | 0.5 mg/ml in M2 medium |
| Inverted Microscope | Zeiss | Axiovert 200 | |
| Ketamine 100mg/ml | Biowet Pulawy | N/A | 50 mg/kg |
| Liquid Paraffin | Merck Millipore | 8042-47-5 | |
| M16 medium EmbryoMax | Sigma | MR-016-D | |
| M2 medium | Sigma | M7167 | |
| Magnesium Chloride 1M | Sigma Aldrich | 63069-100ML | |
| Microforge | Narishige | MF-900 | |
| Mineral Oil | Sigma | M8410-500ML | |
| NaCl 0.9% | POLPHARMA OTC | N/A | sterile, 5ml ampules |
| Operation microscope | Inami Ophthalmic Instruments | Deca-21 | |
| Packaging system coding plasmid for lentiviral vectors (delta R8.2 plasmid) | ADDGENE | 12263 | |
| PEI reagent (Polyethylenimine, Mw ~ 25,000,), | Polysciences, Inc | 23966-1 | |
| Penicilin-streptomycin | Sigma Aldrich | P0781-100ML | |
| Phosphate Buffered Saline, pH 7.4, liquid, sterile-filtered, suitable for cell culture | Sigma Aldrich | 806552-500ML | |
| Puller | Sutter Instrument Co. | P-97 | |
| Reflex Clip Applier/Reflex Clips | World Precision Instruments | 500345/500346 | |
| Safil, polyglycolic acid, braided, coated, absorbable threads | B.Braun Surgical | 1048029 | |
| Stereomicroscope | Olympus | SZX16 | |
| Surgical Sewing Thread | B.Braun | C1048040 | |
| SYBR Green PCR Master Mix | Applied Biosystem | 4334973 | |
| Tolfedine 4% (tolfenamic acid) | Vetoquinol | N/A | 2 mg/kg |
| TransferMan NK2 | Eppendorf | N/A | |
| Trypsin EDTA solution | Sigma Aldrich | T3924-500ML | |
| Ultracentrifuge | Beckman Coulter | Optima L-100 XP | |
| VacuTip | Eppendorf | 5175108.000 | holders capillary |
| Vita-POS | Ursapharm | N/A | eye ointment |
| Warming Plate | Semic | N/A | |
| Watchmaker Forceps | VWR | 470018-868 |
References
- Lazar, J., Moreno, C., Jacob, H. J., Kwitek, A. E. Impact of genomics on research in the rat. Genome Research. 15 (12), 1717-1728 (2005).
- Tarkowski, A. K. Studies on mouse chimeras developed from eggs fused in vitro. National Cancer Institute Monographs. 11, 51-71 (1963).
- Gordon, J. W., Ruddle, F. H. Integration and stable germ line transmission of genes injected into mouse pronuclei. Science. 214 (4526), 1244-1246 (1981).
- Gill, T. J., Smith, G. J., Wissler, R. W., Kunz, H. W. The Rat as an Experimental Animal. Science. 245 (4915), 269-276 (1989).
- Aitman, T. J., et al. Progress and prospects in rat genetics: a community view. Nature Genetics. 40 (5), 516-522 (2008).
- Hammer, R. E., Maika, S. D., Richardson, J. A., Tang, J. P., Taurog, J. D. Spontaneous inflammatory disease in transgenic rats expressing HLA-B27 and human beta 2m: an animal model of HLA-B27-associated human disorders. Cell. 63 (5), 1099-1112 (1990).
- Mullins, J. J., Peters, J., Ganten, D. Fulminant hypertension in transgenic rats harbouring the mouse Ren-2 gene. Nature. 344 (6266), 541-544 (1990).
- Menoret, S., Remy, S., Usal, C., Tesson, L., Anegon, I. Generation of Transgenic Rats by Microinjection of Short DNA Fragments. Rat Genomics: Methods and Protocols. 597, 81-92 (2010).
- Tesson, L., et al. Transgenic modifications of the rat genome. Transgenic Research. 14 (5), 531-546 (2005).
- Charreau, B., Tesson, L., Soulillou, J. P., Pourcel, C., Anegon, I. Transgenesis in rats: Technical aspects and models. Transgenic Research. 5 (4), 223-234 (1996).
- Ritchie, W. A., Neil, C., King, T., Whitelaw, C. B. Transgenic embryos and mice produced from low titre lentiviral vectors. Transgenic Research. 16 (5), 661-664 (2007).
- Lois, C., Hong, E. J., Pease, S., Brown, E. J., Baltimore, D. Germline transmission and tissue-specific expression of transgenes delivered by lentiviral vectors. Science. 295 (5556), 868-872 (2002).
- Pfeifer, A., Ikawa, M., Dayn, Y., Verma, I. M. Transgenesis by lentiviral vectors: lack of gene silencing in mammalian embryonic stem cells and preimplantation embryos. Proceedings of the National Academy of Sciences of the United States of America. 99 (4), 2140-2145 (2002).
- Koza, P., et al. Neuronal TDP-43 depletion affects activity-dependent plasticity. Neurobiology of Disease. 130, 104499 (2019).
- Scherr, M., Battmer, K., Blomer, U., Ganser, A., Grez, M. Quantitative determination of lentiviral vector particle numbers by real-time PCR. Biotechniques. 31 (3), 520 (2001).
- Canseco, R. S., et al. Gene transfer efficiency during gestation and the influence of co-transfer of non-manipulated embryos on production of transgenic mice. Transgenic Research. 3 (1), 20-25 (1994).
- Charreau, B., Tesson, L., Soulillou, J. P., Pourcel, C., Anegon, I. Transgenesis in rats: technical aspects and models. Transgenic Research. 5 (4), 223-234 (1996).
- Brinster, R. L., Chen, H. Y., Trumbauer, M. E., Yagle, M. K., Palmiter, R. D. Factors affecting the efficiency of introducing foreign DNA into mice by microinjecting eggs. Proceedings of the National Academy of Sciences of the United States of America. 82 (13), 4438-4442 (1985).
- Armstrong, D. T., Opavsky, M. A. Superovulation of immature rats by continuous infusion of follicle-stimulating hormone. Biology of Reproduction. 39 (3), 511-518 (1988).
- Popova, E., Krivokharchenko, A., Ganten, D., Bader, M. Comparison between PMSG- and FSH-induced superovulation for the generation of transgenic rats. Molecular Reproduction and Development. 63 (2), 177-182 (2002).
- Johnson, L. W., Moffatt, R. J., Bartol, F. F., Pinkert, C. A. Optimization of embryo transfer protocols for mice. Theriogenology. 46 (7), 1267-1276 (1996).
- van den Brandt, J., Wang, D., Kwon, S. H., Heinkelein, M., Reichardt, H. M. Lentivirally generated eGFP-transgenic rats allow efficient cell tracking in vivo. Genesis. 39 (2), 94-99 (2004).
- Remy, S., et al. The Use of Lentiviral Vectors to Obtain Transgenic Rats. Rat Genomics: Methods and Protocols. 597, 109-125 (2010).



