Summary
이 문서는 접합체 perivitelline 공간으로 바이러스 현탁액의 다중 주사를 사용하여 쥐 배아에 있는 lentiviral transgenesis를 위한 방법론을 제공하는 것을 작정입니다. 다른 지배적 인 모피 색상과 비옥한 남성 균주와 교교 여성 쥐는 의사 임신 수양 어머니를 생성하는 데 사용됩니다.
Abstract
형질전환 동물 모델은 현대 생물 의학 연구에 근본적으로 중요합니다. 초기 마우스 또는 쥐 배아에 외국 유전자의 통합은 살아있는 유기체에 있는 유전자 기능 분석을 위한 귀중한 공구입니다. 표준 트랜스제네시스 방법은 수정된 난모세포의 프로핵으로 외래 DNA 단편을 미세 주입하는 것을 기반으로 합니다. 이 기술은 마우스에서 널리 사용되지만 다른 동물 종에서 상대적으로 비효율적이고 기술적으로 요구되는 상태로 남아 있습니다. 이식 유전자는 또한 lentiviral 감염을 통해 1 세포 단계 태아로 소개될 수 있습니다, 표준 pronuclear 주입에 효과적인 대안을 제공하, 특히 더 도전적인 배아 구조물을 가진 종 또는 긴장에서. 이 접근법에서, 렌티바이러스 벡터를 포함하는 현탁액은 기술적으로 덜 까다롭고 더 높은 성공률을 가지고 있는 수정된 쥐 배아의 perivitelline 공간으로 주입된다. 렌티바이러스 벡터는 안정적인 형질전환 라인의 생성을 결정하기 위해 게놈 내로 이식유전자를 효율적으로 통합하는 것으로 나타났다. 몇 가지 제한에도 불구하고 (예를 들어, 생물 안전성 수준 2 요구 사항, DNA 단편 크기 제한), 렌티바이러스 트랜스제네시스는 신속하고 효율적인 트랜스제네시스 방법이다. 추가적으로, 다른 지배적인 모피 색깔을 가진 비옥한 남성 긴장과 결합되는 암컷 쥐를 사용하여 의사 임신 수양 어머니를 생성하는 대안으로 제출됩니다.
Introduction
몇 년 동안, 실험실 설치류, 쥐와 쥐 등, 인간의 생리 및 병 적 조건을 모델링 하는 데 사용 되었습니다. 동물 연구는 다른 방법으로 는 달성 할 수없는 발견으로 이어졌다. 처음에, 유전 학문은 인간 상태를 밀접하게 모방하기 위하여 여겨지는 자발적으로 생기는 무질서 및 표현형의 분석에 집중했습니다1. 유전 공학 방법의 발달은 특정 유전자의 소개 또는 삭제가 원하는 표현형을 얻기 위하여 허용했습니다. 따라서, 형질전환 동물의 생성은 살아있는 유기체에 있는 유전자 기능의 연구를 허용하는 현대 연구에서 근본적인 기술로 인식되고 있습니다.
형질전환 동물 기술은 실험적인 발생학과 분자 생물학에 있는 성과의 조합을 통해 가능하게 되었습니다. 1960년대에 폴란드의 배아학자 A. K. Tarkowski는 발달2의초기 단계에서 마우스 배아 조작에 대한 첫 번째 작업을 발표했습니다. 추가적으로, 분자 생물학자는 동물의 게놈으로 외국 DNA의 interalia 소개를 위한 DNA 벡터 (즉, 운반대)를 생성하는 기술을 개발했습니다. 이들 벡터는 수행되는 연구의 유형에 따라 선택된 유전자의 전파 및 이들의 적절한 변형을 허용한다. 용어 "형질 전환 동물"고든과 러들 에 의해 도입되었다3.
신경생물학, 생리학, 약리학, 독성학 및 생물 의학의 많은 다른 분야에서 사용된 첫번째 널리 받아들여진 종은 노르웨이 쥐, Rattus norvegicus4이었습니다. 그러나, 쥐 배아 조작의 어려움 때문에, 하우스 마우스 근육은 유전 연구에서 지배적 인 동물 종되고있다5. 이러한 연구에서 마우스의 우위를 지키기 위한 또 다른 이유는 이 종에 대한 녹아웃 동물을 생성하는 배아 줄기 세포 기술의 가용성이었다. 형질 전환의 가장 일반적으로 사용되는 기술 (모든 태어난 동물에 비해 형질 전환 자손의 2-10 %)은 수정 된 난모 세포의 pronucleus로 DNA 조각의 미세 주입입니다. 1990년에, 마우스에서 처음 소개된 이 접근은, 쥐6,,7를위해 적응되었습니다. 쥐의 투과성 은 탄성 플라즈마 및 프로핵막의 존재와 엄격하게 관련이 있는 마우스에 비해 낮은 효율8을 특징으로한다(9) 조작 후 배아의 생존율은 마우스보다 40-50% 낮지만, 이 기술은 유전자 변형 쥐10의생성에서 표준으로 간주된다. 주입된 zygotes의 능률적인 이식 유전자 통합 및 더 높은 생존율을 보장할 수 있는 대안적인 접근은 조사되었습니다.
자손에게 안정된 이식 유전자 발현 및 전달의 주요 결정요인은 숙주 세포 게놈으로의 통합이다. 렌티바이러스(LV)는 분할 세포와 비분할 세포를 모두 감염시킬 수 있는 독특한 특징을 가지고 있습니다. 이종 유전자를 배아에 통합하기 위한 도구로 사용하는 것은 매우 효율적인것으로 입증되었으며,형질전환 개인은 통합된 DNA 단편의 안정적인 발현을 특징으로 한다. 렌티바이러스 벡터의 효능은 마우스12,13,쥐12,,14,및 기타 종11의유전자 변형에 대해 확인되었다., 이 방법에서, LV 현탁액은 2개의 전구핵의 단계에서 배아의 조나 펠루시다 아래에 주입된다. 이 기술은 oolemma가 영향을 받지 않는 남아 있기 때문에 본질적으로 배아의 100% 생존을 보장합니다. 고품질 및 상대적으로 고농축 LV 서스펜션의 생산은 중요한 요소입니다. 그러나, LV 현탁액의 낮은 농도는반복주사(11)에의해 극복될 수 있으며, 이는 막 통합에 영향을 미치지 않는 동안 계란 표면에서 바이러스 입자의 양을 증가시킨다. 연막선 공간으로 반복 주사를 행하는 배아는 더 발전하고, 형질전환 자손은 생식선을 통해 이식유전자를 전달할 수 있다. 렌티바이러스 트랜스제네틱에 의한 형질전환 쥐 생성의 효율은 80%12로높을 수 있다.
여기에서, 우리는 VEIDStomatitis 바이러스 (VSV) G 봉투 단백질로 가성형이 된 HIV-1 유래 재조합 렌티바이러스의 생산을 기술한다. 2 세대 포장 시스템 VSV 의사 유형의 사용은 바이러스 입자의 광범위한 감염성을 결정하고 초원심분리 및 냉동 보존에 의해 집중 될 수있는 매우 안정적인 벡터의 생산을 허용합니다. 역가 검증 후, 벡터는 알비노 위스타 래트 접합체로의 트랜스유전자 전달을 위한 비차량으로서 사용될 준비가 되어 있다. 일련의 주사 후, 배아는 하룻밤 배양하고 어머니를 육성하기 위해 2 세포 단계에서 옮길 수 있습니다. 이 시점에서 두 가지 대체 방법 중 하나를 고려할 수 있습니다. 표준 절차는 태아 수령인으로 의사 임신 여성을 이용합니다. 그러나, vasectomized 수컷과 교배 후에 임신 비율이 낮을 때, 태아는 어두운 모피 색깔을 가진 비옥한 수컷 쥐와 교배되는 임신 한 Wistar/Sprague-Dawley (SD) 암컷으로 이식될 수 있습니다 (예를 들면, 갈색 노르웨이 [BN] 쥐). 모피의 색상은 옮겨진 조작 된 배아에서 유래 한 자손에서 자연 임신에서 자손을 구별 할 수 있습니다.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
바이러스 벡터의 생산 및 적용은 생물 안전 성 수준 2 지침에 따라 폴란드 환경부의 승인을 받았습니다. 아래에 설명된 모든 실험 동물 절차는 지역 윤리 위원회의 승인을 받았습니다. 동물은 안정된 온도(21-23°C)와 습도(50-60%)에서 개별적으로 통풍이 잘 되는 케이지에 보관되었습니다. 12 시간 / 12 h / 12 h 의 빛 / 어두운 주기에서 물과 음식에 대한 광고 리비텀 액세스.
1. 렌티 바이러스 벡터 생산
- HEK 293T 세포의 형질감염
참고: 본원에 제시되는 프로토콜은 약 200 mL의 조질 벡터 상판을 생산하는 20Ø10 cm 배양 접시의 형질화를 위해 설계된다.- 배양 HEK 293T 세포는 37°C에서 가습된CO2 인큐베이터에서 태아 소 혈청(10%, v/v)으로 보충되는 DMEM 배지에서. 형질 감염의 경우, 접시 당 20cm 직경 플레이트, 씨앗 1.5-2 x 106 HEK 293T 세포를 준비합니다.
- 합류가 ~70%에 도달하면, DNA의 1 μg 당 PEI의 3 μg의 비율로 폴리에틸렌민 (PEI) 시약, pH 7.0을 사용하여 세포를 트랜스펙트.
- 다섯 접시에 대한 형질 전환 혼합물을 준비 (요리의 총 수에 따라 반복의 수를 준비). Dulbecco의 변형 된 독수리 매체 (DMEM; 혈청없이)의 1 mL에 VSVg 플라스미드 25 μg, 델타 R8.2 50 μg 및 코딩 플라스미드 50 μg의 최종 양에 도달할 수 있도록 3 개의 플라스미드혼합물을 추가합니다.
- 피펫을 위아래로 하고, 3 μg/μL의 농도로 PEI 125 μL을 첨가하고, 인큐베이션 시 튜브를 3회 반전시키고, 실온에서 15분 동안 인큐베이팅한다. 플레이트당 형질전환 혼합물200 μL을 첨가한다. 다음으로, 플레이트를 37°C에서 가습된CO2 인큐베이터로 인큐베이터로 인큐베이션한다.
- 렌티 바이러스 벡터의 농도
- 형질전환 후 48시간 동안 LV 입자를 함유한 배지를 수확합니다. 50 mL 원엽 튜브를 사용합니다.
참고: 형광 태그가 있는 플라스미드를 사용하는 경우 이 시점에서 세포를 시각화하여 형질감염 효율을 확인할 수 있습니다. DMEM 배지의 새로운 부분을 첨가할 수 있고, 세포는 추가로 24시간 동안 배양될 수 있다. LV 수율은 형질전환 후 48 및 72 시간 포인트에서 수집될 때 와 비교된다. - 배지를 3,000 x g에서 5분 동안 원심분리하고 실온에서 분리된 세포를 제거한다.
- 상급 (0.45 μm)을 걸레질하고 새로운 튜브에 부어.
참고: 이 단계는 생략할 수 있습니다. - DNase I(RNase 불포함, 1 μg/mL)와 MgCl2(1 mM)를 추가하고 37°C에서 15분 동안 수조에서 배양합니다.
- 배지를 일회용 폴리에틸렌 튜브로 옮기고, 1.5시간 동안 115,000 x g 및 4°C에서 스윙 로터에서 초원심분리기를 전달한다.
- 원심 분리 후 중간 잔류물에서 튜브 벽을 부드럽게 배출합니다.
- 멸균 인산완식염수린으로 펠릿을 담급니다(PBS; 튜브당 70-80 μL).
- 4-8 °C에서 2 시간 동안 배양하십시오.
- 부드러운 파이펫팅으로 PBS의 바이러스 벡터를 다시 일시 중단합니다.
주의: 거품을 피하십시오. - 1.5 mL 원심분리기 튜브 및 원심분리기를 7,000 x g 및 4°C에서 30초 동안 옮기십시오. 셀룰러 파편 펠릿이 보이지 않는 때까지 이 단계를 반복합니다.
- 알리쿼트 및 -80°C에서 동결. LV 알리쿼트의 고정을 피하십시오.
- 형질전환 후 48시간 동안 LV 입자를 함유한 배지를 수확합니다. 50 mL 원엽 튜브를 사용합니다.
- 정량적 중합효소 연쇄 반응을 이용한 바이러스 적시성 측정
참고: 바이러스 벡터의 적정은 정량적 PCR(qPCR)을 사용하여 수행됩니다. 이 방법은 바이러스게놈(15)의긴 말단 반복 영역 내에서 이중 가닥 84 bp 긴 DNA 단편을 증폭시키는 것을 기초한다.- LV 코딩 플라스미드의 직렬 희석을 1:500, 1:1,000, 1:5,000, 1:10,000, 1:100,000 및 1:100,000으로 만들어 표준 곡선을 준비합니다. 표준 곡선에 사용되는 플라스미드의 복사본 수를 결정합니다. 다음 공식을 사용: 복사 수 /μL = (농도 [g/μL] x 6.02 x 1023 [숫자/몰]) / (660 [g/mol] x 플라스미드 크기 [bp]), 여기서 6.02 x 1023 숫자/몰은 아보가드로의 수, 660 g/mol은 bp 중량입니다.
참고: 온라인 복사 번호 계산기를 사용할 수 있습니다. - 렌티바이러스 현탁액의 희석을 준비하십시오: 1:100, 1:500, 및 1:1,000.
- 반응 혼합물(잘당 부피): qPCR 마스터믹스 10 μL, 1 0 μM 포워드 프라이머 1 μL, 1 μL 의 1 μL 10 μM 역프라이머, 7 μL의 H2O. 파이펫 혼합물을 96웰 플레이트의 웰내로 준비한다.
참고 : 앞으로 프라이머 : 5'-AGCTTGCCTTGCTTCA. 역프라이머: 5'-TGACTAAAAGGGTCTGGGGGGGGG. - 각 표준 희석 및 렌티바이러스 현탁액을 삼중으로 1 μL 첨가합니다.
- 다음 매개 변수에 따라 qPCR을 실행: 50 °C 에 대 한 2 분, 96°C에 대 한 5 분, 그리고 35 사이클 96 s에 대 한 96°C, 60 s에 대 한 60°C, 그리고 70°C 1 분, 다음 용융 곡선 단계: 95 분 동안 그리고 60°C 에서 30 s.
- 각 희석에 대해 수신되는 분자수를 표준 곡선과 비교하여 결과를 분석합니다. 각 희석에 대해 3개의 복제물의 평균으로 벡터 분자의 농도를 결정합니다.
참고: 제시된 정량화는 바이러스 입자의 물리적 농도를 제공한다. 기능적 티터로 취급해서는 안됩니다.
- LV 코딩 플라스미드의 직렬 희석을 1:500, 1:1,000, 1:5,000, 1:10,000, 1:100,000 및 1:100,000으로 만들어 표준 곡선을 준비합니다. 표준 곡선에 사용되는 플라스미드의 복사본 수를 결정합니다. 다음 공식을 사용: 복사 수 /μL = (농도 [g/μL] x 6.02 x 1023 [숫자/몰]) / (660 [g/mol] x 플라스미드 크기 [bp]), 여기서 6.02 x 1023 숫자/몰은 아보가드로의 수, 660 g/mol은 bp 중량입니다.
2. 형질전환 쥐의 생성
- 수정 된 배아의 과다 채취 및 수집
- 생식샘 자극 호르몬을 관리합니다.
참고: 수집된 배아의 수를 늘리려면(여성 당 약 30개), 호르몬 자극을 위해 미성숙한 5주된 Wistar 암컷을 사용하십시오.- 1일째(오후 12시-오후 1시)에, 복강 내 암말의 혈청 생식샘 자극호르몬(PMSG; 여성 당 25IU)을 주입합니다. 호르몬 분말을 0.9% NaCl에서 용해시켜 125 IU/mL의 농도로 작업 용액의 1 mL aliquots를 준비합니다. 최대 1개월 동안 -20°C에서 보관하거나 최대 6개월 동안 -80°C로 보관하십시오.
- 3 일째 (12 PM-1 PM), 복강 내 인간 융모 성 생식샘 자극 호르몬을 주입 (hCG; 여성 당 30 IU). 호르몬 분말을 0.9% NaCl에 용해시켜 작업 용액 (150 IU / mL)의 1 mL aliquots를 준비하십시오. 최대 1개월 동안 -20°C에서 보관하거나 최대 6개월 동안 -80°C로 보관하십시오.
- hCG 투여 후, 성적으로 비옥한 남성 (3-10 개월)과 암컷 1 :1짝.
- 다음날 아침(4일 오전 8-10시) 여성에게 질 플러그가 있는지 확인하십시오. 최상의 시각화를 위해 짝짓기 밤 후 이른 아침에 확인해야 하는 희끄무레한 짝짓기 플러그의 존재에 대한 질 개구부를 확인하십시오. 배아 수집의 경우, 눈에 보이는 플러그가 있는 여성만 사용하십시오.
- 오전 10시에 배아를 수집합니다. 동물을 희생하여 난관을 절제하고 미리 데운 M2 배지가있는 접시에 난관을 수집합니다.
- 0.5 mg/mL의 농도로 소 고환의 히알루로니다아제와 함께 미리 데운 M2 배지가 들어있는 35mm 접시에 난관을 옮니다.
- 입체 현미경의 밑에 미세 한 집게를 사용하여 oviduct의 벽을 열고 배아가 풀려날 때까지 ampulla (즉, 적운 세포로 둘러싸인 수정된 배아를 포함하는 oviduct의 부은 부분)를 누릅니다.
참고: 히알루로니다아제는 효소적으로 적혈구세포를 소화하여 배아를 방출합니다.
주의: 히알루로니다제에 장기간 노출되면 배아에 해가 됩니다. 따라서 이 단계는 5분 이상 지속되지 않아야 합니다. - 적운 세포에서 배아의 방출을 용이하게하기 위해, 부드럽게 입 작동 흡인기 튜브에 연결된 유리 전달 피펫을 사용하여 위아래로 피펫.
- 전사 파이펫을 생산하려면 유리 파스퇴르 피펫을 화염 위에 당겨 직선 ~5-10cm 팁을 생성합니다. ~4cm 팁을 남기고 파이펫을 부수.
- M2 배지에서 배아를 몇 번 세척하여 히알루로니다아제와 세포 파편을 제거합니다. 액체 파라핀 또는 미네랄 오일로 덮인 미리 균형 조정된 M16 배지를 5%CO2 분위기로 가습된 37°C 인큐베이터에 포함시킨 60 mm 접시에 배아를 옮니다.
- 생식샘 자극 호르몬을 관리합니다.
- 조나 펠루시다 하에서 1 세포 단계 배아에 렌티 바이러스 벡터의 미세 주입
참고 : 미세 주입을위한 두 개의 눈에 보이는 전핵구와 1 세포 단계 배아를 사용합니다(그림 1).- 실온에서 LV 알리쿼트를 해동하고 10,000 x g및 RT에서 10,000 x g 및 RT로 2 분 동안 나머지 세포 파편을 펠렛하십시오.
- 미세 주입 설정
- 마이크로포지를 사용하여 유리 보유 파이펫(보로실리케이트 유리 모세관)을 준비한다. 유리 모세관을 화염 위로 당겨 5-10cm 팁을 생성합니다. ~4cm 팁을 남기고 파이펫을 부수. 외부 직경은 ~ 80-120 μm이어야한다.
참고: 파이펫 팁이 완벽하게 직선적이고 매끄러운지 확인하십시오. - 가열 필라멘트 앞의 팁으로 당겨진 파이펫을 마이크로 포지에 조립합니다. 필라멘트를 파이펫 팁에 매우 가깝게 가열하고 직경 ~15 μm (배아 크기의 약 20 %)로 수축할 수 있습니다. 파이펫을 가열 필라멘트에 수직으로 놓고 파이펫 팁에서 2-3mm 떨어진 곳에서 가열합니다. 유리가 부드러워집니다. 15° 각도에 도달할 때까지 가열합니다.
- 파이펫 풀러를 사용하여 필라멘트로 미세 주입 보로 실리 케이트 유리 모세 혈관을 준비합니다. 당기 챔버에 모세관을 삽입합니다. 램프 테스트를 실행합니다(필라멘트를 변경한 후 새 유리를 처음 그리고 매번). 램프 값 -10, 당기기 100, 속도를 150으로, 시간을 100으로 설정합니다.
참고: 파라미터를 수정하여 최적의 주입 모세관을 얻습니다. - 생체 안전성 층류 후드 하에서, 마이크로로더 팁으로 바이러스 용액의 약 2 μL을 마이크로 사출 파이펫에 적재한다.
- 액체 파라핀이나 미네랄 오일로 덮인 M2 배지 (중간에)의 100 μL 드롭으로 미세 주입 접시 (60mm 페트리 접시 뚜껑)를 준비하십시오.
- 거꾸로 된 현미경으로 소분관리기 및 미세 사출 접시에 바이러스 용액이 로드된 홀딩 파이펫 및 미세 사출 모세관을 장착합니다.
- 마이크로포지를 사용하여 유리 보유 파이펫(보로실리케이트 유리 모세관)을 준비한다. 유리 모세관을 화염 위로 당겨 5-10cm 팁을 생성합니다. ~4cm 팁을 남기고 파이펫을 부수. 외부 직경은 ~ 80-120 μm이어야한다.
- 미세 주입을 수행합니다.
- 15-20 개의 1 단계 배아를 미세 주사 접시에 M2 드롭으로 옮김. 배아를 홀딩 피펫을 사용하여 잡아 라.
- 400x 배율을 사용하여 자동 인젝터에 연결된 유리 모세관을 사용하여 조나 펠루시다 아래에 LV 용액을 연막선 공간에 주입합니다. 잠시 조나 펠루시다 아래에 모세관을 잡습니다.
참고 : 부드러운 양압을 사용하면 바이러스 용액이 주입 모세관에서 지속적으로 흐르지만 전달되는 현탁액의 부피를 제어 할 수 없습니다. - 미세 파이펫을 사용하여, 배아를 5%CO2 분위기에서 37°C에서 인큐베이터에서 배양 접시로 되감습니다. 하나의 접합체의 주사수는 다양할 수 있으며 바이러스 벡터 농도에 기초하여 적응될 수 있다.
참고: 주입된 배아는 1세포 단계에서 어머니를 양육하기 위하여 옮겨지거나 2 세포 단계에서 옮겨지기 전에 M16 배지에 있는 O/N배양될 수 있습니다. 쥐 배아의 장기간된 시험관 내 배양 피해 야 한다.
- 어머니를 양육하기 위하여 주입한 태아의 전송
- 비옥한 BN 남성과 성적으로 성숙한 SD 암컷을 교배하여 수양 어머니를 준비하거나 vasectomized SD 남성과 (정관 절제술 절차는 아래 섹션 3에 설명되어 있습니다) 3 일째 (1 세포 단계에서 배아를 옮기기 위해) 또는 4 일째 (2 세포 단계에서 배아를 옮기기).
참고 : 난관 전달의 경우, 0.5 일 후 coitum (dpc) 암컷을 사용하십시오. - 다음 해 아침, 질 플러그에 대한 SD 여성을 확인하고, 눈에 보이는 플러그가있는 사람만 사용합니다.
- 배아 이식을 수행합니다.
참고 : 입체 현미경으로 멸균 기구로 외과 적 수술을 하십시오. 수술 당일, 오토클레이브 가위, 미세 집게, 바늘 홀더 및 메스 홀더.- 케타민 (50 mg /kg)과 메데토미딘 (0.5 mg / kg) 용액을 i.p. 투여하여 여성을 마취시. 외과 적 수술을 시작하기 전에 마취를 확인하기 위해 반사 신경을 테스트하십시오.
- 동물에게 톨레페나믹산(2 mg/kg), 버토르판올 타르트레이트(1 mg/kg), 그리고 엔로록사신(5-10 mg/kg)을 각각 주입하여 염증, 통증 및 감염을 예방합니다.
- 각막 건조를 방지하기 위해 두 눈에 안과 연고 윤활을 적용하십시오. 뒤에서 모피를 면도하고 수술 용 스크럽으로 피부를 살균 한 다음 멸균 비 준수 패드를 사용하여 70 % 알코올을 살균하십시오. 피부가 건조해지도록 합니다.
- 절개 부위에 0.25 % 부피바카인 (국소 마취제)의 100 μL로 동물을 피하로 주입하십시오. 수술 용 현미경의 목적아래 가열 패드의 깨끗한 표면으로 동물을 옮기는 경향이 있는 위치에 동물을 옮김을 옮김을 옮김을 옮김을 옮김을 줍니다. 쥐를 살균 드레이프로 덮고 허리를 잘라 작은 구멍을 뚫습니다.
- 요추 척추 기둥에 평행한 약 2cm 피부 절개를 수행합니다.
- 날카로운 가위를 사용하여 복벽을 잘라냅니다. 집게를 사용하여 난소 지방 패드를 잡고 난소와 난관을 꺼내 0.9 % NaCl로 젖은 거즈에 놓습니다.
- 흡인 M2 배지, 3개의 기포 공기, 및 배아를 전사 모세관내로. 전송될 배아의 총 수 (일방적 또는 양측): 임신 한 여성 (≤ 15-16 배아), 의사 임신 여성 (≤ 30 배아).
- 마이크로 가위를 사용하여 난관 (infundibulum과 ampulla 사이)에 작은 절개를하고 난관에 전달 파이펫을 삽입합니다.
- 배아와 기포를 피펫에서 난관으로 부드럽게 추방하십시오. 무딘 집게로 생식 기관을 복강에 다시 놓습니다.
- 폴리 글리콜산 흡수 봉합사로 복벽을 봉합하고 상처 클립으로 피부 절개를 닫습니다. 사용 가능한 배아의 수에 따라 다른 난관에 대해이 절차를 반복하십시오.
- 마취효과를 되돌리기 위해 동물을 복강내 아티파메졸(0.5 mg/kg)으로 주입합니다.
- 동물을 깨끗한 케이지로 옮기고 온난화 판에 보관하여 마취에서 완전히 회복하십시오. 쥐에서 의 납품은 ~ 21 일 후에 생깁니다.
참고 : 남성 BN 쥐가 짝짓기위해 사용될 때, 흰 새끼만이 잠재적으로 형질전환입니다. 갈색 새끼는 자연 임신에서 입니다. - 조직 단편을 수집 (바람직하게는 귀에서) 유전자형 3 주 된 새끼.
- 비옥한 BN 남성과 성적으로 성숙한 SD 암컷을 교배하여 수양 어머니를 준비하거나 vasectomized SD 남성과 (정관 절제술 절차는 아래 섹션 3에 설명되어 있습니다) 3 일째 (1 세포 단계에서 배아를 옮기기 위해) 또는 4 일째 (2 세포 단계에서 배아를 옮기기).
3. 정관 절제술
참고 : 수술 당일, 오토 클레이브 가위, 미세 집게 및 바늘 홀더.
- 케타민 (50 mg/kg) 및 메데토미딘 (0.5 mg/kg) 용액의 i.p. 투여와 함께 5 주 된 남성 SD 쥐를 마취. 외과 적 수술을 시작하기 전에 마취를 확인하기 위해 반사 신경을 테스트하십시오.
- 톨페나믹산(2 mg/kg), 부토르판아올 타르트레이트(1 mg/kg), 그리고 엔로플로크사신(5-10 mg/kg)을 피하적으로 투여하여 염증, 통증 및 감염을 예방합니다.
- 각막 건조를 방지하기 위해 두 눈에 안과 연고 윤활을 적용하십시오. 가열 패드에 깨끗한 표면에 쥐 supine을 놓고, 수술 스크럽과 고환에 피부를 살균 한 다음 멸균 비 준수 패드를 사용하여 70 % 알코올. 피부가 건조해지도록 합니다. 고환에 작은 구멍으로 멸균 드레이프로 쥐를 덮습니다. 부드럽게 음낭 낭에 고환을 노출복부를 누릅니다.
- 외과 용 가위를 사용하여 음낭 낭 중간에 ~ 0.5 cm 절개를합니다. 고환 사이의 중간선 벽(희끄무레한 선)을 찾습니다.
- 중간선 벽의 왼쪽에 가까운 고환 막에서 5mm 절개를 합니다.
- 조심스럽게 왼쪽으로 고환을 밀어 단일 혈관과 흰색 덕트로 (고환과 중간 선 사이) vas deferens를 찾습니다.
- 워치메이커의 집게를 사용하여 음낭에서 꽃병을 부드럽게 당깁니다. 한 쌍의 집게로 꽃병을 잡고 미세 한 가위로 잘라냅니다 (또는 두 번째 집게 쌍의 뜨거운 팁으로 소작하십시오). 덕트의 ~ 1cm 조각을 제거합니다.
참고: 소작이 수행되면 두 번째 집게 의 끝을 불꽃에 넣습니다. - 다른 고환에 대해 위의 절차를 반복합니다. 폴리 글리콜산 흡수 성 봉합사로 피부를 봉합하고 아티파메졸 (0.5 mg / kg)으로 동물 에게 복강 내 주사하십시오.
- 동물이 마취에서 회복 될 때까지 온난화 접시에 깨끗한 케이지에 쥐를 놓습니다.
참고: 남성은 ~ 2주 회복 기간 후에 테스트 짝짓기에 사용할 수 있습니다. 불임이 확인된 후, 그들은 의사 임신 유도에 사용할 수 있습니다.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
본 원에 기재된 프로토콜을 사용하여, Syn-TDP-43-eGFP 구제를 운반한 렌티바이러스 벡터를 생산하였다(물리적 LV 이터 = 3.4 x 10 8/μL) 이어서 1단계 배아 서브구역 주사에 사용될 수 있었다.8 두 개의 눈에 보이는 전핵구를 가진 배아만 시술을 받았다. 바이러스 현탁액의 주사 수는 실험적으로 결정되었다. 높은 이식 효율과 형질전환 자손의 동시 부족은 성공적인 형질 전환에 대한 바이러스 입자의 부족의 지표로 간주되었다. 이 경우 주사 횟수가 증가했습니다. LV의 단 하나 관리는 20F0 세대 쥐의 출생 귀착되었습니다, 어느 것도 형질 전환되지 않았습니다. 한 단계의 크기의 주사 수가 증가하면 쥐가 태어나지 않았지만 배아의 100 %가 2 세포 단계로 발전했습니다. 후속 실험에서, 주사의 수는 자손이 얻은 값과 비교하여 하나씩 증가하였다. 2개의 주사의 변이체에 대해, 8마리의 쥐가 태어났고, 그 중 3마리가 이식유전자를 운반하는 것으로 확인되었다(표 1에요약됨). 설립자 중 하나는 자손에 이식 유전자를 전송하지 않았다. 각 실험 이체에서 주입 및 전달된 배아의 수는 LV x1 및 LV x2 변이체에서 48개, LV x10에서 45개였다. 3명의 수양 암컷을 각 실험 설정에 사용하였다. 선택된 접근법은 전체 중추 신경계전반에 걸쳐 신경 시냅신-1 프로모터의 제어하에 TDP-43-eGFP 융합 단백질을 발현하는 안정적인 형질전환 래트 라인의 생성을 허용하였다(도2A, B)14. 렌티바이러스 계 이식발생은 qPCR(도2C)에의해 입증된 바와 같이 이식유전자의 단일 카피 삽입을 초래하였다.
상술한 실험 설정에서, 주입된 배아의 생존율은 95%였다. 유사한 결과는 표 2에요약된 바와 같이 다른 렌티바이러스 벡터에 대해 동일한 방법을 사용했을 때 얻어졌다. 핵 주사에서 살아남은 배아의 비율은 현저히 낮았다 (29-45%). 표 2는 임신 한 여성 대 의사 임신의 전달을 고려하여 조작 된 zygotes의 이식 효율의 대표적인 결과를 요약합니다. 주입된 배아와 함께 조작되지 않은 배아의 사용은 이전에16로보고되었다. 우리의 전반적인 결과는 임신 한 여성 쥐가 유사한 효율성을 가진 위탁 어머니로 사용될 수 있다는 것을 건의합니다. 우리는 임신과 의사 임신 쥐에서 외국 배아의 이식의 유사한 비율을 얻었다 (여러 실험 설정에 대한 전반적인 평균: 15% 대. 16%). 그러나, 배아가 더 미묘한 조작을 겪었을 때 이식 비율은 더 높았으며, 이는 subzonal 주입 (10% 대 21%)을 의미합니다. 특히, 개별 적인 주사 를 위해 분석된 수치 데이터는 이식의 효과는 1개의 태아의 주사 수에 의존한다는 것을 나타냈다(표 1,마지막 열) 간접적으로 바이러스 부하에 의존.
| 벡터 | 주사/배아 수 | 주입된 배아 수 | 새끼의 수 | 위탁 어머니의 수 | 형질전환 창업자 수 | 각 변종에 대한 이식 효율 |
| Syn-TDP-43WTLV | 1 | 48 | 20 | 3 | 0 | 42% |
| 10 | 45 | 0 | 3 | 0 | 0% | |
| 2 | 48 | 8 | 3 | 3 | 17% |
표 1: Syn-TDP-43WT렌티바이러스 벡터를 가진 zygotes의 subzonal 주사의 수의 요약.
| 메서드 | 벡터 | 티터/ 농도 | 주입된 배아의 수 | 살아남은 배아 | 생존율 | 위탁 어머니의 수 | 새끼의 수 | 이식 효율 | 임신 (P) / 의사 임신 (PP) |
| PNI (주) | TTYH1-Thy1-EGFP | 1 ng/μL | 1083 | 424 | 39% | 16 | 54 | 13% | Pp |
| PNI (주) | H3m체리 | 0.5-2 ng/μL | 2229 | 647 | 29% | 29 | 67 | 10% | Pp |
| PNI (주) | Syn-TDP-43-A315T | 2 ng/μL | 1256 | 562 | 45% | 31 | 42 | 7% | Pp |
| Lv | Syn-TDP-43-A315T | 8.7 x 108 | 115 | 106 | 92% | 7 | 18 | 17% | P |
| Lv | 신 TDP-43 WT | 3.4 x 108 | 152 | 141 | 93% | 9 | 28 | 20% | P |
| Lv | LVH3mcherry | 1.3 x 107 | 504 | 450 | 89% | 13 | 115 | 26% | Pp |
표 2: 배아 생존율 및 이식 효율, 사용된 주사 방법에 따라 임신 대 의사임신 유도. PNI, 핵 주사; LV, 렌티바이러스 벡터 서브구역 주사.

도 1: 서브존 렌티바이러스 벡터 주사를 위해 제조된 1단계 쥐 배아의 현미경 사진. 배아를 고정된 피펫으로 고정시켰습니다. 모계 및 친자 유전 물질과 극성 체를 포함하는 두 개의 전핵을 볼 수 있습니다. 배율 막대 = 20 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
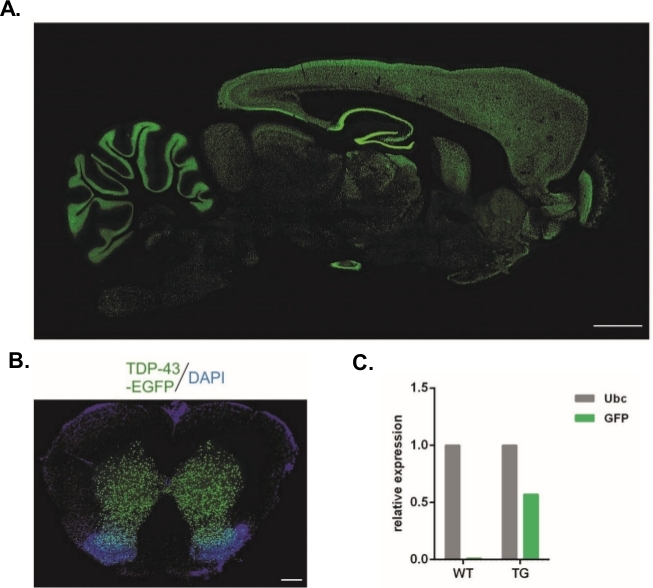
도 2: 전체 중추 신경계에 걸쳐 신경 시냅신-1 프로모터의 제어하에 TDP-43-eGFP 융합 단백질을 발현한 안정적인 형질전환 래트 라인의 생성. (a)시냅신-1(Syn)-구동 hTDP-43-eGFP 발현 패턴은 형질전환 쥐 뇌의 시상 섹션에서. 스케일 바 = 3 mm.(B)DAPI로 얼룩진 eGFP 형광이 척수의 회색 물질로 제한된 형질전환 쥐의 척수의 코로나 절편. 배율 막대 = 250 μm. (C)유비퀴틴 C 참조 전사체와 비교하여 GFP 이식유전자 전사체의 상대적 발현. n = 2 개의 와일드 타입. n = 2 형질전환. 그림은14에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
형질전환 기술의 발전으로 설치류 모델은 생물 의학 연구에서 귀중한 도구로 만들었습니다. 그(것)들은 생체 내에서 유전자형 표현형 관계를 공부하는 기회를 제공합니다. 여기서, 우리는 핵 주사에 의한 종래의 종래의 기진에 대해 널리 이용 가능한 대안을 제시한다. 렌티 바이러스 유전자 전달의 사용은 바이러스 벡터가 조나 pellucida의 밑에 주입될 수 있기 때문에 까다로운 미세 주입을 위한 필요를 우회합니다. 이 접근은 본질적으로 주입된 zygotes를 위한 100% 생존율을 보장하는 태아 무결성에 영향을 미치지 않습니다. 렌티바이러스 벡터를 통해 통합되는 이식유전자는 숙주 게놈에 안정적으로 통합되어 장기 발현 및 생식선 전달을 허용한다. 추가적으로, 우리는 어머니를 양육하기 위하여 수정한 태아 전송을 위한 2개의 대체 기술을 제시합니다. 1개의 기술은 vasectomized 불임 수컷과 교배해서 이전에 준비된 의사 임신 한 여성에 태아 전송을 이용합니다. 다른 기술은 비옥한 수컷과 교제되지만 다른 모피 색상 (즉, BN 쥐)과 결합된 자연적으로 임신 한 여성의 사용을 기반으로합니다. 임신의 이 더 생리적인 과정은 도전적인 유전 수정을 겪는 태아의 적당한 발달을 허용합니다16.
형질전환 쥐를 생성하는 첫번째 성공적인 시도는 1990년7년에보고되었습니다. 그러나, 쥐의 형질전환(17)에 어려움이 있기 때문에, 비교적 적은 수의 형질전환래트라인이 최근 수십년 동안 생성되고있다 9.17 몇몇 주요다름은 마우스와 마우스 transgenesis 사이 현미경 주입을 사용하여 관찰됩니다. 쥐의 경우, 주로 근친 배드 라인(예: Wistar 및 SD)이 종족 발생에 사용됩니다. 마우스를 위해, 연구원은 주로 그들의 더 높은 비옥, 호르몬 과다 증열에 더 나은 반응, 및 배아의 상대적으로 쉬운 발달 때문에 근친 교배 균주의 F1 교배를 18 배반포에18에시험관내로 이용합니다. 쥐에 있는 과급 ovulation의 유도는 표준 PMSG/hCG 호르몬 자극을 사용하여 마우스에서 보다는 훨씬 덜 효율적입니다. 이러한 이유로, 단일 PMSG투여(19)대신 지속적인 FSH 주입을 활용하는 쥐에서 이러한 호르몬을 투여하는 대체 프로토콜을 개발하려는 시도가 이루어졌다. 그러나, PMSG/hCG 또는 FSH/hCG에 의해 야기되는 과다 배란은 비교 효율20을가지는 것으로 나타났다. 우리의 의견으로는, 과다 배란의 효과에 영향을 미치는 가장 중요한 요소는 선택한 여성의 나이입니다. 그럼에도 불구하고, 정확한 매개 변수는 각 쥐 긴장, 실험실 등에게 시험되어야 합니다.
단세포 배아의 전핵에 DNA 용액을 주입하는 절차는 두 설치류 종 모두에 대해 유사하다. 그러나, 쥐 zygotes의 pronuclei는 마우스에서와 같은 정규 모양을 가지고 있지 않으며 세포의 세포질에서 정의하기 가 더 어려운 경향이 있다. 추가적으로, 쥐 zygote 세포막 및 pronuclear 막은 DNA 해결책으로 적재되는 유리 마이크로파이펫의 삽입을 복잡하게 하는 더 탄성 및 점성입니다. 이러한 요인은 미세 주입 후 낮은 쥐 계란 생존율로 이어질 (31-65% 대. 80% 쥐에서) 쥐에서 낮은 transgenesis 효율성을 설명9. 또한, 배아의 집중적이고 기계적 조작은 또한 우리의 실험실을 포함한 많은 실험실에서 최대 10 %에 도달하는 이식 효율에 영향을 미칠 수 있습니다. 이러한 비교적 낮은 수율은 적절한 수의배아(21)를이식한 후에도 관찰된다.
전술한 어려움을 극복하는 한 가지 방법은 레트로 바이러스가있는 단세포 배아의 감염입니다. 레트로 바이러스는 감염된 세포로 진입할 때 바이러스의 역전사에 의해 DNA로 전사되는 RNA의 형태로 유전 물질을 포함합니다. DNA는 그 때 세포 핵에 핵 기공을 통해서 수송되고, 여기서 provirus의 양식에 있는 세포의 게놈으로 통합됩니다. 렌티바이러스 벡터는 형질전환 마우스 및 래트12,,14,,22를생성하는데 사용되어 왔다. 조나 펠루시다가 결여된 단세포 배아는 렌티바이러스 벡터를 가진 용액에서 배양될 수 있거나, 또는 벡터가 조나 펠루시다 아래에 경막세포 내로 주입될 수 있다. 이 방법의 주요 장점은 트랜스 제닉 자손의 80 % 이상에 도달하는 매우 높은 효율입니다. lentiviral 벡터를 감염 한 후, 다른 사이트에서 많은 사본은 1개의 통합 부위가 일반적으로관찰되는핵 미세 주입에 의한 트랜스제네시스 방법과는 달리, 접합 게놈에 통합될 수 있다. 렌티 바이러스 벡터를 사용하여 만들어진 형질전환 설립자의 자손에서, 이식유전자의 개별 사본은 각각의 자손에서 이식유전자의 다른 발현 단면도에 의해 명시될 수 있는 분리됩니다. 그러나, 이는 이식유전자로부터 유래되는 원하는 발현 프로파일을 가진 피험체를 수신할 확률을 증가시킬 수 있다. 제한은 주로 약 8 kb23로제한되는 이식 유전자의 크기에 적용됩니다.
쥐 이식에 있는 또 다른 어려움은 유전으로 변형된 태아를 위한 대리 어머니로 봉사하는 여성의 생성입니다. 표준 절차에서, 여성은 의사 임신을 유도하기 위해 멸균 vasectomized 남성과 교차된다. 쥐에서, 의사 임신 평가 기술은 쥐에서 보다 훨씬 더 어렵다, 그래서 자극 호르몬 주 작동 근을 방출 하는 자극 은 때때로 남성과 짝짓기 하기 전에 몇 일 사용. 이러한 이유로, 설명된 프로토콜에서 우리는 위탁 어머니를 얻기 위하여 2개의 대안 적인 접근을 제공합니다. 임신 또는 의사 임신 여성이 사용될 때 조작 된 zygotes의 전반적인 이식 효율은 유사하다. 그러나, 조작된 것과 함께 자연적인, 비 조작된 태아의 존재는 임신 율16를향상할 수 있습니다. 이식 비율에 있는 주요 다름은 조작 기술 (즉, PNI 대 LV, 10% 대 20%; 표 2참조), 수양 어머니로 의사 임신 여성의 사용은 몇몇 실험에 유익할 지도 모릅니다.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
저자(W.K.)는 폴란드 특허청으로부터 "형질전환동물의 생산방법"에 대한 특허권(P 355353; 21.03.2008)을 가지고 있다.
Acknowledgments
이 연구는 폴란드 과학 재단의 팀 테크 코어 시설 플러스 프로그램 내 ANIMOD 프로젝트에 의해 지원되었으며, 유럽 지역 개발 기금에서 WK에 따라 유럽 연합 (EU)이 공동 으로 자금을 지원했습니다.
Materials
| Name | Company | Catalog Number | Comments |
| 7500 Real Time PCR System | Applied Biosystems | ||
| Aerrane (isoflurane) | Baxter | FDG9623 | |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma | A5177-5EA | |
| Atipam 5 mg/ml | Eurovet Animal Health BV | N/A | 0.5 mg/kg |
| Baytril 25 mg/ml (enrofloksacin) | Bayer | N/A | 5-10 mg/kg |
| Borosilicate glass capillaries with filament GC100TF-15 | Harvard Apparatus Limited | 30-0039 | injection capillary |
| Bupivacaine 25 mg/ml | Advanz Pharma | N/A | 0.25% in 0.9% NaCl |
| Butomidor 10 mg/ml (butorphanol tartrate) | Orion Pharma | N/A | 1 mg/kg |
| CELLSTAR Tissue Cell Culture Dish 35-mm | Greiner Bio-One | 627160 | |
| CELLSTAR Tissue Cell Culture Dish 60-mm | Greiner Bio-One | 628160 | |
| CellTram Oil | Eppendorf | 5176 000.025 | |
| Cepetor (Medetomidine) 1 mg/ml | cp-pharma | N/A | 0.5 mg/kg |
| Chorulon, Human Chorionic Gonadotrophin | Intervet | N/A | 150 IU/ ml ml 0.9% NaCl |
| DMEM low glucose | Sigma Aldrich | D6048 | |
| DNase, RNase-free | A&A Biotechnology | 1009-100 | |
| EmbryoMax Filtered Light Mineral Oil | Sigma | ES-005-C | |
| Envelope protein coding plasmid for lentiviral vectors (VSVg plasmid) | ADDGENE | 14888 | |
| FemtoJet | Eppendorf | 4i /5252 000.013 | |
| Fetal Bovine Serum | Sigma Aldrich | F9665-500ML | |
| Folligon, Pregnant Mare’s Serum Gonadotropin | Intervet | N/A | 125 IU/ml in .9% NaCl |
| HEK 293T cells | ATCC | ATCC CRL-3216 | |
| Hyaluronidase from Bovine Testis | Sigma | H4272-30MG | 0.5 mg/ml in M2 medium |
| Inverted Microscope | Zeiss | Axiovert 200 | |
| Ketamine 100mg/ml | Biowet Pulawy | N/A | 50 mg/kg |
| Liquid Paraffin | Merck Millipore | 8042-47-5 | |
| M16 medium EmbryoMax | Sigma | MR-016-D | |
| M2 medium | Sigma | M7167 | |
| Magnesium Chloride 1M | Sigma Aldrich | 63069-100ML | |
| Microforge | Narishige | MF-900 | |
| Mineral Oil | Sigma | M8410-500ML | |
| NaCl 0.9% | POLPHARMA OTC | N/A | sterile, 5ml ampules |
| Operation microscope | Inami Ophthalmic Instruments | Deca-21 | |
| Packaging system coding plasmid for lentiviral vectors (delta R8.2 plasmid) | ADDGENE | 12263 | |
| PEI reagent (Polyethylenimine, Mw ~ 25,000,), | Polysciences, Inc | 23966-1 | |
| Penicilin-streptomycin | Sigma Aldrich | P0781-100ML | |
| Phosphate Buffered Saline, pH 7.4, liquid, sterile-filtered, suitable for cell culture | Sigma Aldrich | 806552-500ML | |
| Puller | Sutter Instrument Co. | P-97 | |
| Reflex Clip Applier/Reflex Clips | World Precision Instruments | 500345/500346 | |
| Safil, polyglycolic acid, braided, coated, absorbable threads | B.Braun Surgical | 1048029 | |
| Stereomicroscope | Olympus | SZX16 | |
| Surgical Sewing Thread | B.Braun | C1048040 | |
| SYBR Green PCR Master Mix | Applied Biosystem | 4334973 | |
| Tolfedine 4% (tolfenamic acid) | Vetoquinol | N/A | 2 mg/kg |
| TransferMan NK2 | Eppendorf | N/A | |
| Trypsin EDTA solution | Sigma Aldrich | T3924-500ML | |
| Ultracentrifuge | Beckman Coulter | Optima L-100 XP | |
| VacuTip | Eppendorf | 5175108.000 | holders capillary |
| Vita-POS | Ursapharm | N/A | eye ointment |
| Warming Plate | Semic | N/A | |
| Watchmaker Forceps | VWR | 470018-868 |
References
- Lazar, J., Moreno, C., Jacob, H. J., Kwitek, A. E. Impact of genomics on research in the rat. Genome Research. 15 (12), 1717-1728 (2005).
- Tarkowski, A. K. Studies on mouse chimeras developed from eggs fused in vitro. National Cancer Institute Monographs. 11, 51-71 (1963).
- Gordon, J. W., Ruddle, F. H. Integration and stable germ line transmission of genes injected into mouse pronuclei. Science. 214 (4526), 1244-1246 (1981).
- Gill, T. J., Smith, G. J., Wissler, R. W., Kunz, H. W. The Rat as an Experimental Animal. Science. 245 (4915), 269-276 (1989).
- Aitman, T. J., et al. Progress and prospects in rat genetics: a community view. Nature Genetics. 40 (5), 516-522 (2008).
- Hammer, R. E., Maika, S. D., Richardson, J. A., Tang, J. P., Taurog, J. D. Spontaneous inflammatory disease in transgenic rats expressing HLA-B27 and human beta 2m: an animal model of HLA-B27-associated human disorders. Cell. 63 (5), 1099-1112 (1990).
- Mullins, J. J., Peters, J., Ganten, D. Fulminant hypertension in transgenic rats harbouring the mouse Ren-2 gene. Nature. 344 (6266), 541-544 (1990).
- Menoret, S., Remy, S., Usal, C., Tesson, L., Anegon, I. Generation of Transgenic Rats by Microinjection of Short DNA Fragments. Rat Genomics: Methods and Protocols. 597, 81-92 (2010).
- Tesson, L., et al. Transgenic modifications of the rat genome. Transgenic Research. 14 (5), 531-546 (2005).
- Charreau, B., Tesson, L., Soulillou, J. P., Pourcel, C., Anegon, I. Transgenesis in rats: Technical aspects and models. Transgenic Research. 5 (4), 223-234 (1996).
- Ritchie, W. A., Neil, C., King, T., Whitelaw, C. B. Transgenic embryos and mice produced from low titre lentiviral vectors. Transgenic Research. 16 (5), 661-664 (2007).
- Lois, C., Hong, E. J., Pease, S., Brown, E. J., Baltimore, D. Germline transmission and tissue-specific expression of transgenes delivered by lentiviral vectors. Science. 295 (5556), 868-872 (2002).
- Pfeifer, A., Ikawa, M., Dayn, Y., Verma, I. M. Transgenesis by lentiviral vectors: lack of gene silencing in mammalian embryonic stem cells and preimplantation embryos. Proceedings of the National Academy of Sciences of the United States of America. 99 (4), 2140-2145 (2002).
- Koza, P., et al. Neuronal TDP-43 depletion affects activity-dependent plasticity. Neurobiology of Disease. 130, 104499 (2019).
- Scherr, M., Battmer, K., Blomer, U., Ganser, A., Grez, M. Quantitative determination of lentiviral vector particle numbers by real-time PCR. Biotechniques. 31 (3), 520 (2001).
- Canseco, R. S., et al. Gene transfer efficiency during gestation and the influence of co-transfer of non-manipulated embryos on production of transgenic mice. Transgenic Research. 3 (1), 20-25 (1994).
- Charreau, B., Tesson, L., Soulillou, J. P., Pourcel, C., Anegon, I. Transgenesis in rats: technical aspects and models. Transgenic Research. 5 (4), 223-234 (1996).
- Brinster, R. L., Chen, H. Y., Trumbauer, M. E., Yagle, M. K., Palmiter, R. D. Factors affecting the efficiency of introducing foreign DNA into mice by microinjecting eggs. Proceedings of the National Academy of Sciences of the United States of America. 82 (13), 4438-4442 (1985).
- Armstrong, D. T., Opavsky, M. A. Superovulation of immature rats by continuous infusion of follicle-stimulating hormone. Biology of Reproduction. 39 (3), 511-518 (1988).
- Popova, E., Krivokharchenko, A., Ganten, D., Bader, M. Comparison between PMSG- and FSH-induced superovulation for the generation of transgenic rats. Molecular Reproduction and Development. 63 (2), 177-182 (2002).
- Johnson, L. W., Moffatt, R. J., Bartol, F. F., Pinkert, C. A. Optimization of embryo transfer protocols for mice. Theriogenology. 46 (7), 1267-1276 (1996).
- van den Brandt, J., Wang, D., Kwon, S. H., Heinkelein, M., Reichardt, H. M. Lentivirally generated eGFP-transgenic rats allow efficient cell tracking in vivo. Genesis. 39 (2), 94-99 (2004).
- Remy, S., et al. The Use of Lentiviral Vectors to Obtain Transgenic Rats. Rat Genomics: Methods and Protocols. 597, 109-125 (2010).



