Summary
Bu protokol, lazer mikro ışınlama ile DNA onarım proteini alımını ölçmek gibi aşağı akış mikroskopi çalışmaları için S faz hücrelerini verimli bir şekilde tanımlamak için invaziv olmayan bir yöntemi açıklar.
Abstract
DNA hasarı onarımı, oldukça reaktif bir ortamda hücrelerin genetik bütünlüğünü korur. Hücreler, metabolik aktiviteler veya UV radyasyon gibi hem endojen hem de eksojen kaynaklar nedeniyle çeşitli DNA hasarı türleri biriktirebilir. DNA onarımı olmadan, hücrenin genetik kodu tehlikeye girer, proteinlerin yapılarını ve işlevlerini baltalar ve potansiyel olarak hastalığa neden olur.
Çeşitli hücre döngüsü aşamalarında farklı DNA onarım yollarının mekansal dinamiklerini anlamak, DNA hasarı onarımı alanında çok önemlidir. Mevcut floresan mikroskopi teknikleri, DNA hasarı indüksiyonu sonrası farklı onarım proteinlerinin işe alım kinetiğini ölçmek için harika araçlar sağlar. Hücre döngüsünün S evresi sırasında DNA sentezi, DNA onarımı ile ilgili hücre kaderinde tuhaf bir noktadır. Tüm genomun hatalarını taramak için benzersiz bir pencere sağlar. Aynı zamanda, DNA sentez hataları, bölünmeyen hücrelerde karşılaşılmayan DNA bütünlüğü için de bir tehdit oluşturur. Bu nedenle, DNA onarım süreçleri S fazında hücre döngüsünün diğer aşamalarına göre önemli ölçüde farklılık gösterir ve bu farklılıklar yekçe anlaşılamaz.
Aşağıdaki protokol, 405 nm lazer hattı ile donatılmış bir lazer tarama konfokal mikroskobu kullanılarak, hücre hatlarının hazırlanmasını ve yerel olarak indüklenen DNA hasar bölgelerinde S fazında DNA onarım proteinlerinin dinamiklerinin ölçüldüklerini açıklar. Etiketli PCNA (mPlum ile), S fazında DNA hasarı alımını ölçmek için acgfp etiketli bir onarım proteini (yani EXO1b) ile birlikte bir hücre döngüsü işaretleyicisi olarak kullanılır.
Introduction
Hücrelerde ortaya çıkabilecek farklı DNA lezyonlarını ele almak için çeşitli DNA onarım yolları gelişti ve bunların hepsi hem uzayda hem de zamanda son derece düzenlenmiştir. Hücre döngüsünün en savunmasız dönemlerinden biri DNA sentezinin gerçekleştiği S fazıdır. Çoğalma yaşam için temel olsa da, aynı zamanda büyük bir zorluk sağlar. Hücrelerin, mutasyonların gelecek nesillere aktarılabilmesi için genomlarının sadık bir şekilde çoğaltılmasını sağlamaları gerekir. Sonuç olarak, çoğalma onkoloji alanında terapötik yaklaşımların geliştirilmesi için kullanılan terapötik bir müdahale noktası sağlar.
DNA lezyonlarında protein alımını incelemek için kullanılan tüm ana tekniklerin güçlü ve sınırlamaları vardır. Mikro ışınlama, iyonlaştırıcı radyasyon kaynaklı odakların (IRIF), kromatin-immünoreipitasyonunun (ChIP) veya biyokimyasal fraksiyonasyonun immünofluoresan görüntülemesi gibi alternatif yöntemlerin çoğundan daha iyi mekansal ve zamansal çözünürlük1'e sahiptir. Bununla birlikte, mikro ışınlama, aynı anda çok sayıda hücreyi örnekleyebilen yukarıda belirtilen tekniklerin sağlamlığını sağlar.
S fazında DNA onarımını araştırmak için, zaman uyumsuz hücre kültürü popülasyonundaki S faz hücrelerini ayırt edebilmek gerekir. Bunu ele almak için, hücrelerin senkronizasyonunu veya farklı hücre döngüsü aşamalarının görselleştirilmesini içeren birçok iyi bilinen yöntem vardır. Bununla birlikte, her iki yaklaşım da önemli zorluklar ve olası eserler ortaya koyuyor. Erken S fazında hücreleri zenginleştirmek için yaygın olarak kullanılan kimyasal senkronizasyon yöntemleri (örneğin, çift timidin bloğu, afidikolin ve hidroksiüre tedavisi) replikasyon stresinin indüksiyonu ile senkronizasyon elde eder ve sonunda DNA hasarının kendisi. Bu, S faz2'dekiDNA onarım süreçlerini incelemek için bu yöntemlerin kullanımını sınırlar. Serum açlığı ve salınımı yoluyla senkronizasyon sadece sınırlı sayıda hücre hattı için geçerlidir, büyük ölçüde dönüştürülmemiş hücre hatlarına kıyasla hücre döngüsü ilerlemesi için büyüme faktörlerine daha az dayanan kanser hücre hatları hariç. Floresan Ubiquitin Hücre Döngüsü Göstergesi (FUCCI) sistemi hücre döngüsünü incelemek için özellikle yararlı bir araçtır, ancak S ve G2 hücre döngüsü aşamaları arasında ayrım yaparken temel bir sınırlamaya sahiptir3.
Burada, S fazı için invaziv olmayan bir işaretleyici olarak floresan etiketli PCNA kullanmanın, kimyasal hücre döngüsü senkronizasyon yöntemlerinin dezavantajlarını sınırlarken, FUCCI sisteminden daha fazla özgüllük ve esneklik sağladığını gösterilmiştir. Tek bir işaretleyici olarak, PCNA sadece zaman uyumsuz bir popülasyondaki S faz hücrelerini vurgulamakla kalmaz, aynı zamanda S fazı içindeki hücrelerin tam ilerlemesini de gösterebilir (yani, erken, orta veya geç S fazı)4. Eksojen, etiketli PCNA'nın düşük ekspresyon seviyeleri, hem hücre döngüsü ilerlemesi hem de DNA onarım süreçlerine minimum parazit sağlar. Daha da önemlisi, PCNA ayrıca birkaç DNA lezyonunun onarımında yer aldığı ve lokal olarak indüklenen DNA hasar bölgelerine1,4.
Burada sunulan deneyler, S aşamasında EXO1b'nin işe alım dinamiklerinin nasıl ölçüldüğini ve bunun köklü PARP inhibitörü olaparib'den nasıl etkilendiğini göstermektedir. EXO1b nükleaz aktivitesi, uyuşmazlık onarımı (MMR), nükleotid eksizyon onarımı (NER) ve çift iplikli kırılma (DSB) onarımı dahil olmak üzere çok çeşitli DNA onarım yolları ile ilgilidir. S fazında EXO1b, DNA rezeksiyonu sırasında 3' ssDNA çıkıntlarının oluşumu yoluyla homolog rekombinasyonda (İK) önemli bir rol oynar5. EXO1b, replikasyonda iplikçik yer değiştirmesi sırasında gecikmeli iplikçikte astar kaldırma ve Okazaki parça olgunlaşmasının yanı sıra durmuş DNA çatallarını yeniden başlatmak için kontrol noktası aktivasyonundaki rollerle DNA replikasyonuna daha da karışmıştır5. Hasarlı DNA bölgelerine EXO1b alımı poli (ADP-riboz) (PAR)6,7ile doğrudan etkileşim ile düzenlenir. EXO1b'nin çok sayıda hücre döngüsüne özgü etkileri nedeniyle, PCNA kullanarak S fazı spesifik işe alım çalışmaları için mükemmel bir seçimdir.
Protocol
1. İnsan osteosarkom türevi hücrelerin yetiştirilmesi (U-2 OS)
NOT: U-2 işletim sistemi hücreleri, düz bir morfolojiye, büyük çekirdeğe sahip oldukları ve cam da dahil olmak üzere çeşitli yüzeylere güçlü bir şekilde tutturuldukları için bu çalışmalar için idealdir. Benzer özelliklere sahip diğer hücre hatları da kullanılabilir.
- U-2 işletim sistemi hücre hatlarının yetiştirilmesi için, McCoy'un %10 fetal sığır serumu (FBS) ve antibiyotiklerle (100 U/mL penisilin ve 100 μg/mL streptomisin) desteklenmiş 5A ortamını kullanın. Hücreleri 37 °C'de% 5 CO2içeren nemli bir atmosferde kuluçkaya yatır. Mikroskopi çalışmaları için yeterli hücre sayısını sağlamak için hücre kültürünü 10 cm'lik bir tabakta koruyun.
- Hücreler% 90 izdiah (~7 x 106 hücre/ 10 cm çanak) yaklaştığında, hücreleri bölün.
- Serumun içinde bulunan tripsin inhibitörlerini yıkamak için hücreleri PBS ile durulayın.
- 1 mL Tripsin-EDTA ekleyin ve hücre katmanının eşit şekilde kaplatılmış olduğundan emin olun.
- Hücre tabakası plakadan kaldırılana kadar 37 °C'de kuluçkaya yatırın (yaklaşık 6 dk).
- Tripini inaktive etmek ve hacmin 1/10'unu (~0,7 x 106 hücre)10 mL takviyeli büyüme ortamı içeren yeni bir 10 cm plakaya eklemek için medya içeren serumdaki denenmiş hücreleri yeniden biriktirin.
- Denemeden önce, üreticinin tavsiyesine uyarak Evrensel Mikoplazma Algılama kitini kullanarak hücreleri mikoplazma kontaminasyonu için rutin olarak test edin.
2. Retroviral enfeksiyon
NOT: BSL-2 güvenlik önlemleri için ve rekombinant virüslerle çalışırken lütfen şu kaynaklara bakın: NIH Yönergeleri, Bölüm III-D-3: Doku kültüründe rekombinant virüsler.
- Tohum 4 x 106 HEK293T hücreleri, 10 cm'lik bir kültür yemeğine kaplatma yaptıktan sonra 24 saat içinde ~% 60 izdiah elde etmek için.
- HEK293T yetiştirmek için lütfen bu protokolün 1.1-1.3'unda açıklanan U-2 işletim sistemi ekim adımlarını izleyin. HEK293T için McCoy'un DMEM için 5A ortamını değiştirin. HEK293T hücrelerini doku kültürü plakalarına zayıf bir şekilde tutturuldukları için her zaman hafifçe yıkadığıktan emin olun.
- Plazmidlerin viral ambalajı için lipid bazlı transfeksiyon reaktifi kullanarak HEK293T hücrelerini transfect.
- Retroviral vektörler için, 1,5 μg VSV-G (Addgene #8454) ve 1,5 μg pUMVC (Addgene #8449) ambalaj vektörlerini birleştirin ilgi genini içeren vektörün 3 μg'si ile (püromisin direncine sahip retroviral vektör omurgasında) bir mikrosantrifüj tüpünde 250 μL Opti-MEM azaltılmış serum ortamına. Opti-MEM/DNA karışımına eklenen her μg DNA için 1 μL P3000 reaktif ekleyin (bu durumda 6 μL) ve dokunarak hafifçe karıştırın. Yukarı ve aşağı girdap veya pipet yapmayın.
- Başka bir mikrosantrifüj tüpünde, μg DNA başına 2 μL (bu durumda 12 μL) transfeksiyon reaktifini 250 μL Opti-MEM azaltılmış serum ortamı ile birleştirin.
- İki karışımı birleştirin (500 μL kombine, girdap yapmayın, sadece hafifçe dokunarak karıştırın) ve oda sıcaklığında 15 dakika kuluçkaya yatmasına izin verin.
- Dikkatlice, karışımı hücreleri ayırmadan tohumlanmış HEK293T hücrelerine damla yönünde ekleyin. Tabakları yavaşça döndürün.
- Viral enfeksiyon stabil hücre hatları oluşturmak için.
- Transfeksiyondan 72 saat sonra HEK293T hücrelerinden süpernatant içeren virüsü çıkarın. Hücre kalıntılarını ve ayrılmış hücreleri gidermek için çözeltiyi 0,45 μm filtre ile dikkatlice filtreleyin. İsteğe bağlı olarak, viral enfeksiyonu kolaylaştırmak için viral süpernatant içine 8 μg / mL polibren ekleyin.
- U-2 işletim sistemi hücrelerine 10 cm'lik bir tabakta (~3 x 106 hücre) ~%50 izdiahta süpernatant içeren virüs ekleyin. U-2 işletim sistemi hücrelerini bir gün önce tohumla.
- Virüs içeren süpernatant çıkarmadan ve atmadan önce 6-16 saat boyunca enfekte edin.
NOT: İlgi genleri için istenen miktarda aşırı ifade elde etmek için, bir dizi viral seyreltmeyi sabit bir süre kuluçkaya yatırın. Yeni kurulan her hücre hattındaki transjenin ifade düzeylerini, endojen düzeylerle karşılaştıran batı lekesi ile kontrol edin. - Hücrelerin uygun antibiyotiklerin varlığında (2 μg/ mL son konsantrasyonda pürüzlü olması durumunda 3-4 gün boyunca) seçmelerine izin verin ve bir mikroskop altında ilgi çekici floresan protein etiketli genin ekspresyonunun doğrulanmasına izin verin.
- Çift etiketli hücre çizgileri oluşturmak için bu adımları yineleyin. Burada sunulan deneylerde mPlum-PCNA, exo1b-acgfp ile birlikte retroviral vektörden (pBABE) ifade edildi, ayrıca retroviral vektörden (pRetroQ-AcGFP1-N1) ifade edildi.
3. Hücrelerin mikro ışınlama için hazırlanması
- Kaplama hücreleri: Deneyden önce 24 saat, toplam 8,0 x10 4 hücreyi, yüksek büyütme konfokal mikroskopi ve lazer mikro ışınlama için ideal sonuçlar veren 1,5 numaralı borosilikat cam tabana sahip dört iyi odalı örtü üzerinde 500 μL-1 mL arasında bir ortam hacmine (kabaca% 70 izdiah için) plakalar. Daha yüksek bir hücre konflümanisi, tek bir görüş alanında (FOV) ölçülen daha fazla hücreye izin verir; ancak tam birleştiği slaytlar hücre döngüsü düzensizlikleri getirecektir.
- Görüntüleme ortamı: Mikro ışınlamadan bir saat önce, FluoroBrite DMEM için %10 FBS, 100 U/mL penisilin ve 100 μg/mL streptomisin, 15 mM HEPES (pH=7.4) ve 1 mM sodyum-pirvavat ile desteklenmiş düzenli büyüme ortamını değiştirin. Bu görüntüleme ortamı, çok loş floresanların algılanmasını sağlayan sinyal-gürültü oranını en üst düzeye çıkarmaya yardımcı olur. HEPES içerdiğinden, %5 CO2 atmosferinin yokluğunda pH'ı da stabilize eder.
- Bu adımda görüntülemeden önce herhangi bir ek tedavi uygulayın. Burada sunulan deneylerde, hücreler görüntülemeden bir saat önce olaparib (PARP inhibitörü, 1 μM son konsantrasyonda) veya bir araç kontrolü (DMSO)1,8,9ile ön işlemden geçirildi.
4. Mikroskobun hazırlanması ve görüntüleme için S faz hücrelerinin seçilmesi.
- En iyi sonuçlar için burada özetlenen sistemle benzer özelliklere sahip bir konfokal sistem kullanın. Burada sunulan deneyler ters mikroskop standına monte edilmiş bir konfokal mikroskop kullanılarak gerçek gerçekleştirildi (bkz. Malzeme Tablosu).
NOT: Burada kullanılan mikroskop 50 mW 405 nm FRAP lazer modülü ve 60x 1.4 NA yağ planı-apochromat hedefi ile donatılmıştır. Konfokal tarama kafasının iki tarayıcı seçeneği vardı: galvano tarayıcı (yüksek çözünürlük için) ve rezonans tarayıcı (yüksek hızlı görüntüleme için).- Fotobleaching (FRAP) lazerden sonra floresan kurtarmayı yazılım kontrollü bir XY galvano cihazı aracılığıyla örneğe tanıtın. AcGFP'yi heyecanlandırmak için 488 nm lazer hattı ve mPlum'u heyecanlandırmak için 561 nm veya 594 nm lazer hattı kullanın.
NOT: Aşağıdaki filtre kombinasyonu en iyi sonuçları verir: 560 nm uzunluğunda bir geçiş filtresi kullanılarak, 560 nm'den daha düşük dalga boyuna sahip emisyon ışığı AcGFP için 525/50 nm emisyon filtresinden geçirilirken, dalga boyu 560 nm'den yüksek olan emisyon ışığı mPlum için 595/50 nm emisyon filtresinden geçirildi. Minimum floresan kanaması sağlayan uygun herhangi bir filtre seti (örneğin, FITC/TRITC, GFP/mCherry, FITC/TxRed) kullanılabilir.
- Fotobleaching (FRAP) lazerden sonra floresan kurtarmayı yazılım kontrollü bir XY galvano cihazı aracılığıyla örneğe tanıtın. AcGFP'yi heyecanlandırmak için 488 nm lazer hattı ve mPlum'u heyecanlandırmak için 561 nm veya 594 nm lazer hattı kullanın.
- Çevre odasını ve mikroskop bileşenlerini açın.
- Kararlı görüntü alımı için termal denge sağlamak için denemenin başlamasından en az 4 saat önce ısıtmayı (mümkün olduğunda aşama, hedef ve çevre odası), CO2 beslemesini ve nem regülatörü açın.
- Hücrelerin mikroskopa aktarılmasından en az 1 saat önce lazer hatlarıyla birlikte ışık kaynaklarını başlatın.
- İşaretçi olarak floresan etiketli PCNA kullanarak zaman uyumsuz popülasyondaki S fazlı hücreleri seçin. Aşağıdaki adımları izleyerek bunu yapın.
- Bu hücre döngüsü aşamasının tanımlanmasını mümkün karakt olan S fazında mPlum etiketli PCNA'nın benzersiz yerelleştirme desenini arayın. PCNA, hücre döngüsünün G1 ve G2 evrelerinde çekirdekte tamamen homojen bir dağılım sağlarken, çekirdeklerden dışlanmıştır. S fazında, PCNA çekirdekteki yanıtların bulunduğu yerde odaklar oluşturur. Şekil 1, S fazı boyunca PCNA odaklarının farklı kalıplarını gösterir, bu da erken, orta ve geç S fazını ayırt etmeyi bile mümkün kılar.
- Mikro ışınlama için yeterli S fazlı hücreye sahip bir FOV seçmek için okülerlere bakın. Asenkron U-2 işletim sistemi hücreleri genellikle S fazında popülasyonlarının% 30-40'ına sahiptir.
- Hem PCNA hem de ilgi proteini (POI) için ifade düzeylerindeki aşırılıklardan (parlak ve loş hücreler) kaçınmaya çalışın, bu durumda EXO1b-AcGFP, deneysel eserlere yol açabilir.
- Uygun bir FOV bulurken, fotobleaching ve istenmeyen DNA hasarını en aza indirmek için alanı uzun süre taramaktan kaçınmaya çalışın.
- Mikro ışınlama için istediğiniz ilgi bölgesini (ROI) ayarlayın. İlişkili yazılımı kullanarak (bkz. Malzeme Tablosu),önce ikili satırlar ekleyerek istediğiniz yatırım getirisini ayarlayın (istenen satır sayısını ve aralığı ayarlayın). İkili'yi tıklatın, sonra Satır ekle'yi tıklatın| Daire | İstenen sayıda çizgi çizmek için elips.
- Bu ikili satırları ROI'lere dönüştürün ve son olarak bu ROI'leri stimülasyon ROI'lerine dönüştürün. Bunu yapmak için, önce yatırım getirisinitıklatın, sonra İkili'yi yatırım getirisine taşı 'yıtıklatın, sonra ROI'lerden herhangi birine sağ tıklayın ve Uyarılma Yatırım Getirisi Olarak Kullan: S1'i seçin. Hücrelerin çekirdeğinden geçmek için bu çizgileri FOV'a yerleştirin. Protokol boyunca tüm FOV'u kapsayan 1024 piksel uzunluğundaKI ROI'ler kullanıldı.
5. İmmünofluoresans boyama veya zaman atlamalı görüntüleme için mikro ışınlama.
- En uygun mikro ışınlama ayarlarını belirleme.
- Hücrelerin mikro ışınlanından önce, daha sonra analiz için PCNA odaklarını tanımlamak için FOV'un daha yüksek çözünürlüklü bir görüntüsünü alın. Sıralı tarama yerine, iki dalga boyunda tarama arasında hücre hareketini önlemek için kullanılan her iki optik kanalı da (yeşil ve kırmızı) aynı anda kaydedin. Odakların doğru çözünürlüğü için 1x yakınlaştırma (burada kullanılan görüntüleme sisteminde 0,29 μm piksel boyutu), 2x ortalama ile 1/8 kare/s tarama hızı (4,85 μs/piksel) ile en az 1024 x 1024 piksel/alan çözünürlüğü kullanın. Bu parametreler A1 LFOV Compact GUI ve A1 LFOV Tarama Alanı pencerelerinde ayarlandıktan sonra, FOV'u kaydetmek için Yakala düğmesine basın.
NOT: Karşılaştırılabilir sonuçlar elde etmek için denemeler boyunca aynı piksel boyutunu korumak önemlidir. - Mikro ışınlamayı ayarlamak için, Zaman çizelgesi (A1 LFOV / Galvano Cihazı) penceresine erişmek için görüntüleme yazılımındaki ND Stimülasyon sekmesini açın. Bu, bir dizi ön stimülasyon görüntüsü elde etmek, uyarmak (LUN-F 50 mW 405 nm FRAP lazer kullanarak) ve ardından galvano tarayıcılarını kullanarak tekrar bir dizi uyarım sonrası görüntü elde etmek için galvano tarayıcılarını kullanır. İlk olarak Zaman çizelgesi penceresinde üç aşama ayarlayın. Acq/Stim sütununda Edinme | Beyazlatma | Sırasıyla üç aşama için alım. Ağartma aşaması için S1'i yatırım getirisi olarak ayarlayın.
NOT: Burada sunulan deneyde stimülasyon aşamasında herhangi bir görüntü elde edilmiştir. - Galvano XY penceresinde,mikro ışınlama için temel faktörleri ayarlayın: 405 nm lazer güç çıkışı, bekleme süresi (yineleme bu sistemde varsayılan olarak 1'dir). Burada sunulan deneylerde hücreler 405 nm FRAP lazer (fiber uçta 50 mW) ile %100 güç çıkışında 1000-3000 μs durma süresi ile ışınlandı.
NOT: Lazer bekleme süresi piksel bazında olduğundan, piksel boyutu aynı kaldığı sürece, bekleme süresi ve güç yoğunluğu arasındaki ilişki farklı FOV'lar arasında karşılaştırılabilir olacaktır. Şekil 2A, belirli hasar indüksiyonu için lazer güç ayarlarını optimize etmek için DNA hasar yanıtı (DDR) yolak spesifik proteinlerinin (DSB'ler için FBXL10 ve oksidatif baz hasarı için NTHL1) kullanımını göstermektedir. Bu stabil hücre hatları, protokolün 2.
- Hücrelerin mikro ışınlanından önce, daha sonra analiz için PCNA odaklarını tanımlamak için FOV'un daha yüksek çözünürlüklü bir görüntüsünü alın. Sıralı tarama yerine, iki dalga boyunda tarama arasında hücre hareketini önlemek için kullanılan her iki optik kanalı da (yeşil ve kırmızı) aynı anda kaydedin. Odakların doğru çözünürlüğü için 1x yakınlaştırma (burada kullanılan görüntüleme sisteminde 0,29 μm piksel boyutu), 2x ortalama ile 1/8 kare/s tarama hızı (4,85 μs/piksel) ile en az 1024 x 1024 piksel/alan çözünürlüğü kullanın. Bu parametreler A1 LFOV Compact GUI ve A1 LFOV Tarama Alanı pencerelerinde ayarlandıktan sonra, FOV'u kaydetmek için Yakala düğmesine basın.
- Zaman atlamalı görüntüleme.
- Zaman çizelgesini, A1 LFOV Compact GUI'yi ve A1 LFOV Tarama Alanı pencerelerini kullanarak istenen zaman aralığı penceresi ve aralıkları için zaman atlamalı görüntüleme ayarlayın. Burada sunulan deneylerde, EXO1b ve PCNA'nın işe alımı 12 dakika boyunca görüntülendi, FOV'u her 5 saniyede bir, 1024 x 1024 piksel/alanda, fotoğraf ağartma hızını (1,45 μs/piksel) ortalama olmadan 0,35 kare/s tarama hızıyla 1x yakınlaştırma (burada kullanılan görüntüleme sisteminde 0,29 μm piksel boyutuyla sonuçlanır) kullanarak taramak.
- A1 LFOV Compact GUI penceresinde görüntüleme sırasında fotoğraf ağartma azaltmak için lazer gücü %, kazanç ve ofset ayarlarını optimize edin. Hem İçN hem de PCNA'yı ölçmeyi hedefliyorsanız, alanı iki ayrı florofor için tarama arasında hücre hareketini önlemek için sıralı tarama yerine eşzamanlı tarama kullanın.
- Görüntüleme sistemi aşağıdaki ayarlarla kullanılmıştır. 488 nm lazer hattı (20 mW): % 7 lazer gücü, kazanç: 45 (GaAsP dedektörü) ile ve 2 ofset, 561 nm lazer hattı (20 mW): 4% lazer gücü, 40 kazanmak (GaAsP dedektörü) ile ve ofset 2.
- Proteinin kinetiğine bağlı olarak, görüntüler arasındaki aralığı veya toplam zaman aşımı süresini uzatın veya kısaltın. Zaman Çizelgesi penceresinde, üçüncü aşama Edinme satırı için istediğiniz Aralık ve Süre'yi ayarlayın.
- Mikro ışınlamayı ve sonraki zaman atlamalı görüntülemeyi yürütmek için Şimdi çalıştır'a basın.
- Zaman atlamalı görüntülemenin sonunda, stimülasyon ROI'lerini ayrı görüntüler olarak kaydedin, bu da analiz için kullanılan herhangi bir aşağı akış yazılımında mikro ışınlama koordinatlarını tanımlamak için yararlı bir yardımcı olacaktır.
- İmmünofluoresans lekesi.
NOT: Adım 5.1.3 ve Şekil 2A, mikro ışınlama ile ortaya konan DNA lezyonlarının türlerini değerlendirmek için bilinen DNA onarım proteinlerinin kullanımını göstermektedir. Bazı DNA lezyonları, hücreleri sabitledikten sonra spesifik antikorlar kullanılarak da tespit edilebilir. Endojen proteinin antikor tespiti ile İçN'nin işe alımını tespit etmek de mümkündür. DSB'leri kontrol etmek için φH2A.X görselleştirmesi aşağıda gösterilmiştir (Şekil 2B). Şekil 3, hem endojen hem de eksojen etiketli PCNA için hücre döngüsü boyunca PCNA lokalizasyonu ve işe alım tutarlılığını göstermektedir.- 5.1.3 adımından sonra, mPlum-PCNA'nın işe alımına dayalı uygun FRAP olayını sağlamak için mikro ışınlamadan sonra sadece bir görüntü alın. İmmünofluoresan etiketlemeden sonra alanı bulmak için FOV'un tam koordinatlarını not alın.
- Hücre kültürü odasını mikroskoptan alın ve 5-10 dakika boyunca% 5 CO2 içeren nemli bir atmosferde 37 ° C'de hücreleri kuluçkaya yatırın.
NOT: Paraformaldehit (PFA) toksiktir ve iyi havalandırılmış bir alanda veya duman kaputunda çalışma yapılmalıdır. Sonraki tüm yıkama ve inkübasyon, 4 kuyu haznesi kaydırasında 0,5 mL hacimlerle yapılacaktır. Kuluçka süresinden sonra, hücreleri 0,5 mL PBS (137 mM NaCl, 2,7 mM KCl, 8 mM Na 2 HPO4ve2mM KH2PO4)ile yıkayın ve oda sıcaklığında (RT) 10 dakika boyunca PBS'de% 4 PFA'nın 0,5 mL'si ile sabitlayın. - Hücreleri PBS ile bir kez yıkayın, ardından artık PFA'yı söndürmek için 50 mMNH 4Cl ile yıkayın.
- PBS'de %0,1 Triton X-100 ile RT'de 15 dakika boyunca hücrelerin dengesini bozun.
- Örnekleri bloke tamponu ile 1 saat boyunca engelleyin (PBS'de % 5 FBS, % 3 BSA, % 0.05 Triton X-100).
- Engelleme solüsyonını çıkarın ve seyreltilmiş birincil antikoru (anti-φH2A.X, 1:2000) RT'de 1 saat boyunca engelleme tamponu içine ekleyin.
- Kuyuları 3 x 10 dk blokaj tamponu ile yıkayın.
- RT'de 1 saat boyunca engelleme arabelleğine seyreltilmiş ikincil antikor (anti-fare Alexa 488 Plus konjuge, 1:2000) ekleyin.
- Kuyuları 3 x 10 dk blokaj tamponu ile yıkayın.
- Pbs'de 15 dakika boyunca 1 μg/mL DAPI çözeltisi ile çekirdeği karşı saldırıya edin.
- Hücreleri PBS ile bir kez yıkayın. Görüntüleme, fotobleachingi azaltmak için doğrudan PBS veya antifade reaktifli bir PBS çözeltisinde (örneğin, AFR3) gerçekleştirilebilir.
6. İşe alım analizi
NOT: Şekil 4A, DMSO veya olaparib varlığında Exo1b ve PCNA işe alımlarının temsili görüntülerini göstermektedir. Şekil 4B, veri analizi için temsili bir görüntü göstermektedir. Ortalama floresan değerleri, Fiji kullanılarak farklı zaman noktalarında mPlum-PCNA (A, sarı dikdörtgenler) tarafından vurgulanan lazer izi boyunca bir dikdörtgen kullanılarak ortalama AcGFP yoğunlukları ölçülerek hesaplanmıştır. PCNA, yatırım getirisi koordinatları boyunca başarılı ışınlamayı vurgulamak için dahili bir kontrol görevi görebilirsiniz. Benzer şekilde, çekirdeğin hasarsız bölgeleri (B, mavi dikdörtgenler) için ortalama AcGFP floresan değerleri de hesaplanmıştır. Arka plan sinyal yoğunluğu nüfussuz alanlarda (C, kırmızı dikdörtgenler) ölçüldü ve ortalama floresan değerlerden(Şekil A ve B)çıkartıldı. Bu nedenle, her veri toplama noktası için göreli ortalama floresan birim (RFU), RFU = (A − C)/ (B − C)8,9denklemi ile hesaplanmıştır. Mikro ışınlama bölgesinin elde edilen RFU değerleri, mikro ışınlamadan önce RFU değerlerine normalleştirilir.
- Mikro ışınlanmış bölgenin A bölgesini tanımlamak için, hücrenin nükleoz bölgeleri, replikasyon odakları ve düzensiz nükleer bölgelerini ölçümden hariç tutun. İki ayrı bölgeyi tek olarak gruplamak için Fiji'de iki ROI çizme arasında shift tuşunu basılı tutun.
NOT: Protein alımı farklı genler ve ışınlama koşulları arasında değişecektir; bu nedenle, A bölgesinin büyüklüğü ayrı ayrı belirlenmelidir. A bölgesinin piksel genişliği belirlendikten sonra, karşılaştırmalı işe alımlar için sabit kalmalıdır. Burada sunulan deneylerde 7 piksel genişliğinde dikdörtgenler kullanılmıştır. - Kaydedilen videolar süresince hareket eden hücreleri analizden hariç tutun. Son derece mobil hücreleri dahil etmek için, açıklanan analiz kare kare yapılmalıdır.
- İşe alım profilini görselleştirmek için, istatistiksel bir yazılım kullanarak normalleştirilmiş RFU değerlerini zamana karşı çizin.
- Mann-Whitney testi kullanarak DMSO ve olaparib (n=31) tedavisi arasındaki farkı belirtilen bir zaman noktasında hesaplayın.
Representative Results
Hücreler, her DNA lezyon türünü, hangi hücre döngüsü evresinde olduklarına da bağlı olarak belirli bir şekilde ele haline gelir. Örneğin, mikro ışınlamadan sonra, çift iplikli kesmeler (DSB), hücre döngüsü aşamasına bağlı olarak homolog olmayan uç birleştirme (NHEJ) veya İk tarafından işlenir. Hücre döngüsünün S ve G2 aşamalarında en yoğun şekilde hareket eden nükleazlar, uygun İk için çok önemli olan DNA çıkıntları oluşturur. S fazındaki hücrelerin değerlendirilmesini teşvik etmek için PCNA tek renkli hücre döngüsü işaretleyicisi olarak kullanıldı. Şekil 1A, hücre döngüsü ilerlemesi sırasında mPlum-PCNA'nın yerelleştirme profilini gösterir. PCNA, G1 ve G2 fazında çekirdekte tamamen homojen bir dağılım vardır (aynı zamanda çoğunlukla çekirdeklerden dışlanmıştır). S fazında, PCNA çekirdekte parlak noktalar olarak görselleştirilebilen DNA replikasyon bölgelerine lokalize olur. Erken S faz hücrelerinde, lekeler nispeten küçüktür ve hücrenin çekirdeği boyunca eşit olarak dağılmıştır. Orta S fazına doğru ilerleyen lekeler bulanıklaşır ve çekirdeğin ve çekirdeğin çevresine doğru daha fazla lokalize olur. Geç S aşamasında, noktalar sayıca azalır, ancak PCNA geç çoğaltma sitelerinde yoğunlaştıkça giderek daha büyük hale gelir (Şekil 1B). Daha da önemlisi, pBABE vektör omurgasından eksojen PCNA ekspresyonu endojen seviyelerden daha azdı, ancak hücre döngüsü ilerlemesi ve DDR'deki potansiyel eserleri en aza indiren mikroskopi ile tespit için yeterliydi. Şekil 1C, PCNA aşırı ifadenin endojen seviyelere göre kapsamını göstermektedir. mPlum-PCNA'ya karşılık gelen bandın daha büyük boyutu nedeniyle daha yavaş geçiş yaptığını lütfen unutmayın.
S evresinde bu lezyonlara PARP1/2 bağımlı EXO1b alımını araştırmak için mikro ışınlama sırasında DSB'leri tanıtmayı amaçladık. Şekil 2A, düşük dozda enerjinin (1000 μs durma süresi) EGFP-FBXL10'un işe alınmasına neden olmadığını göstermektedir, bir DSB yanıtlayıcısı (FRUCC kompleksinin bileşeni 8), bir baz eksizyon onarımı (BER) yol proteini olan NTHL1-mCherry'nin işe alımını teşvik etmek için yeterliyken, oksidatif DNA hasarı bölgelerine işe alım10,11,12. 3000 μs'de, hem EGFP-FBXL10 hem de NTHL1-mCherry işe alım, hem oksidatif lezyonlar hem de DSB'ler üreten bir lazer çıkışı gösterir. PCNA, her iki lazer bekleme süresi ayarıyla da yeterince işe alım yaptığı için hem hücre döngüsü işaretleyicisi hem de başarılı mikro ışınlama için bir işaretleyici görevi görür. Daha da önemlisi, bu muhabir işlevi için hem eksojen hem de/veya endojen floresan protein etiketli PCNA benzer şekilde davranarak kullanılabilir (Şekil 3). Endojen olarak etiketlenmiş PCNA, mRuby'yi PCNA locus13'ün bir alelesine ilk ekson ile çerçeveye yerleştirerek tasarlanmıştır (hücre hattı Jörg Mansfeld'in nazik bir hediyesiydi).
Şekil 4A ve Şekil 4C, S faz hücrelerinde ACGFP etiketli EXO1b'nin işe alımını göstermektedir. EXO1b, mikro ışınlama bölgelerinde yaklaşık 1 dakika boyunca maksimum birikim seviyesine ulaşır ve daha sonra yavaşça DNA lezyonlarından ayrılmaya başlar. Mikro ışınlama alanlarındaki zenginleştirmeler, grafikte > 1 göreli floresan birimi ile gösterilir. Olaparib varlığında, 1 dakikada lazer şeritte EXO1b birikimi araç kontrolüne göre önemli ölçüde daha azdır. Bu sonuçlar literatür6,7 ileuyulur. Şekil 4B, protokoldeki 6. Şekil 4D, mikro ışınlama için kullanılan hücrelerde endojen EXO1b ve eksojen EXO1b-AcGFP'nin karşılaştırılabilir ifade düzeylerini göstermektedir.
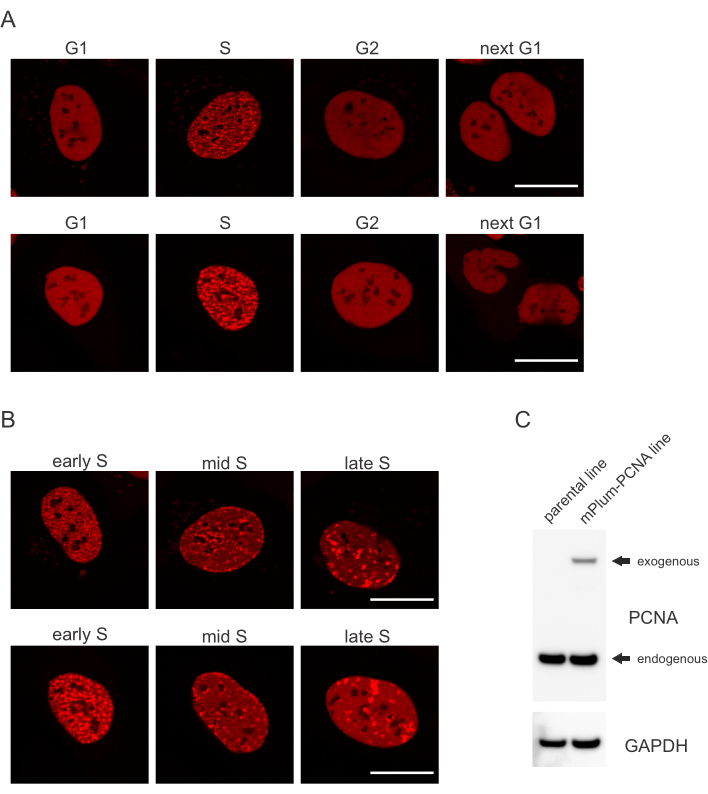
Şekil 1: PCNA'nın yerelleştirme deseni. (A) Görüntüler, U-2 işletim sistemi hücrelerindeki hücre döngüsü boyunca stably entegre, eksojen PCNA'nın lokalizasyon modelini göstermektedir. (B) Görüntüler, U-2 işletim sistemi hücrelerinde S fazının farklı aşamalarında (erken, orta ve geç) PCNA odak desenlerini gösterir. (C) Görüntüleme için kullanılan U-2 işletim sistemi hücrelerinde endojen ve eksojen PCNA seviyelerini gösteren batı lekesi. Ölçek çubuğu 20 μm'yi temsil eder.

Şekil 2: Optimize edilmiş lazer güç çıkışı ile DSB'lerin indüksiyonu. (A) Lazer ayarları farklı DNA hasarı formlarına neden olacak şekilde optimize edilebilir. Sırasıyla DSB'leri ve oksidatif lezyonların bölgelerini tanımlamak için hem EGFP-FBXL10 hem de NTHL1-mCherry'yi saptayarak ifade eden U-2 OS hücreleri kullanıldı. 405 nm lazer hattı ile mikro ışınlama, 1000 μs veya 3000 μs durma süresine sahip asenkron U-2 işletim sistemi hücrelerinde gerçekleştirildi. Ölçek çubuğu 20 μm'yi temsil eder. (B) φH2A.X'e karşı immünofluoresan boyama, mRuby etiketli endojen PCNA'ya sahip insan retina pigment epitel hücrelerine (hTERT RPE-1) yapıldı. Hücreler mikro ışınlamadan 5 dakika sonra 1000 μs veya 3000 μs durma süresi ile sabitlendi ve işlendi. Ölçek çubuğu 20 μm'yi temsil eder.

Şekil 3: Endojen mRuby-PCNA ve eksojen mPlum-PCNA'nın 1000 μs veya 3000 μs lazer bekleme süresinde mikro ışınlama alanlarına benzer işe alımı. S fazı sırasında hem endojen hem de eksojen etiketli PCNA form replikasyon odakları. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: PARP1/2-bağımlı EXO1b S aşamasında işe alım. EXO1b-AcGFP ve mPlum-PCNA'yı saptayarak ifade eden U-2 işletim sistemi hücreleri, 3000 μs durma süresi kullanılarak 405 nm FRAP lazer hattı ile mikro ışınlandı. (A)Araç kontrolü (DMSO) veya olaparib (1 μM) ile ön işlemden sonra belirtilen zaman noktalarında mikro ışınlanmış hücrelerin temsili görüntüleri. Ölçek çubuğu, işe alım analizi için A,Bve C alanlarının tanımlanmış bölgelerinin 20 μm. ( B ) Temsili görüntülerini temsil eder. Ölçek çubuğu 20 μm'yi temsil eder. (C) DNA hasarı işe alım dinamikleri canlı hücre görüntüleme ile yakalandı. Göreceli ortalama floresan değerleri ve görüntüleri 12 dakika boyunca her 5 sn elde edildi. Her durum için ≥30 hücre değerlendirildi. Ortalama göreli floresan değerleri (düz siyah çizgiler) ve standart hata (gölgeli bir alanla görselleştirilmiş aralık) zamana göre çizildi. Kesikli çizgi, mikro ışınlamadan sonra işe alım değerlerini 1 dakikada gösterir. DMSO (n=32) ve olaparib (n=31) tedavisi arasındaki fark Mann-Whitney testi kullanılarak hesaplandı. Asterix, s<0.0001'i belirtir. (D) Batı blot mikro ışınlama için kullanılan hücrelerde endojen EXO1b ve eksojen EXO1b-AcGFP ifade düzeylerini karşılaştırır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Discussion
Kritik adımlar ve olası protokol sorun giderme/değişiklikleri
Mikro ışınlama için uygun doku kültürü damarı başarı için kritik öneme sahiptir. Çoğu yüksek çözünürlüklü görüntüleme sistemi 0,17 mm kapak camı kalınlığı için optimize edilmiştir. Daha yüksek veya daha düşük kalınlıklı görüntüleme odaları veya plastik polimerlerden yapılmış olanları (405 nm görüntüleme için optimize değildir) kullanmak görüntü kalitesini önemli ölçüde azaltabilir. Cam yüzeyleri kullanırken, hücre yapışmasını arttırmak için doku kültürüne göre işlem gördüğünden emin olun. Doku kültürü tedavi edilmezse, bu odaların, örneğin hücrelerin tohumlamadan önce poli-D lizin ile kaplanması gerekecektir. Hücreleri odalı örtü örtüsüne kaplarken, hücre döngüsü düzensizliklerini ve hücrelere ek stresi önlemek için ideal hücre yoğunluğu çok önemlidir. Kararlı bir sıcaklığı korumak için deneyden önce mikroskop bileşenlerinin uygun termal dengelenmesi, hem odağın zaman atlamalı görüntüleme boyunca korunması için çok önemlidir hem de zaman ve numuneler arasında homojen bir DDR sağlamak için de gereklidir.
Artekter verileri azaltmak için hücrelerin mikro ışınlamadan önce sağlıklı bir durumda olması önemlidir. Hücrelerin enfeksiyon sonrası/seçim sonrası düzensiz morfolojisi varsa, morfoloji normale dönene kadar hücrelerin birden fazla geçitten ilerlemesine izin verin. Her zaman kullanılan hücre hatlarının mikoplazma kontaminasyonundan arındırılmış olduğundan emin olun. Mikoplazma enfeksiyonunun birçok olumsuz etkisi arasında, konak hücrelerde DNA hasarına neden olur ve DDR yollarını etkileyebilir14,15. Hücre kültüründe mikoplazmayı tespit etmenin en hassas yolu PCR 'dir (DAPI veya Hoechst ile algılamaya karşı).
İlgi çekici onarım proteininin optimal aşırı ekspresyonu, endojen seviyelerle karşılaştırılabilir, ancak tespit için yeterince yüksek olmalıdır. Viral vektörlerde kullanılan promotör, enfeksiyon sırasında viral titre ve enfeksiyon süresinin uzunluğu ideal ifade seviyeleri için ayarlanabilir. Tutarlı sonuçlar için, homojen ifade düzeylerini ve normal hücre morfolojisini sağlamak için tek tek hücre klonlarını izole edin. Uygun hücre döngüsü ve DNA onarım işaretleyici işlevi için etiketli PCNA'yı endojen seviyelerden daha yüksek bir seviyede aşırı ifade etmeyen vektör yapılarının kullanılması önerilir. Düşük PCNA aşırı ifade seviyeleri bile S faz hücrelerini ayırt etmek için yeterlidir. Retroviral pBABE vektörleri bu amaçla başarıyla kullanılmıştır (Addgene #1764, #1765, #1766, #1767). PCNA, herhangi bir monomerik kırmızı(örneğin, mPlum, mCherry, mRuby, vb.) veya monomerik yeşil floresan proteinlerle (örneğin, mEGFP, AcGFP, mWasabi, mNeonGreen, mEmerald, vb.) etiketlenebilir ve daha sonra dönüşümlü olarak etiketlenmiş bir POI ile birleştirilebilir. Floresan etiketli bir İçN'yi aşırı ifade etmenin bazı sınırlamaları ve dikkat edilmesi gereken noktalar vardır. Floresan etiketler normal protein fonksiyonunu ve lokalizasyonunu bozabilir. Bu nedenle, etiketin konumu (N veya C terminali) dikkate alınmalıdır. Monomerik olmayan varyantların oligomerizasyonu İçN'nin işlevini etkileyebileceğinden, her zaman monomerik floresan proteinler kullanın.
Optik yolun birçok bileşeni hücrelere teslim edilen gerçek gücü etkileyeceğinden, lazer ayarları her görüntüleme sistemi için belirlenmelidir. Lazer mikro ışınlama, heyecan dalga boyuna, FRAP lazerinin güç çıkışına ve önceden duyarlı ajanların (Bromodeoxyuridine veya Hoechst gibi) kullanılıp kullanılmadığına bağlı olarak çeşitli DNA lezyonlarına neden olabilir. 405 nm lazerler oksidatif DNA hasarına neden olabilir, tek ve çift iplikli kırılmalar16,17. Daha yüksek lazer çıkış ayarları kullanılarak, DSB miktarı artar. Bu protokolde ön duyarlılık yöntemleri kullanılmamıştır, ancak bu teknikler literatürde büyük ölçüde ele alınmıştır ve aşağıdaki tartışmada yeniden kaplanmıştır. Bize göre, istenen lezyonun üretilip üretilmemelerini test etmenin en iyi yolu, bilinen DNA hasar yolu spesifik genlerinin işe alımını test etmektir. BER yolunun bileşenleri olan NTHL1 veya OGG1'in işe alınması, oksitlenmiş DNA bazları10 , 11,17,18,19'unindüksiyonunu önerirken, FBXL10 veya XRCC5 DSB 8 ,20,21'invarlığını gösterir. XRCC1'in işe alımı hem oksitlenmiş DNA bazlarının varlığını hem de tek iplikli kırılmaları (SSB)22,23gösterebilir. XPC (yani RAD4), ultraviyole ışık (UV)17,24tarafından üretilen hacimli DNA eklerini kaldıran iyi bir NER göstergesidir. Eksojen proteinlerin işe alınması bazı düzensizliklere neden olabileceğinden, endojen DNA onarım proteinlerinin veya belirteçlerinin immünofluoresan lekelenmeleri (çift iplikli molalar için φH2A.X gibi) spesifik DNA lezyonlarının varlığını doğrulayabilir. Alternatif olarak, belirli DNA lezyonlarına karşı yetiştirilen antikorlar da kullanılabilir. Teslim edilen lazer gücünü ayarlamak için hem durma süresi hem de lazer gücü değiştirilebilir.
Matematiksel modelleme yardımıyla, İçN'nin işe alım özellikleri hakkında değerli içgörüler sağlayabilecek ayrıntılı bir kinetik analiz yapılabilir (örneğin, birden fazla DNA bağlayıcı etki alanının katkısı, farklı sinyal olaylarına duyarlılık vb.). Otomatik işe alım değerlendirmesi ve hücre takibi, sağlam iş akışları oluşturmak için birleştirilebilir 1,25.
DNA ön duyarlılığının avantajları ve sınırlamaları
Mikro ışınlamadan önce DNA'nın önceden duyarlı hale getirilmesi, DNA onarım proteini alımı için yaygın olarak kullanılan bir araçtır16,17. Dna'yı mikro ışınlamadan önce hassaslaştırmak DSB'lere karşı daha hassas hale gelir. DNA ön duyarlılığı için en yaygın iki yöntem Bromodeoxyuridine (BrdU) veya Hoechst boyası ile hücrelerin ön tedavisidir. Yüksek lazer güçlerinde mikro ışınlama yapamayan sistemler için, bu yöntemler DSB'ler gibi DNA lezyonlarını indükleme için gerekli olabilir. Ayrıca, iletilen bir ışık dedektörünün veya hücre çekirdeğini vurgulayan bir floresan sinyalin yokluğunda (örneğin, etiketlenmemiş endojen DNA onarım proteinlerinin alımını incelerken), Hoechst hem önceden hassaslaştırıcı bir araç hem de floresan bir nükleer leke görevi görür. Bununla birlikte, DNA ön duyarlılığı önemli komplikasyonlar ortaya getirebilir. BrdU (10 μM'lik son konsantrasyonda kullanılır), DNA'ya düzgün bir şekilde dahil olmak için hücrelere 24 saat (veya kullanılan hücre hattındaki tam hücre döngüsüne eşdeğer bir süre) eklenmelidir ve hücre döngüsü parazitine neden olabilir26. Hoechst 33342 (1 μg/mL'lik son konsantrasyonda kullanılır) uzun kuluçka dönemlerinden sonra sitotoksiktir, ancak çekirdeği boya ile doyurmak için yeterli zaman gerektirir. Bu nedenle, mikro ışınlamadan sadece 15-20 dakika önce uygulanmalıdır; aksi takdirde, işe alım verileri tutarlı olmayacaktır. Bu şekilde boyanmış hücreler birkaç saatten fazla kültürde tutulamaz27,28. Hoechst 33342 boyası kadar hücre geçirgen olmayan Hoechst 33358'i kullanmamaya dikkat edin. Ön duyarlılık ayrıca deneyler arasında gereksiz farklılıklar ortaya çıkarır ve deneyi hücre yoğunluğundaki farklılıklara karşı daha da hassas hale getirir (çünkü bu, birikmiş boya / hücre miktarını etkileyecektir).
Konfokal mikroskopinin avantajları ve sınırlamaları
Konfokal mikroskopinin görüntüleme hızı geniş alan mikrokroskopisi ile karşılaştırıldığında sınırlayıcı olabilir. Bununla birlikte, rezonans tarayıcı ile donatılmış bir konfokal mikroskop, dönen disk mikroskopi hızlarına yaklaşan görüntüleme hızını (çözünürlük pahasına) inanılmaz derecede artırabilir. Üç özellik, A1R HD25 konfokal sistemi burada sunulan protokol için mükemmel bir seçim haline getirir. İlk olarak, sistemin 25 mm FOV'u, tek bir taranmış alanda (normal kurulumlarda 5-10 hücreye karşı) 15-20 hücre arasında görüntü oluşturmayı mümkün kılar ve istatistiksel analiz için yeterli hücre elde etmek için gerekli kazanım sayısını sınırlar. İkincisi, FRAP modülü ve iki scanhead, hücreleri yalnızca ardışık olarak değil, aynı anda görüntülemeyi ve mikro ışınlanmayı mümkün kılır. Son olarak, hem rezonans hem de galvano tarayıcılara sahip olma esnekliği, floroforların söndürülmesine en aza indiren olağanüstü hıza sahip yüksek zamansal çözünürlüklü görüntüleme ile daha yüksek sinyal-gürültü oranına sahip görüntüler üretmek için daha yavaş tarama hızlarını kullanan yüksek uzamsal çözünürlüklü görüntüleme arasında kolayca geçiş yapma olanağı sağlar. Kullanılan sistem yukarıda belirtilen esnekliğe izin verirken, daha yaygın olarak bulunan konfokal mikroskop konfigürasyonlarına benzemesi için, sunulan deneylerde (hem mikro ışınlama hem de sonraki görüntüleme için) sadece galvano tarayıcı kullanılmıştır.
Mikro ışınlamanın avantajları ve sınırlamaları
Mikro ışınlama rakipsiz mekansal ve zamansal çözünürlük sağlarken, sınırlamasız değildir. Lazer mikro ışınlama ile DNA hasarı, doğal olarak meydana gelen zarar verici ajanlara kıyasla çekirdeğin belirli bölgelerine yüksek oranda kümelenmiştir. Bu nedenle, mikro ışınlama nedeniyle kromatin yanıtı homojen olarak dağıtılmış hasara göre farklılık gösterebilir. Ek olarak, mikro ışınlama zaman alıcıdır ve sadece birkaç düzine hücre üzerinde yapılabilirken, büyük popülasyon bazlı biyokimyasal yöntemler (kromatin fraksiyonasyonu, immün önkoşulasyon, ChIP) aynı anda binlerce hücreyi inceleyerek daha fazla sağlamlık sağlayabilir. Mikro ışınlama ile yapılan gözlemlerin geleneksel biyokimyasal tekniklerle doğrulanması güvenilir sonuçlar için etkili bir stratejidir. Belirli bir FOV'daki birçok hücrenin aynı anda mikro ışınlanması mümkün olsa da, görüntüleme sisteminin görevi yerine getirmek için daha fazla zamana ihtiyacı olacaktır. Bu nedenle, DNA lezyonlarına çok hızlı bir şekilde katılan proteinlerin dinamiklerinin ölçülmesi, aynı anda kullanılan mikro ışınlama için olası ROI sayısını sınırlar. Bu protokol için kullanılan görüntüleme sisteminde, tek bir 1024 piksel uzunluğundaki yatırım getirisinin mikro ışınlanması, 1000 μs bekleme süresi kullanılarak 1032 ms ve tamamlanması için 3000 μs bekleme süresi kullanılarak 3088 ms sürer. Birden fazla ROI satırı kullanmak mikro ışınlamayı bitirmek için gereken süreyi önemli ölçüde artıracaktır (örneğin, 7 x 1024 piksel uzunluğunda yatırım getirisi, 1000 μs bekleme süresi kullanarak 14402 ms ve 3000 μs bekleme süresi kullanarak 21598 ms sürer). Bu süre görüntü alımından kaybolur ve dikkate alınmalıdır. Hızlı işe alım olaylarını görüntülerken, mümkün olan en kısa yatırım getirisini kullanın ve aynı anda yalnızca bir hücreyi mikro ışınlayın.
Senkronizasyon yöntemlerine göre avantajlar ve sınırlamalar
Hücre döngüsüne özgü çalışmalar için, mevcut yöntemler ya hücrelerin belirli hücre döngüsü aşamalarına eşitlenmesini ya da hücrenin belirli hücre döngüsü aşamasını tanımlamak için floresan muhabirlerin kullanılmasını içerir. Ancak, bu yöntemlerin her biri kendi zorluklarını ve sınırlamalarını sağlar.
FUCCI sistem3 (CDT1 ve Geminin floresan protein etiketli kesilmiş formlarına dayanarak) hücre döngüsü çalışmaları için özellikle yararlı bir araçtır, ancak hücre döngüsünün S ve G2 aşamaları arasında ayrım yapma konusunda sınırlamaları vardır. Geminin seviyeleri zaten orta S fazından yüksektir ve M fazı olana kadar yüksek kalır, bu da bu aşamaların ayrılmasını zorlaştırır. FUCCI sisteminin kullanılması, İçN'yi görüntülemek için mikroskobun iki optik kanalının kullanılamayacağı anlamına da gelir.
Kanser dışı hücre hatları, serumda bulunan büyüme faktörlerinin (serum açlığı) uzaklaştırılmasıyla G0'ye senkronize edilebilir ve hücrelerde çok az DNA hasarına neden olabilir veya hiç DNA hasarına neden olmaz. Bununla birlikte, çoğu kanser hücresi hattı, ortamlarında yeterli miktarda serum olmasa bile hücre döngüsü boyunca kısmen ilerlemeye devam edecektir. Ayrıca, hücreler G1'in sonlarına, erken S aşamasına kadar senkronizasyonu kısmen kaybetmeye başlar. Serum açlığı ek olarak, hücre döngüsü senkronizasyonu elde etmek için çok sayıda kimyasal yöntem vardır. Hidroksiüre, aphidicolin ve timidin blokları, hücreleri erken S fazına senkronize etmek için DNA replikasyonunu durdurma yöntemleridir. Bu yöntemler ucuz ve basit olsa da, DNA hasarına neden olan çoğaltma stresi ortaya çıkarandır. Bu DNA replikasyon inhibitörlerinin H2A'nın fosforilasyonunun indüklendiğini göstermiştir. X, DSBs 2,29'uniyi bilinen bir işareti. S fazlı hücreler için bir işaretleyici olarak etiketli-PCNA kullanma yöntemi, kimyasal senkronizasyonun neden olduğu eserler için potansiyeli azaltır ve serum açlığına kıyasla çok çeşitli hücre hatlarına uygulanabilir.
Son
DNA hasarı, mutajenik lezyonların hücrelerin kötü huylu dönüşümüne yol açabileceği genetik hastalıklar için itici bir güçtür. DNA sentez makinelerinin hedeflenmesi, kanser gibi hiperproliferatif hastalıkların tedavisinde temel bir terapötik stratejidir. Bu hastalıkları daha hedefli bir şekilde tedavi etmek için DNA lezyonlarını onaran proteinlerin daha iyi anlaşılmasına ihtiyacımız vardır. Burada açıklanan protokol, olası eserleri azaltmak ve deneylerin tekrarlanabilirliğini artırmak için geleneksel senkronizasyon yöntemlerinin sunduğu zorlukları en aza indirerek S aşamasında mikro ışınlama tabanlı çalışmalara yardımcı olur.
Disclosures
Yazarlar, sunulan eserin yayınlanmasının Nikon Corporation tarafından desteklendiğini belirtmiştir. Yazarlar rakip çıkarların olmadığını beyan eder.
Acknowledgments
Yazarlar M. Pagano'ya sürekli desteği için ve D. Simoneschi, A. Marzio ve G. Tang'a makaleyi eleştirel incelemeleri için teşekkür eder. B. Miwatani-Minter, R. Miwatani ve B. Minter'e sürekli destekleri için teşekkür ediyor. G. Rona, K. Ronane Jurasz ve G. Rona'ya sürekli destekleri için teşekkür ediyor.
Materials
| Name | Company | Catalog Number | Comments |
| Ammonium chloride | Sigma-Aldrich | A9434-500G | For quenching formaldehyde |
| Anti-EXO1 Rabbit Polyclonal Antibody | Proteintech | 16253-1-AP | primary antibody |
| Anti-phospho-Histone H2A.X (Ser139) Antibody, clone JBW301 | Millipore | 05-636 | primary antibody |
| Bovine Serum Albumin | Sigma-Aldrich | 3117332001 | BSA for blocking |
| BrdU (5-Bromo-2'-deoxyuridine) | Merck | 19-160 | pre-sensitizing agent |
| Citifluor™ Mountant Solution AFR3 | Electron Microscopy Sciences | 17973-10 | antifade containing PBS solution for imaging |
| DAPI | Sigma-Aldrich | D9542-1MG | nucleic acid stain |
| DMEM Medium | Thermo Fisher Scientific | 10569010 | Cell culture medium for HEK293T cells |
| DMSO | Sigma-Aldrich | D2650-100ML | Vehichle control and dissolution solvent |
| EGFP-FBXL10 | Addgene | #126542 | viral expression vector for EGFP-FBXL10 |
| EXO1b-AcGFP (in pRetroQ) | custom cloning | na | EXO1b cDNA was cloned in the NheI, BamHI sites of pRetroQ-AcGFP1-N1 vector. |
| Fetal Bovine Serum | Gibco | 16140071 | Media supplement |
| FluoroBrite DMEM | Thermo Fisher Scientific | A1896701 | Phenol red free medium for microscopy |
| Goat anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 488 | Thermo Fisher Scientific | A32723 | secondary antibody |
| HEK293T cells | ATCC | ATCC CRL-3216 | Cell line for viral packaging |
| HEPES | Sigma-Aldrich | H0887-100ML | Buffering agent to supplement live cell imaging medium |
| Hoechst 33342 | Thermo Fisher Scientific | H3570 | pre-sensitizing agent |
| Lipofectamine 3000 | Thermo Fisher Scientific | L3000015 | Transfection reagent |
| McCoy’s 5A (Modified) Medium | Life Technologies | 16600-108 | Cell culture medium for U-2 OS cells |
| mCherry-PCNA | Addgene | #55117 | non-viral PCNA construct suitable for cell cycle marker |
| mPlum-PCNA | Addgene | #55994 | non-viral PCNA construct suitable for cell cycle marker |
| mPlum-PCNA (in pBABE) | custom cloning | na | mPlum-PCNA cDNA was cloned from Addgene #55994 in the BamHI, SalI sites of pBABE (puro) |
| Nikon A1R-HD25 Confocal Scanhead and Controller | Nikon | na | confocal imaging system |
| Nikon LUN4 laser unit | Nikon | na | excitation system |
| Nikon LUN-F 50 mW 405 nm FRAP laser unit | Nikon | na | FRAP laser unit |
| Nikon NIS Elements Confocal Controller Software | Nikon | na | Confocal controlling software |
| Nikon Ti2-E Inverted Microscope | Nikon | na | inverted epifluorescent microscope base |
| Nikon Ti2-LAPP Modular Illumination System | Nikon | na | illumination system |
| NTHL1-mCherry (in pRetroQ) | custom cloning | na | NTHL1 cDNA was cloned in the NheI, SalI sites of pRetroQ-mCherry-N1 vector. |
| Nunc Lab-Tek II Chambered Coverglass (4 well) | Thermo Fisher Scientific | 155382PK | Live cell microscopy cell culture chamber |
| Olaparib | Selleck Chemicals | S1060 | PARP inhibitor |
| Opti-MEM reduced serum media | Thermo Fisher Scientific | 31985062 | Dilution medium for transient transfection |
| Paraformaldehyde aqueous solution (32%) | Thermo Fisher Scientific | 50-980-494 | Fixative |
| pBABE (hygro) | Addgene | #1765 | retroviral expression vector (for low expression levels) |
| pBABE (neo) | Addgene | #1767 | retroviral expression vector (for low expression levels) |
| pBABE (puro) | Addgene | #1764 | retroviral expression vector (for low expression levels) |
| pBABE (zeo) | Addgene | #1766 | retroviral expression vector (for low expression levels) |
| PCNA Antibody (PC10) | Santa Cruz | sc-56 | primary antibody |
| Penicillin-Streptomycin-Glutamine (100x) | Gibco | 10378016 | Media supplement |
| polybrene | Sigma-Aldrich | TR-1003 | Increase viral infection efficiency |
| pRetroQ-AcGFP-C1 | Takara | 632506 | retroviral expression vector |
| pRetroQ-AcGFP-N1 | Takara | 632505 | retroviral expression vector |
| pRetroQ-mCherry-C1 | Takara | 632567 | retroviral expression vector |
| pRetroQ-mCherry-N1 | Takara | 632568 | retroviral expression vector |
| pUMVC | Addgene | #8449 | Viral packaging vector |
| Sodium-pyruvate | Thermo Fisher Scientific | 11360070 | Supplement for live cell imaging medium |
| Triton X-100 aqueous solution (10%) | Sigma-Aldrich | 11332481001 | Dilute in PBS for cell permeabilization buffer |
| Trypsin-EDTA Solution 10X | Sigma-Aldrich | 59418C-100ML | Dilute in PBS to split cells |
| U-2 OS Cells | ATCC | HTB-96 | Optimal cell line for microscopy experiments |
| Universal Mycoplasma Detection Kit | ATCC | 30-1012K | PCR based Mycoplasma detection kit |
| VSV-G | Addgene | #8454 | Viral protein envelope vector |
References
- Aleksandrov, R., et al. Protein dynamics in complex DNA lesions. Molecular Cell. 69 (6), 1046-1061 (2018).
- Darzynkiewicz, Z., Halicka, H. D., Zhao, H., Podhorecka, M. Cell synchronization by inhibitors of DNA replication induces replication stress and DNA damage response: Analysis by flow cytometry. Methods in Molecular Biology. 761, 85-96 (2011).
- Sakaue-Sawano, A., et al. Visualizing spatiotemporal dynamics of multicellular cell-cycle progression. Cell. 132 (3), 487-498 (2008).
- Herce, H. D., Rajan, M., Lattig-Tunnemann, G., Fillies, M., Cardoso, M. C. A novel cell permeable DNA replication and repair marker. Nucleus. 5 (6), 590-600 (2014).
- Keijzers, G., et al. Human exonuclease 1 (EXO1) regulatory functions in dna replication with putative roles in cancer. International Journal of Molecular Sciences. 20 (1), (2018).
- Cheruiyot, A., et al. Poly(ADP-ribose)-binding promotes Exo1 damage recruitment and suppresses its nuclease activities. DNA Repair (Amsterdam). 35, 106-115 (2015).
- Zhang, F., Shi, J., Chen, S. H., Bian, C., Yu, X. The PIN domain of EXO1 recognizes poly(ADP-ribose) in DNA damage response. Nucleic Acids Research. 43 (22), 10782-10794 (2015).
- Rona, G., et al. PARP1-dependent recruitment of the FBXL10-RNF68-RNF2 ubiquitin ligase to sites of DNA damage controls H2A.Z loading. elife. 7, (2018).
- Young, L. M., et al. TIMELESS forms a complex with PARP1 distinct from its complex with TIPIN and plays a role in the dna damage response. Cell Reports. 13 (3), 451-459 (2015).
- Kong, X., et al. Laser microirradiation to study in vivo cellular responses to simple and complex dna damage. Journal of Visualized Experiments. (131), e56213 (2018).
- Kong, X., et al. Condensin I recruitment to base damage-enriched DNA lesions is modulated by PARP1. PLoS One. 6 (8), 23548 (2011).
- Lan, L., et al. Novel method for site-specific induction of oxidative DNA damage reveals differences in recruitment of repair proteins to heterochromatin and euchromatin. Nucleic Acids Research. 42 (4), 2330-2345 (2014).
- Zerjatke, T., et al. Quantitative cell cycle analysis based on an endogenous all-in-one reporter for cell tracking and classification. Cell Reports. 19 (9), 1953-1966 (2017).
- Ji, Y., Karbaschi, M., Cooke, M. S. Mycoplasma infection of cultured cells induces oxidative stress and attenuates cellular base excision repair activity. Mutation Research. 845, 403054 (2019).
- Sun, G., et al. Mycoplasma pneumoniae infection induces reactive oxygen species and DNA damage in A549 human lung carcinoma cells. Infection and Immunity. 76 (10), 4405-4413 (2008).
- Gassman, N. R., Wilson, S. H. Micro-irradiation tools to visualize base excision repair and single-strand break repair. DNA Repair (Amsterdam). 31, 52-63 (2015).
- Muster, B., Rapp, A., Cardoso, M. C. Systematic analysis of DNA damage induction and DNA repair pathway activation by continuous wave visible light laser micro-irradiation. AIMS Genetics. 4 (1), 47-68 (2017).
- Ikeda, S., et al. Purification and characterization of human NTH1, a homolog of Escherichia coli endonuclease III. Direct identification of Lys-212 as the active nucleophilic residue. Journal of Biological Chemistry. 273 (34), 21585-21593 (1998).
- Rosenquist, T. A., Zharkov, D. O., Grollman, A. P. Cloning and characterization of a mammalian 8-oxoguanine DNA glycosylase. Proceedings of the National Academy of Science U. S. A. 94 (14), 7429-7434 (1997).
- Reid, D. A., et al. Organization and dynamics of the nonhomologous end-joining machinery during DNA double-strand break repair. Proceedings of the National Academy of Science U. S. A. 112 (20), 2575-2584 (2015).
- Taccioli, G. E., et al. Ku80: product of the XRCC5 gene and its role in DNA repair and V(D)J recombination. Science. 265 (5177), 1442-1445 (1994).
- Marsin, S., et al. Role of XRCC1 in the coordination and stimulation of oxidative DNA damage repair initiated by the DNA glycosylase hOGG1. Journal of Biological Chemistry. 278 (45), 44068-44074 (2003).
- Thompson, L. H., Brookman, K. W., Jones, N. J., Allen, S. A., Carrano, A. V. Molecular cloning of the human XRCC1 gene, which corrects defective DNA strand break repair and sister chromatid exchange. Molecular and Cell Biology. 10 (12), 6160-6171 (1990).
- Scharer, O. D. Nucleotide excision repair in eukaryotes. Cold Spring Harbor Perspective Biology. 5 (10), 012609 (2013).
- Oeck, S., et al. High-throughput evaluation of protein migration and localization after laser micro-irradiation. Science Reports. 9 (1), 3148 (2019).
- Mistrik, M., et al. Cells and stripes: A novel quantitative photo-manipulation technique. Science Reports. 6, 19567 (2016).
- Durand, R. E., Olive, P. L. Cytotoxicity, mutagenicity and dna damage by hoechst 33342. Journal of Histochemistry and Cytochemistry. 30 (2), 111-116 (1982).
- Tobey, R. A., Oishi, N., Crissman, H. A. Cell cycle synchronization: reversible induction of G2 synchrony in cultured rodent and human diploid fibroblasts. Proceedings of the National Academy of Science U. S. A. 87 (13), 5104-5108 (1990).
- Podhorecka, M., Skladanowski, A., Bozko, P. H2AX phosphorylation: Its role in DNA damage response and cancer therapy. Journal of Nucleic Acids. 2010, (2010).



